0 引言
【研究意义】中国是最大的花生生产国,总产量达到1 470.79×104 t,占世界总产量的40.8%,位居世界第1位[1]。但由于中国人多地少,且过度追求较高的种植效益,导致花生重茬连作现象严重。近年来,在中国花生主产区,花生连作重茬减产严重,连作的年限越长,减产的幅度就越大[2,3]。连作障碍已成为一个广泛存在、危害严重的生产性问题。【前人研究进展】连作障碍现象在作物中普遍存在,现有的众多研究结果表明,土壤理化性质恶化、土壤生物学环境恶化和作物的自毒作用是导致连作障碍的三大因素[4,5]。但由于这些因素之间存在着错综复杂的关系,至今仍未从根本上阐明连作障碍的产生机理。而越来越多的研究显示出,在农业生态系统中,作物本身的自毒作用是导致连作障碍的重要因素,并成为备受重视的研究热点。水稻、大豆、小麦、黄瓜、芦笋、苹果、西洋参等[6,7,8,9,10,11,12,13]植物的根系分泌物和腐解物中鉴定出许多自毒物质。自毒物质能促进土壤病菌的生长,影响作物种子的发芽,根系的吸收能力和细胞膜透性,从而加重连作障碍。可见,植物自身产生自毒物质现象普遍,且自毒物质作用广泛,毒害持久,深入研究自毒作用机理对阐明连作障碍的成因至关重要。刘苹等[14,15,16]首次采用连续收集法提取到花生植株的根系分泌物,并通过研究证明花生根系能释放化感物质对花生的生长发育产生自毒作用,且这些化感物质主要通过抑制胚根的生长、损伤细胞膜的结构来抑制花生植株的生长。其进一步对花生根系分泌物的中性组分进行研究,鉴定出2, 4-二甲基苯甲醛、月桂酸、豆蔻酸、软酯酸、油酸和硬酯酸等6种主要成分,但其仅就根系分泌物的碱性、酸性及中性成分对根腐镰刀菌及固氮菌的影响进行了研究,没有确定其对花生的自毒作用,也并未对根系分泌物的碱性和酸性组分进行鉴定,其后对邻苯二甲酸、对羟基苯甲酸和苯甲酸以及3种酚酸类物质的混合物分析发现,在较高添加浓度时对花生种子发芽和炭疽病菌均产生了抑制作用,对固氮菌的生长表现为低促高抑,且3种酚酸类物质两两互作时对花生种子发芽的影响增强。李培栋等[17]研究了南方红壤区不同连作年限花生土壤中酚酸物质的种类、含量,及其对花生生长的影响。研究结果表明,连作花生土壤中存在3种酚酸类物质,分别为对羟基苯甲酸、香草酸和香豆酸,且这3种酚酸物质均随着连作年限的增加而呈现累积的趋势,并可以抑制花生幼苗的生长和提高花生的发病率。【本研究切入点】笔者前期研究发现花生根系分泌物的自毒作用与花生连作障碍有着密切关系,在根际土壤水浸液中鉴定出4种酚酸类物质,分别为对羟基苯甲酸、香草酸、香豆酸和香豆素,其中香草酸和香豆素含量较高且变化规律性明显,在土壤中的含量随连作年限的增加而呈累积上升趋势[18],但并没有对这些酚酸类物质进行系统的化感自毒效应研究。【拟解决的关键问题】因此,本试验通过对4种酚酸类物质进行初筛后选用香草酸处理花生种子及幼苗,研究其对花生种子萌发和幼苗生长的影响。此外,通过盆栽试验研究添加不同浓度香草酸后,花生根际微生物区系的变化,旨在说明土壤中微生物的数量变化特点,揭示根际土壤微生物在花生生育期内对自毒物质的响应变化规律。1 材料与方法
1.1 试验材料
花生品种为阜花12号150GY,该品种属连续开花亚种小粒珍珠豆型,抗旱、抗倒、耐瘠、适应性广,生育期125—128 d,较适宜辽西北风沙半干旱地区栽培。自毒物质香草酸(vanillic acid)为分析纯,购于sigma公司。真菌培养采用马丁氏培养基,细菌培养采用牛肉膏蛋白胨培养基,放线菌培养采用高氏一号培养基[19]。1.2 试验设计
本研究设计3个试验。1.2.1 香草酸对花生种子萌发影响的试验 共设6个处理,分别不施加香草酸(CK),施加香草酸的浓度分别为0.01、0.03、0.05、0.07、0.09 mmol·L-1,分别记作M1、M2、M3、M4、M5。挑选大小相当的花生种子6粒放于铺有滤纸的培养皿(9 cm)中,分别加入不同浓度的香草酸溶液 2 mL培养,对照加无菌水。每个处理3次重复,每重复3个培养皿。在恒温培养箱中培养8 d(2015年4月2—9日),设定温度25℃,定期补充无菌水,每天观察发芽情况,调查种子发芽数,当胚根突破种皮,长度为种长一半时计为发芽种子。6 d后测定发芽势、8 d后测定发芽率、根长,计算发芽指数。
发芽率(%)=(发芽终期全部正常发芽的种子数/供试种子数)×100% ;
发芽势(%)=(6 d内发芽种子数/供试种子数)×100%;
发芽指数 = ∑(Gt/Dt)
式中,Gt为逐日发芽种子数,Dt为相应发芽天数。
1.2.2 香草酸对花生幼苗生长影响试验
(1)试验方法 将300 g无菌沙子混少量珍珠岩后装入大小相当的营养钵中,于2015年4月12日,浇透水后分别播入经浸种催芽处理的种子。试验共设置5个处理,分别为CK(不施加香草酸)、Y1(香草酸0.01 mmol·L-1)、Y2(香草酸0.03 mmol·L-1)、Y3(香草酸0.05 mmol·L-1)和Y4(香草酸0.07 mmol·L-1),每个处理3次重复,每重复10株,每处理共计30株。置于人工智能气候箱中培养,条件为:24℃下,14 h光周期;22℃下,10 h暗周期;光强为400 µmol·m-2·s-1。3 d后各处理分别加入相应浓度的香草酸溶液10 mL,并以无菌水作对照,6 d后再分别加入相应浓度的香草酸溶液10 mL。出苗后每盆加入Hoagland营养液15 mL,每隔5 d浇水,出苗20 d后进行生长及生理指标测定。
(2)植株生长指标测定 每处理随机选取15株,用直尺测量株高,用蒸馏水冲净根系后测定主根长,收集并吸干植株后称整株鲜重,然后放入烘箱105℃杀青1 h,之后80℃下烘干至恒质量,称其干重。
(3)叶绿素含量测定 采用美国产CCM-200 plus叶绿素含量测定仪测定主茎倒3完全展开叶,每个处理测定30片叶,重复3次,以CCI值表示叶绿素含量。
(4)叶片光合速率及气体交换参数测定 净光合速率、气孔导度和胞间CO2浓度使用LI-6400便携式光合测定仪进行活体测定,测定于晴天上午9:30—10:30光照充足且相对稳定的时间进行,每个处理测定5片叶,重复3次。
(5)叶片丙二醛含量和根系吸收面积测定 采用TCA法测定叶片丙二醛含量[20],采用甲烯蓝蘸根比色法测定根系总吸收面积、活跃吸收表面积和根系活力[21]。
1.2.3 香草酸对微生物区系影响试验
(1)试验方法 试验于2015年在沈阳农业大学花生定位科研基地进行,盆栽土壤为花生连作风沙土(取自辽宁省康平县海州窝堡花生连作区,耕层土壤有机质含量5.55 g·kg-1,全氮0.66 g·kg-1,全磷0.12 g·kg-1,全钾21.02 g·kg-1,碱解氮49.5 mg·kg-1,速效磷13.81 mg·kg-1,pH 6.24)。采用塑料盆,上口直径32 cm、下口直径25 cm、高22 cm,每盆装干土10 kg,播种前一次性施用肥料(N:0.05 g·kg-1干土;P2O5和K2O分别为0.1 g·kg-1干土)。试验设5个处理,分别为CK(不施加香草酸)、P1(香草酸0.01 mg·kg-1干土)、P2(香草酸0.03 mg·kg-1干土)、P3(香草酸0.05 mg·kg-1干土)和P4(香草酸0.07 mg·kg-1干土),每个处理3次重复,每个重复5盆,即每个处理共播种15盆。于2015年5月22日播种,每盆播4穴,每穴播1粒,2周后出苗,出苗后每盆留健苗3株。生育期间精细管理,按重量法适时浇水,2015年9月30日收获。
(2)根际土壤样品的获取 每个处理于花生苗期、花针期、结荚期和成熟期进行采样。采样前两天浇一次透水,采样时连同花生一同拔起,抖落掉根上较大的土块,附着在根表面的土壤收集后晾干研碎作为根际土壤样品[22]。
(3)微生物的分离与计数 采用稀释平板测数法。细菌37℃下培养36 h,进行菌落计数;放线菌28℃下培养5 d后计数;真菌在28℃下培养7 d后计数。结果以每克干土所含数量表示[23]。
1.3 数据处理
参照WILLIAMSON等[24]提出的响应指数(response index,RI)作为衡量自毒效应的大小。即:RI = 1-C/T T≥C
RI = T/C-1 T<C
式中,C为对照值,T为处理值,RI>0为促进,RI<0为抑制,定义对照的RI值为0,绝对值的大小与作用强度一致。所得数据(除注明外,均以原始数据进行)用SPSS15.0软件进行差异显著性分析、单因子方差分析结合多重比较分析。以95%可信度水平做差异显著性分析。
2 结果
2.1 香草酸对花生种子萌发的影响
由表1可以看出香草酸对花生种子萌发有较大影响,具有显著的自毒效应。经不同浓度香草酸溶液处理后,花生种子的发芽率、发芽势和发芽指数均低于CK,与对照存在显著性差异,即香草酸对种子萌发存在一定的抑制作用,且该抑制作用具有一定的浓度效应。当香草酸溶液浓度为0.09 mmol·L-1时(M5),发芽率为61%,发芽势为28%,发芽指数为0.56,和对照相比分别降低了39%、66.3%和55.9%,自毒效应响应指数达到最大值,分别为-0.39、-0.67和-0.56,即自毒作用强度最大。根长的变化趋势与以上3个指标不同,即随着香草酸浓度的增大不同处理间并不存在显著性差异。数据结果进一步显示,和其他3指标相比,种子发芽势对自毒物质浓度变化更为敏感,当香草酸溶液浓度为0.01 mmol·L-1时(M1),发芽势达到89%,和对照相比提高了6%,其自毒效应响应指数为0.06(RI>0),即表现为促进作用。当香草酸溶液浓度为0.09 mmol·L-1时(M5),发芽势和发芽率相比,下降幅度更为明显,且RI值降到最低,仅为-0.67,即自毒作用强度最大,呈现出明显的自毒物质低促高抑现象。Table 1
表1
表1不同浓度香草酸溶液对花生种子萌发指标的影响
Table 1Effects of different concentrations of vanillic acid solution on the indexes of peanut seed germination
| 处理 Treatment | 发芽率 Germination ratio | 发芽势 Germination energy | 发芽指数 Germination index | 根长 Root length | ||||
|---|---|---|---|---|---|---|---|---|
| 发芽率值 Value (%) | 响应指数 RI | 发芽势值 Value (%) | 响应指数 RI | 发芽指数值 Value | 响应指数 RI | 根长值 Value (cm) | 响应指数 RI | |
| CK | 100a | - | 83±17a | - | 1.27±0.15a | - | 3.98±2.12a | - |
| M1 | 94±10a | -0.06 | 89±10a | 0.06 | 1.01±0.10ab | -0.21 | 3.84±0.45a | -0.03 |
| M2 | 78±25ab | -0.22 | 78±38a | -0.06 | 0.96±0.39ab | -0.24 | 3.78±0.38a | -0.05 |
| M3 | 67b | -0.33 | 61±10ab | -0.27 | 0.70±0.03bc | -0.45 | 3.46±0.42a | -0.13 |
| M4 | 78±19ab | -0.22 | 61±35ab | -0.27 | 0.76±0.24bc | -0.40 | 3.39±1.01a | -0.15 |
| M5 | 61±10b | -0.39 | 28±25b | -0.67 | 0.56±0.03c | -0.56 | 2.40±0.35a | -0.40 |
新窗口打开
2.2 香草酸对花生幼苗生长的影响
香草酸对花生幼苗生长有一定影响,具有自毒效应(表2)。经不同浓度香草酸溶液处理后,花生幼苗的主根长和单株干重两个指标均低于CK,与对照存在显著性差异,即香草酸对幼苗生长存在一定的抑制作用,且该抑制作用具有一定的浓度效应。当外源施加0.07 mmol·L-1(Y4)香草酸溶液时,幼苗主根长和单株干重比对照降低了37.3%和40.0%,主根长和单株干重仅为5.20 cm和0.48 g,自毒效应响应指数达到最大值,分别为-0.37和-0.40,即自毒作用强度最大。幼苗株高和单株鲜重两个指标随着香草酸浓度的增大与对照间并不存在显著性差异。Table 2
表2
表2不同浓度香草酸溶液对花生幼苗生长的影响
Table 2Effects of different concentrations of vanillic acid solution on the peanut growth
| 处理 Treatment | 株高 Height | 主根长 Root length | 单株鲜重 Fresh weight | 单株干重 Dry weight | ||||
|---|---|---|---|---|---|---|---|---|
| 株高值 Value (cm) | 响应指数 RI | 主根长值 Value (cm) | 响应指数 RI | 单株鲜重值 Value (g) | 响应指数 RI | 单株干重值 Value (g) | 响应指数 RI | |
| CK | 14.04±1.31a | - | 8.30±1.50a | - | 4.24±0.86a | - | 0.80±0.07a | - |
| Y1 | 12.56±1.36a | -0.11 | 6.82±1.68ab | -0.17 | 4.04±1.08a | -0.05 | 0.69±0.23ab | -0.14 |
| Y2 | 13.06±0.88a | -0.07 | 5.28±1.21b | -0.36 | 4.20±0.94a | -0.01 | 0.67±0.17ab | -0.17 |
| Y3 | 12.64±1.66a | -0.10 | 5.22±1.19b | -0.37 | 3.80±1.09a | -0.10 | 0.54±0.09b | -0.33 |
| Y4 | 12.28±1.40a | -0.13 | 5.20±0.92b | -0.37 | 3.28±0.36a | -0.23 | 0.48±0.15b | -0.40 |
新窗口打开
2.3 香草酸对花生幼苗光合特性的影响
由表3可以看出香草酸对花生幼苗光合特性指标有较大影响。经不同浓度香草酸溶液处理后,花生幼苗的叶绿素含量、净光合速率和气孔导度均低于CK,而胞间CO2浓度高于CK,即香草酸对幼苗的光合特性存在一定的抑制作用,且该抑制作用具有一定的浓度效应。叶绿素含量、净光合速率和气孔导度3个指标均随着香草酸浓度的增大而降低,其中,气孔导度在不同处理间均存在显著性差异,而叶绿素含量和净光合速率两个指标仅与对照存在显著性差异,但各处理间差异不显著。当香草酸溶液浓度为0.07 mmol·L-1时(Y4),叶绿素含量为41.81%,净光合速率为2.29 μmol·m-2·s-1,气孔导度为47.45 mmol·m-2·s-1,和对照相比分别降低了19.0%、53.9%和49.1%,抑制作用最为明显。胞间CO2浓度的变化趋势与以上3个指标相反,即随着香草酸浓度的增大而呈现上升的趋势,但各处理间差异不显著,当香草酸溶液浓度为0.07 mmol·L-1时(Y4),胞间CO2浓度达到最高,为696.19 μmol·mol-1,比对照提高了46.1%。Table 3
表3
表3不同浓度香草酸溶液对花生幼苗光合特性的影响
Table 3Effects of different concentrations of vanillic acid solution on the peanut photosynthetic characteristics
| 处理 Treatment | 叶绿素含量 Chlorophyll content (%) | 净光合速率 Net photosynthetic rate (μmol·m-2·s-1) | 气孔导度 Stomatal conductance ( mmol·m-2·s-1) | 胞间CO2浓度 Intercellular CO2 concentration (μmol·mol-1) |
|---|---|---|---|---|
| CK | 51.63±9.81a | 4.97±0.85a | 93.25±8.94a | 476.51±19.76b |
| Y1 | 45.49±9.42ab | 4.36±0.27ab | 75.11±7.40b | 531.68±10.64ab |
| Y2 | 46.62±7.41ab | 3.32±0.68ab | 68.12±6.57c | 626.50±13.71ab |
| Y3 | 43.01±5.67b | 2.58±0.96b | 58.39±9.70d | 659.08±22.87ab |
| Y4 | 41.81±9.97b | 2.29±0.05b | 47.45±3.99e | 696.19±17.89a |
新窗口打开
2.4 香草酸对花生幼苗根系吸收面积的影响
由表4可以看出香草酸对花生幼苗根系活力指标有较大影响。Y2、Y3和Y4处理中花生根系总吸收面积、活跃吸收面积和根系活力(活跃吸收面积/总吸收面积)均低于CK。3个指标均随着香草酸浓度的增大而降低,其中Y1处理与CK间差异不显著,其余3个处理均与CK存在显著性差异。即当香草酸浓度≥0.03 mmol·L-1时对花生幼苗的根系活力存在一定的抑制作用,且该抑制作用具有一定的浓度效应。当外源施加0.07 mmol·L-1(Y4)香草酸溶液时,根系总吸收面积和根系活跃吸收面积值最小,分别为0.118 m2和0.022 m2,根系活力最低(0.19),与对照相比降幅分别达到22.4%、54.2%和40.6%。Table 4
表4
表4不同浓度香草酸溶液对花生幼苗根系吸收面积的影响
Table 4Effects of different concentrations of vanillic acid solution on the absorption area of peanut root
| 处理 Treatment | 根系总吸收面积 Total absorption area (m2) | 根系活跃吸收面积 Active absorption area (m2) | 根系活力 Root activity |
|---|---|---|---|
| CK | 0.152±0.008a | 0.048±0.006a | 0.32±0.007a |
| Y1 | 0.141±0.007a | 0.040±0.009a | 0.28±0.008a |
| Y2 | 0.127±0.008b | 0.031±0.007b | 0.24±0.007b |
| Y3 | 0.122±0.005c | 0.027±0.003c | 0.21±0.004c |
| Y4 | 0.118±0.003c | 0.022±0.005c | 0.19±0.004c |
新窗口打开
2.5 香草酸对花生幼苗叶片丙二醛含量的影响
由图1可以看出外源添加香草酸对花生幼苗叶片的MDA含量具有一定的影响。当香草酸溶液浓度为0.03、0.05和0.07 mmol·L-1(Y2、Y3和Y4)时,叶片的MDA含量明显高于CK,与对照呈现显著性差异,分别较CK提高了30.9%、39.5%和43.3%,Y1处理与CK间差异不显著,即当香草酸浓度≥0.03 mmol·L-1时对花生幼苗叶片产生MDA含量存在一定的促进作用。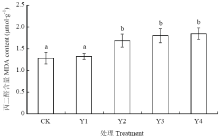 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同浓度香草酸溶液对花生叶片丙二醛含量的影响
-->Fig. 1Effects of different concentrations of vanillic acid solution on the MDA content
-->
2.6 香草酸对花生根际土壤中微生物区系的影响
2.6.1 对土壤中细菌数量的影响 由图2可见,香草酸对花生根际土壤中细菌数量变化有较大影响。经不同浓度香草酸溶液处理后,根际细菌数量从苗期到成熟期呈现不同的变化趋势。从总体上看,在花生全生育期内,根际土壤中细菌数量的变化为逐渐上升的动态变化曲线。即在花生苗期和花针期阶段,各处理中根际细菌的初始菌量较为接近,无明显差异,且均为整个生育期内的最低值。进入结荚期后各处理中细菌数量开始出现明显上升趋势,成熟期时均达到全生育期内最高值。进入花生生育后期,添加不同浓度香草酸溶液的各处理中,其根际细菌数量始终低于对照组,即香草酸对花生根际土壤中细菌生长存在一定的抑制作用,且该抑制作用具有一定的浓度效应。细菌数量随着香草酸浓度的增大而降低,抑制作用逐渐增强。成熟期时,CK的细菌数量达到最高值(4.39×107 CFU/g),P4处理(香草酸0.07 mg·kg-1干土)的细菌数量为最低值(4.5×106 CFU/g),和CK相比降低了89.7%。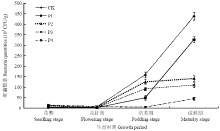 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同浓度香草酸溶液对花生根际细菌数量的影响
CK、P1、P2、P3、P4分别表示施加香草酸的浓度为0、0.01、0.03、0.05、0.07 mg·kg-1干土。下同
-->Fig. 2Effects of different concentrations of vanillic acid solution on the bacteria quantities in rhizosphere soil
CK, P1, P2, P3 and P4 mean application of different vanillic acid amounts: 0, 0.01, 0.03, 0.05, 0.07 mg·kg-1 dry soil. The same as below
-->
2.6.2 对土壤中放线菌数量的影响 由图3可见,香草酸对花生根际土壤中放线菌数量变化有较大影响。经不同浓度香草酸溶液处理后,根际放线菌数量从苗期到成熟期呈现不同的变化趋势。从总体上看,在花生全生育期内,根际土壤中放线菌数量的动态变化和细菌呈现相反的变化趋势,为逐渐下降的动态变化曲线,即在花生苗期和花针期阶段,各处理中初始菌量均达到生育期内最高值,且各处理间菌量差异明显,随着花生生育进程的推进,进入生育后期各处理间菌量趋于一致,并无明显差异,进入成熟期后各处理的菌量均达到生育期内最低值。在花生生育前期,添加不同浓度香草酸溶液的各处理中,其根际放线菌数量始终低于对照组,即香草酸对花生根际土壤中放线菌生长存在一定的抑制作用,且该抑制作用具有一定的浓度效应。放线菌数量随着香草酸浓度的增大而降低,抑制作用逐渐增强。苗期时,CK的放线菌数量达到最高值(8.18×104 CFU/g),P4处理(香草酸0.07 mg·kg-1干土)的放线菌数量为最低值(2.38×104CFU/g),和CK相比降低了70.9%。
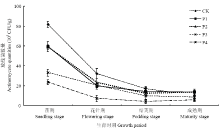 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同浓度香草酸溶液对花生根际放线菌数量的影响
-->Fig. 3Effects of different concentrations of vanillic acid solution on the actinomycete quantities in rhizosphere soil
-->
2.6.3 对土壤中真菌数量的影响 由图4可见,香草酸对花生根际土壤中真菌数量变化有较大影响。经不同浓度香草酸溶液处理后,根际真菌数量从苗期到成熟期呈现不同的变化趋势。从总体上看,在花生全生育期内,根际土壤中真菌数量呈现先上升后下降再小幅上升的变化趋势,花针期时各处理的菌量均达到峰值。在整个生育期内,P1(香草酸0.01 mg·kg-1干土)和P2处理(香草酸0.03 mg·kg-1干土)的真菌数量始终高于对照组,即低浓度的香草酸溶液对花生根际土壤中真菌生长存在一定的促进作用;而P3(香草酸0.05 mg·kg-1干土)和P4处理(香草酸0.07 mg·kg-1干土)的真菌数量始终低于对照组,即高浓度的香草酸溶液对真菌生长具有一定的抑制作用。在花针期时,CK的真菌数量为2.93×103 CFU/g,P1处理的菌量达到最高值(4.03×103 CFU/g),和CK相比提高了37.5%,而P4处理的菌量达到最低值(2.73×103 CFU/g),较CK降低了6.8%。
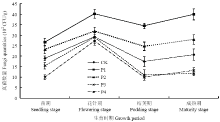 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同浓度香草酸溶液对花生根际真菌数量的影响
-->Fig. 4Effects of different concentrations of vanillic acid solution on the fungi quantities in rhizosphere soil
-->
3 讨论
3.1 香草酸对花生种子萌发和幼苗生长的影响分析
花生连作障碍的成因十分复杂[25,26,27],****普遍认为酚酸类自毒物质的累积是引起花生连作障碍的直接原因[28,29,30]。酚酸类自毒物质主要来自植物残体的分解产物和根系的分泌作用,其通过影响植物的膜系统、光合作用、内源激素合成等对植物生长产生抑制作用[31,32,33]。目前国内外****关于自毒物质的作用机制,对植物生理影响方面的研究已取得较大进展,研究多集中在大豆、黄瓜和地黄等作物,近年来国内****也相继对花生自毒作用进行研究,但目前在花生自毒作用的机理以及调控措施方面研究较少。笔者通过前期研究在根际土壤水浸液中鉴定出4种酚酸类物质,分别为对羟基苯甲酸、香草酸、香豆酸和香豆素,其中香草酸和香豆素含量较高且变化规律性明显,其在土壤中的含量随连作年限的增加而呈累积上升趋势,但并没有对这些酚酸类物质进行系统的化感自毒效应研究。因此,本试验通过对4种酚酸类物质进行初筛后选用香草酸处理花生种子及幼苗,研究其对花生种子萌发和幼苗生长的影响。试验结果显示香草酸对花生种子萌发和幼苗生长有较大影响,存在一定的抑制作用,且该抑制作用具有一定的浓度效应,即其具有显著的自毒效应。其中,种子发芽率、发芽势、发芽指数、幼苗主根长和单株干重5个指标均随着香草酸浓度的增大而降低,与对照存在显著差异,自毒效应逐渐增强。这与部分****的研究结果相吻合,如袁云云等[34]研究发现外源添加不同浓度的邻苯二甲酸对花生发芽全程均有较强的抑制作用,该抑制作用随浓度的增加而增强。邻苯二甲酸对花生根长的影响,在苗期时各浓度都有明显的抑制作用,到结荚期时,10 mg·kg-1浓度对花生根长的抑制作用已达到极显著,其余高浓度处理的植株抑制作用更显著。邵庆勤等[35]研究发现不同浓度的阿魏酸、香草酸和混合酸处理野燕麦后种子萌发率都有不同程度的降低,并且都随着酸浓度的增加,抑制效果增强,在浓度为10 mmol·L-1的水平下抑制作用最强,阿魏酸、香草酸及其混合物的萌发率分别为对照的72%、80%和78%。然而针对酚酸类物质对苜蓿、人参和水稻种子萌发影响的研究[36,37,38],结果均显示出酚酸类物质对种子萌发产生了低浓度促进、高浓度抑制作用,与本试验结果不完全相同,本试验中只有较为敏感的指标(种子发芽势)显示出一定的低促高抑现象,此现象可能是由于酚酸物质对不同作物的影响阈值差异所致。3.2 香草酸对花生幼苗光合特性、根系活力和丙二醛含量的影响分析
众所周知,植物根系是活跃的吸收器官和合成器官,根的活力水平直接影响地上部分的生长、营养状况和产量水平,根系活性降低必然导致植株养分吸收的减少。叶绿素含量与植株的光合速率密切相关,叶绿素含量的多少反映了植物进行光合作用的能力强弱。植物在逆境下受到伤害以及植物对逆境抵抗能力往往与体内的SOD 活性水平相关,衰老时往往伴随着SOD活性的降低从而导致自由基增加,同时伴随着丙二醛(MDA)含量的上升,即膜脂过氧化的加剧。关于自毒物质对膜脂过氧化作用的影响前人已有很多研究[39,40]。本试验结果显示出,香草酸对花生幼苗根系活力、叶绿素含量和光合速率都有一定的抑制作用,并且随着浓度的增加效果越明显;对叶片中的丙二醛含量有一定的促进作用,且随着浓度的升高,效果越明显。该结果说明香草酸对花生幼苗生长具有一定的自毒效应。3.3 香草酸对花生根际土壤中微生物区系的影响分析
作物连作导致酚酸类自毒物质在土壤中不断积累,从而对作物和土壤微生物产生自毒作用,而土壤微生物是土壤有机物转化的执行者,又是植物营养元素的活性库,是土壤中最活跃的部分[41]。本试验以酚酸类物质香草酸为研究对象,通过盆栽试验研究添加不同浓度香草酸后,花生根际微生物区系的变化,旨在说明土壤中微生物的数量变化特点。研究结果显示,外源施入不同浓度的香草酸溶液均会使花生根际细菌和放线菌的数量降低,说明香草酸抑制根际土壤中细菌和放线菌的生长繁殖;而香草酸对土壤真菌的影响呈现低促高抑的现象,即低浓度的香草酸溶液对花生根际土壤中真菌生长存在一定的促进作用;而高浓度的香草酸溶液对真菌生长具有一定的抑制作用。但值得进一步探讨的是,多位****研究发现[42,43]随着外源物质浓度的升高,土壤微生物数量均呈现先增加后降低的变化趋势,而在本试验中除真菌外均未发现该趋势,作者分析可能是由于以下几个原因导致:第一,以上****开展的研究均是在无作物种植的情况下进行,而本试验是在盆栽花生条件下,开展全生育期内的微生物区系动态变化研究;第二,由于外源施加的酚酸类物质种类不同,此现象可能是由于不同酚酸物质对作物的影响阈值具有一定差异所致;第三,细菌、放线菌的生长可能对香草酸具有更高的灵敏度,后续试验应以现有浓度为基础向下设置更低的浓度梯度系列。终上所述,针对多种酚酸类物质对花生植株及根际微生物的自毒作用及阈值范围尚需要进一步系统研究。4 结论
香草酸对花生种子萌发和幼苗生长有较大影响,存在一定的抑制作用,且该抑制作用具有一定的浓度效应,即其具有显著的自毒效应。香草酸亦会抑制花生幼苗的光合作用,降低根系活力,促进幼苗叶片产生丙二醛。此外,不同浓度的香草酸均会使花生根际细菌和放线菌的数量降低,说明香草酸抑制根际土壤中细菌和放线菌的生长繁殖;而香草酸对土壤真菌的影响呈现低促高抑的现象,即低浓度的香草酸(0.01 mg·kg-1干土)对花生根际土壤中真菌生长存在一定的促进作用,而高浓度的香草酸(0.07 mg·kg-1干土)对真菌生长具有一定的抑制作用。The authors have declared that no competing interests exist.
