0 引言
【研究意义】甘蓝型油菜是世界上仅次于大豆的第二大油料作物,同时也是中国最主要的冬季油料作物,其产油量占国产油料作物产油量的45%以上[1,2]。油菜籽榨油后剩余的饼粕含有丰富的蛋白质,是发展畜禽渔业的良好蛋白饲料源。然而,传统油菜的种子中含有大量的硫苷,影响动物的适口性,并不适合于直接作饲料[3]。硫苷虽然本身无毒,但在芥子酶的作用下可降解为具有毒性的异硫氰酸等物质,影响油菜饼粕作为饲料的质量[4]。因此,降低种子硫苷含量成为世界各国油菜品质育种的主要目标。通过多年的努力,在20世纪90年代,油菜主要生产国基本普及了双低(低芥酸、低硫苷)品种,种子中的硫苷含量被控制在30 μmol∙g-1以下,产生了显著的社会经济效益。然而,长期推广应用双低油菜也出现了一些严重的问题,与传统的双高油菜相比,双低油菜的抗病性、抗虫性和抗逆性普遍下降,容易发生灾害,造成产量损失[5,6]。究其原因,是由于油菜种子中积累的硫苷主要是在叶片中合成,种子中的硫苷含量与叶片、茎杆等组织的硫苷含量高度相关,而双低油菜选育过程并没有打破这种相关性,在降低种子硫苷含量的同时,叶片等组织的硫苷含量也同步降低,从而导致油菜整体的抗病性抗逆性下降[7]。为此,有****提出了新的品质育种策略,即在育种过程中仅仅降低种子中的硫苷含量而保持其他组织部位较高的硫苷含量,以便保留其优良的抗病性和抗逆性。因此,开展油菜硫苷代谢及转运相关遗传因子的研究对于新时期的油菜品质改良具有重要意义。【前人研究进展】拟南芥中关于硫苷合成通路上的基因已基本明确,主要涉及到氨基酸链的延伸、硫苷核心结构的生成以及侧链的修饰[8]。硫苷在植物中的积累是动态的,其生成部位与积累部位并不相同,通常认为,硫苷主要是在叶片中合成,后期通过茎秆转运到种子中。在角果成熟期,特殊的转运蛋白促使硫苷从角果皮转运到胚胎中[9]。有研究表明,拟南芥gtr1和gtr2双突变体的种子硫苷含量极低(常规方法无法检出),而叶片的硫苷含量则上升了10倍。这两个基因都编码细胞膜上的硫苷转运蛋白,负责将硫苷从质外体向韧皮部转运[10]。在甘蓝型油菜和白菜中,目前已通过传统QTL分析和全基因组关联分析发现了一些硫苷含量相关的QTL区间和候选基因[11,12,13,14,15]。然而,这些位点都只是通过对一个时期(成熟种子)的硫苷含量进行分析得到,因而不能全面、准确了解种子硫苷积累的遗传机理[16,17,18]。【本研究切入点】全基因组关联分析(GWAS)是剖析复杂性状遗传机制的有效方法,其主要原理是充分利用历史重组事件形成的连锁不平衡性来推断控制群体表型变异的遗传位点[19]。因此,关联分析的突出优点是具有更加精确的定位效果和能检测到更多的有效变异位点[20,21]。随着二代测序技术的迅猛发展和测序成本的降低,基于转录组学的关联分析方法应运而生,并开始在油菜等多倍体作物中得到应用[22]。转录组关联分析除了使用SNP标记外,更重要的是还能使用基因表达量标记(gene expression marker,GEM),从而检测到更多的关联区段,具有明显的优越性[23]。因此,利用该技术对动态变化中的硫苷进行分析,有望发现新的硫苷代谢及转运相关基因。【拟解决的关键问题】本研究采用113份甘蓝型油菜品种构建关联群体,通过转录组测序数据开发出SNP标记和GEM标记,对油菜成熟种子的硫苷含量以及授粉后25 d的角果皮和种子中的硫苷含量进行转录组关联分析,以筛选与硫苷代谢及转运相关的候选基因,来揭示油菜硫苷变异的遗传基础,以及用于分子辅助育种来改良油菜品质。1 材料与方法
1.1 材料和样品采集
本试验采用的甘蓝型油菜材料通过项目合作从英国引进,主要是欧洲不同时期选育的冬性品种,其中59%的材料属于低硫苷品种(<30 μmol∙g-1)(表1)。所有材料均经过DH培养纯化,一致性好,表型稳定,在国内已经繁殖5代,生育期基本一致,能够适应长江流域气候。Table 1
表1
表1本试验用到的油菜材料
Table 1Brassica napus varieties used in this study
| 品种名称 Cultivar name | 类型 Type | 来源 Origin | 生育期 Growth duration (d) | 成熟种子硫苷含量 GS content in mature seeds (μmol∙g-1) |
|---|---|---|---|---|
| Alaska | 冬性 Winter | 欧洲 Europe | 173 | 20.29 |
| Adder | 冬性 Winter | 欧洲 Europe | 171 | 32.58 |
| Milena | 冬性 Winter | 欧洲 Europe | 171 | 20.95 |
| Agalon | 冬性 Winter | 欧洲 Europe | 182 | 20.52 |
| Picasso | 冬性 Winter | 欧洲 Europe | 173 | 21.75 |
| Boston | 冬性 Winter | 欧洲 Europe | 171 | 23.60 |
| Escort | 冬性 Winter | 欧洲 Europe | 170 | 58.30 |
| Montego | 冬性 Winter | 欧洲 Europe | 165 | 13.07 |
| Ontario | 冬性 Winter | 欧洲 Europe | 174 | 21.63 |
| Pacific | 冬性 Winter | 欧洲 Europe | 166 | 13.13 |
| Savannah | 冬性 Winter | 欧洲 Europe | 166 | 13.24 |
| Manitoba | 冬性 Winter | 欧洲 Europe | 174 | 19.50 |
| Idol | 冬性 Winter | 欧洲 Europe | 166 | 11.97 |
| Bristol | 冬性 Winter | 欧洲 Europe | 163 | 20.63 |
| Lisabeth | 冬性 Winter | 欧洲 Europe | 174 | 32.57 |
| Lipton | 冬性 Winter | 欧洲 Europe | 166 | 50.76 |
| Lisek | 冬性 Winter | 欧洲 Europe | 170 | 12.02 |
| Lion | 冬性 Winter | 欧洲 Europe | 167 | 17.30 |
| Oase | 冬性 Winter | 欧洲 Europe | 170 | 17.67 |
| Madrigal | 冬性 Winter | 欧洲 Europe | 169 | 25.99 |
| Laser | 冬性 Winter | 欧洲 Europe | 176 | 26.61 |
| Fortis | 冬性 Winter | 欧洲 Europe | 170 | 22.16 |
| Roxet | 冬性 Winter | 欧洲 Europe | 163 | 22.40 |
| NK Fair | 冬性 Winter | 欧洲 Europe | 172 | 20.15 |
| Aviso | 冬性 Winter | 欧洲 Europe | 167 | 29.70 |
| Tenor | 冬性 Winter | 欧洲 Europe | 161 | 20.77 |
| Musette | 冬性 Winter | 欧洲 Europe | 169 | 23.38 |
| Falstaff | 冬性 Winter | 欧洲 Europe | 175 | 31.73 |
| SW Sinatra | 冬性 Winter | 欧洲 Europe | 170 | 17.10 |
| Viking | 冬性 Winter | 欧洲 Europe | 166 | 20.73 |
| Aurum | 冬性 Winter | 欧洲 Europe | 171 | 21.18 |
| Lorenz | 冬性 Winter | 欧洲 Europe | 174 | 19.99 |
| Baros | 冬性 Winter | 欧洲 Europe | 163 | 17.42 |
| Rasmus | 冬性 Winter | 欧洲 Europe | 168 | 19.81 |
| Gefion | 冬性 Winter | 欧洲 Europe | 168 | 19.64 |
| SLM 0512 | 冬性 Winter | 欧洲 Europe | 167 | 16.57 |
| LSF 0519 | 冬性 Winter | 欧洲 Europe | 170 | 26.81 |
| 品种名称 Cultivar name | 类型 Type | 来源 Origin | 生育期 Growth duration (d) | 成熟种子硫苷含量 GS content in mature seeds (μmol∙g-1) |
| Beluga | 冬性 Winter | 欧洲 Europe | 163 | 25.98 |
| Campari | 冬性 Winter | 欧洲 Europe | 176 | 16.03 |
| Caramba | 冬性 Winter | 欧洲 Europe | 174 | 15.31 |
| Duell | 冬性 Winter | 欧洲 Europe | 164 | 14.19 |
| Express 617 | 冬性 Winter | 欧洲 Europe | 167 | 39.81 |
| Jessica | 冬性 Winter | 欧洲 Europe | 173 | 26.36 |
| Orlando | 冬性 Winter | 欧洲 Europe | 170 | 21.82 |
| Prince | 冬性 Winter | 欧洲 Europe | 166 | 20.72 |
| NK Nemax | 冬性 Winter | 欧洲 Europe | 178 | 15.03 |
| NK Passion | 冬性 Winter | 欧洲 Europe | 163 | 18.07 |
| Lilian | 冬性 Winter | 欧洲 Europe | 164 | 14.47 |
| Barrel | 冬性 Winter | 欧洲 Europe | 170 | 16.87 |
| Amber x Commanche DH line | 冬性 Winter | 欧洲 Europe | 166 | 19.31 |
| Apex-93_5 x Ginyou_3 DH line | 半冬性 Semi-Winter | 欧洲/中国 Europe/China | 158 | 41.62 |
| Canberra x Courage DH line | 冬性 Winter | 欧洲 Europe | 168 | 26.46 |
| Licrown x Express DH line | 冬性 Winter | 欧洲 Europe | 174 | 12.56 |
| Shannon x Winner DH line | 冬性 Winter | 欧洲 Europe | 167 | 8.87 |
| Norin | 冬性 Winter | 日本 Japan | 174 | 72.67 |
| Mansholt | 冬性 Winter | 欧洲 Europe | 173 | 75.46 |
| Samourai | 冬性 Winter | 欧洲 Europe | 171 | 14.09 |
| Sollux | 冬性 Winter | 欧洲 Europe | 170 | 85.53 |
| Maplus | 冬性 Winter | 欧洲 Europe | 166 | 21.00 |
| Lirabon | 冬性 Winter | 欧洲 Europe | 172 | 49.09 |
| Darmor | 冬性 Winter | 欧洲 Europe | 170 | 46.58 |
| Falcon | 冬性 Winter | 欧洲 Europe | 170 | 17.13 |
| Mohican | 冬性 Winter | 欧洲 Europe | 173 | 30.66 |
| Flip | 冬性 Winter | 欧洲 Europe | 172 | 14.92 |
| Zenith | 冬性 Winter | 欧洲 Europe | 165 | 29.12 |
| Phil | 冬性 Winter | 欧洲 Europe | 173 | 18.42 |
| Leopard | 冬性 Winter | 欧洲 Europe | 166 | 25.93 |
| RESYN-H048 | 冬性 Winter | 欧洲 Europe | 170 | 77.10 |
| Resyn-Gö S4 | 冬性 Winter | 欧洲 Europe | 175 | 80.87 |
| Resyn-Gö H226 | 冬性 Winter | 欧洲 Europe | 170 | 43.45 |
| Baltia | 冬性 Winter | 欧洲 Europe | 173 | 38.01 |
| Brink | 冬性 Winter | 欧洲 Europe | 170 | 78.53 |
| Ceres | 冬性 Winter | 欧洲 Europe | 172 | 19.70 |
| Coriander | 冬性 Winter | 欧洲 Europe | 170 | 89.44 |
| Dippes | 冬性 Winter | 欧洲 Europe | 174 | 97.29 |
| Doral | 冬性 Winter | 欧洲 Europe | 170 | 91.75 |
| 品种名称 Cultivar name | 类型 Type | 来源 Origin | 生育期 Growth duration (d) | 成熟种子硫苷含量 GS content in mature seeds (μmol∙g-1) |
| Gross-Luesewitzer | 冬性 Winter | 欧洲 Europe | 174 | 111.83 |
| G7403/2016rwitz | 冬性 Winter | 欧洲 Europe | 171 | 88.76 |
| Hokkai 3-Go | 冬性 Winter | 欧洲 Europe | 162 | 70.70 |
| Janpol | 冬性 Winter | 欧洲 Europe | 171 | 91.25 |
| Jantar | 冬性 Winter | 欧洲 Europe | 176 | 15.00 |
| Krapphauser | 冬性 Winter | 欧洲 Europe | 168 | 73.34 |
| Kromerska | 冬性 Winter | 欧洲 Europe | 168 | 22.86 |
| Liglory | 冬性 Winter | 欧洲 Europe | 174 | 19.07 |
| Liporta | 冬性 Winter | 欧洲 Europe | 162 | 20.17 |
| Lirafit | 冬性 Winter | 欧洲 Europe | 171 | 23.19 |
| Lirakotta | 冬性 Winter | 欧洲 Europe | 173 | 91.90 |
| Madora | 冬性 Winter | 欧洲 Europe | 175 | 59.32 |
| Mestnij | 冬性 Winter | 欧洲 Europe | 165 | 22.16 |
| Mytnickij | 冬性 Winter | 欧洲 Europe | 173 | 85.70 |
| Nemertschanskij 1 | 冬性 Winter | 欧洲 Europe | 175 | 103.64 |
| QuedlinburgerPlatzfester | 冬性 Winter | 欧洲 Europe | 172 | 100.09 |
| Skrzeszowicki | 冬性 Winter | 欧洲 Europe | 173 | 79.73 |
| Skziverskij | 冬性 Winter | 欧洲 Europe | 167 | 88.96 |
| SlovenskaKrajova | 冬性 Winter | 欧洲 Europe | 170 | 85.84 |
| Sonnengold | 冬性 Winter | 欧洲 Europe | 172 | 87.68 |
| Trebicska | 冬性 Winter | 欧洲 Europe | 173 | 98.55 |
| Wolynski | 冬性 Winter | 欧洲 Europe | 173 | 100.52 |
| V8 | 冬性 Winter | 欧洲 Europe | 178 | 62.25 |
| K26-96 | 冬性 Winter | 欧洲 Europe | 170 | 57.63 |
| R53 | 冬性 Winter | 欧洲 Europe | 167 | 43.13 |
| Canard | 冬性 Winter | 欧洲 Europe | 174 | 67.67 |
| Moana, Moana rape | 冬性 Winter | 欧洲 Europe | 170 | 98.10 |
| Emerald | 冬性 Winter | 欧洲 Europe | 178 | 81.92 |
| Parapluie | 冬性 Winter | 欧洲 Europe | 175 | 66.13 |
| Silona | 冬性 Winter | 欧洲 Europe | 168 | 104.20 |
| Cabriolet | 冬性 Winter | 欧洲 Europe | 169 | 17.71 |
| Inca x Contact | 冬性 Winter | 欧洲 Europe | 170 | 16.86 |
| Quinta | 冬性 Winter | 欧洲 Europe | 175 | 83.46 |
| Vision | 冬性 Winter | 欧洲 Europe | 174 | 28.24 |
| Bronze-535 | 冬性 Winter | 欧洲 Europe | 164 | 28.94 |
| Cracker-531 | 冬性 Winter | 欧洲 Europe | 169 | 25.79 |
| Cracker-532 | 冬性 Winter | 欧洲 Europe | 171 | 16.99 |
新窗口打开
试验材料于2015年9月至2016年5月在中国农科院油料所武昌基地种植,每份材料种植2行区(行长2.2 m,行距0.3 m,株距0.2 m),设置3次重复(均取样),随机区组排列。进入盛花期,在每个小区选取3株长势健壮的单株,在主花序上用棉线标记当天开放的花朵,然后套袋自交,谢花后及时去除袋子,让其继续正常生长发育。分别在授粉后的15 d(15 DAP)和25 d(25 DAP)采集鲜嫩角果,小区内单株间混样,立即投入液氮速冻,真空冷冻干燥后将角果皮和幼嫩种子手工剥离,4℃密封保存备用。成熟时,在相同的单株上收获种子。
1.2 硫苷检测方法
对每次重复的混合样品进行硫苷检测,最后以3次重复的平均值作为最终硫苷含量。依照[24-25]的方法提取、测定硫苷。各称取0.1 g自然干燥的成熟油菜种子、低温冷冻干燥的幼嫩角果皮以及幼嫩种子。将样品加入到含有300 μL 70%甲醇溶液以及一个直径4 mm钢珠的2 mL离心管中。用高速研磨机将样品研磨充分,再加入700 μL的70%甲醇溶液以及100 μL浓度为5 μmol∙L-1的丙烯基硫苷标准液。超声波提取10 min后,5 000×g离心取上清。用1 mL 70%甲醇再提取一次。将100 μL混合后的提取液加到含甲酸咪唑处理过的葡聚糖凝胶的96孔水系过滤板中,分别用300 μL浓度为1 mol∙L-1的乙酸钠溶液冲洗两次,加入硫酸酯酶,35℃酶解过夜。以超纯水洗涤过滤板,收集滤液加载到高效液相色谱仪(安捷伦1200,美国)中,色谱条件参照国际硫苷检测标准[25]。1.3 转录组测序及SNP和GEM的检测
RNA提取、测序、标记开发试验在英国约克大学进行。用E.Z.N.A植物RNA试剂盒(Omega Bio-tek, 400 Pinnacle Way, Ste 450, Norcross, GA 30071)提取三叶期油菜幼苗的叶片RNA,具体提取方法参照试剂盒提供的说明书进行。用焦炭酸二乙酯处理过的纯水溶解提取的RNA样品。取1 μL RNA样品在安捷伦RNA 6000 NanoLabChip上检测RNA的浓度和质量。符合质量要求的RNA样品在Illumine HiSeq2500平台测序,后续的数据分析和标记开发按照笔者课题组前期建立的方法进行[23,26-27]。将每一个样品的RNA-seq数据锚定到最近建立的油菜A和C泛转录组参考序列(pan-transcriptome resources for the Brassica A and C genomes)上[28],通过序列比对和meta分析鉴定开发出SNP标记。SNP标记的质量控制标准是:去除测序深度<10,碱基测序质量<Q20,数据缺失>0.25,等位基因数>3的SNP位点。
GEM标记的开发方法:对油菜泛转录组参考序列中的116 098个CDS(coding DNA sequence)进行数量化和均一化,计算各个CDS在关联群体不同品种中的相对表达量(用RPKM值表示),共获得116 098个GEM标记。其中,53 889个标记表达显著(平均RPKM值>0.4)。
1.4 SNP关联分析
首先在PSIKO软件包中利用所有的SNP标记计算获得Q矩阵[29],然后将Q矩阵、SNP数据和表型数据导入到TASSEL 3.0中[30]。其次,在TASSEL中去掉最小等位频率小于0.01的SNP数据,计算能估计品种间亲缘关系的K矩阵[27]。最后,将所有的数据导入到一个混合线性模型(MLM)中,计算单个SNP标记的显著性P值和效应值,再用R包画出manhattan散点图[22]。1.5 GEM关联分析
首先去除表达量(RPKM)小于0.4的GEM标记,然后再用GAPIT R包中的线性回归方法计算基因表达量和GS含量的关系。对于每一个GEM标记(即unigene),以RPKM值为自变量,GS为因变量进行回归分析,输出每一个unigene的R2和显著性P值。以每个标记的P值取对数后的负值为纵坐标,以标记在染色体上的物理位置为横坐标,绘制曼哈顿散点图,方法同上。关联分析显著性采用Bonferroni阈值为标准,计算公式为:P=0.05/标记数量。同时还采用5%错误发现率(FDR)为标准,其含义为在最显著关联的标记中有5%被认为是假阳性。
2 结果
2.1 不同组织硫苷含量的动态变化
在关联分析群体中,采集15 DAP、25 DAP的幼嫩角果以及自然成熟的种子,并将角果分解为角果皮和幼嫩种子两部分后分别测定其硫苷含量,结果见表2。授粉后15 d,种子处于发育早期,干物质较少,种子硫苷含量平均值仅为7.58 μmol∙g-1,但变幅较大(变异系数为50%),从最低的1.69 μmol∙g-1到最高的20.45 μmol∙g-1。同样,同一时期中角果皮的硫苷含量较低,平均值仅有4.8 μmol∙g-1,但变异系数更大,达到95%。由此可见,在授粉15 d内硫苷并没有在角果皮及种子中大量积累。Table 2
表2
表2油菜种子和角果皮硫苷含量的表型变异
Table 2Phenotypic variations of GS content (μmol∙g-1)
| 发育时期 Developing stage | 组织部位 Tissue | 最小值 Minimum | 最大值 Maximum | 平均值±标准误差 Mean±SE | 变异系数 CV (%) |
|---|---|---|---|---|---|
| 授粉后15 d 15 DAP | 种子Seeds | 1.69 | 20.45 | 7.58±0.65 | 50.38 |
| 授粉后15 d 15 DAP | 角果皮Silique walls | 1.47 | 25.23 | 4.81±0.76 | 94.98 |
| 授粉后25 d 25 DAP | 种子Seeds | 2.17 | 147.21 | 12.37±1.73 | 148.42 |
| 授粉后25 d 25 DAP | 角果皮Silique walls | 0.73 | 130.77 | 19.45±2.66 | 145.19 |
| 成熟期 Mature | 种子Seed | 8.87 | 111.83 | 41.18±2.82 | 72.83 |
新窗口打开
授粉25 d后,种子发育处于中间阶段,已经积累了较多的干物质。测定结果表明,种子和角果皮中的硫苷含量出现明显上升。其中,种子的平均硫苷含量为12.37 μmol∙g-1,比15 DAP种子的硫苷含量升高63%,而且基因型之间的变化大(变异系数为148%),个别基因型(Norin)的含量高达147.21 μmol∙g-1,是15 DAP时期含量的8.3倍。角果皮的硫苷含量平均值为19.45 μmol∙g-1,是同时期种子含量的1.6倍,也比15 DAP的角果皮含量高3.0倍,基因型之间的差异也很大。
种子成熟后(约授粉后50 d),硫苷含量总体上进一步升高,平均为41.18 μmol∙g-1,是25 DAP种子硫苷含量的3.3倍,是15 DAP种子硫苷含量的5.4倍;变异范围在8.87—111.83 μmol∙g-1。群体中的硫苷含量最高值也下降到111.83 μmol∙g-1,不及25 DAP种子的最高值。由此可见,硫苷的合成、运输和积累是一个十分复杂的动态变化过程。
相关性分析结果表明,25 DAP种子硫苷含量与同时期角果皮硫苷含量的相关系数为0.34(P<0.05),25 DAP种子硫苷含量与成熟种子硫苷含量的相关系数为0.26(P<0.05),成熟种子硫苷含量与25 DAP角果皮硫苷含量的相关系数为0.53(P<0.01)(表3)。由此可见,油菜成熟种子中的硫苷含量明显与前期角果皮的硫苷含量呈正相关关系,表明角果皮中的硫苷可能在后期转运到种子中,最后促使油菜种子中的硫苷含量大量增加。
Table 3
表3
表3油菜不同时期、组织中的硫苷含量的相关性
Table 3The correlation of GS content in different tissues at different developing stages
| 成熟种子 Mature seeds | 授粉25 d后种子 25 DAP seeds | 授粉25 d后角果皮 25 DAP silique walls | 授粉15 d后种子 15 DAP seeds | |
|---|---|---|---|---|
| 授粉25 d后种子 25 DAP seeds | 0.26* | |||
| 授粉25 d后角果皮 25 DAP silique walls | 0.53** | 0.34* | ||
| 授粉15 d后种子 15 DAP seeds | 0.46** | -0.11 | 0.54** | |
| 授粉15 d后角果皮 15 DAP silique walls | 0.55** | -0.10 | 0.63*** | 0.62*** |
新窗口打开
25 DAP种子和25 DAP角果皮硫苷含量及成熟种子硫苷含量的变异系数都非常大,且呈连续性分布(图1)。这表明这3个性状受多基因控制,属于数量性状遗传。因此,适合对其进行关联作图分析。
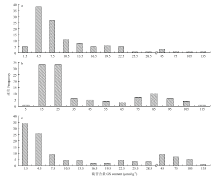 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1硫苷含量的频次分布图
a:授粉后25 d的种子;b:成熟种子;c:授粉后25 d的角果皮
-->Fig. 1Frequency distribution of GS content
a: seeds 25 days after pollination ; b: mature rapeseeds; c: silique walls 25 days after pollination
-->
2.2 SNP关联分析
去除次等位频率(MAF)小于0.01的SNP标记,得到256 397个高质量的SNP标记用于关联分析。以校正后的Bonferroni值(P=0.05/256397=1.95×10-7)为显著性标准,取负对数后的近似值为6.71。对于25 DAP种子的硫苷含量,利用SNP标记进行关联分析,共筛选到158个显著关联的SNP位点(图2-a),这些SNP位点来源于105个CDS。除C4染色体外,其余染色体均有显著关联的SNP位点分布,其中分布较多的染色体是A3、C1和C3。然而,这些SNP位点并没有形成明显的关联峰。
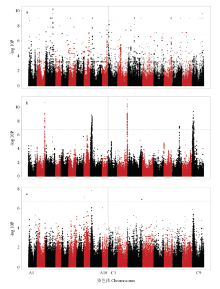 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2硫苷含量的SNP关联分析
a:授粉后25 d的种子;b:成熟种子;c:授粉后25 d的角果皮。显著性阈值为-log10P=6.71
-->Fig. 2SNP association mapping of glucosinolate contents
a: Seeds 25 days after pollination; b: Mature seeds; c: Silique walls 25 days after pollination. The significance threshold -log10P=6.71
-->
对成熟种子的硫苷含量进行关联分析,总共检测到167个显著的SNP位点,来源于57个CDS(部分CDS检测到2—4个位点)。这些SNP位点在A2、A9、C2、C7和C9染色体上形成5个非常明显的关联峰(图2-b)。其中,A9染色体上标记数量最多,达到58个,分布在19个CDS上;位于A2染色体上的标记Cab021711.1:1953:A显著性最高(-log10P=10.7),可解释表型变异的68%(表4)。相较于25 DAP种子硫苷的SNP关联分析,成熟种子硫苷的SNP关联分析检测到的关联位点更加集中。
Table 4
表4
表4成熟种子硫苷含量SNP关联分析结果
Table 4SNP association peak for glucosinolate content in mature seeds
| 关联峰名称 Code for association peak | 代表性SNP Lead SNP | 显著性 -log10P | 贡献率 R2 | 染色体Chromosome | 物理位置 Position | 显著性标记个数 Number of significant markers | CDS个数 Number of CDS |
|---|---|---|---|---|---|---|---|
| SNPb-A2 | Cab021711.1:1953:A | 10.70 | 0.51—0.68 | A2 | 032960934—033185814 | 14 | 6 |
| SNPb-A9 | Cab038252.1:822:G | 8.79 | 0.50—0.59 | A9 | 003504071—005956684 | 58 | 19 |
| SNPb-C2 | Bo2g161630.1:1484:C | 10.43 | 0.50—0.70 | C2 | 050744453—051512787 | 43 | 11 |
| SNPb-C7 | Bo7g098660.1:1137:A | 7.19 | 0.51—0.52 | C7 | 038634261—038654259 | 6 | 2 |
| SNPb-C9 | Bo9g017380.1:522:T | 9.35 | 0.50—0.62 | C9 | 001878509—007582193 | 47 | 19 |
新窗口打开
为了探讨角果皮在硫苷合成和转运中的作用,对授粉后25天的角果皮硫苷含量也进行SNP关联分析(图2-c)。结果表明,仅在A8、A9和C3染色体上各检测到1个显著关联位点,远远少于种子的检测结果。
2.3 GEM关联分析
去除表达量(RPKM)小于0.4的GEM标记,得到53 889个高质量GEM标记,其中,25 834个位于A基因组,28 055个位于C基因组。以硫苷含量为因变量,GEM标记为自变量,利用混合线性模型进行关联分析。以校正后的Bonferroni值(P=0.05/53889= 9.28×10-7)为显著性标准,取负对数后的近似值为6.03。另外,在控制假阳性率的情况下,利用多重假设检验FDR=0.05来检测可能由于Bonferroni值太过严格而遗漏的候选基因或关联区间。结果显示,与25 DAP种子硫苷含量显著关联的GEM标记有16个,分布于A2、A3、A8、A9、C2、C3、C5和C9染色体上,其中分布在A8和C2染色体上的标记较多,分别为5个和3个,其余染色体仅有1—2个标记(图3-a)。若以FDR检验为标准(-log10P=4.5),则筛选到的标记数量达到45个。
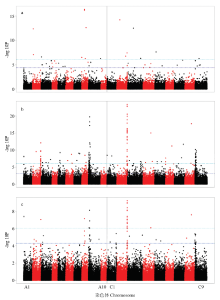 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3硫苷含量的GEM关联分析
a:授粉后25 d的种子;b:成熟种子;c:授粉后25 d的角果皮。浅蓝色虚线为取负对数后的Bonferroni阈值(6.03);深蓝色虚线为FDR显著性阈值
-->Fig. 3GEM association mapping of glucosinolate contents
a: Seeds 25 days after pollination; b: Mature seeds; c: Silique walls 25 days after pollination. The light blue line presents the significance of Bonferroni threshold (6.03). The navy blue line presents the significant FDR threshold
-->
成熟种子硫苷含量共检测到127个显著GEM标记,分布于除A4和A10染色体外的其他所有17条染色体上(图3-b),其中在A2、A9、C2和C9染色体上出现了4个明显的关联峰(表5),即GEMb-A2、GEMb-A9、GEMb-C2和GEMb-C9,其中位于GEMb-C2上的标记数量最多(标记Bo2g161790.1的显著性高达-log10P=23.42,贡献率为65%);其次是GEMb-C9,含有26个标记,显著性最高为-log10P= 10.15;标记最少的峰是GEMb-A2,仅有13个,且代表性标记Cab021665.1的显著性仅为-log10P=12.1。
Table 5
表5
表5成熟种子及授粉25天角果皮硫苷含量GEM关联分析结果
Table 5Association mapping of glucosinolate contents in mature seeds and 25 DAP silique walls with GEM
| 关联峰名称 Code for association peak | 代表性GEM Lead GEM | 显著性 -log10P | 贡献率 R2 | 染色体 Chromosome | 位置 Position | 显著性标记个数 Number of significant markers |
|---|---|---|---|---|---|---|
| GEMb-A2 | Cab021665.1 | 12.10 | 0.22—0.40 | A2 | 32747192—033434395 | 13 |
| GEMb-A9 | Cab038300.1 | 19.76 | 0.22—0.58 | A9 | 001907083—005873254 | 22 |
| GEMb-C2 | Bo2g161790.1 | 23.42 | 0.22—0.65 | C2 | 050486640—052040063 | 28 |
| GEMb-C9 | Bo9g008130.1 | 10.15 | 0.22—0.35 | C9 | 001872683—005305598 | 26 |
| GEMc-A8 | Cab037416.1 | 7.14 | 0.17—0.25 | A8 | 010989492—013307044 | 5 |
| GEMc-A9 | Cab038386.2 | 8.12 | 0.19—0.31 | A9 | 002465183—004136068 | 7 |
| GEMc-C2 | Bo2g164130.1 | 9.23 | 0.18—0.33 | C2 | 050898605—052105646 | 20 |
| GEMc-C9 | Bo9g001100.1 | 5.37 | 0.15—0.19 | C9 | 000019404—003889850 | 11 |
新窗口打开
授粉25 d后角果皮硫苷含量共检测到24个显著性标记,分布于A1、A2、A8、A9、C2、C4和C8染色体上(图3-c)。C9染色体上有一个明显的关联峰,但未达Bonferroni显著性阈值,因此采用假阳性率FDR=0.05为新的阈值来筛选关联区间,最终得到GEMc-A8、GEMc-A9、GEMc-C2和GEMc-C9四个关联区间(表5)。
2.4 不同标记关联分析比较
GEM关联分析表明,25 DAP角果皮与成熟种子的硫苷含量共同检测到3个明显重合的关联区间,分别位于A9、C2和C9上(图3和表5)。不仅在区间上存在重合,而且有22个显著标记在两个性状间也是相同的。而成熟种子与25 DAP种子的硫苷含量却只检测到1个共同的显著标记,25 DAP种子与25 DAP角果皮的硫苷则没有检测到共有的显著标记。作为对比,在SNP关联分析中,各个性状之间没有检测到共同的标记。但是,以显著性SNP标记所在的CDS为目标,SNP标记关联分析共筛选出165个CDS,其中有14个同时被GEM标记关联分析检测到(共筛选出的144个CDS)(表6)。
Table 6
表6
表6SNP和GEM共同检测到的CDS
Table 6Common CDS detected by SNP and GEM in association mapping
| CDS | 染色体 Chromosome | 位置 Position | 显著性 -log10P | 拟南芥同源基因 Arabidopsis homologue gene | 注释 Annotation |
|---|---|---|---|---|---|
| Bo2g164170.1 | C2 | 051298836—051300601 | 20.53 | AT4G28360.1 | 核糖体蛋白L22p / L17e家族蛋白 Ribosomal protein L22p/L17e family protein |
| Bo2g161630.1 | C2 | 050925826—050930832 | 17.92 | AT5G61780.1 | TUDOR-SN蛋白2 TUDOR-SN protein 2 |
| Bo2g164000.1 | C2 | 051193078—051194563 | 15.75 | AT5G62200.1 | 胚胎特异性蛋白3 Embryo-specific protein 3, (ATS3) |
| Bo2g164140.1 | C2 | 051279237—051280578 | 15.58 | ||
| Bo2g163990.1 | C2 | 051188221—051191814 | 15.48 | AT5G62190.1 | DEAD盒RNA剪切酶 DEAD box RNA helicase (PRH75) |
| Bo2g161640.1 | C2 | 050931684—050934267 | 11.98 | AT5G61790.1 | 钙联接蛋白1 Calnexin 1 |
| Bo9g008120.1 | C9 | 001878509—001881282 | 10.14 | AT3G27020.1 | 烟草胺转运蛋白 YELLOW STRIPE like 6 |
| Bo2g161720.1 | C2 | 050978119—050984221 | 10.11 | AT5G61910.4 | 发育与细胞死亡相关蛋白 DCD (Development and Cell Death) domain protein |
| Cab021724.1 | A2 | 033083524—033079765 | 9.73 | AT5G61790.1 | 钙联接蛋白1 Calnexin 1 |
| Cab040075.1 | A9 | 005875272—005873254 | 8.62 | AT2G14910.1 | |
| Cab040078.1 | A9 | 005861746—005860402 | 7.93 | AT2G14860.1 | 过氧化物酶体膜22kDa家族蛋白 Peroxisomal membrane 22 kDa (Mpv17/PMP22) family protein |
| Bo9g012580.1 | C9 | 003794670—003806441 | 7.79 | AT5G24710.1 | 转导蛋白/WD40重复超家族蛋白 Transducin/WD40 repeat-like superfamily protein |
| Cab021711.1 | A2 | 033148871—033144959 | 6.46 | AT5G61960.2 | MEI2类似蛋白1 MEI2-like protein 1 |
| Cab038368.1 | A9 | 003504071—003499920 | 6.32 | AT5G24150.1 | 结合FAD/NAD(P)的氧化还原家族蛋白 FAD/NAD(P)-binding oxidoreductase family protein |
新窗口打开
另外,本研究检测到的主要关联区域与前人报道结果相吻合[13-14,31-32](表7)。比如,FENG等[31]利用DH群体定位到的油菜种子硫苷含量的4个QTL,以及LI等[33]利用472份油菜进行关联分析获得的3个关联区段,在本研究中得到进一步证实。以上比对结果说明,本研究所采用的技术策略是有效的,而且比前人检测到更多显著的关联标记,因而功能更加强大。
Table 7
表7
表7不同油菜成熟种子硫苷含量定位研究的比较
Table 7The comparison of different traits on genetic analysis of GS content of mature rapeseed
| 文献 References | 群体类型 Population types | 群体大小 Population size | 标记类型 Maker types | 标记个数 Number of markers | 重合区间 Common intervals |
|---|---|---|---|---|---|
| [14] | DH群体 DH population | 71 (DH38), 64 (DH30) | AFLP, SSR | 321 (DH38), 300 (DH30) | SNPb-A9 |
| [31] | DH群体 DH population | 202 | SSR, STS, SNP, SSCP, RFLP, CAPS, AFLP | 786 | SNPb-A9, SNPb-C2, SNPb-C7, SNPb-C9 |
| [13] | 自然群体 Nature population | 472 | SNP | 26841 | SNPb-A9, SNPb-C2, SNPb-C7 |
| [32] | DH群体 DH population | 261 | SSR | 316 | SNPb-A2, SNPb-A9 |
新窗口打开
2.5 候选基因的预测
以拟南芥基因功能注释为参考,通过序列相似性比对来筛选与硫苷代谢相关的油菜同源基因。整合不同时期、不同组织器官硫苷含量检测到的关联区间,共得到6个关联区间,分别位于A2、A8、A9、C2、C8和C9染色体上。在关联区间内提取所有显著的CDS,将CDS的序列比对到拟南芥数据库(Tair,www.arabidopsis.org),并进行功能注释(表8)。在A2、A9、C2和C9染色体上共发现15个参与硫苷代谢的候选基因。其中A2染色体关联区间内所含候选基因最少,只有2个候选基因,而其他区间都含有4—5个候选基因。在4个关联区间内,MYB28转录因子蛋白被重复检测到,而且该转录因子在以往关联分析研究中也被多次检测出与种子硫苷存在明显的关联性[22,23]。而其他基因则在硫元素同化、氨基酸合成、硫苷核心结构生成以及硫苷转运过程中发挥重要作用。Table 8
表8
表8SNP和GEM关联峰内筛选到的候选基因
Table 8Summary of candidate genes within association peaks with SNPs and GEMs
| 染色体 Chromosome | 关联峰区间 Association peak intervals | 候选基因 Candidate gene | 位置 Position | 拟南芥同源基因 Arabidopsis homologue gene | 注释 Annotation |
|---|---|---|---|---|---|
| A2 | 032747192—033434395 | Cab021778.1 | 032747192—032742935 | AT5G23010.1 | MAM1 |
| Cab021728.1 | 033057664—033056053 | AT5G61420.2 | MYB28 | ||
| A9 | 001907083—005873254 | Cab040088.1 | 005722596—005721362 | AT2G14750.1 | APK |
| Cab040082.1 | 005807580—005805353 | AT5G26000.1 | BGLU38 | ||
| Cab040081.1 | 005834008—005831285 | AT5G26000.1 | BGLU38 | ||
| Cab038298.3 | 003885476—003883159 | AT5G61420.1 | MYB28 | ||
| Cab038255.1 | 004179370—004177015 | AT5G62680.1 | GTR2 | ||
| C2 | 050486640—052105646 | Bo2g161100.1 | 050486640—050490897 | AT5G23010.1 | MAM1 |
| Bo2g161170.1 | 050563060—050567283 | AT5G60890.1 | ATR1 | ||
| Bo2g161180.1 | 050584964—050586148 | AT5G60890.1 | ATR1 | ||
| Bo2g161590.1 | 050898605—050900210 | AT5G61420.2 | MYB28 | ||
| C9 | 000019404—007582193 | Bo9g006220.1 | 001386905—001389231 | AT4G03050.1 | AOP3 |
| Bo9g006240.1 | 001403914—001405348 | AT4G03050.1 | AOP3 | ||
| Bo9g014950.1 | 004682547—004683445 | AT4G13430.1 | LEUC1 | ||
| Bo9g014610.1 | 004435723—004437065 | AT5G61420.2 | MYB28 | ||
| Bo9g015100.1 | 004824486—004826864 | AT5G62680.1 | GTR2 |
新窗口打开
在关联峰区间外提取两种显著标记(SNP或者GEM)所在的CDS,并进行功能注释,筛选出与硫苷代谢相关的候选基因(表9)。以SNP为标记共检测到3个硫苷代谢相关候选基因。其中,BnWRKY21和BnMYB73拟南芥突变体表现为明显的低硫苷水平[33],而BnCYP81D3则是预测为吲哚族硫苷代谢相关的基因。这3个候选基因都是在25 DAP种子的关联分析中检测到的,分布在A3和C1染色体上。GEM关联分析仅在成熟种子中检测到6个硫苷代谢相关候选基因,分布在A3、A6、C5和C7等多个染色体上。
Table 9
表9
表9关联峰区间外筛选到的候选基因
Table 9Summary of candidate genes out of association peak intervals
| 标记类型 Type of the markers | 基因 Gene | 表型 Trait | 显著性 -log10P | 染色体 Chromosome | 位置 Position | 拟南芥同源基因 Arabidopsis homologue gene | 注释Annotation |
|---|---|---|---|---|---|---|---|
| SNP | Cab002516.1 | 25 DAP种子 Seed 25 DAP | 7.76 | A3 | 007802516—007804932 | AT2G30590.1 | WRKY21 |
| Bo1g004770.1 | 25 DAP种子 Seed 25 DAP | 7.05 | C1 | 000976293—000979013 | AT4G37340.1 | CYP81D3 | |
| Bo1g004900.1 | 25 DAP种子 Seed 25 DAP | 7.05 | C1 | 001028299—001029276 | AT4G37260.1 | MYB73 | |
| GEM | Bo7g098000.1 | 成熟种子 Mature seed | 7.72 | C7 | 038240972—038243771 | AT5G23010.1 | MAM1 |
| BnaA06g11000D | 成熟种子 Mature seed | 6.90 | A6 | 006601832—006604159 | AT1G16400.1 | CYP79F2 | |
| BnaA06g11010D | 成熟种子 Mature seed | 6.88 | A6 | 006605612—006607992 | AT1G16410.1 | CYP79F1 | |
| Bo5g021810.1 | 成熟种子 Mature seed | 6.57 | C5 | 007831826—007834735 | AT1G16410.1 | CYP79F1 | |
| Cab003764.1 | 成熟种子 Mature seed | 6.29 | A3 | 014678186—014683453 | AT4G03060.1 | AOP2 | |
| Cab001426.1 | 成熟种子 Mature seed | 6.21 | A3 | 022866685—022869101 | AT5G23010.1 | MAM1 |
新窗口打开
3 讨论
利用一个欧洲甘蓝型冬油菜自然群体,首次开展了不同组织器官硫苷含量动态变化分析和转录组关联分析。硫苷主要分布在成熟种子以及授粉25 d后的角果皮中,而幼嫩种子中的硫苷含量很少。相关分析表明,成熟种子中硫苷积累量与角果皮中硫苷的含量存在明显的正相关关系。在GEM标记的关联分析中,25 DAP角果皮检测到的显著性GEM标记大部分(92%)在成熟种子中能重复检测到,暗示油菜中的硫苷也可能像拟南芥、芜菁以及芥菜一样存在由角果皮到种子的转运过程[10,34]。甘蓝型油菜具有A和C两个染色体组,分别来源于白菜和甘蓝。这两套遗传物质非常相似,其中在结构上存在大约15%的差异,而表达模式仅存在3%的差异[22,35]。这种染色体间高度的序列相似性严重影响到全基因组关联分析的检测效果。为此,本研究利用了一种新的关联分析技术—转录组关联分析(associative transcriptomic,AT),这种技术既可以产生高密度的SNP标记,同时也能产生大量的GEM标记。利用这两种标记来分析控制表型性状的遗传机制能克服全基因组关联分析在多倍体中应用的不足[23]。有研究表明,大量基因在幼嫩叶片中表达,叶片是营养生长阶段硫苷合成的主要部位,在生殖生长阶段再转运至植株的其他组织器官中[10,24,36-37]。因此,叶片上表达的基因与后期角果皮以及种子中硫苷的积累存在生物学上的联系。在本研究中,利用油菜嫩叶提取的RNA,通过转录组测序技术开发了大量的SNP和GEM标记,在此基础上对油菜两个发育时期的种子以及角果皮硫苷含量进行转录组关联分析。结果发现,在成熟种子中共检测到5个明显的关联峰,其位置与前人的QTL作图分析以及普通全基因组关联分析结果相吻合[13-14,31-32]。这也表明,转录组关联分析方法具有很好的可靠性和稳定性。利用SNP和GEM标记分别检测出165和144个候选CDS,其中有14个CDS被两种标记共同检测到。通过拟南芥同源基因功能注释,发现GEM检测到与硫苷直接相关候选基因的比例明显多于SNP标记。这进一步说明,转录组数据提供额外的GEM标记能对全基因组关联分析方法起到验证作用和补充效果。
基于动态表型性状,关联分析可以充分挖掘控制表型性状的遗传位点[16]。本研究中,在成熟种子中共扫描到5个关联峰,在25 DAP角果皮中共扫描到4个关联峰,而在25 DAP种子中没有扫描到明显的关联峰。以上结果说明,仅仅进行单一发育时期或单一组织器官的关联分析可能会遗漏掉很多重要的遗传位点,而这些差异的遗传位点正是解释表型动态变化的关键位点[17]。以上结果还说明,不同时期表型的变异受到不同遗传位点调控[18]。利用GEM标记,在成熟种子与嫩角果皮中检测到22个共同的候选基因,其中大部分候选基因与硫苷合成相关。其原因可能是,种子与角果皮中的硫苷都是在其他部位(如叶片)合成后运输过来的。
本研究中,成熟种子和角果皮中均检测到3个与硫苷显著关联的标记(Cab021728.1、Cab038298.3和Bo2g161590.1)。这3个标记对应的基因有着明显的序列相似性,均编码转录因子蛋白(Myb28),它能通过调控多个硫苷通路上的基因来影响脂肪族硫苷的合成[22,23]。在成熟种子中还检测到多个表达MAM1蛋白的基因,其氨基酸序列与2-异丙基苹果酸合成酶序列高度相似,在硫苷合成过程中控制脂肪族硫苷R链的延伸[38]。在大白菜中超表达拟南芥MAM1能导致3-丁烯基硫代葡萄糖苷以及4-戊希基硫代葡萄糖苷的积累[39]。本研究还检测到硫苷主链合成过程中的3个基因,CYP79F1、CYP79F2和UGT74B1。其中CYP79F1和CYP79F2参与脂肪族硫苷主链合成的第一步,这些蛋白能催化甲硫氨酸同系物转化为相应的醛肟[40,41]。UGT74B1则表达一种UDP依赖性葡萄糖基转移酶。拟南芥功能互补试验表明UGT74B1控制硫苷的积累并影响植物生长素的内稳态[42,43]。AOP2能介导甲基亚砜烷基硫苷到烯烃基硫苷的转化过程,该基因产物除了能参与这种转化过程,还能促进MYB28和MYB29这两个控制硫苷合成的转录因子的表达[44,45]。虽然候选基因中还有很多并不是硫苷合成通路上的基因,但是这些基因大多属于转录因子、信号响应因子、具有氧化还原活性的酶和参与细胞过程的蛋白等。这些基因可以通过间接的方式潜在地影响硫苷的积累。例如位于A9染色体上的APK就是通过参与硫元素的同化过程从而间接影响硫苷的合成[46]。而在A9和C9染色体的关联区间内找到的GTR2则表达一种硫苷转运蛋白,这种蛋白参与硫苷的转运过程,最终影响硫苷在植物种子中的积累[10,34]。这些都可能间接影响油菜硫苷在不同部位的积累。以上结果足以说明转录组关联分析方法的强大功能。除此之外,本研究还同时检测到多个新的候选基因,这些基因的功能还不是很明确或是还没有证实与硫苷的积累有关,需要通过后续研究来进一步解析其在油菜硫苷积累中的作用。
4 结论
通过对113份甘蓝型油菜种子及角果皮硫苷含量的转录组关联分析,获得了328个显著关联的单核苷酸多态性标记(SNP)和144个基因表达量标记(GEM),预测到25个与油菜硫苷代谢相关的候选基因,以及73个功能未知的新基因,这些结果可用于油菜硫苷含量的遗传调控以及分子标记辅助选择研究。The authors have declared that no competing interests exist.
