0 引言
【研究意义】赤拟谷盗(Tribolium castaneum)属鞘翅目拟步甲科,是一类在全球范围内广泛分布的仓储害虫。同时,因赤拟谷盗繁殖能力强、易于饲养及遗传操作,被广泛地用于昆虫的生长发育、繁殖等方面的基础研究。2008年,赤拟谷盗基因组测序完成[1],进一步推动了该虫作为模式昆虫的地位,同时赤拟谷盗功能基因组学等各个领域的研究也蓬勃发展。章鱼胺(octopamine,OA)是一种在无脊椎动物神经系统普遍存在的微量生物胺,可调控昆虫的学习和记忆、节律、嗅觉、好斗与飞行等重要生理功能[2]。OA作为昆虫体内重要的神经活性物质(如神经调质、神经递质、神经激素)[3,4],被相应的神经元释放,并通过与其受体(章鱼胺受体,octopamine receptors,OctRs)结合进而发挥其生理功能[3,5]。由于章鱼胺信号传递系统在昆虫生命活动中的重要生理功能,其一直被视为新型杀虫剂潜在的作用靶标而备受关注。开展赤拟谷盗章鱼胺受体基因分子生物学特性研究,可为进一步深入揭示赤拟谷盗章鱼胺受体的生理功能打下基础,同时也将丰富对昆虫章鱼胺受体生理功能的认识。【前人研究进展】章鱼胺受体是典型的G蛋白偶联受体(G-protein coupled receptor,GPCR)。自第一个章鱼胺受体基因从黑腹果蝇(Drosophila melanogaster)[6]中克隆以来,研究人员在多种昆虫中成功克隆了章鱼胺受体基因,如烟草天蛾(Manduca sexta)、家蚕(Bombyx mori) [7]、二化螟(Chilo suppressalis)[8]和橘小实蝇(Bactrocera dorsalis)[9]等。根据章鱼胺受体的氨基酸序列和信号通路与哺乳动物肾上腺素受体的相似性,目前已鉴定的章鱼胺受体分为3类:α-adrenergic-like octopamine receptors (OctαRs)、β-adrenergic-like octopamine receptors (OctβRs)和octopamine/tyramine receptors(TyrRs)。在章鱼胺受体的转导途径中,OctαRs被激活后最初引起细胞内钙离子浓度增加,同时细胞内环腺苷酸(cAMP)的浓度也会有轻微的升高[10,11];OctβRs的3种类型被激活后均能够增加细胞内cAMP的浓度[12];TyrRs与脊椎动物α2肾上腺素受体的结构和药理学相似,它被Tyr激活后诱导细胞内cAMP水平的降低[13]。近年来,对于昆虫体内的章鱼胺受体研究日益增多,EVANS等[14]对其药理学研究较为深入,对章鱼胺受体特异、高效的激动剂和拮抗剂的筛选,有可能以章鱼胺受体作为一种潜在的药剂靶标来防控害虫[3,15]。【本研究切入点】章鱼胺受体在昆虫体内具有重要作用,而模式昆虫赤拟谷盗有关章鱼胺受体的研究未见报道。【拟解决的关键问题】利用qPCR技术,克隆赤拟谷盗OctβR3 cDNA全序列,解析其时空表达模式,借助异源表达系统和RNAi技术,明确其在昆虫体内的功能,丰富对昆虫章鱼胺受体生理功能的认识。1 材料与方法
试验于2016年5月至2017年3月在西南大学昆虫分子生态实验室完成。1.1 供试昆虫与试剂
赤拟谷盗GA1品系源自美国农业部仓储害虫研究课题组Richard Beeman实验室,由河南工业大学鲁玉杰教授馈赠。在实验室内以人工饲料(全麦粉﹕酵母粉=1﹕1),在恒温30℃、相对湿度为60%—70%、全黑暗的条件下饲养。高保真DNA聚合酶PrimerSTARTM Max Premix及PCR相关试剂均购自TaKaRa公司,Trizol试剂以及细胞培养相关试剂购自Life Technologies公司,反转录试剂盒、克隆载体pGEM®-T Easy、T4 DNA ligase、GlosensorTM cAMP Reagent购自Promega公司,iQTM SYBR® Green Supermix购自Bio-rad公司,T7体外转录试剂盒购自Thermo Scientific公司,限制性内切酶NotI-HF购自NEB公司,HEK293细胞、质粒Glosensor、pcDNA3.1(+)由美国堪萨斯州州立大学Yoonseong Park教授馈赠,转染试剂TransIT-LT1购自Mirus Bio LLC公司,PCR引物合成和测序工作均由Invitrogen公司完成。
1.2 TcOctβR3 cDNA克隆
挑取4头赤拟谷盗第7日龄成虫,加入Trizol试剂充分研磨,参照Trizol试剂说明书提取样品的总RNA,使用RQ1 Rnase-Free Dnase去除基因组DNA,并经过琼脂糖凝胶电泳和Nanodrop检测,按照反转录试剂盒说明书进行反转录合成第一链cDNA,在-20℃冰箱中保存备用。根据GenBank中的序列信息(XP-008198078),利用Oligo 6.0软件和Primer premier 5.0软件设计赤拟谷盗TcOctβR3的全长引物(表1),并用DNAMAN 6.0对所设计的引物进行评价。以反转录合成的第一链cDNA为模板,采用巢式PCR扩增,体系为25 μL:cDNA 1 μL、ddH2O 9.5 μL、PrimerSTAR Max 12.5 μL、上下游引物各1 μL。反应条件:98℃预变性3 min,98℃变性10 s,55℃退火15 s,72℃延伸90 s,进行35个循环,最后72℃后延伸10 min。用1.5%琼脂糖凝胶电泳检测,并按照TaKaRa胶回收试剂盒回收目的条带,将回收产物连接到pGEM®-T Easy载体上,并转化到感受态大肠杆菌(DH5α)中,过夜培养挑取白斑菌落,进行菌液PCR检测,挑选阳性克隆测序(Invitrogen)。
Table 1
表1
表1本研究所用引物序列
Table 1Primer sequences used in this study
| 引物类型 Primer type | 引物名称 Primer name | 引物序列 Primer sequence (5′-3′) |
|---|---|---|
| 全长验证 Full-length confirmation | TcOctβR3-F1 | GACGAAACGATGATAGTGATG |
| TcOctβR3-R1 | CTCGTTAGAGTTTCTCGTCTTG | |
| TcOctβR3-F2 | GCAATGGCTTCATTCTCAG | |
| TcOctβR3-R2 | GTATCCTGTGGCTAAAGGAAC | |
| qPCR引物 Primers for qPCR | TcOctβR3-qF | GCAGTCCAAAAGCTGGAGAG |
| TcOctβR3-qR | GCCGAGTTGAAGTAGCCAAC | |
| TcRPS-qF | CGCATTCATGGTTGATAACG | |
dsRNA引物 Primers for dsRNA | TcRPS-qR dsTcOctβR3-F dsTcOctβR3-R | GGGCACCAAGTTAGTCTGGA (T7)-TGGTACACAACGGAGGATC (T7)- CCAACATAACATGAAAGCAC |
新窗口打开
1.3 序列分析
序列分析通过DNAMAN、EdiSeq等软件完成。利用NCBI ORF finder (http://www.ncbi.nlm.nih.gov/ gorf/gorf.html)确定开放阅读框(ORF),用在线工具TMHMM(http://www.cbs.dk/services/TMHMM)进行跨膜结构域预测,利用MEGA 5.1软件构建系统进化树。1.4 TcOctβR3表达模式分析
赤拟谷盗不同发育阶段和不同组织表达模式的样品收集参照JIANG等[16]方法,具体如下:不同发育阶段选取早期卵(<1 d)、晚期卵(>2 d)、早期幼虫(<1 d)、老熟幼虫(>5龄)、早期蛹(<1 d)、晚期蛹(>3 d)、早期成虫(<1 d)、老熟成虫(7 d);选取羽化后7日龄未交配的成虫解剖不同组织,包括中枢神经系统、脂肪体、中肠、后肠、马氏管、精巢和卵巢。每个样品3个生物重复,总RNA提取和cDNA合成参照1.2节。根据1.2节中测序获得的序列设计赤拟谷盗TcOctβR3特异性qPCR引物,同时选择赤拟谷盗核糖体蛋白S3(TcRPS3)为内参基因(表1)。qPCR反应体系如下:cDNA 1 μL、GoTaq®qPCR Master Mix 10 μL、ddH2O 7 μL、上下游引物各1 μL。反应条件:95℃预变性2 min,95℃变性15 s,60℃退火30 s,60℃延伸30 s,进行40个循环,最后95℃后延伸30 s。每次试验技术重复3个,设置生物重复3次。利用2-∆∆Ct法[17]对数据进行分析。
1.5 饥饿胁迫
分别挑取4头正常饲养和饥饿处理6、12、16、24 h的赤拟谷盗孵化后10—15日龄的幼虫,加入Trizol充分研磨,总RNA提取和cDNA合成参照1.2节,每个处理3个生物重复。1.6 异源表达及活性测定
利用限制性内切酶NotI-HF单酶切pcDNA3.1(+)载体和pGEM-T-TcOctβR3质粒,于37℃孵育20 h以保证酶切效率。反应结束后琼脂糖凝胶电泳,进行目的条带分离和纯化。用FastAP(Fermentas)去磷酸化,防止载体pcDNA3.1(+)自连,随后进行纯化备用。将酶切后的目的基因与去磷酸化的pcDNA3.1(+)载体通过T4 Ligase连接,将连接产物转入感受态细胞DH5α中,接种到含有氨苄青霉素(Ampicillin)的培养基,于37℃过夜培养后,在平板上挑取单菌落,PCR菌液检测后送Invitrogene公司测序,确保获得正确的pcDNA3.1(+)-TcOctβR3重组表达质粒。用转染试剂TransIT-LT1共转染pcDNA3.1(+)- TcOctβR3质粒和GloSensor质粒到HEK293细胞中,30 h后收集细胞。活性测定参照LI等[9]的方法,略有改动。在收集的细胞中加入1% GloSensor试剂,置于磁力搅拌器上孵育2 h,利用微量滴度荧光发光检测仪自动加样,加50 μL细胞(浓度约为105个/50 μL)到96孔板中,然后测定化学发光值的变化。测试配体有章鱼胺盐酸盐(OA)、萘甲唑啉盐酸盐(NA)、酪氨盐酸盐(TA)和多巴胺盐酸盐(DA),供试配体按照10倍浓度梯度稀释。每个浓度设定3个技术重复和3个生物重复,在供试4种配体中,以NA在10 μmol·L-1的发光值为基准,数据经logistic模型拟合后计算有效中浓度EC50,所有计算使用Origin 8.6(OriginLab)软件。
1.7 RNA干扰
赤拟谷盗TcOctβR3的dsRNA特异性引物序列见表1。参照T7体外转录试剂盒(Thermo Scientific)的说明书合成dsRNA,经琼脂糖凝胶电泳检测后备用。dsRNA注射方法参照BUCHER等[18]法。挑选化蛹时间24 h内的蛹注射dsRNA,每头注射200 ng(浓度为2 000 ng·μL-1),待蛹羽化5—7 d提取4头(2雌2雄)成虫的RNA,检测沉默效率,注射相同体积的PBS为对照。待蛹羽化后第5天,用昆虫轨迹球行为记录仪测试赤拟谷盗的爬行速度。具体的试验方法参照使用说明书和THIERY等[19]方法。简言之,在测试的过程中,球体转动的方向与昆虫爬行的方向相反,但是速度始终保持一致。连续记录2 min,用TrackSphere软件处理数据。羽化第7天,将雌虫和雄虫单对配对放入装有面粉、直径3.5 cm的塑料养虫盒中,饲养5 d后记录每头雌虫的产卵量[20],共处理25对。所得产卵量使用SPSS 16.0进行统计分析(P<0.05)。
2 结果
2.1 赤拟谷盗TcOctβR3序列分析及系统进化关系分析
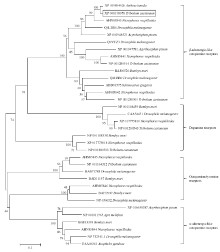
利用RT-PCR技术,克隆获得了赤拟谷盗TcOctβR3cDNA全长序列(GenBank登录号:XP-008198078)。cDNA全长1 305 bp,编码434个氨基酸。TMHMM 2.0蛋白跨膜结构预测软件分析结果表明,TcOctβR3具有7个α螺旋跨膜区(图1),是典型的G蛋白偶联受体。进一步分析结果表明,跨膜区氨基酸的位置分别位于第49—71、83—105、125—147、167—189、209—231、346—368和383—405位,且每一个跨膜域都包含23个氨基酸。该序列与鞘翅目、双翅目、鳞翅目、半翅目、直翅目和膜翅目等6个目昆虫的章鱼胺受体进行同源性比较分析并构建系统发育树(图2),结果显示,TcOctβR3与所有β类受体聚为一簇,并且与红斑尼埋葬甲(Nicrophorus vespilloides)及小蜂甲(Aethina tumida)等β类受体关系较近。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1TcOctβR3全长序列及其编码的氨基酸序列
-->Fig. 1The nucleic acid sequence of TcOctβR3 and the deduced amino acid (AA) sequence
*:终止子,跨膜结构用下划线表示Terminator, the transmembrane structure is underlined
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2TcOctβR3系统发育分析
-->Fig. 2Phylogenetic relationships analysis of TcOctβR3
生物胺受体来源及GenBank登录号:The origin of the amine receptors and their GenBank accession numbers。红斑尼埋葬甲Nicrophorus vespilloides NvesOctβR1 (AHN85841.1), NvesOctβR2 (AHN85842.1), NvesOctβR3 (AHN85843.1), NvesOctR1 (AHN85844.1), NvesTAR1 (AHN85845.1), NvesTAR2 (AHN85846.1), NvesDAR1 (XP_017775810.1), NvesDAR2 (XP_017775018.1);豌豆蚜Acyrthosiphon pisum ApisOctβR1 (XP_001947781.1), ApisOctβR3 (XP_001948521.2), ApisOctR1 (XP_016658387.1);黑腹果蝇Drosophila melanogaster DmelOctβR1 (Q9VCZ3.1), DmelOctβR2 (Q4LBB9.2), DmelOctβR3 (Q4LBB6.4), DmelOctR1 (NP_732541.1), DmelTAR1 (BAB71788.1), DmelTAR2 (NP_650652.1), DmelDAR1 (CAA54451.1);家蚕Bombyx mori BmorOctβR2 (BAJ06526.1), BmorOctR1 (BAF33393.1), BmorTAR1 (BAD11157.1), BmorTAR2 (BAI52937.1), BmorDAR1 (NP_001108459.1), BmorDAR2 (NP_001108338.1);冈比亚按蚊Anopheles gambiae AgamOctR1 (EAA06361.5);小蜂甲Aethina tumida AtumOctβR3 (XP_019864626.1);意大利蜜蜂Apis mellifera AmelOctR1 (NP_001011565.1);沙漠蝗Schistocerca gregaria SgreOctβR2 (ADD91575.1);赤拟谷盗Tribolium castaneum TcasOctβR1 (NP_001280514.1), TcasOctβR2 (NP_001280501.1), TcasOctβR3 (XP_008198078.1), TcasTAR1 (NP_001164312.1), TcasDAR1 (NP_001280543.1), TcasDAR2 (NP_001280503.1)。标尺代表遗传距离 The scale in the figure represents genetic distance
-->
2.2 TcOctβR3表达模式
TcOctβR3在赤拟谷盗的不同发育阶段包括卵、幼虫、蛹和成虫中均有所表达,在幼虫期的表达水平最高(图3-A)。TcOctβR3在所测定的成虫各组织中也均有所表达,尤其在中枢神经系统的表达量最高,其余组织表达量从高到低依次为精巢、脂肪体、卵巢、后肠、中肠和马氏管(图3-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3The expression profiles of TcOctβR3 in different developmental stages (A) and tissues (B) of T. castaneum
EE:早期卵Early egg;OE:老熟卵Old egg;EL:早期幼虫Early larva;OL:老熟幼虫Old larva;EP:早期蛹Early pupa;OP:老熟蛹Old pupa;EA:早期成虫Early adult;OA:老熟成虫Old adult;CNS:中枢神经系统Central nervous system;FB:脂肪体Fat body;HG:后肠Hindgut;MG:中肠Midgut;MT:马氏管 Malpighian tubule;OV:卵巢Ovary;TE:精巢Testis。柱上不同的字母表示经Duncan新复极差测验比较后差异显著Different letters on the bar indicate significant difference by Duncan’s multiple range tests (P<0.05)
-->Fig. 3
-->
2.3 TcOctβR3在饥饿胁迫下的表达模式
赤拟谷盗幼虫在饥饿胁迫下,TcOctβR3表达量发生明显变化(图4)。饥饿6 h,TcOctβR3的相对表达量为0.47,极显著低于对照(P<0.01);随着饥饿时间不断延长,TcOctβR3的表达量逐渐上升,在16 h最大达1.80,显著高于对照(P<0.05);饥饿24 h后,TcOctβR3表达量又恢复到正常水平。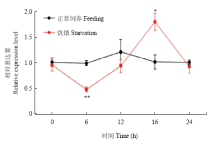 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4TcOctβR3在饥饿胁迫下的相对表达量
-->Fig. 4Relative expression levels of TcOctβR3 of T. castaneum in starvation stress
*:在P<0.05水平差异显著 Significant difference at P<0.05 level;**:在P<0.01水平差异显著 Significant difference at P<0.01 level
-->
2.4 TcOctβR3活性测定
HEK293细胞异源表达TcOctβR3后,4种供试生物胺均能呈浓度依耐性激活TcOctβR3,引起细胞内cAMP的变化(图5)。其中,NA对该受体的激动活性最高,其有效中浓度EC50为8.56×10-8 mol·L-1,而模式配体OA的激动剂活性相对较弱,EC50为8.68×10-7 mol·L-1,TA和DA的EC50分别为4.92×10-7、1.22×10-5 mol·L-1。因此,4种供试配体激动活性由强到弱为NA>TA>OA>DA。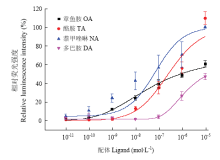 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图54种配体对表达TcOctβR3细胞内cAMP的影响
-->Fig. 5The effect of 4 aminergic ligands on cAMP levels in HEK293 cells expressing TcOctβR3
-->
2.5 RNA干扰后表型观察
采用半定量和实时定量PCR技术分析了注射dsOctβR3后TcOctβR3的表达变化情况(图6-A、6-B),结果显示,注射dsOctβR3后,靶标基因的表达量极显著下调(P<0.01),与注射PBS相比,沉默效率为61.5%。同时,赤拟谷盗羽化后第5天,用昆虫轨迹球行为记录仪测定试虫的爬行速度,结果显示,注射dsOctβR3试虫的平均爬行速度为10.30 mm·s-1,注射PBS试虫的平均爬行速度为11.61 mm·s-1,二者无显著差异(P>0.05)(图6-C)。在羽化后第7天进行雌雄配对,结果显示(图6-D),注射dsOctβR3后,赤拟谷盗雌虫在5 d内的平均产卵量为35粒,而对照的产卵量为32粒,二者亦无显著差异(P>0.05)。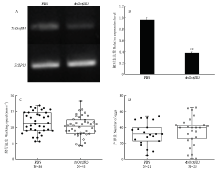 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6注射dsOctβR3后赤拟谷盗表型变化
-->Fig. 6The phenotype changes in T. castaneum after dsOctβR3 injection
A:半定量检测RNA干扰后TcOctβR3的相对表达量 Semi-quantitative RT-PCR detection of TcOctβR3 levels after RNA interference;B:实时荧光定量分析RNA干扰后TcOctβR3的转录水平,以注射PBS的相对表达量作为基准进行统计学分析。**表示t 检验存在显著差异(P<0.01)qRT-PCR analysis of TcOctβR3 transcriptional level after RNA interference. With relative expression after injecting phosphate-buffered saline (PBS) as a benchmark for statistical analysis. ** indicates significant difference at P<0.01 level by Student t-test;C:注射dsOctβR3后赤拟谷盗成虫爬行速度的变化,t检验无显著性差异(P>0.05)The changes of the walking speed of T. castaneum adult after dsOctβR3 injection. There is no significant difference by Student t-test (P>0.05); D:注射dsOctβR3后赤拟谷盗产卵量的变化,t检验无显著性差异(P>0.05) The changes of egg numbers of T. castaneum after dsOctβR3 injection. There is no significant difference by Student t-test (P>0.05)
-->
3 讨论
本研究克隆获得了赤拟谷盗TcOctβR3 cDNA序列,预测其编码的蛋白质有7个α螺旋跨膜区域,属于典型的G蛋白偶联受体,预示TcOctβR3在调控赤拟谷盗生理活动过程中具有重要作用。通过与其他昆虫章鱼胺受体氨基酸序列比较发现,赤拟谷盗、红斑尼埋葬甲、小蜂甲等昆虫的OctβR3单独聚为一簇,这种结果可能是由它们的亲缘关系和基因结构决定的。本研究发现TcOctβR3在赤拟谷盗不同发育阶段均有所表达,尤其在幼虫期高表达,这与棉铃虫(Helicovrpa armigera)[21]、二化螟[8]体内OctβR2的表达模式相似,暗示章鱼胺在幼虫阶段发挥重要的作用。在赤拟谷盗成虫不同组织中,TcOctβR3在中枢神经系统的表达量占主导地位,表明该受体可能在神经系统扮演着重要角色。在黑腹果蝇中,DmOctβR3主要在脑部高表达[22],在沙漠蝗(Schistocerca gregaria)体内,SgOctαR在中枢神经系统高表达,而SgOctβR2在飞行肌高表达[23],这预示着不同类型的章鱼胺受体承担着不同的生理功能。近年来一些研究表明,在饥饿条件下,昆虫体内血淋巴中章鱼胺含量会发生明显变化,同时活跃度也会增加[24,25]。与此相似,橘小实蝇BdOctβR1在饥饿条件下表达量显著上调[9],暗示章鱼胺受体在饥饿调节过程中发挥着重要作用。本研究结果显示,赤拟谷盗幼虫在饥饿过程中,TcOctβR3表达量起初呈现出显著性下调,而后又显著性上调,最后恢复正常水平,暗示TcOctβR3参与了饥饿调节过程。
赤拟谷盗是一种世界性仓储害虫,可通过系统RNAi研究其基因的功能[26]。沉默赤拟谷盗TcOctβR3,成虫爬行速度与对照相比并无显著性差异,这一结果与NvOctβR3[27]、BdOctβR3[22]在胸部肌肉组织低表达相似,表明OctβR3可能不参与昆虫的运动过程。注射dsOctβR3后,雌虫产卵量不受影响,这一结果与NvOctβR3在卵巢中的表达模式相似[27],预示OctβR3可能与产卵无关。
近年来,对于昆虫体内章鱼胺受体的药理学研究日益增多,很多对章鱼胺受体有高度特异的激动剂和拮抗剂用于害虫的防治,例如杀虫脒和双甲脒[3],同时它们可以作为增效剂来筛选新型药剂,可有效防治埃及伊蚊(Aedes aegypti)幼虫[15]。借助异源表达系统,β类章鱼胺受体的活性在多种昆虫中得到验证,如DmOctβR3与DmOctβR1活性相似,激动剂活性均为NA>OA,而DmOctβR2则是OA>NA[14],对于BdOctβR1,激动剂活性为NA>OA[9]。本研究测试配体对TcOctβR3的激动剂活性发现强弱为NA>OA,与DmOctβR3相似[14]。OA对赤拟谷盗TcOctβR3有效中浓度EC50为8.68×10-7 mol·L-1,其激动活性弱于果蝇DmOctβR3, EC50为1.40×10-8 mol·L-1[12],这种结果可能是由于不同昆虫OctβR3敏感差异所致。
目前对章鱼胺受体的亚型是如何调节章鱼胺的研究具有局限性,对果蝇、家蚕β类受体研究较多,而对鞘翅目昆虫章鱼胺受体的研究极少,仅CUNNINGHAM等阐释了亚社会性昆虫红斑尼埋葬甲6种章鱼胺受体基因的表达模式[27,28],而在鞘翅目模式昆虫赤拟谷盗则未见报道。本研究从生物信息学和转录方面分析了赤拟谷盗TcOctβR3的一些基本特性,丰富了对昆虫章鱼胺受体生理功能的认识。由于章鱼胺在昆虫体内重要的生理作用及其在脊椎动物中含量极少的特性,以其受体为靶标将有助于开发出更为高效安全的新型药剂[29]。因此,对赤拟谷盗TcOctβR3和其他受体的功能和调控机制仍需进一步研究。
4 结论
赤拟谷盗TcOctβR3为典型的G蛋白偶联受体,其基因的表达具有发育阶段和组织特异性,主要在幼虫期和中枢神经系统中高表达;TcOctβR3可能参与饥饿调节过程,但与运动和产卵无关;章鱼胺可有效激活TcOctβR3,表明TcOctβR3具有良好的控制剂靶标潜力。The authors have declared that no competing interests exist.
