0 引言
【研究意义】Tillering and Dwarf 1(TAD1)是近年发现的揭示植株形态建成新机制的重要基因之一,该基因可通过泛素化过程降解植物腋芽形成发育关键调控基因,从而影响植株分枝(蘖)数目并进一步影响植株形态建成及单产[1]。甘蔗(Saccharum spp.)属于禾本科无性繁殖经济作物,主要靠茎秆作为收获产品,而其茎秆又主要由母茎基部非延长节上的腋芽发育而成,因此,甘蔗腋芽的形成发育在甘蔗最终产量形成上扮演着十分重要的角色。鉴于此,从甘蔗中克隆调控侧芽形成发育相关基因TAD1,分析其结构特征和功能,阐明其在甘蔗中的表达特征,对其功能机制研究及利用分蘖性状改良甘蔗品种产量具有重要意义。【前人研究进展】TAD1编码一个细胞分裂后期启动复合物(anaphase-promoting complex,简称APC/ C)的共激活蛋白,能与水稻(oryza sativa)OsAPC10蛋白形成一个复合体,通过细胞周期依赖的方式降解水稻单蘖基因MONOCULM1(MOC1)[2],随后下调水稻同源异型盒基因(Oryza sativa homeobox 1,OSH1)[3]的表达,抑制腋芽分生组织的起始和形成,从而实现对腋芽形成和萌发的调控[1]。动物钙粘连素基因(Cadherin 1,Cdh1)[4]、植物细胞周期调控蛋白基因(cell cycle switch 52,CCS52)[5-7]、水稻分蘖增强子基因(Tiller Enhancer,TE)[8]都属于TAD1的同源基因。前期研究表明CCS52主要通过调节植物细胞由有丝分裂向细胞核内复制转换而最终影响植物腋芽分生组织的起始和形成[9-12],另外还有研究表明该基因还与茎、根分生组织的维持及种子、叶片、毛状体分枝等表型性状的形成相关[9,11,13-16]。最近,LIN等[17]研究表明TAD1还可以通过介导赤霉素(GA)和脱落酸(ABA)信号通路的拮抗作用,调控水稻等植物的生长发育。【本研究切入点】TAD1在水稻分蘖中具有重要作用,且该基因在植物中功能保守,但甘蔗中尚未见该基因的相关研究报道。【拟解决的关键问题】本研究通过克隆甘蔗ScTAD1,并对其蛋白结构和功能进行生物信息学预测分析,运用qPCR分析明确其在甘蔗不同组织中的表达特征,及其与甘蔗腋芽形成发育及腋芽发育相关调控激素的关系,为后续该基因的功能机制研究和分子辅助育种奠定良好的理论基础。1 材料与方法
1.1 材料及处理方法
1.1.1 研究材料 以中国主栽甘蔗品种新台糖22号(ROC22)为研究材料,由国家甘蔗种质资源圃提供。1.1.2 材料处理 于2015年5月初取ROC22分蘖盛期的分蘖苗茎尖生长点部位,用于后续RNA的提取及ScTAD1的克隆。选用成熟期ROC22种茎进行桶栽种植(每桶5芽),待5—7叶期取其根、茎、叶、分蘖芽、叶鞘、茎尖等组织部位用于ScTAD1的组织表达分析。于2015年8月中旬,选取拔节后期ROC22的蔗茎,取茎尖生长点及其以下第1节位(幼嫩腋芽)、第3节位(半大腋芽)、第5节位(较大腋芽)、第7节位(成熟休眠芽)处不同发育阶段的腋芽,用于不同发育阶段腋芽中ScTAD1的表达分析。另外,于2016年3月14日,取成熟期ROC22种茎,砍成单芽后种植于泥炭土与黏土2:1的塑料桶中,每桶5芽,每组5桶,共2组;放置于云南省农业科学院甘蔗研究所第一科研基地温室中适时适量浇水,待蔗苗长至4叶1心时,于2016年4月14日早晨8:00—9:00对2组甘蔗分别喷施600 mg·L-1的IAA(Sigma公司)和6-BA(Sigma公司),喷施至叶片表面水珠不下滴为止(每次喷施200 mL左右),然后每隔6 h取甘蔗幼苗非伸长茎梢部(腋芽分生组织形成部位)用于不同植物外源激素处理下ScTAD1的表达分析。
1.2 RNA提取及反转录
使用液氮速冻组织样品,并研磨提取总RNA,提取方法参照全式金TransZolTM Plant RNA试剂盒,提好的RNA通过1.0%的琼脂糖凝胶和Bio Drop Lite PC超微量可见紫外分光光度计检测质量和浓度,然后分别使用试剂盒Trans Script One-step gDNA Removal and cDNA Synthesis Super Mix和SMARTERTM RACE cDNA Amplification Kit反转录成常规cDNA模板和RACE cDNA模板后于-20℃保存备用。1.3 ScTAD1的克隆
以水稻TAD1(AK058595)mRNA序列为探针,通过BLAST检索甘蔗EST文库并下载相关序列,然后使用Vector NTI 11.5、DNAMAN 5.0软件对获得的EST序列进行拼接比对,获得重叠群,再使用重叠群持续比对检索直至无新的甘蔗EST序列可供拼接延伸,最终获得电子克隆序列。根据所获得的电子克隆序列,设计RT-PCR引物(表1),使用高保真Trans Start Fast Pfu Fly DNA聚合酶进行基因片段的扩增,验证电子克隆序列的准确性。对已验证正确的电子克隆序列进行编码区比对分析,然后设计RACE特异引物(表1),进行RACE扩增,所有试验步骤参照SMARTERTM RACE cDNA Amplification Kit说明书进行。使用Vector NTI 11.5拼接电子克隆序列与RACE序列,然后根据拼接序列设计引物扩增ScTAD1的完整编码区序列,验证cDNA序列的正确性。所有PCR产物使用EasyPure Quick Gel Extraction Kit回收,并使用全式金零背景克隆载体(pEASY- Blunt Zero Cloning Kit)将回收的扩增产物连接、转化到大肠杆菌DH5α感受态细胞内,挑取至少3个克隆交由深圳华大基因测序,测序序列使用DNAMAN 5.0软件比对分析。Table 1
表1
表1ScTAD1扩增及实时荧光定量PCR引物信息
Table 1Primers used for ScTAD1 amplification and qPCR
| 引物名称 Primer name | 序列 Sequence (5′-3′) | 功能 Function |
|---|---|---|
| TAD1-199-F | GACCGCTTCATCCCCAG | RT-PCR扩增 RT-PCR amplification |
| TAD1-962-R | GGCAAAATCAGCCCTCCT | |
| TAD1-572-R | CCGTCTTGAATCTGAAGATGTTCCCG | 5′RACE扩增 5′RACE amplification |
| UPM | CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT | |
| TAD1-302-R | TGAAGCGGTCGCTGTAGACGGTG | 5′RACE巢式扩增 5′RACE nested amplification |
| NUP | AAGCAGTGGTATCAACGCAGAGT | |
| ScTAD1-49-F | GGAAGCAAGCCTTAGTT | 基因编码区扩增 Gene CDS region amplification |
| ScTAD1-1816-R | CAGTTCACCATATTGCATCGT | |
| QTAD1-1051-F | TCAGGTGGCAATGATAACAGACT | 荧光定量PCR qPCR |
| QTAD1-1164-R | GAGATGAGGAGACCAGGCAAT | |
| GAPDH-F | CACGGCCACTGGAAGCA | 荧光定量PCR qPCR |
| GAPDH-R | TCCTCAGGGTTCCTGATGCC |
新窗口打开
1.4 ScTAD1的生物信息学分析
首先利用在线工具ORF Finder查找所得序列的开放阅读框(ORF),然后使用ExPASy服务器中的ProtScale和ProtParam软件、SIGNA-IP软件、TargetP 1.1、SOP-MA在线软件、SWISS-MODEL、ProtFun软件、TMHMM 软件分别预测ScTAD1的理化性质、信号肽、亚细胞定位、二级结构、三级结构及功能;再通过DNAMAN 5.0和MEGA 6.0等生物学软件对TAD1 同源蛋白进行序列比对和NJ系统进化树构建,进化树的bootstrap设置为1 000次。1.5 ScTAD1的实时荧光定量PCR表达分析
根据已获得的ScTAD1序列,使用Primer Express 3.0.1设计荧光定量PCR引物,以LING等[18]发表的GAPDH作为内参基因,选用TaKaRa公司的PrimeScriptTM RT Reagent Kit with gDNA Eraser(Perfect Real Time)和SYBR®Premix Ex TaqTM II(TIi RNaseH Plus),ROX plus试剂盒,按试剂盒说明书进行操作,定量PCR体系为20 μL,包括cDNA 模板(50 μg·μL-1)2 μL、SYBR® Premix Ex TaqTM II(Tli RNaseH Plus)(2×)10.0 μL、上下游引物(10 μmol·L-1)0.8 μL、ROX Reference Dye II(50×)0.4 μL和H2O 6 μL。采用两步法 PCR扩增,程序为95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s;60℃ 1 min;95℃ 15 s。每个样品设3次生物学重复和3次技术重复,在ABI Vii7 Real time PCR System(Applied Biosystems,USA)上进行试验。最后利用2-ΔΔCT法[19]计算 ScTAD1的相对表达量。2 结果
2.1 ScTAD1 cDNA全长的获得及序列分析
以水稻TAD1(AK058595)mRNA序列为探针,借助电子克隆技术获得2个重叠群,长度分别为688和1 218 bp,分别位于该基因的上游和下游区域,中间存在200 bp左右的缺口,在2个重叠群两端设计RT-PCR引物(TAD1-199-F和TAD1-962-R),扩增得到一条长1 812 bp的片段(图1),经测序比对,该片段与电子克隆获得的2个重叠群相似性分别高达 95.19%和99.23%,证实了拼接电子克隆序列的正确性。序列分析表明RT-PCR获得序列包含部分编码区序列和450 bp的3′非编码区序列。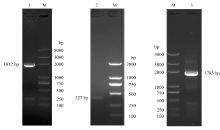 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1ScTAD1 PCR扩增电泳结果
M:Trans2K Plus DNA Marker;1:反转录PCR产物;2:ScTAD1 5’RACE产物;3:ScTAD1编码区全长PCR产物
-->Fig.1Agarose gel electrophoresis of the PCR amplification product of ScTAD1
M: Trans2K Plus DNA Marker; 1: RT-PCR amplicon product; 2: 5’ RACE amplicon prodct of ScTAD1; 3: The PCR amplicon product of ScTAD1’s coding region length
-->
使用5′RACE基因特异引物TAD1-572-R和TAD1-302-R经过两轮PCR最终获得一条327 bp的RACE产物(图1),将该片段序列与上述获得的1 812 bp的片段进行序列拼接,最终获得2 129 bp的cDNA序列,比对分析表明该cDNA序列包含1 560 bp的编码区、118 bp的5′非编码区和450 bp的3′非编码区。使用基因编码区扩增引物ScTAD1-49-F和ScTAD1-1816-R进行RT-PCR扩增得到一条1 785 bp的片段(图1),测序比对为该基因的编码区序列,证实了所获得cDNA序列的正确性,将该基因命名为ScTAD1,上传至GenBank数据库,序列号为KX611166。
2.2 ScTAD1的生物信息学分析
2.2.1 ScTAD1编码氨基酸结构及其相应理化性质 使用ORF Finder程序分析可知ScTAD1包含一个1 560 bp的最大完整开放阅读框(ORF),编码519个氨基酸残基。Conserved domain search工具分析表明该蛋白具有7个WD40的保守结构域(图2)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2ScTAD1保守结构域预测结果
-->Fig. 2Prediction of the conserved domain of ScTAD1
-->
ScTAD1蛋白的分子质量约为55.57 kD、理化等电点pI为9.16、共包含7 707个原子,分子式为C2433H3795N711O751S17;在组成该蛋白的20种氨基酸中丝氨酸(Ser)所占比例最高,达到13.7%,而蛋氨酸(Met)所占比例最低,为1.0%;该蛋白不稳定指数(II)为47.27,大于40,表明该蛋白不稳定,脂肪指数(AI)为70.15,总平均亲水性-0.328,介于-0.5—0.5,推测其可能是两性蛋白,其亲/疏水信号如图3,其中第227和228位具有最高分值,均为1.778,疏水性最强,第321位具有最低分值为-2.067,亲水性较强。
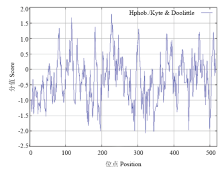 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3ScTAD1亲疏水性分析
-->Fig. 3Hydrophilicity/hydrophobicity prediction of ScTAD1
-->
2.2.2 ScTAD1的信号肽和蛋白亚细胞定位预测 蛋白的信号肽预测结果表明ScTAD1第54位的丙氨酸(Ala)残基具有最高的剪切位点分值0.111(图4),第11位的丝氨酸(Ser)残基具有最高的结合剪切位点分值0.107,第1位的蛋氨酸(Met)残基具有最高的信号肽分值0.123;由于最后算得信号肽平均值较小,为0.100(小于0.5),因此推测ScTAD1所编码的蛋白不存在信号肽,为非分泌蛋白。
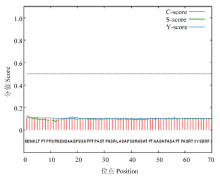 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图 4ScTAD1的信号肽预测
C-score:剪切位点分值;S-score:信号肽分值;Y-score:C和S-score综合分值
-->Fig. 4Signal peptide prediction of ScTAD1
C-score: Cleavage site score; S-score: Signal peptide score; Y-score: Combined cleavage site score
-->
TargetP 1.1在线软件预测表明ScTAD1蛋白主要位于叶绿体,少数位于除线粒体和分泌通路的其他位置,PSORT II亚细胞定位分析表明该蛋白定位于细胞核、细胞质、线粒体和过氧化物酶体的概率分别为73.9%、17.4%、4.3%和4.3%,说明该蛋白可能主要定位于细胞核,细胞质中也可能有少量分布。
2.2.3 ScTAD1的二级结构和功能预测 使用SOPMA软件预测ScTAD1蛋白的二级结构(图5)。该蛋白主要由α-螺旋(h)、β-折叠(e)、无规则卷曲(c)和β-转角(t)构成,其中,无规则卷曲最多,比例为47.78%,其次为β-折叠(26.20%)和α-螺旋(17.53%),β-转角最少(8.48%)。使用ProtFun 2.2 预测ScTAD1蛋白功能,结果表明,该蛋白行使复制和转录作用概率为0.332,调控作用概率为0.231,参与翻译的概率为0.093,其中参与中枢代谢的机率最高;该蛋白属于酶的概率达到了0.446,几率为1.557,表明该蛋白可能是酶蛋白;从基因功能分类来看,该基因更可能属于转录因子。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5ScTAD1二级结构预测
蓝色:α螺旋;红色:β折叠;橙色:无规则卷曲
-->Fig. 5Secondary structure analysis of ScTAD1
Blue: Alpha helix; red: β-sheet; orange: Random coil
-->
2.3 ScTAD1的三级结构预测
使用SWISS-MODEL在线工具对ScTAD1进行三级结构预测,根据预测结果可知ScTAD1的空间结构以螺旋和无规则卷曲为主(图6)。将该蛋白与二穗短柄草、玉米和水稻TAD1同源蛋白的三级空间结构图进行比较,结果显示它们的三级空间结构高度相似。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6TAD1及其同源蛋白三级结构预测
A:甘蔗;B:二穗短柄草;C:玉米;D:水稻
-->Fig. 6Tertiary structure analysis of ScTAD1 and other homologous protein
A: Saccharum officinarum L.; B: Brachypodium distachyon; C: Zea mays; D: Oryza sativa
-->
2.4 ScTAD1蛋白同源性比对及进化树分析
使用DNAMAN5.0软件对高粱(Sorghum bicolor)、二穗短柄草(Brachypodium distachyon)、小米草(Setaria italica)、水稻(Oryza sativa Japonica Group)、短花药野生稻(Oryza brachyantha)、玉米(Zea mays)、青稞(Hordeum vulgare subsp. vulgare)、拟南芥(Arabidopsis thaliana)、玉山筷子芥(Arabidopsis lyrata subsp. lyrata)、葡萄(Vitis vinifera)、烟草(Nicotiana tabacum)、大豆(Glycine max)、陆地棉(Gossypium hirsutum)、苜蓿(Medicago truncatula)等14种植物的TAD1同源蛋白与ScTAD1蛋白进行氨基酸序列同源性分析(图7)。从图中可以看出,TAD1蛋白与其他物种TAD1同源蛋白总体表现为N端保守性较差,C端较保守。此外,ScTAD1与单子叶植物高粱、玉米、小米草等作物相关蛋白相似度在92.75%—98.07%,而与葡萄、拟南芥、大豆等双子叶植物相似度在67.50%—69.17%,表明该蛋白在单子叶植物之间具有高度的保守性。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7ScTAD1与几种植物相似蛋白同源性比对结果
-->Fig. 7Sequence alignment of amino acid residues of ScTAD1 with other related proteins
-->
使用ClustalX和MEGA6.0软件,采用NJ法(BootStrap,1000)构建进化树,分析ScTAD1蛋白与其他物种的TAD1同源蛋白的进化关系,结果如图8所示。单子叶植物和双子叶植物的ScTAD1蛋白明显属于两大不同的分支;在单子叶植物分支中,甘蔗与同属C4植物的高粱、玉米同属一个小分支,表现出较近的亲缘关系。
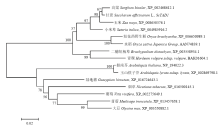 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8不同植物TAD1同源蛋白的NJ分子进化树
-->Fig. 8NJ molecular evolutionary tree of the amino acid sequences of TAD1 with homologous among sugarcane and other plants
-->
2.5 ScTAD1表达分析
2.5.1 ScTAD1组织特异性分析 组织特异性表达的qPCR分析表明,ScTAD1在甘蔗不同组织部位均有表达,但表达量有所差异,其中,在分蘖芽中的表达量最高,且显著高于其他组织部位,其次为叶和叶鞘部位,根和茎尖表达较低,其中,根中表达最低(图9)。由此表明,ScTAD1在甘蔗中的表达具有明显的组织特异性。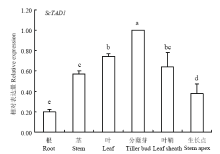 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9ScTAD1在甘蔗不同组织部位的表达分析
不同字母表示差异显著(P<0.05), n=3。下同
-->Fig. 9Expression analysis of ScTAD1 in different sugarcane tissues
Bars with different superscripts differ significantly (P<0.05), n=3. The same as below
-->
2.5.2 ScTAD1在茎尖生长点和不同发育阶段腋芽中的表达分析 qPCR分析表明,ScTAD1在茎尖生长点和不同发育阶段腋芽组织中的表达量有所差异,在茎尖生长点和成熟腋芽部位表达相对较低,而在幼嫩腋芽中表达最高,随着腋芽的逐渐成熟,表达呈现下降的趋势,在腋芽形成发育过程中总体呈现出“先升后降”的趋势(图10),说明ScTAD1可能在甘蔗腋芽形成初期发挥作用。
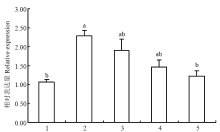 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图10不同发育时期蔗芽中ScTAD1的表达分析
1:茎尖生长点;2:幼嫩腋芽;3:半大腋芽;4:较大腋芽;5:成熟休眠腋芽
-->Fig. 10Expression analyses of ScTAD1in sugarcane buds at different developmental periods
1: Stem apex; 2: Tender axillary bud; 3: Medium axillary bud; 4: Largish axillary bud; 5: Mature dormant axillary bud
-->
2.5.3 植物外源激素对ScTAD1的表达影响分析 对使用IAA、6-BA处理甘蔗幼苗茎梢部组织的qPCR分析表明,IAA处理0—24 h,ScTAD1表现出微弱的下调趋势,但相比较0 h,未有显著性的变化;后续的36和48 h逐步表现出上升趋势,且48 h相比较0 h,呈显著性上升(图11左)。而6-BA处理,在0—24 h,出现“先升高后降低再升高”的情况,但与0 h相比,均未达到显著性变化;而在36 h时,表达升高,并达显著性变化水平,到48 h又出现回落(图11右)。以上研究结果表明ScTAD1的表达受IAA和6-BA调控,且明显响应时段主要发生在36和48 h时段。
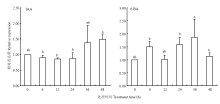 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图11叶面喷施 IAA、6-BA不同时间后甘蔗茎尖生长点处ScTAD1的表达分析
-->Fig. 11Expression analyses of ScTAD1 in sugarcane stem apex after IAA, 6-BA foliage spray
-->
3 讨论
腋芽是决定禾本科植物形态建成和产量构成的重要器官[20],其形成和发育过程受一系列基因调控[2]。前人研究表明,单双子叶植物都是通过TAD1/TE/ CCS52A—MOC1/LAS—OSH1/STM这一保守途径调控腋芽的起始和发育[8],其中调控腋芽形成关键基因MOC1处于该途径的中心位置,但其表达量的多少又受上游TAD1的调控,因此,TAD1是该调控通路上游十分关键的基因。本研究克隆的ScTAD1编码的蛋白质具有7个WD40重复序列的保守结构域,与水稻TAD1蛋白保守结构域相似[1],该结构域是蛋白复合体或蛋白质-DNA复合体之间十分重要的互动平台[21]。亚细胞定位分析发现,ScTAD1蛋白主要定位于细胞核,其次是细胞质,这与许操[22] 研究证实的水稻TAD1亚细胞定位结果一致。蛋白同源性分析表明ScTAD1与其他单双子叶植物同源蛋白在C端较为保守,N端存在较多变异,与同属C4植物的高粱、玉米表现出较近的亲缘关系。表达分析显示ScTAD1在甘蔗不同组织部位均有表达,其中,分蘖芽中表达量最高,其次是叶,这与水稻[1]、番茄[23]中其同源基因表达模式类似,推测该基因可能参与甘蔗分蘖芽的形成。
甘蔗分蘖芽位于茎基部的非延长节上,实质上也属于腋芽。为了弄清楚ScTAD1是否参与甘蔗腋芽形成的调控,本研究分析了甘蔗茎尖生长点和不同发育阶段甘蔗腋芽组织部位该基因的表达情况。结果表明,在甘蔗腋芽形成初期(幼嫩腋芽中),ScTAD1表达量较高,随着腋芽的不断发育至成熟,其表达量逐渐降低。由此表明,ScTAD1在甘蔗腋芽形成初期发挥一定作用,可能参与了腋芽的形成发育调控。
除了受基因调控,植物激素尤其细胞分裂素(CTK)和生长素(IAA)在腋芽的形成发育过程中也扮演着十分重要的角色[24-27],但激素通常又是通过和基因间形成调控网络共同调控腋芽的形成发育[28-29]。本研究表明分别使用外源IAA和6-BA处理后的甘蔗幼苗茎梢部ScTAD1均表现出一定程度的上调表达,虽然目前未见IAA和CTK对ScTAD1及其同源基因表达调控相关的报道,但有研究指出,水稻突变株体内IAA、CTK含量及IAA/CTK比值有利于侧芽形成[30],而ScTAD1又在腋芽形成中发挥作用,因而这两种激素均可诱导ScTAD1的上调表达并不矛盾。本研究表明ScTAD1对IAA和CTK两类激素有响应,但它们之间具体的调控方式还需后续更深入研究。
4 结论
获得甘蔗分蘖重要调控基因ScTAD1的cDNA序列,其包含1个最大的1 560 bp的完整开放阅读框,编码519个氨基酸,编码蛋白主要定位于细胞核,其次是细胞质。ScTAD1与玉米、高粱同源蛋白亲缘关系最近。ScTAD1在甘蔗不同组织部位均有表达,其中,在分蘖芽中的表达量最高,叶、叶鞘以及茎中次之,根中表达较弱;ScTAD1在甘蔗腋芽形成初期表达量明显上升,随着腋芽发育又逐步降低;分别喷施两种外源激素IAA和6-BA 48 h、36 h后的甘蔗幼苗非伸长茎梢部的ScTAD1的表达量最高。表明ScTAD1在甘蔗分蘖芽形成发育过程中发挥重要作用,其表达受IAA和6-BA的影响。The authors have declared that no competing interests exist.
