 ,1, 杨澜1, 阮仁武2, 李中安
,1, 杨澜1, 阮仁武2, 李中安 ,1
,1Analysis of Photosynthetic Characteristics of Hybrid Wheat at Seedling Stage and Its Use for Early Prediction of Strong Heterosis Combinations
LI JiangLing ,1, YANG Lan1, RUAN RenWu2, LI ZhongAn
,1, YANG Lan1, RUAN RenWu2, LI ZhongAn ,1
,1通讯作者:
责任编辑: 杨鑫浩
收稿日期:2021-02-25接受日期:2021-06-21
| 基金资助: |
Received:2021-02-25Accepted:2021-06-21
作者简介 About authors
李姜玲,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (609KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李姜玲, 杨澜, 阮仁武, 李中安. 杂交小麦苗期光合特性分析及其对强优势组合的早期预测. 中国农业科学, 2021, 54(23): 4996-5007 doi:10.3864/j.issn.0578-1752.2021.23.006
LI JiangLing, YANG Lan, RUAN RenWu, LI ZhongAn.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】小麦(Triticum aestivum L.)是世界上种植最广泛的作物,占全球农作物种植面积的17%,为全球约40%的人口提供食物和总饮食热量的20%[1]。中国是世界上最大的小麦生产国和消费国,小麦种植面积和产量仅次于水稻和玉米,小麦产量对保障粮食安全具有举足轻重的作用。增强小麦的光合作用和杂种优势利用均可提高小麦单位面积产量,因此,探明杂交小麦双亲光合特性对杂交种的影响以及与产量的相关性,以此来指导强优势小麦杂交品种的选育,对我国小麦杂种优势的利用具有重要意义。【前人研究进展】杂交种是来自两个良好亲本之间的特定杂交,杂种优势是指杂交子一代在一种或多种性状上优于亲本的现象,特别是产量优势[2],可以超过自交品种产量的15%—50%[3]。杂种优势已被广泛应用于商业育种,特别在玉米、水稻和高粱等作物单产提高上发挥了重要的作用[4]。小麦杂种优势的现象在1919年被报道,FREEMAN发现了杂交一代的一些性状优于其亲本。我国在20世纪60年代初开始杂交小麦研究,先后建立了细胞质雄性不育(CMS)、化学杀雄法系统(CHA)、温光敏雄性核不育、细胞核雄性不育(GMS)等系统,已在不育系选育和强优势组筛选等方面取得了重要进展[5,6],我们建立的蓝标型两系法杂交小麦系统[7]在国家重点研发项目的支持下发展迅速,已选育出一大批不育系和强优势杂交组合。光合作用是植物生长发育和产量形成至关重要的因素,提高叶片光合作用效率是提高作物产量的有效方法[8,9]。穗粒数、亩穗数、千粒重是小麦产量构成的三要素,叶绿素含量、光合速率、Rubisco含量等指标是小麦产量形成的生理基础[10]。FISCHER等[11]早在1998年报道了小麦增产与更高的气孔导度及光合速率相关,之后也有****的研究表明,花后净光合速率的增加与籽粒产量关系密切且呈正相关[12]。亦有****发现株高降低和收获指数增加,是促进产量提高的原因[13,14]。因此,理论上可以通过提高单位叶面积的光合速率、改良冠层结构和光合持续时间来优化光的拦截和利用,从而实现光合作用的改善,达到进一步提高作物产量的目的。在育种实践中,为了提高光合效率,选择高光合速率的小麦材料进行杂交,将光合作用相关性状(例如气孔导度和蒸腾速率)与其他优良性状相结合,使产量水平更高,从而选育出具有高产潜力的品种或材料[15]。在光合作用和杂种优势研究方面,刘红梅等[16]发现籼型杂交稻剑叶光合性状与亲本间存在极显著差异,其中净光合速率和气孔导度具有正向超高亲优势。赵仁杰等[17]研究发现高粱杂交种吉杂319的叶片光合代谢能力显著高于亲本,且其光合优势显著。杂交小麦的光合优势有****认为主要表现在开花之前[18],也有****研究发现从开花始到花后17 d,杂交小麦旗叶的光合速率与其亲本相当,但从花后20 d起,杂交种旗叶表现出比其亲本更高的光合速率[19]。【本研究切入点】目前小麦光合作用的杂种优势研究大多数都是有关抽穗期后旗叶光合特性,而对杂交小麦苗期光合作用的杂种优势鲜有报道。研究苗期的光合作用对小麦杂交种的强优势组合早期筛选和亲本选择具有重要的作用。【拟解决的关键问题】本研究以小麦核不育杂交组合及其亲本为研究对象,测定田间条件下杂交种及其亲本的苗期叶片光合参数、参与光合作用过程关键酶的活性以及成熟期的产量等。分析这些参数的杂种优势及其与产量的相关性,以期更加全面地了解苗期筛选小麦杂交种强优势组合及其双亲的重要指标和要求,为小麦杂种优势的利用提供理论基础,为更快、更好地培育强优势杂交小麦新品种提供参考依据。1 材料与方法
1.1 试验材料
供试小麦恢复系有川14品16和川麦93,不育系有12L8012、12L8015、15L7084和18L7077,及其配制的杂交组合12L8015×14品16(19-200)、15L7084×14品16(19-204)、18L7077×14品16(19-205)、12L8012×川麦93(19-218)、12L8015×川麦93(19-219)和15L7084×川麦93(19-220)。川14品16、川麦93由四川省农业科学院作物研究所提供,不育系及F1代由笔者实验室选育和配制,其中不育系是由笔者所在团队建立的蓝标型两系法杂交小麦系统选育而成的[7]。试验于2019年11月10日在重庆市北碚区西南大学柑桔研究所试验地播种,播种方式为人工开沟点播,以5 cm株距点播,每个品种设置3次重复,每个重复种植4行(行长2 m,行距为25 cm),每行播种41粒种子,平均每行出苗数为36.08—38.58,出苗率为88.00%—94.10%。1.2 试验方法
1.2.1 光合性状测定 在小麦3叶期后,分别于12月26日(3叶期)、1月3日(4叶期)、1月7日(4叶期)、1月11日(5叶期)进行光合测定,每个品种每个重复随机选择叶龄一致的4个植株,利用光合作用测量系统(TARGAS-1,美国PP Systerm公司),在晴朗无风的天气10:00—16:00,测定小麦幼苗顶部第一片全展叶中部的Pn、Gs、Ci、Tr和WUE,若叶片太小无法填满光室,则测量叶片宽度待测完后代入公式重新计算。光强设为1 200 μmol·m-2·S-1,流量为300 mL·min-1,大气CO2 浓度设为400 μmol·mol-1。并于1月11日将测定完光合后的叶片取下放置于液氮盒中用于各项指标的测定。1.2.2 叶绿素含量测定 丙酮-无水乙醇(丙酮﹕无水乙醇=1﹕1)浸提法测定,用酶标仪测定提取液在663 nm和645 nm的OD值,所有指标测定为3次重复。所得 OD 值代入下列公式计算出含量(mg·g-1 FW):
Ca = 12.7D663-2.69D645;
Cb = 22.9D645-4.68D663。
式中,C 为叶绿素浓度,以 mg·L-1 表示,代入鲜重计算含量。
1.2.3 Rubisco活性测定 参照格瑞思植物二磷酸核酮糖羧化酶(Rubisco)试剂盒(微板法)说明书进行,反应结束后于340 nm处检测,读取A1,10 min后读取A2,∆A=A1-A2。将∆A代入公式计算Rubisco活性(nmol·min-1·g-1 FW):
Rubisco活性=643.1×∆A÷W。
式中,W为样品鲜重(g)。
1.2.4 产量及产量构成调查 每个重复取20株进行室内考种,调查株高(plant height,PH)、穗长(spike length,SL)、穗粒数(grain number per spike,GNPS)、主穗小穗数(spikelets number of main spike,SN)、有效穗数(spike number per plant,SNPP)、单株生物量(biomass per plant,BMPP)、单株产量(grain yield per plant,GYPP)、收获指数(harvest index,HI);晾干后数200粒称重,换算成千粒重(thousand grain weight,TGW)。
1.2.5 Rubisco酶大小亚基编码基因相对表达量测定 根据荧光定量PCR方法,测定Rubisco大小亚基编码基因rbcL和rbcS的相对表达量。
1.2.5.1 RNA 提取及cDNA合成 用Trizol(Invitrogen, USA)试剂提取总RNA;以提取的RNA为模板,按照NovoScript®Plus All-in-one 1st Strand cDNA Synthesis SuperMix(gDNA Purge)(novoprotein)说明书合成cDNA。
1.2.5.2 荧光定量PCR 用软件 Primer Premier 5.0 设计引物,基因rbcS参照SONG等[20]的方法。以样品的cDNA作为模版,荧光定量PCR根据Hieff®qPCR SYBR® Green Master Mix(Yeasen)试剂盒说明书进行。反应体积为 20 μL,使用 CFX96 定量 PCR仪,反应程序为95℃,5 min;95℃,10 s;60℃,20 s,经过40个循环,溶解曲线为95℃,10 s,降温至65℃之后再开始升温,维持5 s采集荧光信号,到 95℃结束反应,每个模板做3次重复。以26sRNA基因[21]作为内参基因,相对表达量按照2-ΔΔCt法计算。
1.3 数据分析
采用Origin 2018 软件绘图和SPSS 26.0 软件进行单因素方差分析、LSD多重比较及Person相关系数分析。杂种优势计算方法按公式计算,中亲优势=(F1-MP)/MP×100%,超高亲优势=(F1-HP)/HP×100%,超低亲优势=(F1-LP)/LP×100%,式中Fl为杂交组合性状平均值,MP、HP和LP分别表示双亲平均值、高亲本值和低亲本值,由于不育系无法计算产量,故产量杂种优势均以恢复系为高亲值计算。2 结果
2.1 杂交小麦及亲本间光合性状差异
由表1可知,杂交小麦及其亲本间光合性状均存在显著差异,恢复系川麦93的净光合速率最高,为24.94 μmol·m-2·s-1,不育系中18L7077的净光合速率最高,为28.28 μmol·m-2·s-1,不育系12L8015的净光合速率则最低,为22.38 μmol CO2·m-2·s-1。杂交小麦各组合间光合特性均存在显著差异,其中,组合12L8015×川麦93的净光合速率最高,为31.48 μmol·m-2·s-1,组合15L7084×川14品16 的净光合速率最低,为27.83 μmol·m-2·s-1,杂交小麦的净光合速率全都高于其双亲,且净光合速率的变异系数为10.42%。Table 1
表1
表1杂交小麦及其亲本的光合性状比较
Table 1
| 亲本及F1代 Parents and F1 hybrid | 净光合速率 Pn (μmol·m-2·s-1) | 气孔导度 Gs (mmol·m-2·s-1) | 胞间二氧 化碳浓度 Ci (μmol·mol-1) | 水分利用 效率 WUE (mmol·mol-1) | 蒸腾速率 Tr (mmol·m-2·s-1) | 叶绿素a Chl.a (mg·g-1) | 叶绿素b Chl.b (mg·g-1) | 叶绿素(a+b) Chl.(a+b) (mg·g-1) | |
|---|---|---|---|---|---|---|---|---|---|
| 不育系 Male sterile lines | 18L7077 | 28.28 | 373.78 | 255.09 | 13.45 | 2.10 | 0.842 | 0.253 | 1.095 |
| 15L7084 | 25.58 | 340.2 | 228.01 | 17.35 | 1.56 | 0.848 | 0.262 | 1.109 | |
| 12L8012 | 23.72 | 315.66 | 271.39 | 12.11 | 1.97 | 0.782 | 0.245 | 1.027 | |
| 12L8015 | 22.38 | 269.2 | 237.99 | 14.73 | 1.54 | 0.798 | 0.245 | 1.043 | |
| 恢复系 Restorer lines | 川麦93 Chuanmai93 | 24.94 | 365.86 | 231.84 | 15.7 | 1.64 | 0.850 | 0.259 | 1.108 |
| 川14品16 Chuan14pin16 | 23.53 | 318.98 | 233.02 | 15.32 | 1.55 | 0.896 | 0.269 | 1.164 | |
| F1代 F1 hybrid | 12L8015×川14品16 12L8015×Chuan 14 pin 16 | 27.92 | 434.69 | 256.59 | 16.92 | 1.67 | 0.851 | 0.244 | 1.095 |
| 15L7084×川14品16 15L7084×Chuan 14 pin 16 | 27.83 | 439.33 | 239.79 | 16.58 | 1.75 | 0.826 | 0.245 | 1.071 | |
| 18L7077×川14品16 18L7077×Chuan 14 pin 16 | 30.26 | 454.31 | 235.03 | 13.94 | 2.17 | 0.809 | 0.243 | 1.052 | |
| 12L8012×川麦93 12L8012×Chuanmai 93 | 30.03 | 454.59 | 246.35 | 14.08 | 2.20 | 0.808 | 0.247 | 1.055 | |
| 12L8015×川麦93 12L8015×Chuanmai 93 | 31.48 | 461.67 | 220.00 | 17.75 | 1.89 | 0.778 | 0.236 | 1.014 | |
| 15L7084×川麦93 15L7084×Chuanmai 93 | 28.25 | 396.67 | 230.21 | 14.61 | 1.96 | 0.859 | 0.267 | 1.126 | |
| 均值 Mean | 27.02 | 385.41 | 240.44 | 15.21 | 1.83 | 0.829 | 0.251 | 1.080 | |
| 标准差 Std | 2.814 | 62.018 | 13.874 | 1.640 | 0.236 | 0.033 | 0.010 | 0.042 | |
| 变异系数CV (%) | 10.42 | 16.09 | 5.77 | 10.78 | 12.88 | 4.04 | 4.03 | 3.90 | |
| 组间差异Difference in combinations (F) | 111.460** | 438.683** | 8.840** | 105.507** | 59.222** | 23.849** | 11.24* | 12.46** | |
新窗口打开|下载CSV
2.2 光合性状的杂种优势分析
杂交小麦组合苗期光合特性的杂种优势分析结果表明(表2),在不同的光合特性中,Pn、Gs、Tr的超高亲优势和中亲优势组合数最多,且Pn的超高亲优势和中亲优势范围分别为7.00%—26.23%、11.82%—33.05%,Gs的超高亲优势范围和中亲优势分别为8.42%—36.27%、20.35%—47.81%,Tr的超高亲优势和中亲优势分别为3.59%—19.09%、8.00%—22.07%,而叶绿素的超高亲组合和中亲优势组合数都较少,分别只有1个和2个,且大都表现为负向低亲优势,其他光合特性如Ci和WUE也有少数表现为负向低亲优势,说明杂交小麦的一些光合性状指标并不都存在杂种优势。Table 2
表2
表2杂交小麦光合特性的杂种优势表现
Table 2
| 性状 Trait | 超高亲优势 Over high-parent heterosis | 中亲优势 Over mid-parent heterosis | 超低亲优势 Below low-parent heterosis | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 正向组合数 HPH>0 | 平均 AH (%) | 范围 Range (%) | 正向组合数 MPH>0 | 平均 AH (%) | 范围 Range (%) | 负向组合数LPH<0 | 平均 AH (%) | 范围 Range (%) | |
| 净光合速率 Pn | 6 | 15.40 | 7.00-26.23 | 6 | 20.08 | 11.82-33.05 | 0 | 25.34 | 13.25-40.66 |
| 气孔导度 Gs | 6 | 24.30 | 8.42-36.27 | 6 | 35.82 | 20.35-47.81 | 0 | 39.35 | 16.60-61.47 |
| 胞间二氧化碳浓度 Ci | 3 | -0.61 | -9.22-7.82 | 3 | 0.16 | -6.35-8.95 | 1 | 3.04 | -5.11-10.11 |
| 水分利用效率 WUE | 3 | -2.67 | -15.80-13.06 | 4 | 2.88 | -11.58-16.67 | 1 | 9.42 | -9.00-23.27 |
| 蒸腾速率 Tr | 6 | 11.36 | 3.59-19.09 | 6 | 16.93 | 8.00-22.07 | 0 | 23.82 | 8.28-40.43 |
| 叶绿素a Chl.a | 1 | -5.78 | -9.72-1.13 | 2 | -2.65 | -7.22-1.46 | 3 | 0.79 | -4.59-8.88 |
| 叶绿素b Chl.b | 1 | -6.44 | -9.50-2.17 | 1 | -4.18 | -8.32-2.72 | 4 | 0.16 | -7.11-3.28 |
| 叶绿素(a+b) Chl.(a+b) | 1 | -5.90 | -9.67-1.94 | 1 | -3.00 | -7.48-1.59 | 3 | 0.16 | -5.18-6.67 |
新窗口打开|下载CSV
就同一光合性状来看,超高亲杂种优势因杂交组合的不同而不同(表3)。例如,组合12L8015×川麦93在苗期的Pn超高亲优势为26.23%,组合15L7084×川14品16的Pn超高亲优势为8.80%,但18L7077×川14品16仅为7.00%。在同一杂交组合中,不同光合性状的杂种优势表现也存在明显差异,例如,12L8015×川14品16的Pn和Gs超高亲优势分别为18.63%和36.28%,而Tr则为7.73%(表3);同时杂交组合中当恢复系相同,不育系不同时,其光合性状表现也有所不同,例如组合18L7077×川14品16的Pn和Tr的超高亲优势值表现分别为7.00%、3.59%,但组合15L7084×川14品16的Pn和Tr的超高亲优势值则分别为8.80%、11.64%;同样的,当不育系相同 而恢复系不同时,各光合性状杂种优势的表现也不同,如12L8015×川麦93、12L8015×川14品16的Pn超高亲优势值分别为26.23%和18.63%,且以川麦93为恢复系的杂交小麦Pn的超高亲优势高于以川14品16为恢复系的杂交小麦,t测验结果显示,在6个杂交组合中,大部分光合性状的超高亲优势值达显著或极显著水平,其中以Pn、Gs最为明显。
Table 3
表3
表3小麦杂交组合光合性状的超高亲优势值
Table 3
| F1代 F1 hybrid | 净光合速率 Pn | 气孔导度 Gs | 胞间二氧化碳浓度 Ci | 水分利用效率 WUE | 蒸腾速率 Tr | 叶绿素a Chl.a | 叶绿素b Chl.b | 叶绿素(a+b) Chl.(a+b) |
|---|---|---|---|---|---|---|---|---|
| 12L8015×川14品16 12L8015×Chuan 14 pin 16 | 18.63** | 36.28** | 7.82* | 10.46** | 7.73* | -5.01* | -9.13* | -5.96 |
| 15L7084×川14品16 15L7084×Chuan 14 pin 16 | 8.80* | 29.14** | 2.90 | -4.44 | 11.64** | -9.72** | -9.50* | -9.67* |
| 18L7077×川14品16 18L7077×Chuan 14 pin 16 | 7.00* | 21.54** | 3.08 | -9.01* | 3.59 | -7.76* | -8.82* | -8.00* |
| 12L8012×川麦93 12L8012×Chuanmai 93 | 20.39** | 24.25** | -9.23* | -10.34** | 11.45** | -4.88 | -4.58 | -4.81 |
| 12L8015×川麦93 12L8015×Chuanmai 93 | 26.23** | 26.19** | -7.56* | 13.06** | 14.66** | -8.44* | -8.79* | -8.52* |
| 15L7084×川麦93 15L7084×Chuanmai 93 | 10.44** | 8.42* | -0.70 | -15.80** | 19.09** | 1.13 | 2.17 | 1.54 |
新窗口打开|下载CSV
2.3 杂交小麦组合光合特性的相关性分析
2.3.1 杂交小麦各光合指标之间的相关性分析 从表4可以看出杂交小麦Pn与Gs的相关系数为0.939(P<0.01),呈极显著正相关,且杂交小麦的Pn与Tr的相关系数为0.680(P<0.05),呈显著正相关。其他光合性状与净光合速率的相关并未达显著性水平。此外,叶绿素a与叶绿素b呈极显著正相关。Table 4
表4
表4光合作用相关指标之间的简单相关系数
Table 4
| 性状 Trait | 净光合速率 Pn | 气孔导度 Gs | 胞间二氧化碳浓度 Ci | 水分利用效率 WUE | 蒸腾速率 Tr | 叶绿素a Chl.a | 叶绿素b Chl.b |
|---|---|---|---|---|---|---|---|
| 气孔导度 Gs | 0.939** | ||||||
| 胞间二氧化碳浓度 Ci | -0.534 | -0.189 | |||||
| 水分利用效率 WUE | 0.382 | 0.396 | -0.626* | ||||
| 蒸腾速率 Tr | 0.680* | 0.559 | 0.329 | -0.196 | |||
| 叶绿素a Chl.a | -0.257 | 0.002 | 0.017 | 0.113 | -0.670* | ||
| 叶绿素b Chl.b | -0.414 | -0.269 | -0.107 | -0.017 | -0.619* | 0.843** | |
| 叶绿素(a+b) Chl.(a+b) | -0.199 | -0.062 | -0.010 | 0.082 | -0.678* | 0.992** | 0.904** |
新窗口打开|下载CSV
2.3.2 杂交小麦组合与亲本光合特性的相关性分析 由表5杂交小麦组合与亲本光合特性的相关系数可知,杂交小麦组合光合特性与恢复系、不育系以及双亲中亲值的相关性均未达显著水平。杂交组合叶绿素a的含量与不育系、恢复系和中亲值均呈正相关,相关系数大小依次为中亲值、不育系和恢复系;而叶绿素b的含量只与不育系和中亲值呈正相关;但叶绿素总含量相关系数大小依次为不育系>中亲值>恢复系。杂交组合的净光合速率仅与不育系呈正相关。杂交小麦组合与亲本其余的光合特性指标均呈负相关。
Table 5
表5
表5杂交小麦组合与亲本光合特性的相关系数
Table 5
| 性状 Trait | 净光合速率 Pn | 气孔导度 Gs | 胞间二氧化碳浓度 Ci | 水分利用效率 WUE | 蒸腾速率 Tr | 叶绿素a Chl.a | 叶绿素b Chl.b | 叶绿素(a+b) Chl.(a+b) |
|---|---|---|---|---|---|---|---|---|
| 杂交小麦组合与不育系值HMC | -0.219 | -0.437 | 0.128 | -0.234 | -0.704 | 0.361 | 0.585 | 0.416 |
| 杂交小麦组合与恢复系值HRC | 0.359 | -0.508 | -0.668 | -0.089 | -0.177 | 0.249 | -0.313 | 0.109 |
| 杂交小麦组合与中亲值HMPC | -0.192 | -0.565 | -0.029 | -0.239 | -0.270 | 0.374 | 0.283 | 0.340 |
新窗口打开|下载CSV
2.4 产量及其构成因素的杂种优势分析
由表6可以看出,不同杂交小麦组合产量性状的超高亲优势存在差异,主穗结实小穗数、主穗穗长、穗粒数、有效穗数、单株籽粒产量、千粒重、单株地上生物量和收获系数的超高亲优势变幅分别为-1.39%—5.09%、-12.35%—3.99% 、-25.86%—-1.94%、15.44%—46.22%、7.45%—17.85%、-5.95%—9.40%、4.41%—17.10%、1.03%—6.62%;而在同一杂交小麦组合中,不同产量性状的杂种优势表现出明显的差异。例如,组合12L8015×川14品16的穗粒数和穗长的超高亲优势分别为-20.66%和-6.67%,但有效穗数、单株产量和单株地上生物量则高达40.94%、17.67%和17.10%。同时在杂交组合中当恢复系相同,而不育系不同时,其产量性状表现也有所不同,例如组合12L8012×川麦93和12L8015×川麦93千粒重的超高亲优势分别为-5.95%和9.40%。同样当不育系相同而恢复系不同时,光合性状杂种优势的表现也不同。t 测验结果显示,在6个杂交组合中,大部分高亲优势值达到了显著或极显著水平,其中以有效穗数、单株产量、单株地上生物量最为明显。Table 6
表6
表6小麦杂交组合产量性状的超高亲优势值
Table 6
| F1代 F1 hybrid | 主穗小穗数 SN | 主穗长 SL | 穗粒数 GNPS | 有效穗数 SNPP | 单株产量 GYPP | 千粒重 TGW | 单株生物量 BMPP | 收获指数 HI |
|---|---|---|---|---|---|---|---|---|
| 12L8015×川14品16 12L8015×Chuan 14 pin 16 | 4.15* | -6.67* | -20.66** | 40.94** | 17.67** | 6.16* | 17.10** | 1.03 |
| 15L7084×川14品16 15L7084×Chuan 14 pin 16 | 5.09** | 3.99* | -1.94 | 15.44** | 17.85* | 5.85* | 15.34* | 0.82 |
| 18L7077×川14品16 18L7077×Chuan 14 pin 16 | 0.94 | -0.82 | -10.41** | 24.83** | 16.83* | 4.46 | 14.05* | 1.51 |
| 12L8012×川麦93 12L8012×Chuanmai 93 | 0.13 | -11.25** | -20.28** | 42.11** | 7.45* | -5.95* | 4.60 | 1.38 |
| 12L8015×川麦93 12L8015×Chuanmai 93 | -1.39 | -12.35** | -25.86** | 46.62** | 17.51* | 9.40** | 12.30** | 6.62* |
| 15L7084×川麦93 15L7084×Chuanmai 93 | 2.71 | -4.97* | -19.61** | 35.34** | 7.73* | -0.76 | 4.41 | 4.25 |
新窗口打开|下载CSV
2.5 净光合速率与产量性状的相关性分析
净光合速率(Pn)与主穗长、株高、单株产量、单株地上生物量等产量性状的相关系数结果(表7)显示,净光合速率与单株地上生物量、单株产量的相关系数分别为0.578(P<0.05)、0.862(P<0.01),呈显著和极显著正相关,同时单株产量与单株生物量的相关系数为0.981,呈极显著正相关,单株产量与有效穗数穗数的相关系数为0.815(P<0.05),呈显著正相关。Table 7
表7
表7小麦净光合速率与产量相关性状的相关系数
Table 7
| 株高 PH | 主穗长 SL | 单株生物量 BMPP | 单株产量 GYPP | 有效穗数 SNPP | 穗粒数 GNPS | 主穗小穗数 SN | 千粒重 TGW | 收获系数 HI | |
|---|---|---|---|---|---|---|---|---|---|
| 主穗长 SL | 0.625* | ||||||||
| 单株生物量 BMPP | 0.734** | 0.789** | |||||||
| 单株产量 GYPP | 0.291 | -0.429 | 0.981** | ||||||
| 有效穗数 SNPP | -0.288 | -0.882** | -0.262 | 0.815* | |||||
| 穗粒数 GNPS | 0.612** | 0.928** | 0.903** | 0.209 | 0.799** | ||||
| 主穗小穗数 SN | 0.797** | 0.841** | 0.790** | -0.701 | -0.575 | 0.805** | |||
| 千粒重 TGW | 0.415 | 0.001 | 0.687 | 0.651 | 0.118 | 0.157 | -0.349 | ||
| 收获指数 HI | -0.442 | -0.538 | 0.422 | 0.572 | 0.275 | -0.377 | -0.413 | 0.431 | |
| 净光合速率 Pn | 0.348 | 0.420 | 0.578* | 0.862** | 0.150 | 0.420 | 0.423 | 0.343 | 0.392 |
新窗口打开|下载CSV
2.6 Rubisco活性及其大小亚基编码基因rbcL和rbcS相对表达量杂种优势分析
2.6.1 Rubisco活性比较分析 结合图1-A得知供试杂交小麦组合的Rubisco活性均高于双亲。杂种优势分析表明(表8),杂交小麦均表现出显著的中亲优势和超高亲优势,中亲优势变幅为7.07%—13.00%,平均值为9.84%,超高亲优势变幅为0.84%—8.28%,平均值为5.41%。组合19-220的中亲优势和超高亲优势值最小,分别为7.07%和0.84%,组合19-200的中亲优势值最高,为13.00%,组合19-204的超高亲优势值最大,为8.28%。图1
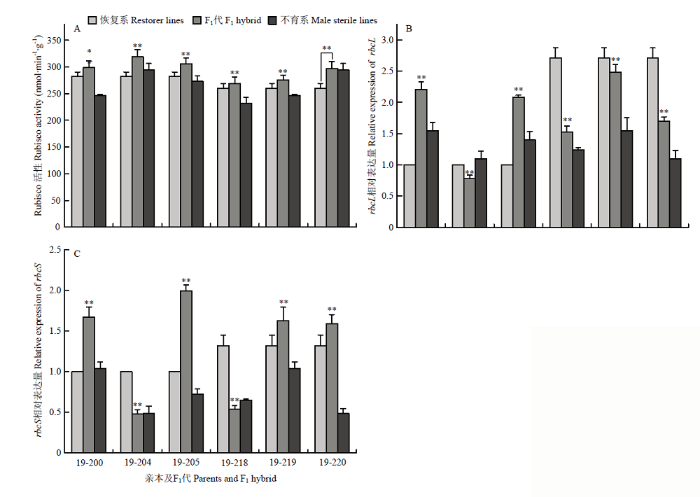 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1杂交小麦Rubisco活性及其大小亚基编码基因rbcL和rbcS相对表达量比较
对照的表达量为1;“**”表示相对于对照及双亲有显著差异,P<0.01
Fig. 1Rubisco activity and relative expression levels of genes encoding rbcL and rbcS in hybrid wheat
The expression level of the control is 1; ** indicates significant difference at P<0.01
Table 8
表8
表8杂交小麦Rubisco活性及其大小亚基编码基因rbcL和rbcS相对表达量的杂种优势比较
Table 8
| 编号 Number | F1代 F1 hybrid | 指标 Index | 中亲优势 Over mid-parent heterosis (%) | 超高亲优势 Over high-parent heterosis (%) | 超低亲优势 Below low-parent heterosis (%) |
|---|---|---|---|---|---|
| 19-200 | 12L8015×川14品16 12L8015×Chuan 14 pin 16 | Rubisco活性 Rubisco activity | 13.00** | 5.72* | 21.37** |
| rbcL相对表达量 Relative expression of rbcL | 73.17** | 42.53** | 120.58** | ||
| rbcS相对表达量 Relative expression of rbcS | 64.22** | 61.50** | 67.03** | ||
| 19-204 | 18L7077×川14品16 18L7077×Chuan 14 pin 16 | Rubisco活性 Rubisco activity | 10.52** | 8.28* | 12.86** |
| rbcL相对表达量 Relative expression of rbcL | -25.26** | -28.56** | -21.65** | ||
| rbcS相对表达量 Relative expression of rbcS | -35.69** | -52.26** | -1.47 | ||
| 19-205 | 15L7084×川14品16 15L7084×Chuan 14 pin 16 | Rubisco活性 Rubisco activity | 10.18** | 8.31* | 27.32** |
| rbcL相对表达量 Relative expression of rbcL | 86.76** | 60.10** | 124.08** | ||
| rbcS相对表达量 Relative expression of rbcS | 131.43** | 99.58** | 175.37** | ||
| 19-218 | 12L8012×川麦93 12L8012×Chuanmai 93 | Rubisco活性 Rubisco activity | 9.30* | 3.30 | 16.04** |
| rbcL相对表达量 Relative expression of rbcL | -22.73** | -43.64** | 22.85** | ||
| rbcS相对表达量 Relative expression of rbcS | -44.97** | -59.00** | -16.36 | ||
| 19-219 | 12L8015×川麦93 12L8015×Chuanmai 93 | Rubisco活性 Rubisco activity | 8.99* | 6.03* | 12.13** |
| rbcL相对表达量 Relative expression of rbcL | 16.70* | -8.32 | 60.51** | ||
| rbcS相对表达量 Relative expression of rbcS | 38.33** | 23.41** | 57.35** | ||
| 19-220 | 15L7084×川麦93 15L7084×Chuanmai 93 | Rubisco活性 Rubisco activity | 7.07* | 0.84 | 14.11** |
| rbcL相对表达量 Relative expression of rbcL | -10.73 | -37.30** | 54.91** | ||
| rbcS相对表达量 Relative expression of rbcS | 76.60** | 20.74** | 228.64** |
新窗口打开|下载CSV
2.6.2 Rubisco大小亚基编码基因rbcL、rbcS相对表达量分析 从图1-B—C和表8可知,杂交小麦及其双亲的rbcL、rbcS的相对表达量具有显著差异,不同杂交小麦组合的rbcL、rbcS表达量存在差异,组合19-200、19-205的rbcL、rbcS的相对表达量都显著高于双亲,且具有60.10%、99.58%的超高亲优势,而组合19-204的rbcL、rbcS的相对表达量都显著低于双亲,具有显著负向低亲优势,其他组合的表达量大都介于双亲之间。
3 讨论
3.1 不同杂交小麦组合光合优势和产量优势分析
光合作用是决定植物生长和生产力的主要因素,约95%的植物干物质来自光合同化的CO2[22]。小麦苗期的光合作用对于整个生长过程至关重要,甚至可能影响成熟期的生物量以及籽粒产量。研究表明,杂交种具有更为显著的光合优势[23,24,25],且杂交小麦在开花之前具有杂种优势[18]。本试验表明,6个杂交小麦在苗期已具有显著的杂种优势,净光合速率、气孔导度、蒸腾速率在苗期表现出显著的超高亲优势,且净光合速率与气孔导度、蒸腾速率呈极显著和显著正相关,说明气孔导度、蒸腾速率可以作为筛选高光合速率材料的指标。本研究发现恢复系为川麦93的杂交小麦比恢复系为川14品16的杂交小麦具有更高的净光合速率和更为显著的超高亲优势值,且川麦93的净光合速率显著高于川14品16,与张其德等[26]研究报道的双亲光合能力共同决定了杂交小麦组合光合特性的杂种优势的结果基本一致。因此,可以考虑选择以净光合速率较高的品种(系)作为恢复系,来进行强优势小麦杂交组合的选育。供试杂交小麦组合成熟期的产量性状表现出显著的超高亲优势,其中单株产量和单株生物量的高亲优势值最高,平均超高亲优势值分别为11.3%和14.1%;而其产量三要素亩穗数、千粒重、穗粒数的杂种优势表现有所不同,其中穗数表现出最高的超高亲优势值,最高达40.94%,大部分组合的千粒重表现出了正向的超高亲优势值。AISAWI等[27]研究发现增加生物量可以增加产量,TAUSZ-POSCH等[28]指出穗数是影响小麦生物量和产量潜力的关键农艺性状,本研究结果也与其一致,通过相关性分析发现单株籽粒产量与单株地上部生物量呈极显著正相关,单株产量与有效穗数呈显著正相关,说明要增加小麦产量可以通过提高穗数及生物量来实现。我们将杂交小麦及其双亲苗期分蘖数进行相关性分析,发现杂交小麦分蘖数与不育系呈显著正相关,由此说明在育种过程中可以选择分蘖数较多的不育系进行配种,从而得到穗数更多和产量更高的杂交小麦。而生物量的增加主要归因于更高的光合速率、气孔导度等[29],将苗期净光合速率与产量和农艺性状进行相关性分析结果表明,净光合速率与单株地上部生物量、单株籽粒产量呈显著和极显著正相关,由此说明,杂交小麦苗期净光合速率的提高与成熟期产量的增长关系密切,可将苗期的净光合速率作为早期初步筛选强优势组合的参考指标。
3.2 不同杂交小麦组合叶绿素含量、光合酶活性及基因表达与光合速率的关系
核酮糖1,5-二磷酸羧化酶(Rubisco)是光合作用中的限速酶[30],Rubisco由8个大亚基和8个小亚基组成,其中大亚基由叶绿体基因组rbcL基因编码,小亚基为核多基因家族rbcS编码[31,32,33],同时Rubisco是一个双功能酶,即调控CO2的固定,又参与调控光呼吸途径[34,35]。叶绿素是光合作用机制的重要组成部分,能够收集光能驱动电子链。为进一步探寻杂交种高光合能力的原因,本研究分析了叶绿素含量、Rubisco的活性及其大小亚基编码基因rbcL、rbcS的相对表达量,发现大多数杂交小麦的叶绿素含量都低于其高亲,但杂交小麦也大都有更高的光合速率,其原因可能是苗期的叶绿素含量都较低,且杂交小麦与亲本间的叶绿素含量差异较小,变异系数较小,仅为3.90%—4.04%;也有****提出在叶绿素含量较低的情况下,植物叶片具有增加捕光色素分子的有效光能吸收截面来提高捕光能力的适应性[36],苗期的杂交小麦可能具有更强的捕光能力,而在LI等[37]的研究中比较了缺乏叶绿素的水稻突变体和野生型正常水稻在光能利用上的差别,并发现了突变体的光合速率与电子传递效率与野生型相当,且突变体的叶绿素缺乏对叶绿体的大小和基粒堆积没有负面影响,也有****提出叶绿素可能会以非活性形式存在。但本研究仅测定了苗期的光合速率和叶绿素含量,关于叶绿素含量和光合速率的关系还需在整个小麦生育期中进行进一步研究,才能更好地探明。本研究结果表明,杂交小麦Rubisco活性显著高于双亲,具有显著的超高亲优势,相关分析显示Rubisco活性与净光合速率正相关,虽不显著,但也说明了更高的Rubisco活性可能对应了更强的光合利用能力;大部分杂交小麦的rbcL和rbcS相对表达量显著高于双亲或介于双亲之间,具有显著的超高亲优势和中亲优势,已有研究表明,Rubisco小亚基编码基因rbcS的过表达可以增加温室条件下水稻剑叶中Rubisco含量[38,39],但不会导致光合速率以及植物生物量的增加,但rbcL、rbcS的相对表达量与Rubisco活性、净光合速率均无显著相关性,这可能是由于不同的环境及生长阶段会影响到 rbcS 的表达量变化[40,41]。另有研究表明,光合作用中一种催化Rubisco活性重要的酶Rubisco活化酶(Rubisco activase,RCA)被发现其表达量与生物量和产量显著正相关[42];DRIEVER等[43]发现了景天庚酮糖-1,7-二磷酸酶(SBPase)的过表达可以提高叶片光合作用以及生物量和籽粒产量,这也说明了要探究杂交小麦高光合能力需要从多个方面来研究,SBPcase以及RCA可能是一些突破口,后续的研究可以从这些方面进行突破。目前也有通过探索杂种优势的分子基础,从而获得知识和信息应用于农业育种,包括亲本的遗传改良和通过优化育种设计有效地创造优良杂交种。当杂种优势位点、致病性杂种优势基因甚至致病性变异已知后,就有可能在亲本中分析关键位点的基因型,提前预测强杂种优势的潜在杂交组合[44]。LIU等[45]研究分析了京麦8及其双亲的转录组,发现来自幼苗组织的差异表达基因(differentially expressed genes,DEGs)在参与光合作用和碳固定的过程中显著丰富,并且与两个自交系相比,这些DEGs中大多数在杂交种京麦8中表达水平更高,而水稻超级杂种Lyp9的初步基因表达系列分析(Serial analysis of gene expression, SAGE)显示,与双亲相比,杂交种中光呼吸关键酶基因被下调,而与碳和氮固定相关的许多其他基因均被上调[46]。这些研究揭示了杂交种中表达丰富的基因,但在育种中的利用还很少,本试验只是结合田间的光合表现和产量表现进行了一定的比较分析,对于杂种优势机制的探索较少,需要在分子基础上去探讨光合优势以及产量优势形成的原因。
4 结论
杂交小麦在苗期已具有显著的光合优势,净光合速率与成熟期单株产量和单株生物量显著正相关,可将苗期的净光合速率作为早期筛选高产品种强优势组合的参考依据,并结合田间分蘖、生长势等农艺性状的表现,早期对杂交组合的产量潜力进行简单预测。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1126/science.1185383URL [本文引用: 1]
[本文引用: 1]
DOI:10.1126/science.1183700URL [本文引用: 1]
DOI:10.1111/jipb.2007.49.issue-6URL [本文引用: 1]
DOI:10.1146/arplant.2014.65.issue-1URL [本文引用: 1]
DOI:10.1007/s00122-019-03397-yURL [本文引用: 1]
(
[本文引用: 2]
[P].(
[本文引用: 2]
DOI:10.1111/nph.2009.181.issue-3URL [本文引用: 1]
DOI:10.1016/j.fcr.2012.09.008URL [本文引用: 1]
DOI:10.3389/fpls.2019.01428URL [本文引用: 1]
DOI:10.2135/cropsci1998.0011183X003800060011xURL [本文引用: 1]
DOI:10.1016/j.fcr.2011.03.015URL [本文引用: 1]
DOI:10.2135/cropsci2006.03.0175URL [本文引用: 1]
DOI:10.1007/s10681-007-9376-8URL [本文引用: 1]
DOI:10.1007/s10681-017-2040-zURL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1016/j.jplph.2006.01.007URL [本文引用: 1]
DOI:10.1016/j.jplph.2017.06.012URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.2135/cropsci2004.2086URL [本文引用: 1]
[本文引用: 1]
DOI:10.1038/nature07523URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.2135/cropsci2014.09.0601URL [本文引用: 1]
DOI:10.1016/j.eja.2014.12.009URL [本文引用: 1]
DOI:10.1016/j.eja.2014.08.005URL [本文引用: 1]
[本文引用: 1]
DOI:10.1007/s004380000404URL [本文引用: 1]
DOI:10.1023/A:1006122619851URL [本文引用: 1]
DOI:10.1146/arplant.1989.40.issue-1URL [本文引用: 1]
DOI:10.1007/BF00377192URL [本文引用: 1]
DOI:10.1007/BF00394870URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/jac.2013.199.issue-1URL [本文引用: 1]
DOI:10.1093/pcp/pcm035URL [本文引用: 1]
DOI:10.1111/pce.2009.32.issue-4URL [本文引用: 1]
DOI:10.1104/pp.108.126946URL [本文引用: 1]
DOI:10.1006/abio.2001.5042URL [本文引用: 1]
DOI:10.1371/journal.pone.0161308URL [本文引用: 1]
[本文引用: 1]
DOI:10.1111/jipb.v62.3URL [本文引用: 1]
DOI:10.1007/s00425-018-2848-3URL [本文引用: 1]
DOI:10.1104/pp.105.060988URL [本文引用: 1]
