 ,, 李金桥, 赵旭, 李克斌, 曹雅忠, 尹姣
,, 李金桥, 赵旭, 李克斌, 曹雅忠, 尹姣 ,中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193
,中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193Expression, Purification and Functional Analysis of Odorant Binding Protein 11 (OBP11) in Anomala corpulenta
QIN JianHui ,, LI JinQiao, ZHAO Xu, LI KeBin, CAO YaZhong, YIN Jiao
,, LI JinQiao, ZHAO Xu, LI KeBin, CAO YaZhong, YIN Jiao ,State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193
,State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193通讯作者:
责任编辑: 岳梅
收稿日期:2020-10-31接受日期:2020-12-5
| 基金资助: |
Received:2020-10-31Accepted:2020-12-5
作者简介 About authors
秦健辉,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (4865KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
秦健辉, 李金桥, 赵旭, 李克斌, 曹雅忠, 尹姣. 铜绿丽金龟气味结合蛋白AcorOBP11的表达纯化及功能分析[J]. 中国农业科学, 2021, 54(14): 3017-3028 doi:10.3864/j.issn.0578-1752.2021.14.008
QIN JianHui, LI JinQiao, ZHAO Xu, LI KeBin, CAO YaZhong, YIN Jiao.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】铜绿丽金龟(Anomala corpulenta)属于鞘翅目,丽金龟科,是我国重要的地下害虫,其成虫主要危害榆树、柳树、苹果树、桃树、苘麻等植物叶片,造成巨大的经济损失。长期以来,化学农药是防治铜绿丽金龟成虫的主要手段,但长期使用化学农药不仅会杀伤天敌、增强害虫抗药性,还会造成一定的环境问题。研究铜绿丽金龟嗅觉蛋白对寄主植物挥发物的识别机制可明确铜绿丽金龟对寄主植物的选择机理,为铜绿丽金龟的生态防控提供新思路。【前人研究进展】目前,开发成虫引诱剂是地下害虫绿色防控的研究热点,其中植物挥发性信息物质是常见的引诱剂之一。一些寄主植物挥发性成分已被证明对金龟子有显著的诱集作用[1]。如丁酸苯乙酯、丁香酚、香叶醇以3﹕7﹕3比例混合时对日本丽金龟(Popillia japonica)有很好的引诱效果,引诱剂现已商品化[2];由苯乙醛、苯甲醛和苯甲醇混配而成的引诱剂能强烈吸引扁绿丽金龟(Anomala octiescostata)成虫[3];邻苯二甲酸二丁酯、肉桂醛、顺-3-己烯基乙酸酯三者混配对华北大黑鳃金龟(Holotrichia oblita)成虫有较好的引诱活性[4]。同样地,铜绿丽金龟对甲基庚烯酮、顺-3-己烯乙酸酯等植物挥发物也产生明显的趋性行为反应[5]。昆虫主要通过高度灵敏的嗅觉系统来识别环境中的寄主植物挥发物,进而产生定位寄主、取食等一系列的行为反应,其中嗅觉蛋白是其发挥嗅觉功能的基础[6]。嗅觉蛋白主要在成虫触角中表达,主要包括气味结合蛋白(odorant binding protein,OBP)、化学感受蛋白(chemosensory protein,CSP)、气味受体(odorant receptor,OR)、离子型受体(ionotropic receptor,IR)、味觉受体(gustatory receptor,GR)、感觉神经元膜蛋白(sensory neuron membrane protein,SNMP)和气味降解酶(odorant-degrading enzyme,ODE)[7]。其中OBP是昆虫专一性识别外界气味物质的第一步生化反应[8]。研究表明,暗黑鳃金龟(Holotrichia parallela)HparOBP1和HparOBP2主要识别寄主植物挥发物[9],HparOBP15a可结合多种寄主植物挥发物与两种性信息素[10];华北大黑鳃金龟HoblOBP1、2、3、4、13识别寄主植物挥发物,HoblOBP5、8、9和24可以识别产卵信息素[11,12,13,14]。另外,通过分子模拟和蛋白突变解析了华北大黑鳃金龟HoblOBP1和HoblOBP1/OBP2异源二聚体对寄主植物挥发物识别的分子机制[15],为阐明鳃金龟的嗅觉识别机制打下了基础。【本研究切入点】作为田间优势种群且成虫危害严重的铜绿丽金龟的嗅觉蛋白研究较少,仅探讨了AcorOBP1识别寄主植物小叶女贞挥发物的功能[16]。因此,本研究通过克隆铜绿丽金龟OBP11的全长基因(AcorOBP11),原核表达并纯化获得重组蛋白,利用荧光竞争结合试验明确其与37种寄主植物挥发物的结合特征,结合同源建模和分子对接探讨蛋白与不同化合物的结合机理。【拟解决的关键问题】研究AcorOBP11与寄主植物挥发物的结合特性,为阐明铜绿丽金龟在定位寄主植物过程中的嗅觉识别机制打下基础。1 材料与方法
试验于2019年在中国农业科学院植物保护研究所完成。1.1 供试材料
铜绿丽金龟采集于河北省石家庄市,成虫饲养于养虫盒中(60 cm×50 cm×40 cm),室温(25±1)℃,光周期为16L﹕8D。将羽化5—7日龄成虫的触角用镊子取下后迅速置于液氮中速冻,于-80℃保存备用。Trizol试剂购自生工生物工程(上海)有限公司,FastKing一步法除基因组cDNA第一链合成预混试剂、胶回收试剂盒购于天根生化科技(北京)有限公司,限制性内切酶 BamHⅠ、Hind Ⅲ购于日本TaKaRa公司,1×Taq PCR Master Mix、DNA Marker、感受态细胞DH5 α、BL21(DE3)感受态细胞购于北京博迈德基因技术有限公司,PEASY-T载体、Trans-T1感受态细胞、重组肠激酶购于北京全式金生物技术有限公司,T4 DNA Ligase购于Promega公司,Kan、Amp、X-gal、IPTG购于Sigma公司,引物由生工生物工程(上海)有限公司合成。
1.2 RNA提取及cDNA第一链的合成
收集铜绿丽金龟雌、雄成虫的触角各60对,平均分装到3个1.5 mL离心管中,将收集到的样品立即置于预冷的无RNA酶研钵中研磨,根据TRIzol试剂提供的说明书提取触角总RNA,加入适量DEPC水溶解沉淀。利用核酸蛋白浓度测定仪测定RNA浓度及质量,用1.0%琼脂糖凝胶电泳检测RNA完整性。按照FastKing一步法除基因组cDNA第一链合成预混试剂说明书进行反转录合成cDNA第一链,作为RT-PCR的扩增模板。1.3 AcorOBP11克隆及序列分析
根据GenBank登录的AcorOBP11(KM251651)基因全长序列,利用Primer Premier 5.0设计特异性引物,引物加上BamH Ⅰ和 Hind Ⅲ酶切位点(下划线表示)及保护碱基, AcorOBP11上下游引物分别为AcorOBP11F:5′-CGGGATCCTTCGAGGATCAGGCT TATAAT-3′;AcorOBP11R:5′-CCCAAGCTTTTAGCA CTTGACAGGTGGTG-3′。以1.2反转录合成的cDNA为模板,在PCR仪中进行扩增。RT-PCR反应体系为50 μL,其中cDNA模板2 μL,上下游引物(10 μmol·L-1)各2 μL,其余用1×Taq PCR Master Mix补齐。扩增程序:95℃ 5 min;95℃ 30 s,45℃ 30 s,72℃ 30 s,30个循环;72℃ 10 min。用1.0%琼脂糖凝胶电泳检测扩增产物,按照普通琼脂糖凝胶回收试剂盒说明书回收符合预期大小的DNA片段。将回收产物与PEASY-T载体连接,转化到Trans-T1感受态细胞中,在含有IPTG、X-gal和AMP的LB固体培养基中进行蓝白斑筛选,挑选5个阳性菌落至10 μL ddH2O中,进行菌落PCR,利用琼脂糖凝胶电泳验证目的基因是否成功插入。将正确的阳性菌落置于LB液体培养基中振荡培养12—16 h(37℃,220 r/min),送至生工生物工程公司测序。测序结果通过DNAMAN进行序列比对进一步验证。
利用ClustaX2.1进行AcorOBP11与其他昆虫OBP的多序列比对,通过MEGA7软件中的最大似然法构建系统进化树。
1.4 AcorOBP11基因重组表达载体构建及原核表达纯化
利用限制性内切酶BamHⅠ和Hind Ⅲ将含有目的片段的重组克隆质粒PEASY-T-AcorOBP11和表达载体pET28a进行双酶切,用普通琼脂糖凝胶回收试剂盒分别回收表达载体和目的片段。利用T4 DNA连接酶将目的片段连接到表达载体pET28a上,再转化到DH5 α感受态细胞中,挑取阳性克隆培养,送至生工生物工程公司测序验证。将测序正确的重组质粒pET28a/AcorOBP11转入大肠杆菌BL21(DE3)表达感受态细胞,挑取单菌落,培养测序。将测序正确的菌液按1﹕100(v/v)的比例接种于新鲜的LB液体培养基(含终浓度50 μg·mL-1 Kan)中,37℃,220 r/min振荡培养至OD600值为0.8—1.0时,加入终浓度为0.25 mmol·L-1 IPTG溶液进行诱导,37℃,220 r/min摇床中诱导4 h。离心收集菌体,加入裂解液将菌体重新悬浮,超声波破碎,12 000 r/min离心30 min,收集上清和沉淀,用SDS-PAGE检测蛋白的表达。使用镍柱亲和层析方法纯化蛋白,使用咪唑磷酸缓冲液进行梯度洗脱,纯化后蛋白用重组肠激酶切除His标签,再次过柱纯化,置于50 mmol·L-1 Tris-HCl(pH 7.4)缓冲液中过夜透析,定量至2 μmol·L-1,置于-20℃备用。1.5 荧光竞争结合试验
分别选择来源于榆树、苹果树、桃树等铜绿丽金龟寄主植物的37种植物挥发物(表1)作为候选配体化合物,以色谱级甲醇为溶剂将各气味溶液配制成1 mmol·L-1的试样。使用970 CRT荧光分光光度计(上海精密科学公司)进行荧光竞争结合试验,供试容器为1 cm宽的石英比色皿,激发狭缝10 nm,灵敏度为1,设定激发光波长为337 nm,扫描波长的范围设定为350—520 nm。取2 mL浓度为2 µmol·L-1的AcorOBP11重组蛋白溶液加入石英比色皿中,逐次加入2 µmol·L-11-NPN直至荧光强度值达到饱和值。分别记录每个浓度梯度产生的荧光强度最大值,利用Scatchard方程计算重组蛋白与1-NPN的结合常数K1-NPN。
在比色皿中加入2 mL浓度为2 μmol·L-1的AcorOBP11蛋白溶液,再加入1-NPN使其终浓度为2 μmol·L-1。将配制好的气味标样逐次加入到比色皿中,使终浓度由2 μmol·L-1递增至40 μmol·L-1,记录荧光强度峰值的变化。假设AcorOBP11活性为100%,且在饱和状态下配体与蛋白按照1﹕1的比例结合。根据公式Ki=[IC50]/(1+[1-NPN]/K1-NPN)计算重组蛋白AcorOBP11与配体的结合常数Ki。[IC50]为AcorOBP11/1-NPN复合物的荧光强度下降50%的配体浓度。[1-NPN]为自由的1-NPN探针的浓度,K1-NPN为AcorOBP11/1-NPN的结合常数。
1.6 AcorOBP11同源建模及分子对接
根据AcorOBP11的氨基酸序列,利用Swiss-model(利用Autodock 4.2.6模拟AcorOBP11与寄主挥发物的结合情况。选取荧光竞争结合试验中与AcorOBP11结合较好的α-紫罗兰酮、异戊醛、丙烯酸-2-乙基己酯、乙酸龙脑酯、柠檬烯、反-2-己烯醛6种化合物开展分子对接。利用ChemDraw 18.0绘制配体的二维结构,然后通过Chem3D 18.0软件将其转换为三维结构,并使用MM2力场优化配体的构型以获得最稳定的构象。利用Autodock 4.2.6为AcorOBP11添加极性氢原子和电荷,其中AutoGrid主要负责计算网格中的相关能量,而AutoDock负责构象搜索和评估。设置GridBox大小为110×110×110,栅格间距设置为0.375 Å。采用半柔性对接,将蛋白质设置为刚性大分子,将配体设置为柔性分子。使用Lamarckian遗传算法寻找配体与受体最佳的结合位置状态。利用半经验的自由能计算方法计算配体与受体之间的结合能力。对接结果生成50个最佳构象,选取结合能最小的构象用Pymol 2.3.4和LigPlus进行可视化分析。
2 结果
2.1 AcorOBP11序列分析
AcorOBP11的开放阅读框(ORF)为639 bp,编码212个氨基酸,预测分子量为23.8 kD,等电点为6.92,氨基酸序列的N末端有17个氨基酸组成的信号肽(图1-A),将AcorOBP11与其他昆虫OBP的氨基酸序列进行序列比对(图1-B),发现其在第6个保守的半胱氨酸后面含有2个保守的半胱氨酸残基和1个脯氨酸残基,属于Plus-C OBP亚家族。构建系统发育树(图1-C),结果显示AcorOBP11与HparOBP9进化关系最近,自展值为100。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1AcorOBP11序列分析
A:AcorOBP11核苷酸序列及其推导氨基酸序列,信号肽用单下划线表示Nucleotide sequence and amino acid sequence of AcorOBP11. The predicted signal peptide is underlined;B:AcorOBP11与其他昆虫OBP的序列比对Sequences alignment of AcorOBP11 with other insect OBPs;C:AcorOBP11与其他昆虫OBP的系统发育树Phylogenetic tree of AcorOBP11 and other insect OBPs
Fig. 1Sequence analysis of AcorOBP11
2.2 AcorOBP11蛋白表达纯化
将含有pET28a/AcorOBP11质粒的BL21(DE3)单克隆菌落接种培养后,取1 mL菌液作为阴性对照,经终浓度0.25 mmol·L-1 IPTG诱导后,SDS-PAGE结果显示,含有His-tag的重组蛋白分子量约在30 kD,与预测的重组蛋白大小一致。将诱导后的菌液超声破碎后,检测包涵体和上清,目的蛋白主要在上清表达。蛋白纯化后用重组肠激酶切除His-tag,获得单一条带的目的蛋白,大小在25 kD左右,符合目的蛋白大小(图2)。图2
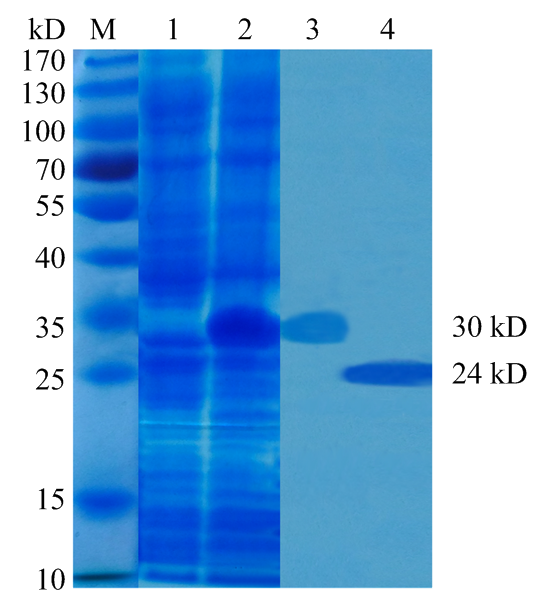 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2AcorOBP11蛋白诱导表达及纯化
M:蛋白质分子量标准物Protein molecular weight marker;1:未诱导的pET28a-AcorOBP11菌体 Non-induced pET28a-AcorOBP11 in Escherichia coli;2:经过IPTG诱导表达的pET28a-AcorOBP11-His目的蛋白 Expressed protein pET28a-AcorOBP11-His after induction by IPTG;3:经过镍柱纯化获得 pET28a-AcorOBP11蛋白Purified protein pET28a-AcorOBP11 through Ni-NTA column;4:经过重组肠激酶切除His标签后的pET28a-AcorOBP11蛋白 Purified protein pET28a-AcorOBP11 with His-tag cleaved by recombinant enterokinase
Fig. 2Expression and purification of the AcorOBP11 protein
2.3 AcorOBP11与气味配体的结合
AcorOBP11与1-NPN的结合曲线如图3-A所示,表明AcorOBP11与1-NPN具有良好的结合特性。利用Scatchard方程可计算出复合物AcorOBP11/1-NPN的结合常数为8.819 μmol·L-1。铜绿丽金龟与37种植物挥发物的荧光竞争性结合试验结果表明(表1),AcorOBP11结合谱较广,能够识别供试的绝大多数寄主植物挥发物,但其与不同寄主植物挥发物的结合能力存在显著差异(图3-B),对13种寄主植物挥发物具有较强的结合能力(IC50<40 μmol·L-1)。其中,AcorOBP11与植物挥发物α-紫罗兰酮结合能力最强,解离常数Ki值为22.78 µmol·L-1,其次是异戊醛(Ki=24.49 µmol·L-1)、丙烯酸-2-乙基己酯(Ki=25.11 µmol·L-1)和乙酸龙脑酯(Ki=26.36 µmol·L-1)。总体而言,AcorOBP11更倾向于结合醛类化合物,除了上述异戊醛,还对反-2-己烯醛、2-乙基己醛、庚醛、丁醛、辛醛有较强的结合能力。
Table 1
Table 1Binding properties of AcorOBP11 with different ligands
| 气味配体 Ligand | 结构式 Structural formula | 分子式 Formula | IC50(μmol·L-1) | Ki (μmol·L-1) |
|---|---|---|---|---|
| α-紫罗兰酮 α-Ionone | 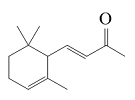 | C13H20O | 25.36 | 22.78 |
| 异戊醛 3-Methylbutanal | 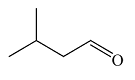 | C5H10O | 27.27 | 24.49 |
| 丙烯酸-2-乙基己酯 2-Ethylhexyl acrylate | 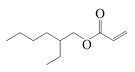 | C11H20O2 | 27.96 | 25.11 |
| 乙酸龙脑酯 Bornyl acetate |  | C12H20O2 | 29.35 | 26.36 |
| 柠檬烯 Cinene |  | C10H16 | 30.39 | 27.29 |
| 反-2-己烯醛 Trans-2-hexenal |  | C6H10O | 32.54 | 29.23 |
| 2-乙基己醛 2-Ethylhexanal |  | C8H16O | 33.33 | 29.94 |
| 异戊酸 Isovaleric acid | 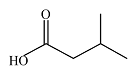 | C5H10O2 | 33.53 | 30.12 |
| 4-羟基-4-甲基-2-戊酮 4-Hydroxy-4-methyl-2-pentanone | 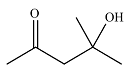 | C6H12O2 | 33.55 | 30.13 |
| 庚醛 Heptanal | 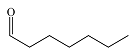 | C7H14O | 36.34 | 32.64 |
| 丁醛 Butyraldehyde | 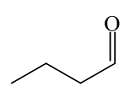 | C4H8O | 38.42 | 34.51 |
| 苯乙酸乙酯 Ethyl phenylacetate | 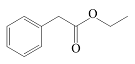 | C10H12O2 | 38.54 | 34.61 |
| 辛醛 Octanal | 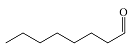 | C8H16O | 38.87 | 34.91 |
| α-松油醇 α-Terpineol | 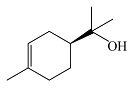 | C10H18O | 41.44 | 37.22 |
| 水杨酸甲酯 Methyl salicylate | 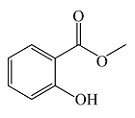 | C8H8O3 | 41.83 | 37.57 |
| 顺-3-己烯基丁酯 Cis-3-hexenyl buyrate | 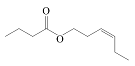 | C10H18O2 | 42.84 | 38.48 |
| 1-辛烯-3-醇 1-Octen-3-ol | 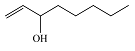 | C8H16O | 44.37 | 39.85 |
| 戊醛 Pentanal | 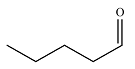 | C5H10O | 44.40 | 39.88 |
| 己二酸二异丁酯 Diisobutyl adipate | 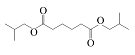 | C14H26O4 | 45.49 | 40.86 |
| 反-2-壬烯醛 Trans-2-nonenal |  | C9H16O | 45.55 | 40.91 |
| 苯甲酸甲酯 Methyl benzoate | 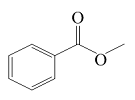 | C8H8O2 | 46.01 | 41.32 |
| 反式-2-己烯-1-醇 Trans-2-hexen-1-ol | 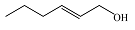 | C6H12O | 47.72 | 42.86 |
| 芳樟醇 Linalool | 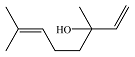 | C10H18O | 48.53 | 43.59 |
| β-石竹烯 β-Caryophyllene | 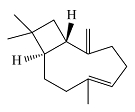 | C15H24 | 48.71 | 43.75 |
| β-罗勒烯 β-Ocimene | 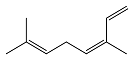 | C10H16 | 48.76 | 43.79 |
| 甲基庚烯酮 6-Methyl-5-hepten-2-one | 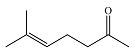 | C8H14O | 49.02 | 44.03 |
| 3,4-二甲基苯乙酮 3,4-Dimethyl phenylketone | 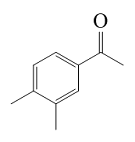 | C10H12O | 49.58 | 44.53 |
| 乙酸叶醇酯 Cis-3-hexenyl acetate | 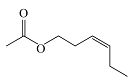 | C8H14O2 | 50.95 | 45.76 |
| 苯甲醛 Benzaldehyde | 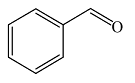 | C7H6O | 51.45 | 46.21 |
| 2-壬酮 2-Nonanone | 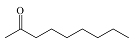 | C9H18O | 53.77 | 48.29 |
| 2-辛醇 2-Octanol | 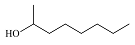 | C8H18O | 54.59 | 49.03 |
| 异丁醛 Isobutyraldehyde | 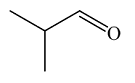 | C4H8O | 59.34 | 53.30 |
| 壬醛 Nonanal | 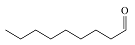 | C9H18O | 70.65 | 63.45 |
| 己酸 Caproic acid | 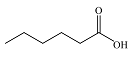 | C6H12O2 | 152.96 | 137.37 |
| α-丁香酚 α-Eugenol | 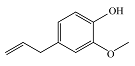 | C10H12O2 | N | N |
| 法尼烯 Farnesene | 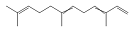 | C15H24 | N | N |
| 十二碳烯 Propylene tetramer |  | C12H24 | N | N |
新窗口打开|下载CSV
图3
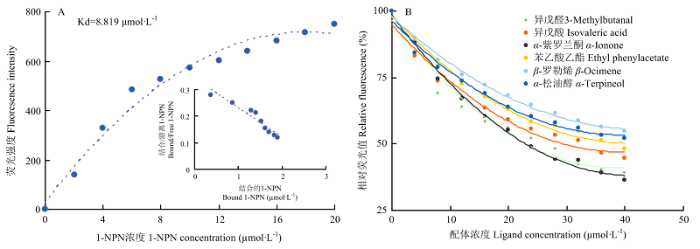 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3AcorOBP11与气味配体的结合
A:AcorOBP11和1-NPN的结合曲线以及Scatchard方程Binding curves and Scatchard plots of AcorOBP11 and 1-NPN;B:AcorOBP11与6种植物挥发物的结合曲线Binding curves of AcorOBP11 to six plant volatiles
Fig. 3Binding of AcorOBP11 with different ligands
2.4 AcorOBP11同源建模及分子对接
根据Swiss-model模板搜索的结果,选择冈比亚按蚊(Anopheles gambiae)气味结合蛋白AgamOBP48(PDB ID:4ij7)作为模板,构建了AcorOBP11三维结构图(图4-A),其主要包括6个α螺旋,分别由51—69(α1)、82—91(α2)、102—113(α3)、117—137(α4)、146—162(α5)、172—184(α6)位氨基酸组成。利用Procheck评估蛋白构象的合理性,分析拉氏图(图4-B)可知,AcorOBP11序列中位于最佳区域和较适合区域的氨基酸残基总和>90%,其中87.7%的氨基酸残基位于最佳区域,9.4%的氨基酸残基位于较合适区,表明构建的AcorOBP11三维结构是合理的。图4
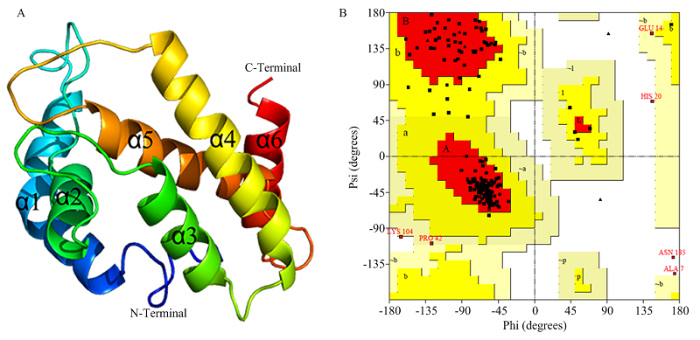 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4AcorOBP11的三维结构模型(A)及拉氏图(B)
Fig. 4Three-dimensional structure model (A) and Ramachandran plot (B) of AcorOBP11
由构建的AcorOBP11三维结构和6种化合物进行分子对接结果可知(表2),AcorOBP11与6种化合物均具有较低的结合能,其中与α-紫罗兰酮结合能最低,为-24.74 kJ·mol-1,表明其结合能力最强。由蛋白与配体结合的二维图可以看出(图5),α-紫罗兰酮、乙酸龙脑酯、异戊醛、丙烯酸-2-乙基己酯和反-2-己烯醛5种化合物分别与蛋白结合腔中的Cys163、Lys51、Glu52、Ala53、Asn176等氨基酸残基形成了氢键,柠檬烯虽然未与结合腔中的氨基酸残基形成氢键,但与12个氨基酸形成疏水作用。另外,由蛋白与配体结合的三维图(图6)可以看出,α-紫罗兰酮的疏水端进入了蛋白的疏水腔中,两个甲基与蛋白表面契合,几何匹配度极高,因此,α-紫罗兰酮与蛋白间结合能力最强;乙酸龙脑酯、丙烯酸-2-乙基己酯、异戊醛也分别与结合腔表面凹槽形状匹配;反-2-己烯醛与柠檬烯则完全进入了蛋白结合腔内部,周围分子间作用力很紧密,因此结合力较强。
Table 2
Table 2Binding energy between AcorOBP11 and ligands
| 配体 Ligand | 结构式 Structural formula | 结合能 Binding energy (kJ·mol-1) |
|---|---|---|
| α-紫罗兰酮 α-Ionone | 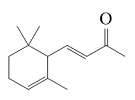 | -24.74 |
| 异戊醛 3-Methylbutanal | 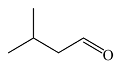 | -20.72 |
| 丙烯酸-2-乙基己酯 2-Ethylhexyl acrylate | 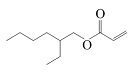 | -21.39 |
| 乙酸龙脑酯 Bornyl acetate |  | -22.52 |
| 柠檬烯 Cinene | 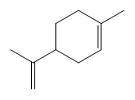 | -21.23 |
| 反-2-己烯醛 Trans-2-hexenal | 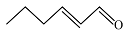 | -18.59 |
新窗口打开|下载CSV
图5
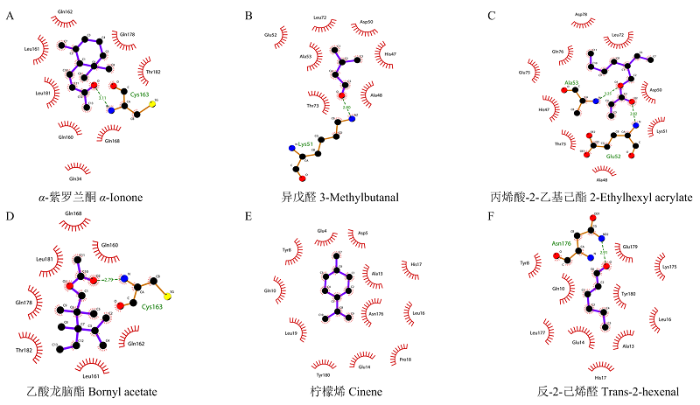 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5AcorOBP11与配体相互作用的关键氨基酸残基(二维结构)
Fig. 5The key residues of the different ligands that interact with AcorOBP11 (two dimensional)
图6
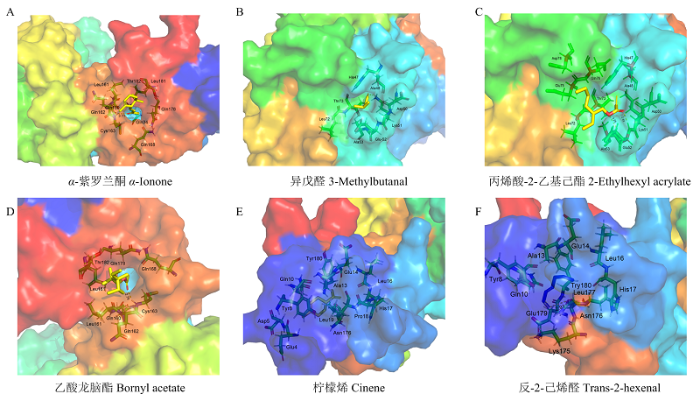 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6AcorOBP11与配体相互作用的氨基酸残基(三维结构)
Fig. 6The key residues of the different ligands that interact with AcorOBP11 (three dimensional)
3 讨论
铜绿丽金龟利用灵敏的嗅觉系统来识别环境中的寄主植物挥发物等气味化合物,气味结合蛋白是其行使嗅觉功能的重要嗅觉蛋白[19]。本文克隆了AcorOBP11,其编码的氨基酸序列在第6个半胱氨酸后存在2个保守的半胱氨酸残基和1个保守的脯氨酸残基,属于Plus-C OBP亚家族,具有鞘翅目气味结合蛋白的典型特征。寄主植物挥发物在昆虫对寄主植物的定位、识别、取食和产卵等生命活动中发挥重要作用[20]。本研究选取了37种铜绿丽金龟寄主植物挥发物,AcorOBP11与其中13种化合物具有较好的结合能力,如反-2-己烯醛、反-2-己烯醇、辛醛、庚醛等化合物均能引起铜绿丽金龟强烈的行为反应[5,21],表明AcorOBP11在铜绿丽金龟对寄主植物的识别定位中发挥着重要作用。然而,水杨酸甲酯、α-松油醇、石竹烯、罗勒烯、3,4-二甲基苯乙酮、苯甲醛、壬醛、法尼烯等植物挥发物虽然也能引起铜绿丽金龟成虫的行为趋性,但是与AcorOBP11结合较弱或不结合,推测这些寄主植物挥发物由铜绿丽金龟其他OBP识别,不同OBP分工明确,协同配合,共同完成其对寄主植物的识别过程[5,21]。选取的37种寄主植物挥发物包含酮类、醛类、酯类、烯类、酸类、醇类和酚类化合物,其中AcorOBP11与醛类化合物结合种类最多,与酮类、酯类、烯类、酸类都可结合,但不能与醇类和酚类化合物结合,说明化合物的官能团可影响AcorOBP11与寄主植物挥发物的结合。DENG等研究表明,气味分子的碳原子数影响配体与蛋白的结合能力,在一定范围内,随着碳原子数的增加,配体与重组蛋白的结合能力逐渐减弱[11,22-23];JU等研究认为气味配体的结合能力与配体的碳原子个数之间无明显线性关系[9,24-25]。本研究通过荧光竞争结合和分子对接试验表明,配体与AcorOBP11的结合能力与碳链长度不呈线性相关。AcorOBP11既可以结合α-紫罗兰酮(C13)、乙酸龙脑酯(C12)、丙烯酸-2-乙基己酯(C11),也可以结合丁醛(C4)、异戊醛(C5)、异戊酸(C5)。根据气味结合蛋白的三维结构模拟可以看出,其表面可形成形状各异的凹槽,推测化合物通过诱导契合原理结合在形状与之匹配的凹槽中,因此同一蛋白可能会结合不同大小及官能团的配体[26]。
荧光竞争结合和分子对接试验中,AcorOBP11均与α-紫罗兰酮结合能力最强,主要是由于α-紫罗兰酮与AcorOBP11在Cys163处形成长3.11 Å的氢键,推测氢键是一种较强的分子间作用力,可使蛋白与配体结合更加稳定。尽管其他化合物也与蛋白疏水腔形成了氢键,但 α-紫罗兰酮不仅与蛋白形成氢键,其疏水端进入了蛋白的结合腔中,两个甲基与蛋白表面高度契合,因此,推测蛋白结合腔与气味配体间的契合程度可以增加蛋白结合配体的稳定性。
分子对接从理论分析角度计算蛋白与配体的作用,与荧光竞争结合试验结果一致,研究结果明确了AcorOBP11蛋白的识别谱,推测AcorOBP11在铜绿丽金龟寄主植物的定位过程中发挥作用,不仅为解析铜绿丽金龟的嗅觉识别机制打下了基础,也为其生态防控提供了新思路。后续将通过RNA干扰、行为生测等进行功能的验证,利用分子动力学模拟、蛋白突变等手段探究蛋白与化合物的结合过程,深度解析AcorOBP11的功能;并进一步开展气味受体识别植物挥发物的功能研究,以期系统解析铜绿丽金龟定位寄主植物的分子机制。
4 结论
AcorOBP11能结合多种寄主植物挥发物,表明其可能在铜绿丽金龟找寻与定位寄主植物的过程中发挥重要作用。研究结果可为解析铜绿丽金龟嗅觉识别机制打下理论基础,并为害虫的无害化防控提供分子靶标。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
DOI:10.1007/BF00988630URL [本文引用: 1]
DOI:10.1007/BF02059891URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
DOI:10.1023/B:JOEC.0000028429.13413.a2URL [本文引用: 1]
DOI:10.1146/annurev-ento-120811-153635URL [本文引用: 1]
DOI:10.1038/293161a0URL [本文引用: 1]
DOI:10.1139/g2012-042URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/chemse/bjr084URL [本文引用: 2]
DOI:10.1371/journal.pone.0084795URL [本文引用: 1]
DOI:10.1016/j.ibmb.2018.11.002URL [本文引用: 1]
DOI:10.1016/j.ijbiomac.2019.06.013URL [本文引用: 1]
DOI:10.1016/j.ijbiomac.2019.10.182URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1107/S0021889892009944URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1046/j.1365-2583.2000.00221.xURL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1371/journal.pone.0033589URL [本文引用: 1]
DOI:10.1016/j.bbrc.2008.05.064URL [本文引用: 1]
DOI:10.1371/journal.pone.0155096URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
