 ,, 刘春宇, 谢贝昱, 张淑淑, 王丹阳, 朱振元
,, 刘春宇, 谢贝昱, 张淑淑, 王丹阳, 朱振元 ,天津科技大学食品科学与工程学院,天津 300457
,天津科技大学食品科学与工程学院,天津 300457Extraction Technology, Preliminary Structure and α-glucosidase Inhibition of Polysaccharide with Alkaline-Extracted from Sugarcane Peel
WANG XuanXuan ,, LIU ChunYu, XIE BeiYu, ZHANG ShuShu, WANG DanYang, ZHU ZhenYuan
,, LIU ChunYu, XIE BeiYu, ZHANG ShuShu, WANG DanYang, ZHU ZhenYuan ,College of Food Science and Engineering, Tianjin University of Science & Technology, Tianjin 300457
,College of Food Science and Engineering, Tianjin University of Science & Technology, Tianjin 300457通讯作者:
责任编辑: 赵伶俐
收稿日期:2020-09-20接受日期:2021-02-28网络出版日期:2021-06-16
| 基金资助: |
Received:2020-09-20Accepted:2021-02-28Online:2021-06-16
作者简介 About authors
王萱萱,E-mail:
刘春宇,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (3133KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王萱萱, 刘春宇, 谢贝昱, 张淑淑, 王丹阳, 朱振元. 碱提甘蔗皮多糖提取工艺、初步结构及其对α-葡萄糖苷酶的抑制作用[J]. 中国农业科学, 2021, 54(12): 2653-2665 doi:10.3864/j.issn.0578-1752.2021.12.015
WANG XuanXuan, LIU ChunYu, XIE BeiYu, ZHANG ShuShu, WANG DanYang, ZHU ZhenYuan.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】甘蔗(Saccharum officinarum)为禾本科(Poaceae)甘蔗属(Sacchrum)的一种多年生高大实心草本高光效C4植物,是重要的糖料与生物能源作物,主要生产国是巴西、印度和中国等国家[1]。甘蔗皮作为一种废弃物,约占甘蔗本身重量的20%,富含纤维、蛋白质、木质素、蔗糖、天然色素等物质[2]。然而,大多数甘蔗皮被当作加工副产物丢弃,造成一定的资源浪费,开展甘蔗皮碱提多糖结构和活性研究,旨在为甘蔗皮多糖的综合开发应用提供一定的理论基础和技术支撑,对废弃资源的再利用有着重要意义。【前人研究进展】目前,以甘蔗皮为原料的研究主要集中在甘蔗皮黄酮、多酚及花色苷的提取分离纯化、结构鉴定及抗氧化活性等方面。周慧芳[3]采用超声辅助法提取甘蔗皮黄酮,通过有机溶剂萃取、聚酰胺层析、葡聚糖凝胶色谱和制备液相色谱分离得到黄酮单体,通过质谱、核磁、红外光谱分析了黄酮单体的结构,此外,甘蔗皮黄酮表现出良好的抑菌活性、抗氧化活性和降血糖活性;陈纯[4]采用超声波法提取甘蔗皮多酚,利用X-5树脂对甘蔗皮多酚进行纯化,通过DPPH·自由基清除法和FRAP法两种体系表明甘蔗皮多酚具有一定的抗氧化活性,随着多酚浓度的升高,抗氧化能力越强;闫怀峰等[5]采用溶剂法提取甘蔗皮中的花色苷,并用辅色剂对花色苷的辅色作用进行了研究。植物多糖含有大量的细胞壁多糖,采用适当浓度的碱溶液可从热水浸提的残渣中继续提取出细胞壁结合多糖,使不溶性多糖转化为可溶性多糖,从而提高多糖得率。田洛等[6]采用碱提取法提取黄芪多糖,黄芪多糖的提取率达到水提取法的3.25倍。此外,研究表明碱性溶液提取的多糖具有抗氧化、抗肿瘤、抗病毒和抗衰老等多种生物活性。焦中高等[7]研究表明,碱提红枣多糖是一种优良的自由基清除剂和α-葡萄糖苷酶及透明质酸酶抑制剂,利用碱提工艺可提高红枣资源的利用率,并获得高活性的红枣多糖。【本研究切入点】目前,甘蔗皮水溶性多糖、黄酮、多酚和花色苷有一些研究,但碱溶液提取甘蔗皮多糖的提取工艺条件、结构表征及其生物活性尚鲜有报道,碱提甘蔗皮多糖的得率、构效关系有待研究。【拟解决的关键问题】以甘蔗皮为原料,利用单因素、响应面试验确定碱提甘蔗皮多糖的最佳提取工艺;综合运用GC-MS、FT-IR等现代仪器分析技术对碱提甘蔗皮多糖进行结构表征;并以体外α-葡萄糖苷酶抑制率为指标,评价碱提甘蔗皮多糖降血糖效果,旨在为甘蔗皮多糖在农业生产加工等领域的综合利用提供理论依据。1 材料与方法
试验于2019—2020年在天津科技大学食品科学与工程学院进行。1.1 材料与试剂
黑皮甘蔗,购自海南省三亚市,保存于实验室。单糖标准品(L-鼠李糖,D-阿拉伯糖,D-木糖,D-甘露糖,D-葡萄糖,D-半乳糖)、α-葡萄糖苷酶、阿卡波糖水合物、4-硝基苯基-β-D-吡喃葡糖糖苷(4-Nitrophenyl β-D-glucopyranoside)购自美国Sigma公司;葡聚糖标准品(T-10、T-40、T-70、T-110、T-500、T-2000)购自北京索莱宝科技有限公司;试验用其他有机溶剂均为国产分析纯。1.2 仪器与设备
Agilent-1260 infinity Ⅱ高效液相色谱系统,美国安捷伦公司;Scion TQ气相色谱-质谱仪,美国布鲁克公司;IS 50傅里叶红外光谱仪,美国尼高力仪器公司;SP-2102UV紫外可见分光光度计,上海光谱仪器有限公司;RE-52AA真空减压旋转蒸发仪,上海亚荣生化仪器厂;TGL-16B台式离心机,上海安亭科学仪器厂。1.3 方法
1.3.1 碱提甘蔗皮多糖的提取工艺 甘蔗→清洗后去皮→烘干→粉碎→过筛→称取粉末→氢氧化钠碱溶液提取→多糖浸提液→浓缩→乙醇沉淀→离心→甘蔗皮粗多糖→除蛋白→除色素→碱提甘蔗皮多糖。1.3.2 操作要点 将新鲜的甘蔗清洗干净后去皮,置于60℃烘箱内烘干。使用粉碎机将甘蔗皮粉碎,过60目筛,备用。精确称取甘蔗皮粉末1.00 g,按照料液比1﹕50(g·mL-1)加入6%氢氧化钠溶液,于35℃恒温水浴提取1 h,沉淀物重复以上操作2次,于4 000 r/min离心15 min后,加入HCl溶液调节至pH 7.0,收集上清液,即多糖浸提液。将上清液在60℃条件下浓缩至一定体积后,按照1﹕4(v﹕v)的比例加入无水乙醇,4℃醇沉静置过夜。4 000 r/min离心15 min后收集沉淀,得到碱提甘蔗皮粗多糖[8]。粗多糖采用Sevge法除蛋白、AB-8树脂除色素进行纯化[9],冷冻干燥后,得到精制的碱提甘蔗皮多糖,命名为SPAP。
1.3.3 碱提甘蔗皮多糖提取单因素试验
(1)提取温度对碱提甘蔗皮多糖提取率的影响
称取甘蔗皮粉末1.00 g,按照氢氧化钠浓度2%,料液比1﹕30(g·mL-1),提取时间1 h,提取次数1次,考察不同提取温度(15、25、35、45和55℃)对碱提甘蔗皮多糖提取率的影响。
(2)NaOH溶液浓度对碱提甘蔗皮多糖提取率的影响
称取甘蔗皮粉末1.00 g,按照提取温度35℃,料液比1﹕30(g·mL-1),提取时间1 h,提取次数1次,考察不同NaOH浓度(2%、4%、6%、8%和10%)对碱提甘蔗皮多糖提取率的影响。
(3)料液比对碱提甘蔗皮多糖提取率的影响
称取甘蔗皮粉末1.00 g,按照提取温度35℃,氢氧化钠浓度6%,提取时间1 h,提取次数1次,考察不同料液比(1﹕20、1﹕30、1﹕40、1﹕50和1﹕60 g·mL-1)对碱提甘蔗皮多糖提取率的影响。
(4)提取时间对碱提甘蔗皮多糖提取率的影响
称取甘蔗皮粉末1.00 g,按照提取温度35℃,氢氧化钠浓度6%,料液比1﹕50(g·mL-1),提取次数1次,考察不同提取时间(1、1.5、2、2.5和3 h)对碱提甘蔗皮多糖提取率的影响。
(5)提取次数对碱提甘蔗皮多糖提取率的影响
称取甘蔗皮粉末1.00 g,按照提取温度35℃,氢氧化钠浓度6%,料液比1﹕50(g·mL-1),提取时间1 h,考察不同提取次数(1、2、3、4和5 次)对碱提甘蔗皮多糖提取率的影响。
1.3.4 碱提甘蔗皮多糖Box-Behnken中心组合试验 在单因素试验的基础上,根据Box-Behnken响应面设计原理,选取提取温度、NaOH浓度、料液比、提取次数4个因素为自变量,以碱提甘蔗皮多糖得率为响应值,运用Design Expert 8.0.7软件对试验进行设计,对碱提甘蔗皮多糖的提取工艺进行优化。Box-Behnken中心组合试验各因素及水平见表1。
Table 1
表1
表1响应面试验的因素与水平
Table 1
| 因素 Factor | 水平Level | ||
|---|---|---|---|
| -1 | 0 | 1 | |
| 提取温度 Extraction temperature A (℃) | 30 | 35 | 40 |
| 氢氧化钠浓度 NaOH concentration B (%) | 5 | 6 | 7 |
| 料液比 Ratio of material to solvent C (g·mL-1) | 1﹕45 | 1﹕50 | 1﹕55 |
| 提取次数 D (次) | 3 | 4 | 5 |
新窗口打开|下载CSV
1.3.5 碱提甘蔗皮多糖基本成分的测定 采用苯酚-硫酸法[10]测定碱提甘蔗皮多糖中性糖的含量,分别精确吸取葡萄糖标准液(0.1 mg·mL-1)0、0.2、0.4、0.6、0.8和1.0 mL置于具塞试管中,加入蒸馏水补足至1 mL;然后加入1 mL质量分数为6%的苯酚溶液,再依次垂直滴加5 mL浓硫酸,用涡旋混合仪充分振荡混合,常温静置15 min至冷却,在λ=490 nm处测定其吸光度值。经回归分析得到葡萄糖标准曲线为y=1.0411x+0.0064,R2=0.9992(其中,y代表吸光度,x代表葡萄糖浓度)。采用硫酸-咔唑法[11]测定碱提甘蔗皮多糖糖醛酸的含量,分别精确吸取半乳糖醛酸标准液(0.1 mg·mL-1)0、0.2、0.4、0.6、0.8和1.0 mL置于10 mL具塞试管中,加入蒸馏水补足至1 mL;在冰水浴中向各管加入5 mL硼砂-硫酸溶液,混匀后沸水浴中加热5 min,取出后冷却至室温;再加入0.1%咔唑溶液0.2 mL,涡旋30 s,沸水浴5 min,冷却后测定各管在523 nm处的吸光度。经回归分析得到半乳糖醛酸标准曲线为y=8.5169x-0.0097,R2=0.9990(其中,y代表吸光度,x代表半乳糖醛酸浓度)。分别根据标准曲线方程计算中性糖及糖醛酸含量,多糖提取得率按照公式计算:
碱提甘蔗皮多糖提取得率(%)=$\frac{m}{M}$×100
式中:m为碱提甘蔗皮粗多糖质量(g),M为甘蔗皮粉末质量(g)。
1.3.6 碱提甘蔗皮多糖结构和性质分析
1.3.6.1 碱提甘蔗皮多糖的含量测定 精确称取精制后的碱提甘蔗皮多糖,将其配成浓度为1 mg·mL-1的溶液,按照1.3.5中所述方法测定并计算碱提甘蔗皮多糖的含量。
1.3.6.2 碱提甘蔗皮多糖的纯度鉴定 将精制后的多糖用蒸馏水溶解配制成浓度为1 mg·mL-1的溶液,利用紫外分光光度计(SP-2102UV)在波长为190—400 nm范围内进行光谱扫描。
1.3.6.3 碱提甘蔗皮多糖分子量分布的测定(HPLC) 采用高效凝胶渗透色谱(HPGPC)对多糖样品分子量进行测定[12]。精确称取样品2 mg溶于1 mL超纯水,过水膜后,取20 μL注入高效液相色谱仪进行分析。色谱条件:色谱柱:TSK gel G4000 PWXL column(7.8 mm×300 mm);检测器:折射率检测器(RID);流动相:超纯水;流速:0.6 mL·min-1;柱温:35℃。以葡聚糖T-2000、T-500、T-110、T-70、T-40和T-10(分子量分别为2 000 000、500 000、110 000、70 000、40 000和10 000 Da)为标准品,根据分子量及保留时间绘制分子量标准曲线。
1.3.6.4 碱提甘蔗皮多糖的红外光谱分析(FT-IR) 将干燥的多糖样品1 mg与干燥的KBr 150 mg混合,研磨均匀后利用压片机将其压成透明薄片。利用傅里叶变换红外光谱仪(Thermo Nicolet Corporation,USA)进行扫描[13]。扫描范围:400—4 000 cm-1,分辨率:4 cm-1,扫描次数:16。
1.3.6.5 碱提甘蔗皮多糖的单糖组成分析 碱提甘蔗皮多糖的单糖组成参考ZHANG等[14]的气相色谱-质谱法(GC-MS)测定。称取样品(5 mg)置于具塞试管中,用2 mL 2.0 mol·L-1 TFA(三氟乙酸)在110℃水解3 h。水解后,向全水解样品中加入盐酸羟胺(10 mg),内标物肌醇六乙酸酯(2 mg)和吡啶(0.5 mL),振荡均匀后,于90℃油浴锅中反应30 min。冷却后,继续加入醋酸酐(0.5 mL)于90℃油浴下反应30 min。得到的糖精乙酸酯衍生物用N2吹干,加入1 mL二氯甲烷重新溶解,取0.2 μL进行气质色谱分析。色谱条件:色谱柱:HP-5MS(30 mm×0.25 mm×0.25 μm);检测器:氢火焰电离检测器(FID);载气:N2;流速1.0 mL·min-1;程序升温:100℃保持2 min→260℃(10℃·min-1)→260℃保持3 min。6种单糖(L-鼠李糖,D-阿拉伯糖,D-木糖,D-甘露糖,D-葡萄糖,D-半乳糖)处理方式同上。
1.3.7 碱提甘蔗皮多糖的α-葡萄糖苷酶抑制作用 α-葡萄糖苷酶抑制活性的反应体系参照LIU等[15]的方法,并略作改进。分别配制0.1 moL·L-1磷酸缓冲盐溶液(PBS)(pH 6.8)、0.6252 mmoL·L-1 PNPG溶液(PBS溶解)、1 U·mL-1 α-葡萄糖苷酶酶液(PBS溶解)以及0.1 moL·L-1 Na2CO3溶液(PBS溶解);待测样品用蒸馏水溶解,采用倍比稀释法稀释至浓度为4、2、1、0.5、0.25和0.125 mg·mL-1的待测液。用阿卡波糖作为阳性对照,同样将浓度稀释为4、2、1、0.5、0.25和0.125 mg·mL-1。取40 μL的样品,加入到96孔板中,然后加入40 μL的酶液(1 U·L-1),混匀,于37℃黑暗中孵育10 min,加入20 μL的PNPG溶液,于37℃黑暗中孵育30 min,最后加入0.1 moL·L-1 Na2CO3溶液100 μL结束反应,于410 nm波长测OD值,每组做3个平行。按照公式计算抑制率,溶液具体加入量见表2。
抑制率(%)=$\frac{\text{OD}\text{-OD}\text{-OD}\text{}}{\text{OD}}$×100
Table 2
表2
表2碱提甘蔗皮多糖对α-葡萄糖苷酶抑制作用试验设计
Table 2
| 样品 Sample (μL) | 阿卡波糖 Acarbose (μL) | α-葡萄糖苷酶 α-glucosidase (μL) | PBS (μL) | PNPG (μL) | |
|---|---|---|---|---|---|
| 样品组 Sample group | 40 | 40 | 20 | ||
| 样品背景组 Sample background group | 40 | 40 | 20 | ||
| 阳性对照组 Positive control group | 40 | 40 | 20 | ||
| 阳性背景组 Positive background group | 40 | 40 | 20 | ||
| 空白组 Blank group | 40 | 40 | 40 |
新窗口打开|下载CSV
1.4 数据分析
每组试验重复3次,结果以平均值±标准差表示,采用Design Expert 8.0.7软件对试验进行设计分析、Origin 2019软件进行数据整理与作图,并利用SPSS 20.0软件中的Duncan法进行方差分析,以P<0.05表示显著性差异。2 结果
2.1 单因素试验结果与分析
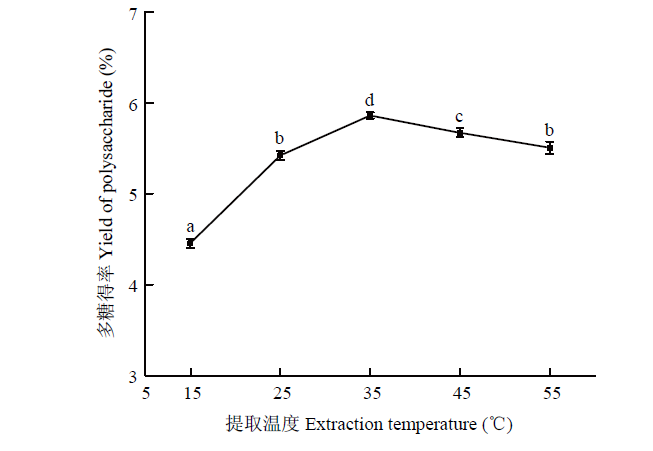
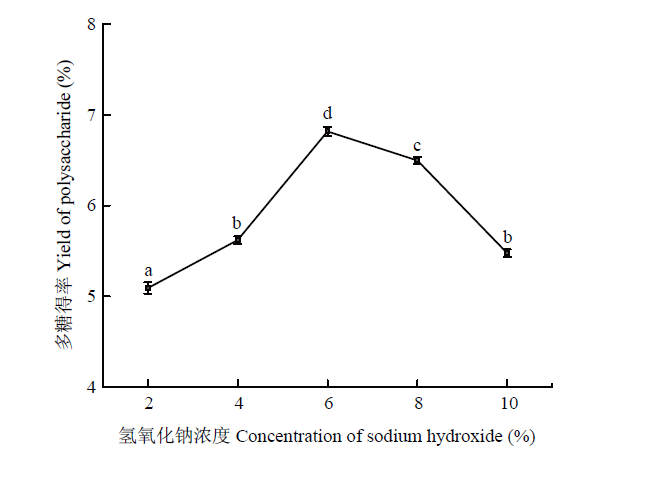
2.1.1 提取温度对甘蔗皮多糖提取的影响 不同提取温度对碱提甘蔗皮多糖得率的影响如图1所示,当温度在15—35℃,碱提甘蔗皮多糖得率随着温度升高而增加;当提取温度为35℃时,多糖得率达到最大值5.86%;当温度超过35℃后,多糖得率反而下降。一定程度上升高提取温度会增加样品多糖的溶出,提高多糖得率,但是过高的提取温度可能会破坏多糖的结构,致使多糖得率低[16]。因此,选择提取温度为35℃。2.1.2 NaOH浓度对碱提甘蔗皮多糖得率的影响 碱液浓度在2%—6%时,碱提甘蔗皮多糖得率随碱液浓度升高而增加;当NaOH浓度超过6%后,碱提甘蔗皮多糖得率反而下降,可能碱液浓度过高会破坏多糖结构 [17];当NaOH浓度为6%时,其多糖得率最高为6.82%(图2)。综合考虑各项因素,选择NaOH浓度为6%效果最佳。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1提取温度对碱提甘蔗皮多糖得率的影响
不同处理间标有不同小写字母表示差异显著(P<0.05)。下同
Fig. 1Effect of temperature on extraction yield of polysaccharide with alkaline-extracted from sugarcane peel
Different treatments marked with different lowercase letters indicate significant differences (P<0.05). The same as below
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2氢氧化钠浓度对碱提甘蔗皮多糖得率的影响
Fig. 2Effect of sodium hydroxide concentration on extraction yield of polysaccharide with alkaline-extracted from Sugarcane peel
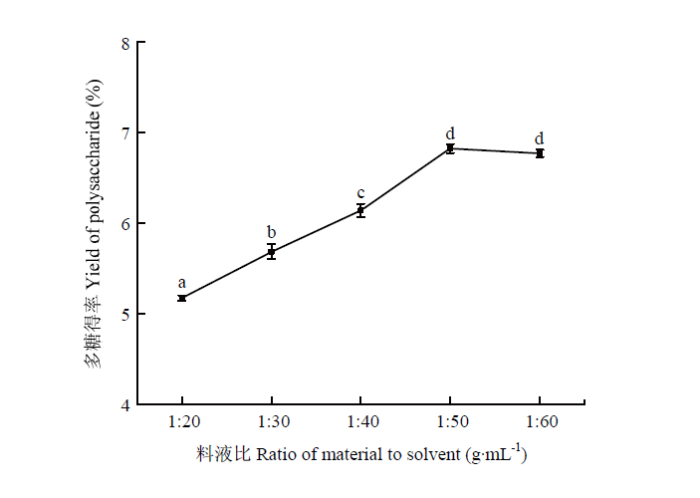
2.1.3 料液比对碱提甘蔗皮多糖得率的影响 随着料液比的增加,在1﹕20—1﹕40(g·mL-1)范围内,碱提甘蔗皮多糖得率呈现升高趋势。当料液比过低时,溶液多黏稠状,细胞空化不完全,导致多糖提取不彻底;当料液比过高时,会使得溶液体积过大,不易后续的分离操作并且浪费资源[18,19]。当料液比为1﹕50(g·mL-1)时,碱提甘蔗皮多糖得率出现峰值为6.82%(图3)。因此,选取料液比为1﹕50(g·mL-1)最合适。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3料液比对碱提甘蔗皮多糖得率的影响
Fig. 3Effect of material liquid ratio on extraction yield of polysaccharide with alkaline-extracted from sugarcane peel
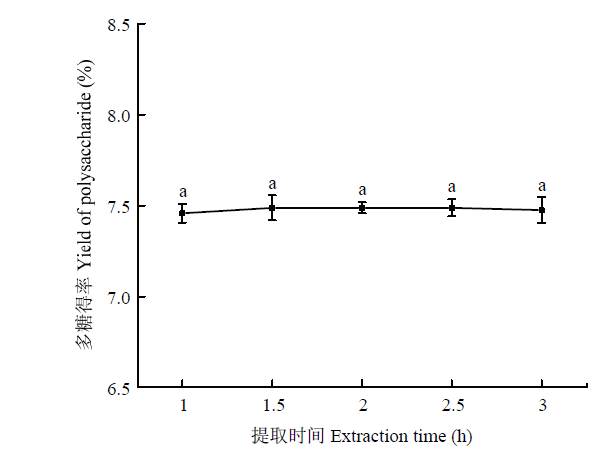
2.1.4 提取时间对碱提甘蔗皮多糖得率的影响 在1.0—3.0 h内,随着提取时间的增加,曲线呈现一条直线,波动较小,表明碱提甘蔗皮多糖得率基本不变,多糖得率约为7.5%(图4)。其他条件一定,综合考虑成本、资源利用等因素[20],选择提取时间为1 h。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4提取时间对碱提甘蔗皮多糖得率的影响
Fig. 4Effect of time on extraction yield of polysaccharide with alkaline-extracted from Sugarcane peel
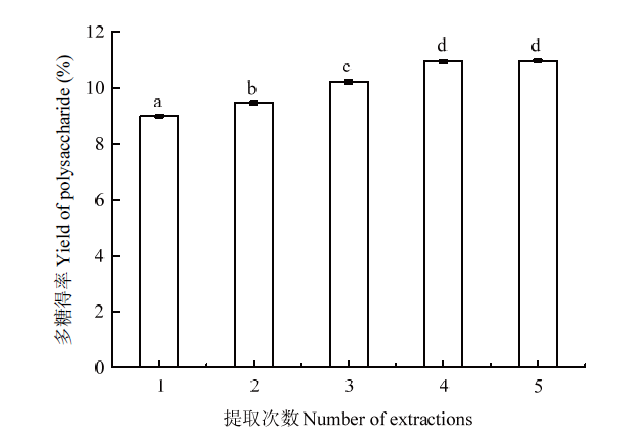
2.1.5 提取次数对碱提甘蔗皮多糖得率的影响 提取次数为1—4次时,碱提甘蔗皮多糖得率与提取次数呈现正相关;当提取次数为4次时,多糖得率达到10.96%;当提取次数大于4次,随着提取次数的增加,多糖得率没有显著性变化(图5)。因此,提取次数4次最优。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5提取次数对碱提甘蔗皮多糖得率的影响
Fig. 5Effect of times on extraction yield of polysaccharide with alkaline-extracted from sugarcane peel
2.2 响应面法优化碱提甘蔗皮多糖提取工艺
2.2.1 试验设计方案及结果 综合单因素试验结果,选取提取温度(A)、NaOH浓度(B)、料液比(C)、提取次数(D)为自变量,以甘蔗皮碱提多糖得率为响应值(Y),设计四因素三水平试验方法,共包括29组试验方案,结果见表3。Table 3
表3
表3响应面试验设计及结果
Table 3
| RUN | A | B | C | D | Y (%) |
|---|---|---|---|---|---|
| 1 | 0 | 0 | 0 | 0 | 10.86 |
| 2 | 0 | 0 | 0 | 0 | 10.86 |
| 3 | 0 | 1 | 1 | 0 | 10.72 |
| 4 | -1 | 1 | 0 | 0 | 10.43 |
| 5 | 0 | 0 | 0 | 0 | 10.95 |
| 6 | -1 | -1 | 0 | 0 | 10.62 |
| 7 | 0 | 0 | 0 | 0 | 10.85 |
| 8 | -1 | 0 | 1 | 0 | 10.69 |
| 9 | 0 | 0 | 1 | 1 | 10.54 |
| 10 | 0 | 1 | -1 | 0 | 10.29 |
| 11 | 0 | -1 | 1 | 0 | 10.51 |
| 12 | 0 | 0 | -1 | -1 | 10.34 |
| 13 | 0 | -1 | 0 | -1 | 10.09 |
| 14 | -1 | 0 | -1 | 0 | 10.58 |
| 15 | -1 | 0 | 0 | 1 | 10.23 |
| 16 | 1 | 0 | 0 | 1 | 10.75 |
| 17 | 0 | 1 | 0 | 1 | 10.30 |
| 18 | 0 | 1 | 0 | -1 | 10.59 |
| 19 | -1 | 0 | 0 | -1 | 10.34 |
| 20 | 0 | 1 | 0 | 1 | 10.99 |
| 21 | 1 | 1 | 0 | 0 | 10.57 |
| 22 | 0 | -1 | -1 | 0 | 10.87 |
| 23 | 1 | 0 | 0 | -1 | 10.53 |
| 24 | 0 | 0 | -1 | 1 | 10.41 |
| 25 | 1 | 0 | -1 | 0 | 10.71 |
| 26 | 0 | 0 | 0 | 0 | 10.81 |
| 27 | 1 | 0 | 1 | 0 | 10.83 |
| 28 | 0 | 0 | 1 | -1 | 10.42 |
| 29 | 1 | -1 | 0 | 0 | 10.61 |
新窗口打开|下载CSV
2.2.2 响应面法试验数据处理及数值分析 利用Design Expert软件对表3中的数据进行拟合,得到碱提甘蔗皮多糖提取率的回归方程:
Y=10.87+0.093A-0.066B+0.042C+0.076D+0.037AB+(2.500E-003)AC+0.083AD+0.20BC-0.30BD+ 0.012CD- 0.11A2-0.15B2-0.11C2-0.28D2
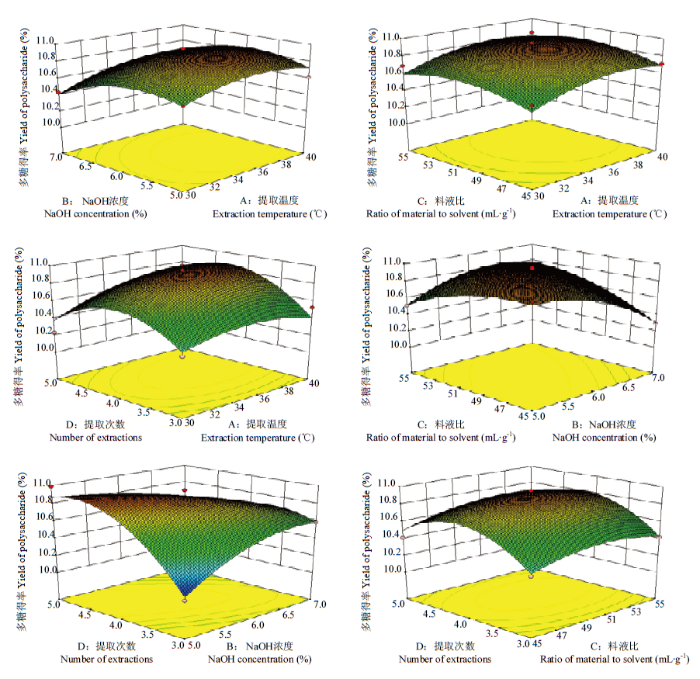
由表4可见该模型显著(P<0.0001),失拟项P=0.0641>0.05,不显著。R2=0.9048,表明90%的数据可以用这个方程解释。各因素影响碱提甘蔗皮多糖得率的主次顺序为A>D>B>C,即提取温度>提取次数>NaOH浓度>料液比。失拟项各项数据分析表明该模型失拟不显著,因此该二次方程能够较好地拟合真实的响应面。另外,由表4和图6分析可知,交互因素中,BC、BD交互作用显著,A2、B2、C2和D2均达到显著。经软件预测分析得到碱提甘蔗皮多糖得率的最佳条件为:提取温度37.52℃,NaOH浓度5%、料液比为46.69 mL·g-1,提取次数为4.72次,因此,为避免资源浪费以及实际试验操作的方便,将碱提甘蔗皮多糖得率的最佳条件修改为提取温度37℃,NaOH浓度5%、料液比为46 mL·g-1,提取次数为4次,相应提取液中甘蔗皮多糖含量为10.98 mg·g-1。在修正后的最佳条件下重复3次平行试验,得到甘蔗皮多糖含量平均值为10.84%,与模型预测值相对误差为1.28%,说明模型预测值与试验实际值符合度较高,该回归模型参数合理,能真实反映各因素对碱提甘蔗皮多糖得率的影响。
Table 4
表4
表4方差表分析
Table 4
| 方差来源 Source of variance | 平方和 Sum of square | 自由度 Degree of freedom | 均方 Mean square | F值 F value | Pr>F | 显著性 Significance |
|---|---|---|---|---|---|---|
| 模型 Model | 1.39 | 14 | 0.099 | 9.50 | < 0.0001 | ** |
| A | 0.10 | 1 | 0.10 | 9.85 | 0.0073 | * |
| B | 0.052 | 1 | 0.052 | 4.99 | 0.0423 | * |
| C | 0.022 | 1 | 0.022 | 2.08 | 0.1713 | |
| D | 0.069 | 1 | 0.069 | 6.62 | 0.0221 | * |
| AB | 5.625E-003 | 1 | 5.625E-003 | 0.54 | 0.4747 | |
| AC | 2.500E-005 | 1 | 2.500E-005 | 2.398E-003 | 0.9616 | |
| AD | 0.027 | 1 | 0.027 | 2.61 | 0.1284 | |
| BC | 0.16 | 1 | 0.16 | 14.97 | 0.0017 | * |
| BD | 0.35 | 1 | 0.35 | 33.96 | < 0.0001 | ** |
| CD | 6.250E-004 | 1 | 6.250E-004 | 0.060 | 0.8101 | |
| A2 | 0.081 | 1 | 0.081 | 7.77 | 0.0145 | * |
| B2 | 0.14 | 1 | 0.14 | 13.86 | 0.0023 | * |
| C2 | 0.077 | 1 | 0.077 | 7.43 | 0.0164 | * |
| D2 | 0.51 | 1 | 0.51 | 49.39 | < 0.0001 | ** |
| 残差 Residual | 0.15 | 14 | 0.010 | |||
| 失拟项 Lack of fit | 0.14 | 10 | 0.014 | 5.15 | 0.0641 | 不显著 No significance |
| 纯误差 Pure error | 0.011 | 4 | 2.630E-003 | |||
| 总和 Sum | 1.53 | 28 |
新窗口打开|下载CSV
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6各因素交互作用对甘蔗皮多糖提取率的响应面图
Fig. 6Response surface graph of interaction of various factors on extraction rate of polysaccharides from sugarcane peel
2.3 碱提甘蔗皮多糖的结构表征
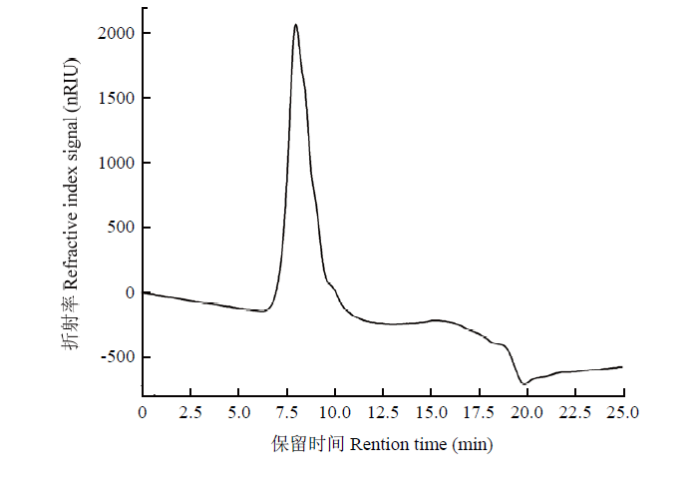
2.3.1 碱提甘蔗皮多糖的分子量测定 采用高效凝胶渗透色谱法和高效液相色谱法对多糖的分子量分布进行检测。以保留时间为横坐标,分子质量对数为纵坐标,得到以葡聚糖为标准品的回归方程y= -0.3395x+9.2104(y=lgMw,x=Rt),R2=0.9953。如图7所示,经除色素、除蛋白后的碱提甘蔗皮多糖高效液相色谱图为单一峰,说明分子量相对均匀[21]。经检测,SPAP中性糖含量为(86.54±0.98)%,糖醛酸含量为(2.82±0.28)%。将多糖的出峰时间(t=8.039 min)代入回归方程,计算得SPAP的分子量为3.03×103 kD。张斌[22]研究表明,甘蔗滓水提多糖主要由两个组分组成,分子量分别为1.93×104 Da和7.523×103 Da,这些差异表明甘蔗不同部位及不同提取方式等会引起多糖间分子量的极大差异。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7碱提甘蔗皮多糖高效液相色谱图
Fig. 7High performance liquid chromatogram of polysaccharide with alkaline-extracted from sugarcane peel
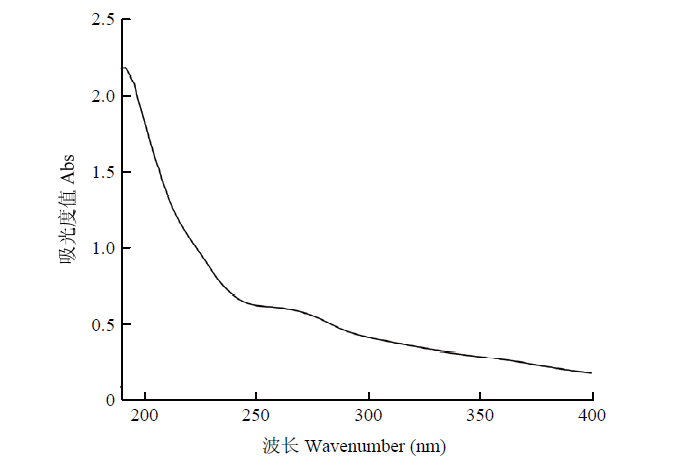
2.3.2 多糖纯度的鉴定 碱提甘蔗皮多糖SPAP的紫外-可见光全波长扫描结果如图8所示,SPAP在260和280 nm处基本无吸收峰,表明多糖中基本不含蛋白和核酸[23]。
图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8碱提甘蔗皮多糖紫外扫描图
Fig. 8UV spectra of polysaccharide with alkaline-extracted from sugarcane peel
2.3.3 单糖组成分析 SPAP经TFA降解,吡啶和乙酸酐衍生化后进行GC-MS分析。如图9所示,混标中1—7的出峰顺序依次代表鼠李糖、阿拉伯糖、木糖、甘露糖、 葡萄糖、半乳糖和内标肌醇六乙酸酯。根据标准单糖的保留时间对碱提甘蔗皮多糖水解样品中的色谱峰进行定位,并按照mi=Ai·ms·f/As公式计算样品中各单糖的含量及比例(Ai、As分别代表待测组分和内标物质的峰面积;mi、ms分别代表待测组分和内标物质的质量;f为相对校正因子,计算公式:f=(m0/As)/(mi/A0),A0为标准单糖的峰面积,m0为标准单糖组分的质量和内标物质的质量)[24]。从图中可以看出,SPAP主要由阿拉伯糖、木糖、葡萄糖和半乳糖组成,其中木糖为主要成分。经计算,SPAP中鼠李糖﹕阿拉伯糖﹕木糖﹕甘露糖﹕葡萄糖﹕半乳糖的摩尔比为0.47﹕5.75﹕15.47﹕1.00﹕3.22﹕2.32。
图9
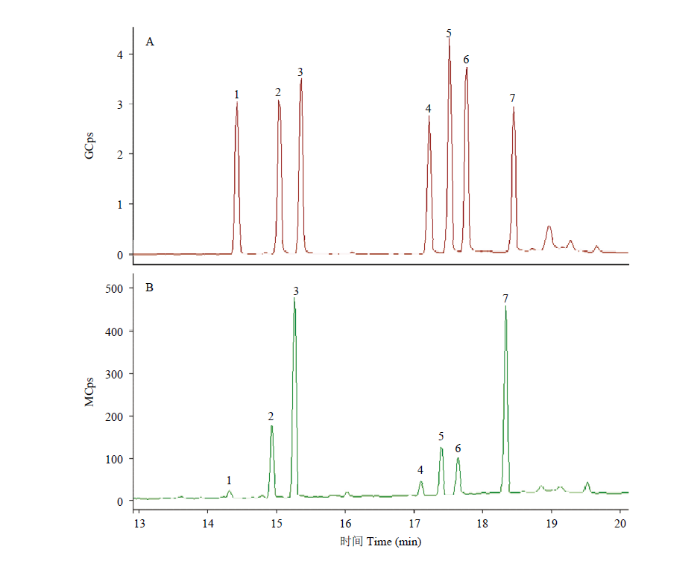 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9混合标准品(A)和碱提甘蔗皮多糖(B)气相-质谱色谱图
Fig. 9GC-MS chromatogram of standard samples (A) and polysaccharide with alkaline-extracted from sugarcane peel (B)
2.3.4 碱提甘蔗皮多糖的红外光谱分析 采用KBr压片法对SPAP进行FT-IR分析,在4 000—450 cm-1范围内的红外光谱如图10所示。在3 404.708 cm-1处有一宽峰,是多糖特征的-OH和水的O-H键之间的伸缩振动引起;2 920.663 cm-1处为C-H伸缩振动[25];1 632.447 cm-1处有一强吸收峰,是由-COOH或-CO基团的C=O非对称伸缩振动引起,表示含有醛基-CHO,一般糖分子结合水在此区域都有吸收峰[26];1 420.798 cm-1周围的吸收峰是C-H的变角振动,以上4处为多糖的特征吸收峰[27]。1 152.741 cm-1、1 072.710 cm-1、1 043.783 cm-1 3处特征吸收峰表明SPAP中含有吡喃型糖苷键,可能存在α-(1→6)糖苷键;897 cm-1附近的吸收峰表示SPAP中存在β型糖苷键[28]。FT-IR结果表明,SPAP中的单糖是吡喃糖基型,可呈现α或β构型。
图10
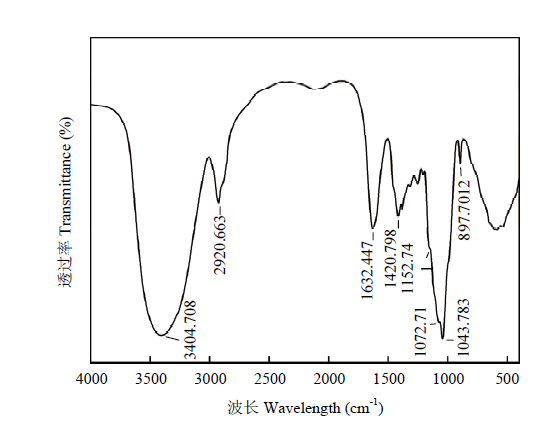 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图10碱提甘蔗皮多糖红外光谱图
Fig. 10FT-IR spectrum of polysaccharide with alkaline- extracted from sugarcane peel
2.4 碱提甘蔗皮多糖对α-葡萄糖苷酶的抑制作用
当样品浓度由0.125 mg·mL-1增加到4.00 mg·mL-1,抑制率由28.52%上升至78.31%,抑制曲线呈现先上升后逐渐平缓的趋势,说明SPAP对α-葡萄糖苷酶的抑制作用存在剂量依赖性。与阳性对照阿卡波糖相比,样品SPAP虽不及阿卡波糖对α-葡萄糖苷酶的抑制率,但在4.00 mg·mL-1时,抑制率达到78.31%,有较好的抑制作用(图11)。IC50值越低,说明样品对α-葡萄糖苷酶的抑制作用越好,经计算,阿卡波糖的IC50为0.178 mg·mL-1,碱提甘蔗皮多糖的IC50为0.3 mg·mL-1,SPAP的IC50值略高于阳性对照。以上结果说明,碱提甘蔗皮多糖对α-葡萄糖苷酶具有良好的抑制作用。图11
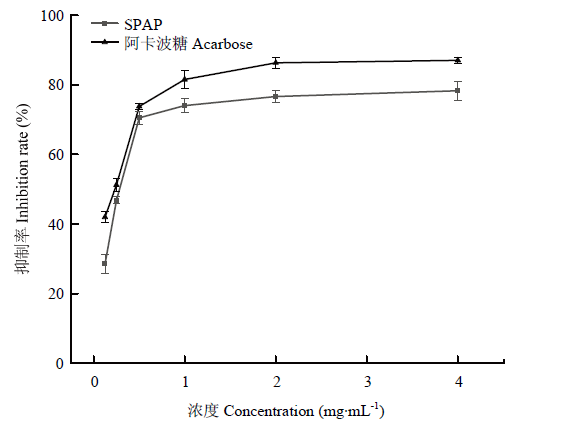 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图11碱提甘蔗皮多糖和阿卡波糖对α-葡萄糖苷酶的抑制作用
Fig. 11Inhibition of α-glucosidase by polysaccharide with alkaline-extracted from sugarcane peel and acarbose
3 讨论
据研究,多糖的提取工艺主要有超声解法、酶解法及水提醇沉解法等[29,30]。碱解法是一项经验成熟的多糖提取方法,能够准确、快速及稳定地提取多糖。此外,碱性溶液提取可以使细胞壁结合多糖更好地转化为可溶性多糖,该方法不仅可以提高多糖提取得率、缩短反应时间,而且提取方法简便、设备要求低、原料可再利用,有利于生产。本研究采用响应面试验优化碱提甘蔗皮多糖提取工艺,得到碱提甘蔗皮多糖最佳提取工艺。张斌[22]研究表明,甘蔗滓经过脱脂、水提醇沉、Sevag法脱蛋白和透析后,得到甘蔗滓多糖的提取率为1.02%。肖亚聪[31]通过水提法、纤维素酶解法、木瓜蛋白酶解法、混合酶-超声联合法等不同提取方法提取甘蔗渣多糖发现,不同提取方法的多糖提取率有较大的差异,整体水平上看酶解-超声联合法都比单种酶酶解多糖提取率要高,酶解-超声联合法平均提取率约在8%。本研究采用碱提多糖工艺方法与水提、酶解等提取方法相比,甘蔗皮多糖提取得率显著提高,该工艺参数下,原料综合利用率高,同时可有效提高产出和效率。近年来,多糖由于其独特的化学结构和生物活性而备受关注[32]。据报道,许多碱性溶液多糖具有各种有用的生物学功能,例如抗炎、抗氧化、抗肿瘤、免疫活性和降血糖作用[33,34,35,36]。多糖的生物活性可能与结构特征有关[37],例如单糖组成及分子量分布。LI等[38]阐述了多糖的功能活性与分子量、单糖组成等几个参数的综合效应有关。低分子量南瓜多糖具有较好的体外降血糖作用,原因可能是低分子量南瓜多糖中含有半乳糖、阿拉伯糖和半乳糖醛酸,可以有效增强多糖与α-葡萄糖苷酶和α-淀粉酶的结合。碱提甘蔗皮多糖是由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成的杂多糖,其中木糖为主要成分。已有研究证实,含有更多阿拉伯糖或木糖残基的多糖对α-葡糖苷酶表现出显着的抑制作用。ZHANG等[14]用5% NaOH溶液从甘草残渣中提取、分离、纯化出一种中性多糖,该多糖由L-鼠李糖、L-阿拉伯糖、D-木糖、D甘露糖、D-葡萄糖和D-半乳糖组成,其中木糖含量最高,且对α-葡萄糖苷酶表现出一定的抑制活性,与本研究结果一致。吕青青等[39]从麦麸获得两种多糖级分(WXA-1和AXA-1),与WXA-1相比,AXA-1的阿拉伯糖和木糖含量更高,这些原因可能导致AXA-1 比WXA-1具有更高的α-淀粉酶和α-葡萄糖苷酶抑制活性。上述结果表明,木糖可能对α-葡萄糖苷酶有较强的抑制作用。但碱提甘蔗皮多糖糖苷键连接方式等结构特性与生物活性之间的关系及机理机制仍需进一步探究。
4 结论
碱提甘蔗皮多糖(SPAP)的最佳提取条件为提取温度37℃、NaOH浓度5%、料液比1﹕46(g·mL-1)、提取次数4次,可有效利用原料、提高产出和效率;由HPLC、FT-IR、GC-MS等方面初步阐述了SPAP的结构特性,同时SPAP对α-葡萄糖苷酶表现出良好的抑制作用,具有一定的降糖潜力。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1007/s10570-019-02740-2URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1021/ac60111a017URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.carbpol.2020.115836URL [本文引用: 1]
DOI:10.1016/j.foodres.2020.109345URL [本文引用: 1]
DOI:10.1016/j.ijbiomac.2019.10.081URL [本文引用: 2]
DOI:10.1016/j.ijbiomac.2017.02.065URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 2]
[D].
[本文引用: 2]
DOI:10.1016/j.ijbiomac.2020.01.178URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.ijbiomac.2020.06.124URL [本文引用: 1]
DOI:10.1016/j.ijbiomac.2015.10.051URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.carbpol.2020.116551URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.saa.2017.10.076URL [本文引用: 1]
DOI:10.1016/j.ijbiomac.2020.03.053URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.ijbiomac.2019.01.029URL [本文引用: 1]
DOI:10.1016/j.foodchem.2011.11.010URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.carbpol.2020.117090URL [本文引用: 1]
[本文引用: 1]
[C].
[本文引用: 1]
