 ,, 朱洁, 熊文飞, 赵萌, 袁建, 鞠兴荣南京财经大学食品科学与工程学院,南京 210023
,, 朱洁, 熊文飞, 赵萌, 袁建, 鞠兴荣南京财经大学食品科学与工程学院,南京 210023Insight into the Impact of Heat Treatment on the Foamability and Structure of Gliadin Colloidal Particles
WANG LiFeng ,, ZHU Jie, XIONG WenFei, ZHAO Meng, YUAN Jian, JU XingRongCollege of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023
,, ZHU Jie, XIONG WenFei, ZHAO Meng, YUAN Jian, JU XingRongCollege of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023责任编辑: 赵伶俐
收稿日期:2020-06-23接受日期:2020-10-14网络出版日期:2021-02-16
| 基金资助: |
Received:2020-06-23Accepted:2020-10-14Online:2021-02-16
作者简介 About authors
王立峰,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (2602KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王立峰, 朱洁, 熊文飞, 赵萌, 袁建, 鞠兴荣. 热效应对小麦醇溶蛋白起泡性与结构的影响[J]. 中国农业科学, 2021, 54(4): 820-830 doi:10.3864/j.issn.0578-1752.2021.04.013
WANG LiFeng, ZHU Jie, XIONG WenFei, ZHAO Meng, YUAN Jian, JU XingRong.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】泡沫型食品(如冰淇淋、蛋糕、面包等)的质构调控通常需要借助两亲性表面活性剂来实现。传统的两亲性小分子活性剂(如蔗糖酯、单甘酯等)均通过化学合成制备,尽管具有较高的界面活性,但过多食用可能会对人体健康产生不利影响[1,2],因此在使用范围和用量上均存在极大限制。近年来,寻找和发掘高性能纯天然起泡剂用于调控泡沫型食品的品质是普遍关注的焦点。蛋白质因其天然的氨基酸结构属性,不仅是人体膳食的宏量营养素,且具有优良的界面活性。因此,当前被认为是天然起泡剂的首选。例如大豆分离蛋白具有良好的起泡能力,可以有效的代替小分子表面活性剂,但其在加工过程中的稳定性较差,导致其应用受到一定的限制[3]。因此,有必要进一步发掘和制造新型食用胶体颗粒作为发泡剂。【前人研究进展】小麦醇溶蛋白是工业小麦淀粉分离的副产物,对面筋的发泡性能起主要作用。小麦醇溶蛋白分子中心区域富含谷氨酰胺和脯氨酸,末端区域富含疏水性氨基酸。其分子中的两亲性表明它可能具有作为表面活性剂和稳定泡沫的潜力。研究发现小麦醇溶蛋白具有良好的发泡特性[4],但其在水中的低溶解性和低分散性限制了其在食品工业中的应用。为解决这一问题,可采用反溶剂法将小麦醇溶蛋白制备成纳米颗粒,以提高其在水中的分散性[5]。尽管小麦醇溶蛋白具有较好的起泡能力与泡沫稳定性,但为了满足食品加工的需求,进一步提高其泡沫特性显得很有必要。热处理作为食品工业中常用的操作单元,是一种绿色高效的蛋白质改性手段。已有研究表明预热处理显著提高了乳清蛋白在气-水界面上的表面张力,热诱导引起的乳清分离蛋白(WPI)的聚集增强了其泡沫稳定性[6]。大豆分离蛋白在热处理下的发泡能力和稳定性也有一定的提高[7]。PHILLIPS等[8]研究了在pH 4.0、5.0和7.0下加热乳清浓缩蛋白对发泡性能的影响,pH 4.0和55℃是获得稳定泡沫的最佳条件,原因可能是β-乳球蛋白的部分去折叠导致薄膜中蛋白质间相互作用的增加。【本研究切入点】小麦醇溶蛋白胶体粒子通过反溶剂法可以很好地分散在水溶液中,但其在热效应作用下的泡沫特性表现还未得到揭示。【拟解决的关键问题】本研究利用反溶剂法耦合热效应制备小麦醇溶蛋白胶体粒子,通过测定其粒径、电位、表面疏水性、蛋白质二级结构等指标研究热处理对其起泡性及结构的影响,以推动小麦醇溶蛋白在泡沫型食品体系的应用。1 材料与方法
试验于2019年在南京财经大学食品安全实验室进行。1.1 材料与试剂
谷阮粉(市售),购于西安博联特化有限公司,蛋白质含量77%,水分含量8%。无水乙醇、乙酸、溴化钾、BCA蛋白测试试剂均为分析纯,购于南京化学试剂公司;5,5-二硫基-双(2-硝基苯甲酸)(DTNB)、8-苯胺基-1-萘磺酸(ANS)、Tris-甘氨酸(Tris-Gly)、乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SDS)、考马斯亮蓝、甘油、溴酚蓝、β-巯基乙醇均为生化试剂,购于Sigma-Aldric。
数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;AE150 pH测定仪,常州国华电器有限公司;Mze多功能酶标仪,上海市离心机械研究所;AL204分析天平,德国梅特勒托利多;Nano-ZS纳米粒度仪,英国马尔文公司;UV-3900紫外可见分光光度计,日本日立公司;F-700荧光光谱仪,日本日立公司;Q2000差示扫描量热仪,美国TA仪器;MOS-450圆二色谱仪,法国Bio-Logic公司;SAXSess小角X光散射仪,奥地利Anton-Paar公司;Multimode原子力显微镜,德国布鲁克;高速剪切均质机(360 W),宁波新芝。
1.2 试验方法
1.2.1 小麦醇溶蛋白的提取 将谷朊粉样品1﹕10溶于70%的乙醇溶液中,室温下搅拌3 h,8 000 r/min离心20 min,取上清液于4℃下静置一晚,再次于8 000 r/min离心20 min得上清液,真空旋转蒸发去除乙醇,冻干备用。1.2.2 小麦醇溶蛋白的热处理 将冻干的小麦醇溶蛋白溶于70%(w/w)的乙醇溶液中,得到浓度为10 mg·mL-1的蛋白质溶液,分别取20 mL蛋白质溶液置于玻璃瓶中并密封,在50℃、70℃、90℃分别水浴加热15、30和60 min。热处理结束后立即将样品放入冰水中冷却至室温备用,样品编号50-15、50-30、50-60分别表示50℃加热15、30和60 min,70-15、70-30、70-60和90-15、90-30、90-60为同样的含义。
1.2.3 小麦醇溶蛋白纳米颗粒的制备 将热处理过的溶液以1﹕5(体积比)逐滴加入蒸馏水(含0.2%乙酸,w/v)中,制备后的样品溶液pH为3.5,并保存于4℃冰箱中待用。
1.2.4 小麦醇溶蛋白溶解性的测定 使用BCA法测量溶液中蛋白质的含量,使用BSA制作标准曲线。将反溶剂后的蛋白溶液在10 000×g下离心15 min,取上清液加入BCA试剂,37℃下震荡30 min后测定其在562 nm处的吸光值,并与标准曲线对比,即可计算待测蛋白的浓度。蛋白质溶解度为上清液中蛋白浓度/原样品中蛋白浓度。
1.2.5 SDS-PAGE凝胶电泳 聚丙烯酰胺分离凝胶浓度为12%(w/v),浓缩凝胶浓度为5%(w/v)并含有4% SDS(w/v)。将蛋白质溶于由10 mol·L-1 Tris-HCl、10%(w/w)甘油、0.02%(w/w)溴酚蓝、2%(w/w)SDS和5%(v/v)β-巯基乙醇组成的缓冲溶液(pH 8.0),制备0.2 mg·mL-1的样品溶液。样品在100℃加热3 min后,于1 500×g离心10 min,用考马斯亮蓝R-250对上清液进行染色,用甲醇﹕乙酸﹕水(50﹕10﹕40)(v/v/v)乙酸进行脱色。
1.2.6 小麦醇溶蛋白纳米颗粒的电位和粒径测定 使用纳米粒度电位仪测量样品(浓度为1%,w/v)的Zeta电位、平均粒径和多分散指数(PDI),结果由仪器自带软件计算。所有测量均在25℃下进行,重复3次。
1.2.7 起泡性测定 取15 mL样品,记录此时体积为V0,使用均质机于8 000 r/min搅拌1 min,立即将泡沫转移至量筒中,分别记录下2 min(V1)和30 min(V2)时的泡沫体积,以计算蛋白质的起泡能力和泡沫稳定性。
1.2.8 表面疏水性测定 使用8-苯胺基-1-萘磺酸(ANS)作为外源荧光探针[9],测定方法参见文献[10]。首先将ANS溶于10 mL去离子水,然后将蛋白质溶液分别稀释到2×10-5、4×10-5、6×10-5、8×10-5、1×10-4和1.2×10-4 mg·mL-1,取4 mL稀释后的样品加入20 μL ANS溶液。溶液在285 nm处激发,用荧光分光光度计测量400—650 nm的发射光谱,发射和激发狭缝为5 nm,然后在25℃下测量荧光强度。根据得到的荧光强度对浓度作图,得到的斜率即为表面疏水性指数H0。
1.2.9 紫外可见吸收光谱 将第1.2.3节所制备的小麦醇溶蛋白溶液适当稀释(0.2 mg·mL-1),然后使用紫外可见分光光度计在200—700 nm范围内进行扫描。
1.2.10 内源荧光光谱 采用荧光分光光度计测定样品内源荧光光谱。发射波长为300—500 nm,激发波长为285 nm,发射和激发狭缝宽均为10.0 nm,电压为550 mV,测量温度恒定为25℃,每个样品平行测定3次。样品浓度0.01 mg·mL-1。
1.2.11 SH/SS含量测定 游离巯基测定方法参照文献[11]。2 mL天然和热处理样品溶液分别加入10 mL Tris-Gly缓冲液(0.09 mol·L-1 Gly、0.086 mol·L-1 Tris、8 mol·L-1尿素、0.004 mol·L-1 EDTA)。取2 mL样品溶液加入50 μL Ellman’s试剂(4 mg·mL-1 DTNB),立即震荡摇匀,15 min后在412 nm波长下测定吸光值(A412)。总巯基测定用含6 mol?L-1盐酸胍的磷酸盐缓冲液(0.1 mol·L-1、pH 8.0)代替磷酸缓冲液,其他步骤相同。游离巯基计算公式如下:
式中,73.53=106/(1.36×104),1.36×104是Ellman’s试剂的摩尔消光系数;A412为λ=412 nm下吸光值;C为蛋白浓度(mg·mL-1)。
1.2.12 差示扫描量热(DSC) 称量冻干后的样品(2—5 mg)密封在铝盘中,放入差示扫描量热仪中测定,以空盘为参考样品。温度扫描范围为20—300℃,扫描速率为10℃·min-1,得到试样的DSC热效应曲线。相同条件下测定的两个空铝盘作为基线,在最终数据中扣除基线背景。
1.2.13 小角X光散射(SAXS) SAXS测量在以30 W操作的Nano STAR系统(Bruker,Germany)上进行。使用CuKα辐射(λ=0.1542 nm)作为X射线源。使用V?nTeC-2000检测器收集散射数据。将样品在环境条件下保持4 h以达到平衡。将放有水的空样品池用作背景。散射矢量q(?-1)定义为q=4πsinθ/λ(2θ,散射角)。测量10次,取平均值,除去溶剂背景基线,得到SAXS曲线。Kratky图(q2I(q)vs q)用于检测样品的折叠构象[12]。
1.2.14 原子力显微镜(AFM) 采用原子力显微镜对颗粒形态进行观察,将3 μL小麦醇溶蛋白溶液(0.1 mg·mL-1)滴在新制备的云母片表面,并在室温下干燥2 h,在显微镜下使用纳米探针悬臂尖端在敲击模式下收集形态图像,频率50—100 kHz,使用AMF仪器软件(Nanoscope Analysis version 1.50,Bruker Corporation,Billerica,MA)进行图像分析。
1.2.15 圆二色谱 先用pH 3.5的去离子水稀释蛋白样品至0.1 mg·mL-1,采用MOS-450圆二色光谱仪(法国Bio Logic公司)进行测定。将扫描参数设置为样品池光程为2 mm,扫描波长190—250 nm,分辨率0.5 nm,灵敏度100 mdeg·cm-1,扫描速度100 nm·min-1。试验在25℃下测定,试验值为4次扫描均值。
1.2.16 数据分析 使用Excel 2017和SPSS Inc公司的SPSS Statistics 21.0软件对数据进行整理与统计分析,所有试验至少测量3次,结果为平均值。采用单因素方差分析(ANOVA)估计差异的显著性(P<0.05)。使用Excel 2017软件作图。
2 结果
2.1 热效应对小麦醇溶蛋白泡沫能力的影响
如图1所示,当加热温度为50℃时,随着热处理时间的增加,起泡能力逐渐增强。但加热温度的进一步增加对蛋白质起泡能力的改善并未产生显著影响(图1-A)。总体上看,在50℃处理60 min即可达到最高的起泡能力。初步推测这种起泡性能的增强与蛋白质的结构和理化特性的转变相关。值得注意的是,与对照组相比,热处理显著提高了小麦醇溶蛋白的泡沫稳定性(约85%)。原因可能是热处理使蛋白质产生了聚集,这些聚集体会吸附在空气/水界面形成网络结构,从而提高泡沫的稳定性[13]。图1
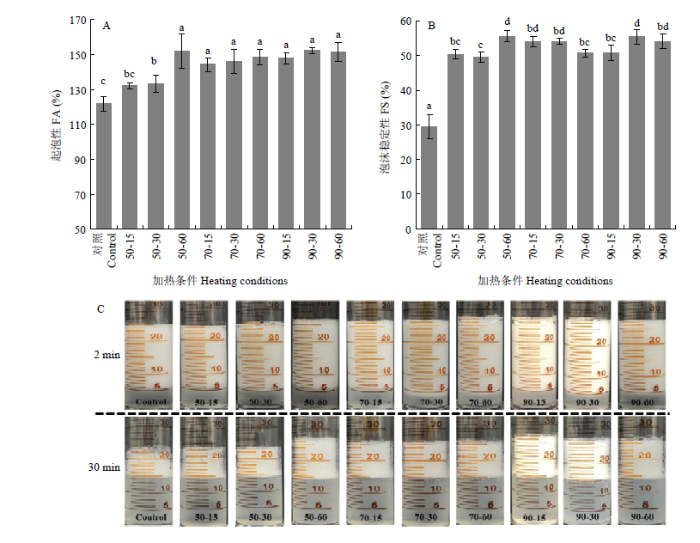 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1不同热处理对小麦醇溶蛋白起泡能力(A)和泡沫稳定性(B)的影响及(C)泡沫的表观形态
不同小写字母表示处理间差异显著(P<0.05)。下同
Fig. 1The effects of different heat treatments on the foaming ability (A), foam stability (B), and the apparent form of foam (C)
Different lowercase letters indicate significant differences (P<0.05). The same as below
2.2 加热对小麦醇溶蛋白溶解度的影响
小麦醇溶蛋白的溶解性会对其功能特性产生一定的影响。如图2所示,加热温度对小麦醇溶蛋白溶解度的影响并不明显,小麦醇溶蛋白的溶解度在加热初期并无明显变化。而随着加热时间的增加,小麦醇溶蛋白的溶解性有了显著的提高,这可能是由于蛋白质在不同加热时间下的变性程度不同所致。已有研究表明适当的热处理会使蛋白质结构展开,暴露其结构内的疏水基团,从而显著改善蛋白质的界面性质[14]。图2
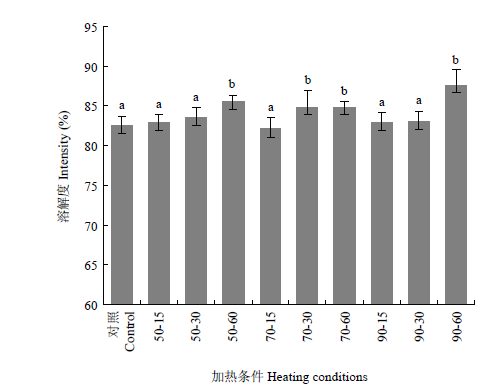 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同热处理温度对小麦醇溶蛋白溶解度的影响。
Fig. 2The effects of different heat treatment temperature on solubility of wheat gliadin
2.3 加热对小麦醇溶蛋白纳米颗粒电位和粒径的影响
颗粒的粒径尺寸主要分布在105—122 nm,PDI值较小,颗粒较为集中。当温度达到90℃时,随着加热时间的增加,颗粒的尺寸呈上升趋势(图3-A)。这表明较高温度的热处理会诱导小麦醇溶蛋白发生聚集。另一方面,蛋白质的Zeta电位可以反应蛋白质表面电荷的情况[15]。如图3-B所示,小麦醇溶蛋白胶体粒子的Zeta电位是在pH 3.5下测得,表明小麦醇溶蛋白带正电荷(与小麦醇溶蛋白等电点6.5符合),随着加热温度及时间的升高,Zeta电位有下降趋势,表明蛋白表面电荷减少,热处理温度为90℃时更为明显。高温会使蛋白构象发生伸展,引起分子表面带电氨基酸的重排,导致表面电荷的变化。表面电荷减少,粒子的静电相互作用增大。通过静电相互作用产生的吸引力会引起粒子的聚集,导致粒径的增大[16]。图3
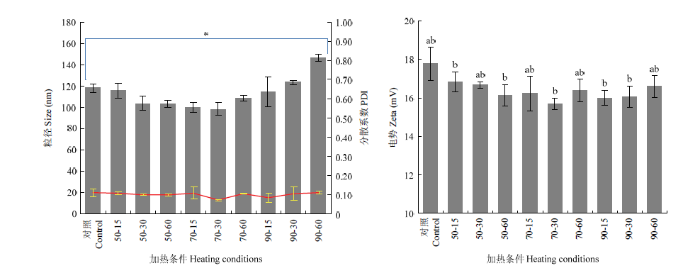 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同热处理对小麦醇溶蛋白颗粒尺寸/PDI(A)和表面电势(B)的影响
Fig. 3The effects of different heat treatments on the particle size/PDI (A) and surface potential (B) of wheat gliadin
2.4 加热对小麦醇溶蛋白表面疏水性和巯基含量的影响
蛋白质中氨基酸残基非极性侧链之间的疏水相互作用是维持蛋白质三级结构最重要的作用力,可以通过测定非极性物质ANS与蛋白质疏水基结合量的多少来间接揭示[17]。图4-A为ANS荧光探针法测得的不同颗粒表面疏水指数H0。结果显示,在50℃时,H0数值变化不明显;当温度上升到70℃时,H0显著提高,并且随着加热时间的增加持续升高。与对照组相比,90℃加热60 min导致蛋白质表面疏水性提高了约1倍,通常蛋白质的去折叠和疏水性残基的暴露是表面疏水性增大的原因[18]。该现象意味着90℃热处理的蛋白暴露了更多的疏水基团,形成表面活性颗粒,更有利于蛋白在水气界面的吸附,并进一步发生相互作用,形成稳定的界面膜从而更好地稳定泡沫[19]。热处理过程中的小麦醇溶蛋白的游离巯基基本稳定(图4-B),随着温度的升高,二硫键含量降低,小麦醇溶蛋白在不同温度下表现出了分子间二硫键的聚合(图4-C),游离巯基含量的微弱变化可能是由于醇溶蛋白中发生了SH/SS交换反应。在较高温度下,二硫键的存在是醇溶蛋白折叠的主要原因[20]。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4不同热处理对小麦醇溶蛋白表面疏水性(A)、自由巯基含量(B)和二硫键(C)的影响
Fig. 4Different heat treatments on the surface hydrophobicity (A)、free sulfhydryl content (B) and -SS- content (C) of wheat gliadin
2.5 原子力显微镜成像观察分析
本研究选取热处理温度为90℃时,对其构象变化进行进一步的表征。原子力显微镜(AFM)可用于样品的成像与表征,具有成像范围小、速度慢、受探头影响较大等诸多特点[21]。如图5-A所示,热处理后的小麦醇溶蛋白胶体粒子的颗粒尺寸有所减小,并随着时间的增加,蛋白出现聚集现象,与图3-A的结果一致。这是由于蛋白质内部的疏水基团随着加热时间的增加逐渐暴露并相互作用,分子相互靠近从而使蛋白质发生聚集。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5不同热处理后小麦醇溶蛋白的原子力显微镜成像图片
Fig. 5AFM images of wheat gliadin after different heat treatments
A:对照组 Control;B:90-15;C:90-30;D:90-60
2.6 加热对小麦醇溶蛋白结构的影响
如图6-A所示,首先采用SDS-PAGE凝胶电泳法分析天然和热处理后的蛋白亚基组成的变化,结果显示天然和热处理蛋白亚基间未展现出显著差异。为了进一步阐明热处理对蛋白质构象变化的影响,采用紫外吸收光谱、荧光光谱及圆二色谱对蛋白质结构进行表征。通常情况下,在紫外吸收光谱中,蛋白质在250 nm和290 nm处的峰值主要是由于苯丙氨基酸残基及两种芳香氨基酸的存在(酪氨酸和色氨酸)[22]。结果显示(图6-B),热处理后蛋白波长的吸收峰值明显升高,并有轻微的红移,这说明蛋白质的二级结构发生了改变。此外,利用荧光光谱对蛋白构象变化进行进一步的探究。在荧光光谱中,发色基团所处微环境极性的升高或降低会导致荧光信号强度的减少或增加以及最大发射波长的红移或蓝移现象[23]。如图6-C所示,所有样品在345 nm处显示出峰,热处理后的蛋白与天然蛋白相比,荧光强度明显减弱,波长并没有明显的变化,这说明蛋白质中芳香族氨基酸在微环境中极性不断增强。进一步证实了热处理会改变小麦醇溶蛋白的二级结构。图6
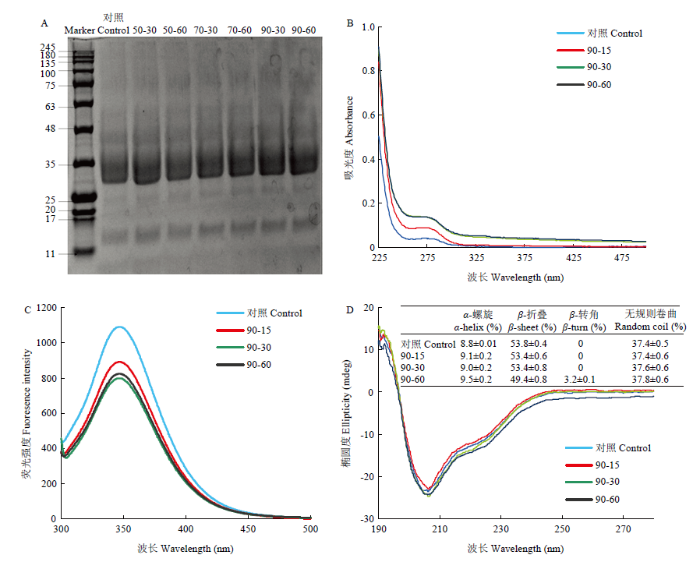 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6不同热处理对小麦醇溶蛋白结构的影响
A:SDS-PAGE电泳;B:UV光谱;C:内源荧光光谱;D:圆二色谱
Fig. 6Different heat treatments on the structure of wheat gliadin
A: SDS-PAGE electrophoresis; B: UV spectrum; C: Endogenous fluorescence spectrum; D: Circular dichroism
为了定量分析蛋白质二级结构的变化,对小麦醇溶蛋白热处理前后进行圆二色谱分析(图6-D)。结果显示,90℃处理60 min时,蛋白中α-螺旋含量比对照增加0.7%,而β-折叠减少4.4%,说明β-折叠转换成了α-螺旋和β-转角。同时,无规则卷曲的增加及β-转角的出现,进一步证实了蛋白质有序结构的减少。
2.7 小麦醇溶蛋白结构的小角X射线散射分析
高于蛋白变性温度的热处理通常引起蛋白的部分去折叠和随之发生的蛋白聚集。通过小角X射线散射(SAXS)进一步表征了热处理前后小麦醇溶蛋白的微观结构。所有样品的散射曲线都呈现相似的形状,并且在较大的q值范围内所有曲线都急剧下降,最终收敛(图7-A)。另一方面,小q范围内散射强度(I(q))和散射矢量(q)之间的幂数关系指数可用作粒子聚集的分形维数(df)[12],df与聚集体的紧密程度有关,df越高表示结构越紧密[24]。与天然小麦醇溶蛋白相比,90℃热处理30 min时df值增大,证明了蛋白质的聚集。从SAXS数据得出的Kratky图通常更好地区分散射强度,以阐明蛋白质折叠构象和致密性[3]。小麦醇溶蛋白在90℃下热处理60 min后,其峰值明显下降(图7-B),表明蛋白质在较高温度下结构有所改变。图7
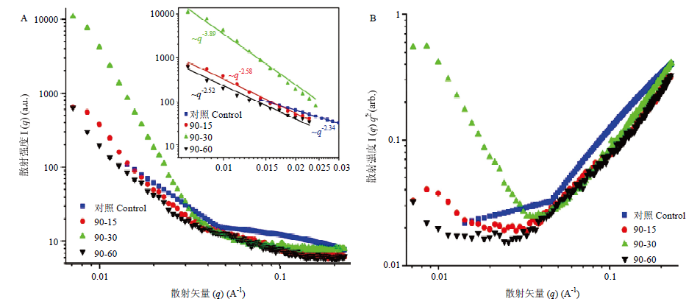 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7不同热处理下小麦醇溶蛋白结构的SAXS散射强度曲线(A)和Kratky图(B)
Fig. 7SAXS scattering intensity profile (A) and Kratky plot (B) of wheat gliadin structure different heat treatments
2.8 小麦醇溶蛋白DSC分析
DSC可以根据图谱中的吸放热过程提供蛋白结构稳定性的信息,测定其构象变化的热效应。用差示扫描量热仪分析90℃下小麦醇溶蛋白的热力学特性,得到的结果如表1。结果显示,小麦醇溶蛋白的变性温度在187℃左右,并且随着热处理时间的延长,变性温度先下降后上升;对照组的熔化温度在196.67℃,随着时间延长,融化温度上升明显。说明热处理改变了小麦醇溶蛋白的变性和融化温度。由于融化温度的上升,DSC的能量峰值也在升高。但其所达到的最高能量从54.33 mW降低到3 mW左右,加热后的谱图比较平缓。热焓的变化说明小麦醇溶蛋白晶体性状的改变,加热时间越长,蛋白质的构象越趋向于无定形态。蛋白质分子吸收的热量随温度的变化主要归因于蛋白质的变性,因此焓的变化与蛋白变性和结构的展开有关[25]。Table 1
表1
表1不同热处理后小麦醇溶蛋白的DSC结果
Table 1
| 处理 Treatment | 起始温度Onset (℃) | 结束温度End (℃) | 峰值Peak (℃) | 峰高Peak height (mW) |
|---|---|---|---|---|
| 对照Control | 187.65 | 196.67 | 188.72 | 54.33 |
| 90-15 | 187.83 | 194.55 | 189.97 | 3.99 |
| 90-30 | 183.55 | 226.34 | 189.93 | 2.99 |
| 90-60 | 185.75 | 253.79 | 189.65 | 3.34 |
新窗口打开|下载CSV
3 讨论
热处理后的小麦醇溶蛋白胶体粒子的泡沫特性得到显著提高,起泡能力和泡沫稳定性均增强。ZHU等[26]研究表明,热处理后的天然WPI有助于泡沫的形成,而产生的聚合物可以有效地稳定泡沫,同时也发现温和的热处理可以改善乳清蛋白的起泡性能。另有研究表明,乳清蛋白的纤维化与同等的非纤维热变性蛋白相比,可显著提高起泡能力和泡沫稳定性[27],这与本研究的结果一致。热处理温度的逐渐升高有利于蛋白小颗粒的聚集,当温度达到90℃时,颗粒的尺寸显著增加,蛋白聚集程度更高,原子力显微镜也证实了这一结果。热诱导的蛋白聚集会使泡沫稳定性得到增强[28]。乳清蛋白在100℃以下时观察到了溶液中可溶性聚集体的出现,平均粒径为160 nm左右,而不可溶聚集体的数量也随着温度的升高而增加,当温度为90℃时达到最大值[29]。热处理蛋白中未聚集的单体和聚集体的比例对泡沫稳定性有较大的影响[28],DAVIS等[30]将在中性条件下80℃加热处理所得乳清蛋白聚集体与天然蛋白以不同比例混合后,测定其表面张力,发现聚集体起到稳定泡沫的作用。但是需要控制聚集体的大小,聚集体的尺寸过大,不利于泡沫稳定性的改善[6]。本研究中所有粒子的尺寸在150 nm左右,加热产生的适当聚集体可以有效改善小麦醇溶蛋白的泡沫稳定性。
热变性会引起蛋白质二级结构、三级结构等许多构象的变化,以及分子间作用力的改变,如氢键、疏水相互作用等。小麦醇溶蛋白胶体粒子在热处理后二级结构发生了改变。本研究中,小角X射线散射(SAXS)结果证实90℃热处理后的小麦醇溶蛋白结构发生了部分去折叠,DSC中热焓的变化也说明蛋白质分子更趋于无定形态分布。紫外吸收光谱中峰值的红移及荧光猝灭的发生也证实了这一点。碱热处理后谷蛋白的小角X射线散射(SAXS)结果证实了加热过程中谷蛋白聚集体尺寸的减小,谷蛋白结构柔性得到增强[31]。热处理后的谷蛋白聚集体尺寸的减少与本研究结果相反,原因可能是蛋白质的差异性所造成。在KIEFFER等[32]的研究中,热处理后蛋白的CD光谱分析中峰值的增加说明了其α-螺旋的增加,其原因是蛋白的处理温度较低,蛋白变性的程度是稳定可逆的。而另有研究发现[33],热处理后乳清蛋白的β-折叠增加,β-转角及无规则卷曲减少,但α-螺旋结构没有变化。95℃加热15 min条件下制备的大豆蛋白纳米颗粒,其蛋白分子内疏水残基暴露,增加了表面疏水性,色氨酸残基的λmax红移进一步证实了疏水残基暴露在了更极端的环境中[33]。这些结果与本研究一致。90℃的热处理引起了小麦醇溶蛋白构象的高度伸展,结构柔性增强,分子内部的疏水氨基酸暴露导致其表面疏水性的增加,而游离巯基含量并无显著差异。前人已经证实加热会使蛋白质发生二硫键断裂,在冷却的过程中游离的二硫键会发生重排现象[34]。当热处理温度低于70℃时,醇溶蛋白的巯基含量几乎没有受到影响[32]。
反溶剂法耦合热处理改善了小麦醇溶蛋白在水中的分散性,同时具有良好的泡沫特性。影响小麦醇溶蛋白结构变化的信息,对于更好地解释热效应对小麦醇溶蛋白泡沫特性的改善具有极大的帮助。表面疏水性的增加是提高蛋白质起泡性质的重要原因,而热效应下产生的适当聚集体能有效地改善泡沫稳定性。
4 结论
利用反溶剂法耦合热效应的方法制备小麦醇溶蛋白胶体粒子,结果表明热处理可以破坏小麦醇溶蛋白质聚集体内部的二硫键,诱导蛋白质的一级、二级和三级结构发生转变,从而促进了蛋白质的聚集,增加了蛋白质的表面疏水性和结构柔性。这些变化,使小麦醇溶蛋白的起泡能力和泡沫稳定性分别提高了25%和85%。因此,反溶剂法耦合热效应是一种有效改善小麦醇溶蛋白功能特性的方法,在泡沫食品体系中具有较强的应用潜力。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
