 ,1,2, 黄伟2, 丁云花1, 王亚钦1, 胡丽萍1, 赵学志1, 何洪巨1, 刘光敏
,1,2, 黄伟2, 丁云花1, 王亚钦1, 胡丽萍1, 赵学志1, 何洪巨1, 刘光敏 ,1
,1Rapid Determination of RAA and GBC in Broccoli by Near Infrared Spectroscopy
LIU QianNan ,1,2, HUANG Wei2, DING YunHua1, WANG YaQin1, HU LiPing1, ZHAO XueZhi1, HE HongJu1, LIU GuangMin
,1,2, HUANG Wei2, DING YunHua1, WANG YaQin1, HU LiPing1, ZHAO XueZhi1, HE HongJu1, LIU GuangMin ,1
,1通讯作者:
责任编辑: 赵伶俐
收稿日期:2020-03-9接受日期:2020-04-20网络出版日期:2020-11-01
| 基金资助: |
Received:2020-03-9Accepted:2020-04-20Online:2020-11-01
作者简介 About authors
刘倩男,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1752KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
刘倩男, 黄伟, 丁云花, 王亚钦, 胡丽萍, 赵学志, 何洪巨, 刘光敏. 青花菜中硫代葡萄糖苷RAA和GBC的近红外光谱快速测定[J]. 中国农业科学, 2020, 53(21): 4497-4506 doi:10.3864/j.issn.0578-1752.2020.21.017
LIU QianNan, HUANG Wei, DING YunHua, WANG YaQin, HU LiPing, ZHAO XueZhi, HE HongJu, LIU GuangMin.
0 引言
【研究意义】青花菜(Brassica oleracea var. italica)又名绿菜花、西兰花,为十字花科芸薹属一、二年生草本植物,以主茎及侧枝顶端形成的绿色花球为产品,营养丰富,色、香、味俱佳,是国内外市场十分畅销的一种蔬菜。青花菜含有较高的维生素C、硒等营养成分和丰富的植物活性物质(Bioactive substances)。植物活性物质是天然存在且含量较少的一类具有抗氧化、抗病、抗突变、调节机体免疫系统或其他生理活性的化学物质,如硫代葡萄糖苷、黄酮类、类胡萝卜素、萜烯类化合物等。十字花科植物的主要活性成分为硫代葡萄糖苷(Glucosinolates,GS,简称硫苷),硫苷是一类含硫化合物,是十字花科植物中特有的次生代谢产物[1,2,3]。硫苷的核心结构是β-D-葡萄糖连接一个磺酸盐醛肟基团和一个来源于氨基酸的侧链,根据侧链R基团的不同把硫苷分为吲哚类、脂肪类和芳香类硫苷[4]。青花菜是硫代葡萄糖苷含量非常高的十字花科蔬菜,所含硫苷的种类至少有8种,其中4-甲基硫氧丁基硫苷(RAA)和3-甲基吲哚基硫苷(GBC)是主要的硫苷,占总含量的60%以上。大量医学和营养学研究表明,青花菜具有防癌抗癌的显著功效[5,6,7,8],而其具有的防癌抗癌特性正是与硫代葡萄糖苷的多种降解产物有关,尤其是具有很强抗癌功效的RAA降解产物莱菔硫烷和GBC的降解产物吲哚-3-甲醇[9,10,11]。不同青花菜品种中RAA以及GBC含量存在较大差异。因此在青花菜的营养品质育种方面,对青花菜中活性成分硫苷的准确快速测定以及培育高含量RAA和GBC青花菜品种尤为重要。【前人研究进展】近红外光谱(Near infrared reflectance spectroscopy,简称NIRs)分析技术可通过测定样品的近红外吸收光谱,达到同时分析样品中多种成分的效果。虽然我国对近红外光谱技术的研究及应用起步较晚,但因其快速、无损伤、分析费用低等优点,NIRs技术在农业、石油化工、制药与临床医学和食品工业等领域均已得到广泛应用[12,13,14,15]。JHA等[16]应用便携式近红外设备采集西红柿汁的光谱,对其酸度和糖度值进行建模和预测,结果表明,随着波长的增加,其校正标准偏差和预测标准偏差减小;PEDRO等[17]建立了西红柿的总固形物、可溶性固形物、番茄红素和其他种类胡萝卜素含量的近红外光谱模型,模型的相关系数较好;覃方丽等[18]通过对不同品种和颜色的鲜辣椒凸表面点的近红外光谱进行分析,建立了较为可靠的可溶性糖和Vc含量的预测模型;王多加等[19]利用傅里叶变换近红外光谱仪建立了小白菜和菜心全植株、完整叶片和剁碎叶片中硝酸盐的无损快速测定准确模型,模型预测值与实际值的相关系数较高;金同铭等[20]运用近红外光谱分析仪筛选出苹果中蔗糖、葡萄糖、果糖和苹果酸的特征波长,建立了这4种组分的定标方程,其对样品的预测值和高效液相色谱法测定值的相关系数均达到0.99以上,从而证实了近红外光谱分析可满足实际应用中苹果糖、酸含量的测定精度。近红外光谱技术在硫苷的快速检测方面也有一些文献报道,如芥菜种子[21]、芥蓝[22]。王耐红等[23]运用近红外光谱技术对甘蓝型油菜硫苷组分的含量进行了检测;贺启川等[24]应用近红外光谱建立了一种快速测定油菜硫苷的模型;郭泽慧[25]完成了萝卜硫苷组分近红外定标模型的构建。【本研究切入点】硫苷的测定方法包括HPLC测定完形硫苷和脱硫硫苷,以及HPLC/MS分析完形硫苷,但是存在分析周期长或耗费高等问题。现在近红外光谱分析技术以其简便、快速、无损、多组分检测的优势,在农业和食品工业方面的应用越来越广泛,在果蔬营养和安全品质检测上有极大的应用潜力。青花菜作为一种大宗食用的高营养价值蔬菜,在膳食结构中有重要地位,对其营养品质和抗癌组分的快速检测研究很有必要。目前还没有利用近红外光谱技术测定青花菜中抗癌硫苷组分的研究报道。【拟解决的关键问题】本研究采用高效液相色谱法(HPLC)测定青花菜中硫苷的组成和含量,在近红外光谱仪扫描样品所获得的光谱文件与HPLC测定结果的基础上,选择不同散射处理和导数处理方法进行预处理,选用最佳组合预处理方法创建近红外光谱模型,并经外部检验确认。该方法为青花菜营养品质指标的快速无损检测提供参考。1 材料与方法
1.1 试验材料
试验的青花菜种质资源由北京市农林科学院蔬菜研究中心提供。样品于2018年3月11日播种,4月16日定植于蔬菜中心四季青农场。6月10日当青花菜花球长到收获标准时分期收获。共选取90个不同青花菜的花球,取代表性的小花球5—10个,切割混匀,使用冷冻干燥机进行冻干处理2 d,再将冻干后的样品粉碎并过筛(60目),制得均匀的干粉样品,低温(-20℃)保存,用于定标模型的建立。用于模型验证的30份样品来源于北京市农林科学院蔬菜研究中心通州基地,于2018年10月20日收获,处理方法同上。
1.2 仪器试剂
试验所用主要仪器:SZJY-117电子分析天平,赛多利斯科学仪器(北京)有限公司;Pilot10-15M真空冷冻干燥机,北京博医康实验仪器有限公司;FW100高速万能粉碎机,天津市泰斯特仪器有限公司;XDS近红外光谱仪,FOSS公司;LC-20AD高效液相色谱仪,SHIMADZU公司;KQ-600DE数控超声波清洗器,昆山市超声仪器有限公司。试剂主要有:甲醇(Fisher Chemical公司),DEAE胶(GE Healthcare公司),NaAc溶液(国药集团化学试剂有限公司),硫酸酯酶(Sigma公司)。
1.3 试验方法
1.3.1 硫苷的提取与分析 称取冻干样品0.2 g,放入15 mL塑料管中。加入内标苯甲基硫苷(TRO)0.25 mL,加入100%预热的甲醇5 mL,80℃下水浴20 min,每隔4—5 min涡旋振荡1次,3 000 r/min离心10 min,取上清液倒入15 mL塑料管中。沉淀物继续用70%甲醇提取2次,同上述处理方法,合并上清液,即为样品液。取一次性注射器,加入玻璃棉,塞紧,放在试管上。加入DEAE胶溶液2 mL,用2 mL双蒸水洗涤,加入样品液2 mL。待样品液不再滴下,加入 0.02 mol?L-1 NaAc溶液。待不再有液体滴下,将注射器转移到另一试管上,加入75 μL硫酸酯酶溶液,封口过夜。将过夜的注射器用双蒸水洗涤3次,每次0.5 mL。用注射头挤压注射器,使液体尽可能转移到试管中。将试管中液体通过0.45 μm滤膜转移到小玻璃瓶中,冷冻保存,待用。取1 mL上清液进行液相色谱检测,记录峰面积。利用内标和响应因子计算硫苷含量[26],硫苷含量计算公式如下:硫苷含量=脱硫硫苷峰面积×内标量×脱硫硫苷相对响应因子内标峰面积×试样质量
1.3.2 近红外光谱仪分析 近红外仪器开机预热30 min,进行光谱和噪声诊断,当诊断结果通过后方可开始扫描。将样品干粉均匀平铺在样品杯中,用盖子压实,保证样品覆盖均匀,然后对样品进行静态扫描,每个样品扫描3次。将HPLC方法得到硫苷含量输入仪器配套的化学计量学软件,进行光谱分析处理。在偏最小二乘回归法分析的基础上,采用不同散射处理方式(SNV、Detrend、SNV+Detrend)和导数处理方式(FD、SD)对光谱数据进行分析预处理,得到校正模型,然后通过验证集对模型进行外部验证。应用近红外光谱仪配套的WinISI III定标软件对光谱数据进行处理。
2 结果
2.1 青花菜品种资源硫苷组成和含量
用高效液相色谱法测定青花菜硫代葡萄糖苷图谱如图1所示,青花菜硫代葡萄糖苷组分在30 min内全部出峰,分离较为完全,共检测到8种硫苷,包括脂肪类、芳香类和吲哚类硫苷,按照出峰顺序分别为2-羟基-3-丁烯基硫苷(PRO)、4-甲基硫氧丁基硫苷(RAA)、3-丁烯基硫苷(NAP)、4-羟基吲哚基-3甲基硫苷(4OH)、4-甲硫基丁烯基硫苷(ERU)、3-甲基吲哚基硫苷(GBC)、4-甲基吲哚基-3甲基硫苷(4ME)、1-甲基吲哚基-3甲基硫苷(NEO)。其中4-甲基硫氧丁基硫苷(RAA)和3-甲基吲哚基硫苷(GBC)是青花菜中存在的主要硫苷,约达到总含量的60%。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1硫苷组分的高效液相色谱图
1:2-羟基-3-丁烯基硫苷 PRO;2:4-甲基硫氧丁基硫苷 RAA;3:3-丁烯基硫苷 NAP;4:4-羟基吲哚基-3甲基硫苷 4OH;5:苯甲基硫苷 TRO;6:4-甲硫基丁烯基硫苷 ERU;7:3-甲基吲哚基硫苷 GBC;8:4-甲基吲哚基-3甲基硫苷 4ME;9:1-甲基吲哚基-3甲基硫苷 NEO
Fig. 1High performance liquid chromatography of the glucosinolates
试验所用材料为本中心青花菜育种课题组的青花菜种质资源和品种,样品覆盖各种不同基因型,包括日本、欧洲、美国等不同来源的材料和品种,生育期有早熟、中熟、晚熟不同类型,株型有直立和半直立、有主球和分枝型,花球有紧实型和松散型,花蕾有细粒、中粒和粗粒,具有广泛代表性。这些样品的硫苷组分含量结果见表1,RAA和GBC是最主要的两种硫苷,其中RAA平均含量为6.20 μmol?g-1,变化范围为0.66—14.54 μmol?g-1,GBC平均含量为4.43 μmol?g-1,变化范围为0.25—10.79 μmol?g-1。通过这个结果可以看出,选取的样品中RAA和GBC成分含量分布范围较广,能很好地代表不同含量RAA和GBC的青花菜样品,适于做建立近红外模型的样品集。
Table 1
表1
表1青花菜样品中硫代葡萄糖苷组分含量
Table 1
| 硫代葡萄糖苷成分 Glucosinolates components | 含量范围 Content range (μmol?g-1) | 平均值 Average (μmol?g-1) |
|---|---|---|
| RAA | 0.66—14.54 | 6.20 |
| GBC | 0.25—10.79 | 4.43 |
| PRO | 0.01—3.42 | 0.72 |
| NAP | 0—0.23 | 0.07 |
| 4OH | 0.03—1.86 | 0.53 |
| 4ME | 0.05—1.16 | 0.42 |
| NEO | 0.06—11.84 | 2.91 |
| ERU | 0.01—1.96 | 0.27 |
新窗口打开|下载CSV
2.2 青花菜近红外光谱分析
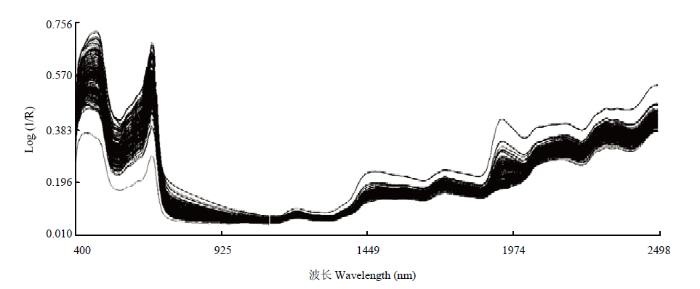
使用近红外光谱仪对90个青花菜样品进行扫描,每个样品扫描3次,所得到的近红外原始光谱除样品自身信息外,还包含了其他大量无关信息和噪声,采用不同散射处理方式和导数处理方式对原始光谱进行预处理,减弱甚至消除各种非目标因素对光谱的影响,净化谱图信息,为校正模型的建立奠定基础。导数处理可有效地提高光谱的分辨率、减小基线漂移、消除光谱的谱峰重叠[27,28],在实际分析中一般采用一阶导数(FD)和二阶导数(SD)来进行光谱预处理。标准正态变量变换(SNV)主要是用来消除固体颗粒大小、表面散射以及光程变化对NIR漫反射光谱的影响,去散射处理(Detrend)是一种用来消除漫反射光谱的基线漂移光谱处理方法,通常与SNV联合使用(SNV+Detrend)[29]。图2为青花菜样品经近红外光谱分析仪得到的近红外原始光谱图,其中横坐标代表光谱波长(nm),纵坐标为青花菜样本的吸光度,对其分析可知青花菜样品在400—1 092 nm的波长范围内有明显的吸收峰和基本相同的变化趋势,说明青花菜样品的吸光度与其化学成分含量之间存在相关性,有利于近红外模型的建立。图3为原始光谱经过SNV+Detrend+FD处理后的光谱曲线图,与原始光谱相比,处理过的光谱曲线起伏更加显著,峰变得更多更尖锐,一些原本平滑的部分也出现了吸收峰。图4为原始光谱经过SNV+Detrend+SD处理后的光谱曲线图,明显出现拟合的现象。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2青花菜近红外原始光谱
Fig. 2Original near-infrared spectrum of broccoli
图3
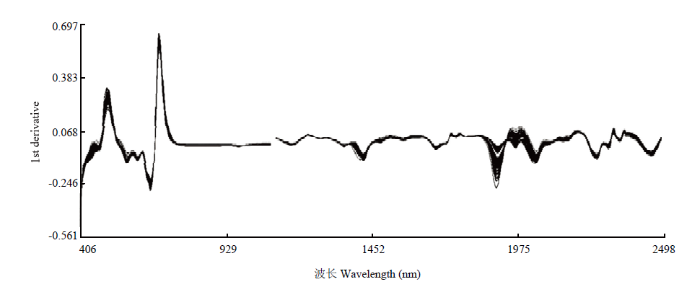 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3SNV+Detrend+FD处理后光谱图
Fig. 3Spectra treated by the SNV+Detrend+FD method
图4
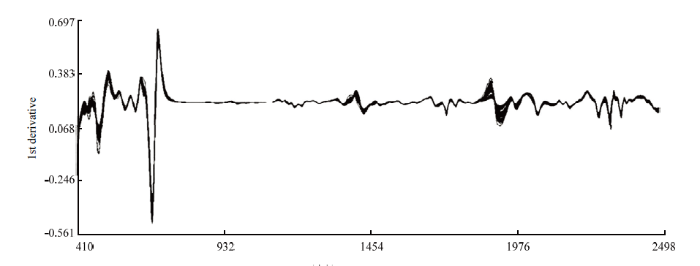 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4SNV+Detrend+SD处理后的光谱
Fig. 4Spectra treated by the SNV+Detrend+SD method
2.3 青花菜硫代葡萄糖苷组分的分析
在利用偏最小二乘回归法(partial least squares,PLS)分析的基础上,采用8种数据处理方法进行处理,比较结果所得参数,确定最合适的处理方法,RSQ是定标相关系数,1-VR是内部交叉验证相关系数,都是越接近于1越好。由表2和表3可知,RAA内部交叉检验效果较好,经过SNV+SD处理后的RSQ和1-VR值分别为0.867和0.846,GBC经过SNV+SD处理后的相关系数RSQ和1-VR值分别达到0.912和0.892。结果表明,该方法用于预测青花菜中RAA和GBC的含量切实可行。Table 2
表2
表2不同处理方法对青花菜中RAA组分定标方程的对比
Table 2
| 光谱预处理方法 Spectral treatment method | RAA | |||
|---|---|---|---|---|
| 定标相关系数 RSQ | 矫正标准偏差 SEC | 内部交叉验证误差 SECV | 内部交叉验证相关系数 1-VR | |
| 原始光谱+FD Original spectrum+FD | 0.814 | 1.436 | 1.461 | 0.808 |
| 原始光谱+SD Original spectrum+SD | 0.848 | 1.263 | 1.330 | 0.831 |
| SNV+Detrend+FD | 0.832 | 1.363 | 1.402 | 0.823 |
| SNV+Detrend+SD | 0.859 | 1.214 | 1.275 | 0.844 |
| SNV+FD | 0.834 | 1.359 | 1.401 | 0.823 |
| SNV+SD | 0.867 | 1.209 | 1.269 | 0.846 |
| Detrend+SD | 0.794 | 1.511 | 1.535 | 0.788 |
| Detrend+FD | 0.839 | 1.319 | 1.385 | 0.823 |
新窗口打开|下载CSV
Table 3
表3
表3不同处理方法对青花菜中GBC组分定标方程的对比
Table 3
| 光谱预处理方法 Spectral treatment method | GBC | |||
|---|---|---|---|---|
| 定标相关系数 RSQ | 矫正标准偏差 SEC | 内部交叉验证误差 SECV | 内部交叉验证相关系数 1-VR | |
| 原始光谱+FD Original spectrum+FD | 0.860 | 0.813 | 0.829 | 0.854 |
| 原始光谱+SD Original spectrum+SD | 0.884 | 0.778 | 0.825 | 0.869 |
| SNV+Detrend+FD | 0.861 | 0.831 | 0.845 | 0.855 |
| SNV+Detrend+SD | 0.899 | 0.717 | 0.760 | 0.887 |
| SNV+FD | 0.862 | 0.846 | 0.867 | 0.854 |
| SNV+SD | 0.912 | 0.692 | 0.738 | 0.892 |
| Detrend+FD | 0.849 | 0.836 | 0.861 | 0.839 |
| Detrend+SD | 0.875 | 0.802 | 0.842 | 0.862 |
新窗口打开|下载CSV
2.4 青花菜硫代葡萄糖苷组分的近红外光谱模型的建立
2.4.1 青花菜硫代葡萄糖苷组分中RAA的近红外光谱模型建立 通过表2中不同的建模效果对比,采用SNV+SD处理后的模型效果较好,SNV+Detrend+SD效果次之,相关系数为0.859,内部交叉验证相关系数为0.844;Detrend+FD的相关系数为0.794,内部交叉验证相关系数为0.788,效果最差。因此将SNV+SD处理作为预处理方法,对青花菜硫代葡萄糖苷中RAA组分进行建模。建模后的效果如图5所示,该效果图能够直观地体现出模型的预测效果,样品无规律地分布在直线两侧的区域,整体呈均匀离散的趋势,没有出现大的偏差,说明模型较准确,可以用于青花菜中RAA含量的预测。图5
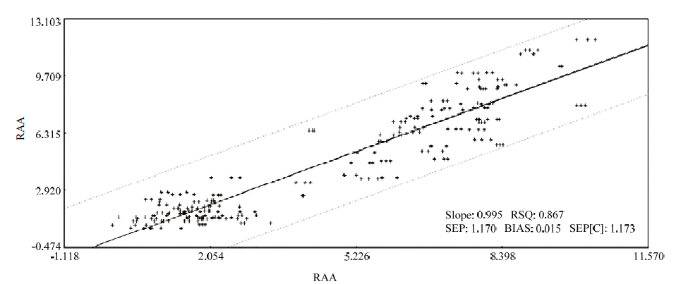 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5RAA模型效果图
Fig. 5RAA model result
2.4.2 青花菜硫代葡萄糖苷组分中GBC的近红外光谱模型建立 由表3可以看出,采用SNV+FD处理后的模型效果最好。SNV+Detrend+SD效果次之,相关系数为0.899,内部交叉验证相关系数为0.887,Detrend+SD的相关系数为0.841,内部交叉验证相关系数为0.862,效果最差。因此采用SNV+FD对数据进行处理,然后对青花菜硫代葡萄糖苷中GBC组分进行建模,建模后的效果如图6所示,模型较准确,该模型可以用于青花菜硫代葡萄糖苷中GBC组分的快速预测实践中,实现高效筛选。
图6
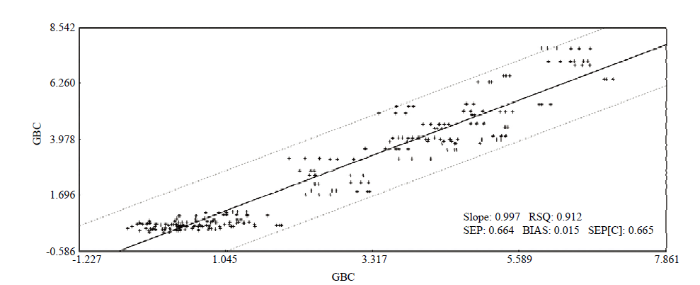 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6GBC模型效果图
Fig. 6GBC model result
2.5 模型验证与分析
基于已建立的模型,随机选择20个与建模样品无关的样品进行验证,使用HPLC测得的样品含量等理化指标,然后使用已建立的模型对这些样品中RAA和GBC含量进行预测,结果如表4所示。通过验证集进行外部检验可以看出,预测青花菜蔬菜粉样品中RAA含量的外部检验相关系数为0.918,预测GBC含量的外部检验相关系数为0.960,RAA的检验偏差较低(0.143);GBC的检验偏差仅有0.064,模型效果较好,因此可以使用此模型来快速预测青花菜蔬菜粉原料中RAA和GBC的含量。Table 4
表4
表4校正模型对外部验证集样品的分析
Table 4
| 组分 Components | 外部检验 External inspection | |||||
|---|---|---|---|---|---|---|
| 验证集(个) Validation set (n) | 平均值 Mean | 外部检验相关系数 RSQ | 预测标准差 SEP | 检验偏差 Bias | ||
| Lab | NIR | |||||
| RAA | 20 | 6.325 | 6.166 | 0.918 | 1.429 | 0.143 |
| GBC | 20 | 4.319 | 4.467 | 0.960 | 0.780 | 0.064 |
新窗口打开|下载CSV
3 讨论
青花菜作为一种营养价值高的蔬菜,在东西方膳食结构中占有重要的地位。青花菜含有的萝卜硫素前体物质RAA的抗癌作用已经有大量研究文献[1-2,5-7]。哈佛大学医学院研究人员最新发现青花菜中含有的活性物质GBC的降解产物吲哚-3-甲醇(I3C)可以有效抑制E3泛素连接酶(WWP1)的功能来促进肿瘤细胞中PTEN的活化,从而发挥抑制肿瘤发生和发展的作用[30]。因此,筛选和培育抗癌硫苷含量高的品种已经成为青花菜品质育种的重要目标。硫苷的分析方法包括HPLC技术测定完形和脱硫硫苷,以及HPLC/MS技术测定完形硫苷,可以准确定性和定量,但是存在花费较高(HPLC-MS)、分析时间长(HPLC)等缺点,限制了大量育种材料的及时筛选和评价。近红外光谱法是根据样品内有机官能团(OH、CH、NH、SH)的自身振动吸收近红外光谱区相应波长的能量,从而产生能量的跃迁在光谱中表现出来[13]。随着计算机技术的发展和广泛应用、化学计量学研究的深入以及近红外光谱仪器制造技术的完善,NIRs分析技术在多个领域特别是农业领域得到广泛的应用和发展。
近红外光谱分析技术不同于其他常规分析技术,采用间接校正方法,通过建立校正模型来预测未知样品成分,分析结果受代表性样品的选择、近红外光谱准确性等众多因素的影响[31]。任何能够对样本的光谱数据及测量数据产生影响的因素,都有可能影响到所建模型的质量。近红外光谱分析技术的关键是建立一个预测准确、抗干扰能力强的校正分析模型,从而实现对未知样本的定性或定量分析[32]。
标准分析方法提供的化学测定值作为基础数据参与近红外模型的创建,其准确性对于建立一个优质可靠的模型至关重要[33]。本研究首先对90份青花菜品种资源样品进行了HPLC硫苷种类与含量的测定,结果发现硫苷的含量在品种间的差异很大,RAA含量为0.66—14.54 μmol?g-1,GBC含量为0.25—10.79 μmol?g-1。不仅为品质育种提供了筛选材料,同时为近红外模型建立提供了有效数据和保证。
在光谱信息处理过程中,采用不同散射处理方式和导数处理方式对光谱数据进行预处理,消除非目标因素对光谱的影响,提高光谱呈现的准确性,并在此基础上优化光谱范围,选择对样品信息反映突出的光谱区域,筛选出最有效的光谱区域,为建立近红外光谱模型奠定基础。本研究使用青花菜的硫苷种类中,RAA和GBC是抗癌效果最好的活性物质,预测模型RAA的相关系数为0.918,GBC的相关系数为0.960,分析时间短,可在半分钟内完成。研究结果表明NIRs能够很好地应用于大量青花菜育种材料资源的快速筛选。另外,几种硫苷的含量相关系数小于0.6,是否和含量较低或与模型的选择和优化等方面有关,需要进一步研究。
4 结论
对于青花菜硫代葡萄糖苷中4-甲基硫氧丁基硫苷(RAA)和3-甲基吲哚基硫苷(GBC)指标采用SNV+SD处理后的模型效果较好。利用近红外光谱检测系统可以实现青花菜干粉样品中硫代葡萄糖苷含量的快速无损预测,具有数据准确、方法快捷、预处理简单等优点,为青花菜品质指标的快速检测提供了切实可行的技术参考,还可用于青花菜的育种实践当中,实现高营养品质青花菜育种材料快速高效的筛选。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1080/01635581.2001.9680607URLPMID:12094621 [本文引用: 2]

In recent years, cancer prevention by natural products has received considerable attention. The potential protective role of cruciferous vegetables and active components present in these vegetables, such as isothiocyanates and indole-3-carbinol, has been extensively studied in experimental in vitro and in vivo carcinogenesis models. Results have consistently shown that the chemopreventive agents derived from this class of vegetables of the Cruciferae family influence carcinogenesis during initiation and promotion phases of cancer development. Similarly, reports from epidemiological studies and clinical trials support this notion. However, there is no comprehensive summary of all these aspects of the association between cruciferous vegetables and cancer prevention. We have attempted to summarize experimental carcinogenesis studies as well as clinical trials and studies on the mechanism of action of selective chemopreventive agents isolated and identified within these natural products. Results clearly point toward a positive correlation between cancer prevention of many target organs and consumption of cruciferous vegetable or their active constituents. Yet we are still far from complete understanding of the effects of combinations of chemopreventive phytochemicals present in these cruciferous vegetables and their overall mechanism(s) of action in providing protective effects.
URLPMID:20172656 [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
URLPMID:16713696 [本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
URLPMID:16082211 [本文引用: 1]
URLPMID:18314259 [本文引用: 1]
URLPMID:18602823 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1021/ac048651rURLPMID:15828787 [本文引用: 1]

Tomato is an important player in the agricultural market. It is the second most consumed vegetable in the world and is a source of important micronutrients such as lycopene and beta-carotene. Recent research has demonstrated that these carotenoids can act as free-radical quenchers in the body and prevent aging, tissue damage, heart disease, and certain cancers. Besides these microcomponents, tomato is composed of soluble and insoluble solids. In industry, these solids govern factory yield and play a major role in the tomato trade. Nowadays, standard methods for determining tomato solids and carotenoids are time and labor consuming. In this work, we present the development of a simultaneous and nondestructive method for determining total and soluble solids, as well as lycopene and beta-carotene, in tomato products by near-infrared spectroscopy. PLS-1 was the calibration technique chosen. For spectra preprocessing, MSC and second derivative were applied. As variable selection techniques, the correlogram cutoff, the successive projections algorithm, the dimension wise selection, and spectra splitting approach were applied. Best models presented satisfactory prediction abilities evaluated through its RMSEP and r values: total solids 0.4157, 0.9998; soluble solids 0.6333, 0.9996; lycopene 21.5779, 0.9996; beta-carotene 0.7296, 0.9981.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1126/science.aax3501URLPMID:31097651 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
