 ,1, 祭芳2, 徐剑宏2, 钱鸣蓉3, 段劲生4, 聂冬霞1, 唐占敏1, 赵志辉1, 史建荣2, 韩铮
,1, 祭芳2, 徐剑宏2, 钱鸣蓉3, 段劲生4, 聂冬霞1, 唐占敏1, 赵志辉1, 史建荣2, 韩铮 ,1
,1Natural Occurrence and Characteristic Analysis of 40 Mycotoxins in Agro-Products from Yangtze Delta Region
FAN Kai ,1, JI Fang2, XU JianHong2, QIAN MingRong3, DUAN JinSheng4, NIE DongXia1, TANG ZhanMin1, ZHAO ZhiHui1, SHI JianRong2, HAN Zheng
,1, JI Fang2, XU JianHong2, QIAN MingRong3, DUAN JinSheng4, NIE DongXia1, TANG ZhanMin1, ZHAO ZhiHui1, SHI JianRong2, HAN Zheng ,1
,1通讯作者:
责任编辑: 赵伶俐
收稿日期:2020-11-2修回日期:2021-02-4网络出版日期:2021-07-01
| 基金资助: |
Received:2020-11-2Revised:2021-02-4Online:2021-07-01
作者简介 About authors
范楷,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (679KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
范楷, 祭芳, 徐剑宏, 钱鸣蓉, 段劲生, 聂冬霞, 唐占敏, 赵志辉, 史建荣, 韩铮. 长三角地区市场常见农产品中40种真菌毒素的污染状况和特征分析[J]. 中国农业科学, 2021, 54(13): 2870-2884 doi:10.3864/j.issn.0578-1752.2021.13.015
FAN Kai, JI Fang, XU JianHong, QIAN MingRong, DUAN JinSheng, NIE DongXia, TANG ZhanMin, ZHAO ZhiHui, SHI JianRong, HAN Zheng.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】真菌毒素(Mycotoxin)是一类由产毒真菌产生的有毒次级代谢产物,广泛存在于各种谷物、水果和蔬菜等农产品及其制品中[1]。目前,已知的真菌毒素已超过400种,危害较大的包括黄曲霉毒素(aflatoxins,AFs)、赭曲霉毒素(ochratoxins,OTs)、单端孢霉烯族毒素(trichothecenes,TCTs)、伏马毒素(fumonisins,FUMs)和玉米赤霉烯酮(zearalenone,ZEN)等40余种[2]。真菌毒素具有肝毒性、肾毒性、胃肠道毒性,有导致生殖紊乱、免疫抑制和致畸、致癌、致突变等毒性作用[3],尤其是黄曲霉毒素B1(aflatoxin B1,AFB1),被国际癌症研究机构IARC(International Agency for Research on Cancer)划为1类强致癌物[4],其毒性分别为砒霜和氰化钾的68倍和10倍[5];而赭曲霉素A(ochratoxin A,OTA)和伏马毒素则被划为2B类可能致癌物,分别与多种急慢性肾脏疾病和食道癌等的发生关系密切[6,7]。因此,全面、系统了解农产品中真菌毒素的污染水平和分布特征,对于保障农产品质量安全和大众身体健康具有重要的意义。【前人研究进展】长三角地区属中国东部北亚热带季风气候,温暖湿润、雨热同期、日照充分、雨量充沛,农作物在耕作、收获、储存和运输等过程中均非常容易被产毒真菌侵染而产生真菌毒素[8]。2010年,在长三角地区76份粮油农产品中,AFs、赭曲霉毒素A(ochratoxin A,OTA)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)和ZEN的检出率分别为14.5%、14.5%、7.9%和27.6%,浓度范围为0.51—700 μg∙kg-1[9];2017年,在38份江苏地区和29份安徽地区的小麦样品中,DON及其衍生物的检出率均为100%,平均浓度分别为102.21 μg∙kg -1和37.26 μg∙kg -1[10];2011—2012年,上海市88份的玉米和小麦样品筛查结果中发现,DON及其衍生物的污染率均为100%,平均浓度分别为141.9 μg∙kg-1和118.2 μg∙kg -1[11]。可见,长三角地区是真菌毒素污染的高发地区,农产品中真菌毒素污染的普遍性及种类的多样性给人们的生命健康带来了一定的安全风险。【本研究切入点】目前,长三角地区农产品中真菌毒素的相关筛查研究大多仅关注AFs、DON、ZEN等少数几类毒素,也缺乏果蔬等农产品中真菌毒素污染情况的报道,并不能完全反映该地区真菌毒素的污染情况。另一方面,近年来,一些新兴真菌毒素和隐蔽型真菌毒素的危害及重要性逐渐受到关注,如链格孢霉毒素(Alternaria Toxins)、桔青霉素(citrinin,CIT)、环匹阿尼酸(cyclopiazonic acid,CPA)及脱氧雪腐镰刀菌烯醇-3-葡萄糖苷(deoxynivalenol-3-glucoside,D3G)等[12],这些毒素在长三角地区的污染情况仍不清楚。【拟解决的关键问题】采用超高效液相色谱串联质谱(ultra-performance liquid chromatography-tandem masss pectrometry,UPLC-MS/MS)技术测定该地区(江苏、浙江、安徽、上海)市场典型农产品(小麦、玉米、稻谷、番茄、桃)中40种重要真菌毒素的含量,分析其污染水平和分布特征,为真菌毒素的风险评估、安全预警及监管防控提供基础数据,为保障农产品质量安全和大众身体健康以及相关标准、政策等的制(修)订提供参考依据。1 材料与方法
1.1 试验材料
1.1.1 样品采集 于2019年3—11月在长三角三省一市(安徽省、江苏省、浙江省和上海市)进行样品采集。为保证所采样品的代表性,从每个省(市)选择3—5个分采样点,从每个分采样点所辖的超市、农家和农贸市场采集样品(采集果蔬(番茄和桃)时,挑选大小适中、成熟度适宜、色泽均匀、果面光滑、新鲜、无病虫害、无机械损伤的果实),共收集720份农产品样品,具体信息见表1。每份样品不少于1 kg,用塑料自封袋装存、完成编号标记后,于0—4℃冷藏运输至上海市农业科学院农产品质量标准与检测技术研究所真菌毒素实验室进行检测分析。实验室接收样品后,将样品充分混合,按四分法分成4份,随机抽取一份制备,其余作为留样保存。谷物(小麦、玉米和稻谷)粉碎后过20目筛;果蔬样品洗净后,取除去果梗和核(桃)的整个果实,切碎并用匀浆机均质。制备后的样品分别装入洁净的盛样瓶内,密封并标记,保存于-20℃冷库。样品的采集、运输、分样、制备和存储等过程中均避免交叉污染。Table 1
表1
表1本研究采集的农产品样品(份)
Table 1
| 地区 Area | 小麦 Wheat | 玉米 Maize | 稻谷 Rice | 番茄 Tomato | 桃 Peach | 合计 Total |
|---|---|---|---|---|---|---|
| 上海 Shanghai | 30 | 30 | 60 | 60 | 60 | 240 |
| 安徽 Anhui | 30 | 30 | 30 | 30 | 30 | 150 |
| 江苏 Jiangsu | 30 | 30 | 30 | 30 | 30 | 150 |
| 浙江 Zhejiang | 30 | 60 | 30 | 30 | 30 | 180 |
| 合计 Total | 120 | 150 | 150 | 150 | 150 | 720 |
新窗口打开|下载CSV
1.1.2 仪器 超高效液相色谱仪(美国Waters公司),TRIPLE QUADTM 5500三重四级杆质谱仪(美国AB SCIEX公司),5804R离心机(德国Eppendorf公司),HSC-24B氮吹仪(上海楚定分析仪器有限公司),Milli-Q超纯水仪(美国Millipore公司),AL104分析天平(美国梅特勒-托利多仪器有限公司),SK8210LHC超声波清洗机(上海科导超声仪器有限公司),BJ-800A食品粉碎机(杭州德清拜杰电器有限公司)。
1.1.3 试剂 甲醇、乙腈、甲酸、醋酸铵(色谱纯,德国Merck公司);无水硫酸镁、氯化钠(美国Sigma-Aldrich公司);40种真菌毒素标准品:AFB1、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素G1(aflatoxin G1,AFG1)、黄曲霉毒素G2(aflatoxin G2,AFG2)、黄曲霉毒素M1(aflatoxin M1,AFM1)、黄曲霉毒素M2(aflatoxin M2,AFM2)、杂色曲霉素(sterigmatocystin,SMC)、OTA、赭曲霉毒素B(ochratoxin B,OTB)、赭曲霉毒素C(ochratoxin C,OTC)、赭曲霉毒素α(ochratoxin α,OTα),交链孢霉烯(altenuene,ALT)、腾毒素(tentoxin,TEN)、细交链孢菌酮酸(tenuazonic acid,TeA)、腐败菌素A(destruxin A,DA)、疣孢青霉原(verruculogen,VER)、伏马毒素B1(fumonisin B1,FB1)、伏马毒素B2(fumonisin B2,FB2)、伏马毒素B3(fumonisin B3,FB3)、蛇形毒素(diacetoxyscirpenol,DAS)、新茄镰孢菌醇(neosolanio,NEO)、胶黏毒素(gliotoxin,GLI)、CPA、T-2毒素(T-2 toxin,T-2)、HT-2毒素(HT-2 toxin,HT-2)、DON、镰刀菌烯酮(fusarenon X,Fus-X)、15-乙酰基-脱氧雪腐镰刀菌烯醇(15-acetyl- deoxynivalenol,15-ADON)、3-乙酰基-脱氧雪腐镰刀菌烯醇(3-acetyl-deoxynivalenol,3-ADON)、D3G、展青霉毒素(patulin,PAT)、CIT、麦考酚酸(mycophenolic acid,MPA)、ZEN、玉米赤霉酮(zearalanone,ZAN)、α-玉米赤霉烯醇(α-zearalenol,α-ZOL)、β-玉米赤霉烯醇(β-zearalenol,β-ZOL)、α-玉米赤霉醇(α- zearalanol,α-ZAL)、β-玉米赤霉烯醇(β-zearalano,β-ZAL)和青霉酸(penicillic acid,PCA),纯度均大于97%(美国Romer公司);5种同位素内标:13C17-黄曲霉毒素B1(13C17-aflatoxin B1,13C17-AFB1)(0.5 μg∙mL -1)、13C20-赭曲霉毒素A(13C20-ochratoxin A,13C20-OTA)(10 μg∙mL -1)、13C15-伏马毒素B1(13C15-fumonisin B1,13C15-FB1)(25 μg∙mL -1)、13C15-脱氧雪腐镰刀菌烯醇(13c15-deoxynivalenol,13C15-DON)(25 μg∙mL -1)、13C18-玉米赤霉烯酮(13C18-zearalenone,13C18-ZEN)(25 μg∙mL -1)(美国Romer公司)。
1.2 试验方法
1.2.1 真菌毒素检测 采用实验室前期所建立的农产品中40种真菌毒素的分析方法,参考文献[13]。1.2.1.1 真菌毒素标准溶液的配制 分别称取40种真菌毒素适量标准品用乙腈稀释成浓度为10 mg∙L-1的标准贮备液,再用乙腈配制为质量浓度为1 mg∙L-1的混合标准工作液,于20℃保存;分别移取适量5种同位素内标标准品,用乙腈配制成13C17-AFB1、13C20-OTA、13C15-FB1、13C15-DON和13C18-ZEN浓度分别为5、100、200、500和50 μg∙L -1的混合内标标准工作液,于-20℃保存。
1.2.1.2 样品前处理 谷物:精密称取2 g(精确到0.01 g)试样于50 mL离心管中,加入200 μL同位素内标混合标准工作液,于室温下静置1 h后,加入5 mL水,浸泡5 min后,超声提取40 min,然后加入8 mL含1%(V/V)甲酸的乙腈溶液,涡旋混匀30 s后,超声提取40 min,加入2.0 g无水硫酸镁和0.5 g氯化钠,立即剧烈振摇30 s,超声10 min,8 000 r/min离心5 min。移取4 mL上清液,于40℃下氮气吹干,用1 mL 5 mmol∙L -1醋酸铵水溶液-乙腈(80﹕20,V/V)溶解残渣,涡旋30 s,经0.22 μm滤膜过滤后,上机测定。
果蔬:精密称取2 g(精确到0. 01 g)试样于50 mL离心管中,室温下静置1 h后,加入10 mL含1%(V/V)甲酸的乙腈溶液,涡旋混匀30 s后,超声提取40 min,加入2.0 g无水硫酸镁和0.5 g氯化钠,立即剧烈振摇30 s,超声10 min,以8 000 r/min离心5 min,移取5 mL上清液,于40℃下氮气吹干,用1 mL 5 mmol∙L-1醋酸铵水溶液-乙腈(80﹕20,V/V)溶解残渣,涡旋30 s,经0. 22 μm滤膜过滤后,上机测定。
1.2.1.3 UPLC-MS/MS检测 色谱条件:色谱柱:Agilent Poroshell 120 EC-C18色谱柱(100 mm×3.0 mm,2.7 mm);流动相:流动相A为5 mmol∙L-1乙酸铵溶液,流动相B为甲醇;梯度洗脱程序:0—1 min,5% B;1—5 min,5%—100% B;5—6 min,100% B;6—6.5 min,100%—5% B;6.5—8 min,5% B;流速0.4 mL∙min-1;进样量3 μL;柱温40℃。
质谱条件:采用电喷雾电离源(electron spray ionization,ESI)正负离子模式同时扫描;雾化气、辅助气均为高纯空气,碰撞气为高纯氮气;雾化气:50 Psi;辅助气:50 Psi;雾化温度:500.0℃;喷雾电压:5 500 V;喷雾电压气帘气:35 Psi;碰撞气:8 Psi;通过多反应监测(multiple reaction monitoring,MRM)模式对目标化合物进行定量。
由于大多数毒素均呈现较强的基质效应,采取基质标准曲线进行定量。然而基质加标后,谷物农产品得到的回收率仍不能满足检测需求,因此进一步采用同位素内标进行校正。将5种同位素内标的回收率40种真菌毒素的绝对回收率进行比较,其回收率值相近的作为相应真菌毒素的内标,用以校正该组目标物前处理过程的损失及基质效应,具体分组情况参考文献[13]。而果蔬样品无需内标校正即可得到满意的回收率,因此采取基质标准曲线外标法定量。不同农产品基质中各毒素检测限(limited of detection,LOD)参考文献[13]。
1.3 数据处理和分析
采用Excel和SPSS 22.0对农产品样品中真菌毒素污染水平进行统计分析。样品中真菌毒素含量低于其LOD时,判定为“未检出”;计算毒素含量均值和进行统计分析时,未检出数据用1/2 LOD替代[14]。采用卡方检验对不同地区不同农产品间真菌毒素检出率进行比较,采用单因素方差分析对不同地区不同农产品间真菌毒素污染浓度水平进行比较,采用Spearman相关对农产品中真菌毒素的含量与产地温、湿度的相关性进行分析。2 结果
2.1 长三角地区农产品中真菌毒素的总体污染情况
本研究所调查的5种720份长三角地区农产品样本中,有542份样品存在不同程度的真菌毒素污染,总污染率达到75.3%。如图1所示,共有36种真菌毒素被检出,主要包括黄曲霉毒素(AFB1、AFB2、AFG1、AFG2),赭曲霉毒素(OTA、OTB、OTC),链格孢霉毒素(ALT、Ten、TeA),伏马毒素(FB1、FB2、FB3),DON及其修饰物(15-ADON、3-ADON、D3G)和ZEN等。其中,FB1检出率最高(49.0%);其次为TeA(37.5%)、FB2(35.7%)、Ten(29.6%)、FB3(29.3%)、ZEN(22.6%)、DON(21.4%)、3-ADON(10.7%)、OTA(10.4%),OTB(8.1%)、D3G(7.2%)、OTC(6.4%)、AFB2(5.8%)和15-ADON(5.4%);AFM1、AFM2、OTα和VER 4种真菌毒素检测值均低于各自LOD,判定为未检出;其他毒素均在少量农产品样本(低于5%)中被检出。图1
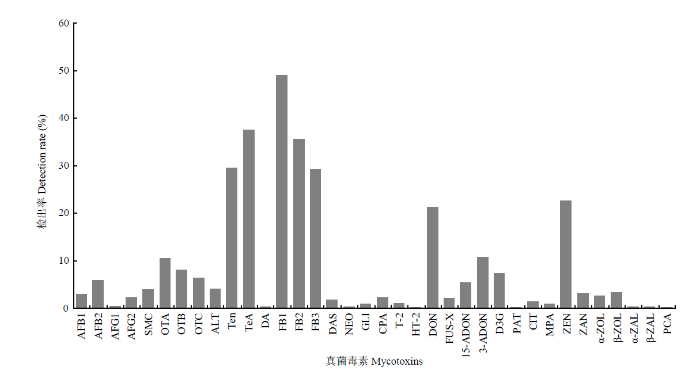 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1农产品样本中真菌毒素的总体污染情况
AFB1:黄曲霉毒素B1 Aflatoxin B1;AFB2:黄曲霉毒素B2 Aflatoxin B2;AFG1:黄曲霉毒素G1 Aflatoxin G1;AFG2:黄曲霉毒素G2 Aflatoxin G2;SMC:杂色曲霉素 Sterigmatocystin;OTA:赭曲霉毒素A Ochratoxin A;OTB:赭曲霉毒素B Ochratoxin B;OTC:赭曲霉毒素C Ochratoxin C;ALT:交链孢霉烯 Altenuene;Ten:腾毒素 Tentoxin;TeA:细交链孢菌酮酸 Tenuazonic acid;DA:腐败菌素A Destruxin A;FB1:伏马毒素B1 Fumonisin B1;FB2:伏马毒素B2 Fumonisin B2;FB3:伏马毒素B3 Fumonisin B3;DAS:蛇形毒素 Diacetoxyscirpenol;NEO:新茄镰孢菌醇 Neosolanio;GLI:胶黏毒素 Gliotoxin;CPA:环匹阿尼酸 Cyclopiazonic Acid;T-2:T-2毒素 T-2 toxin;HT-2:HT-2毒素 HT-2 toxin;DON:脱氧雪腐镰刀菌烯醇 Deoxynivalenol;FUS-X:镰刀菌烯酮 Fusarenon X;15-ADON:15-乙酰基-脱氧雪腐镰刀菌烯醇 15-acetyl-deoxynivalenol;3-ADON:3-乙酰基-脱氧雪腐镰刀菌烯醇 3-acetyl-deoxynivalenol;D3G:脱氧雪腐镰刀菌烯醇-3-葡萄苷 Deoxynivalenol-3-glucoside;PAT:展青霉毒素 Patulin;CIT:桔青霉素 Citrinin;MPA:麦考酚酸 Mycophenolic acid;ZEN:玉米赤霉烯酮 Zearalenone;ZAN:玉米赤霉酮 Zearalanone;α-ZOL:α-玉米赤霉烯醇 α-zearalenol;β-ZOL:β-玉米赤霉烯醇 β-zearalenol;α-ZAL:α-玉米赤霉醇 α-zearalanol;β-ZAL:β-玉米赤霉烯醇 β-zearalanoL;PCA:青霉酸 Penicillic acid。下同 The same as below
Fig. 1Contamination of multiple mycotoxins in agro-products samples
目前,我国仅有少量真菌毒素已制定其限量标准。根据GB 2761-2017《食品安全国家标准 食品中真菌毒素限量》规定,玉米、小麦和稻谷中AFB1限量标准分别为20、5和10 μg∙kg -1;小麦和玉米中DON的限量均为1000 μg∙kg -1;谷物中OTA限量为5 μg∙kg -1;小麦和玉米中ZEN限量为60 μg∙kg -1。本研究所调查的农产品中,有1份玉米样本AFB1超标,浓度为73.35 μg∙kg -1,超标率为0.7%;1份稻谷样本OTA超标,浓度为12.23 μg∙kg -1,超标率为0.7%;6份小麦和2份玉米样本ZEN超标,浓度范围为70.15— 164.99 μg∙kg-1,超标率分别为5.0%和1.3%;无样本DON超标。我国尚未制定伏马毒素的限量标准,参考美国限量标准(FB1+FB2+FB3≤2 000 μg∙kg-1)[15],本次调查有10份玉米超标,超标率为6.7%。在果蔬方面,我国规定了苹果、山楂等水果和制品中PAT的限量标准为50 μg∙kg -1,美国、日本、巴西和印度等国制定了果品中AFB1等黄曲霉毒素的限量标准为5—30 μg∙kg-1[16],而本次调查在番茄和桃中均未检出PAT,仅在2份番茄和1份桃样品中检出黄曲霉毒素,且含量低于5 μg∙kg -1。综上,认为长三角地区农产品中真菌毒素的整体污染水平不高、风险较低,但部分的超标样本也表明可能存在一定的潜在安全风险。
2.2 长三角地区农产品中真菌毒素的混合污染情况
59.5%的样品受到2种或以上真菌毒素污染(表2)。谷物中大部分样本检出2种以上真菌毒素,尤其50.8%的小麦、38.7%的玉米和42.0%的稻谷均受到5种以上真菌毒素的污染。其中,稻谷中被检出混合污染毒素数量最多,有一份样本达到23种,小麦和玉米中最多检测真菌毒素的数量则分别为14和12种。小麦样本中,污染毒素的最少数量也达到2种。相对而言,果蔬中真菌毒素混合污染情况较轻,绝大多数阳性样本受毒素污染数量在1—4种。番茄和桃均只有4.0%的样本受到5种以上毒素污染,最大污染数量分别为14种和7种。Table 2
表2
表2农产品中真菌毒素的混合污染情况
Table 2
| 农产品 Agro-product | 阳性样本中毒素的最大数量 Maximum number of mycotoxins in positive samples | 阳性毒素数量占比 Percent of positive mycotoxins number (%) | |||||
|---|---|---|---|---|---|---|---|
| 0 | 1 | 2—4 | 5—7 | 8—10 | >10 | ||
| 小麦Wheat | 14 | 0.0 | 0.0 | 49.2 | 29.2 | 10.8 | 10.8 |
| 玉米Maize | 12 | 20.7 | 11.3 | 29.3 | 20.7 | 16.0 | 2.0 |
| 稻谷Rice | 23 | 1.3 | 4.7 | 52.0 | 36.0 | 4.0 | 2.0 |
| 番茄Tomato | 14 | 60.7 | 22.7 | 12.7 | 0.0 | 3.3 | 0.7 |
| 桃Peach | 7 | 42.7 | 30.7 | 22.7 | 4.0 | 0.0 | 0.0 |
| 总Total | 23 | 26.1 | 14.4 | 32.5 | 17.5 | 6.7 | 2.8 |
新窗口打开|下载CSV
2.3 不同农产品中真菌毒素的污染水平
小麦、玉米、稻谷、番茄和桃5种农产品中真菌毒素的总检出率分别为100%、79.3%、98.7%、39.3%和57.3%,检出毒素数量分别为23、27、34、20和16种,具体各毒素的检出率和含量见表3。小麦中,链格孢毒素(Ten和TeA)和DON为污染最严重的真菌毒素,其次为伏马毒素(FB1、FB2和FB3)、DON乙酰化修饰物3-ADON、隐蔽型毒素D3G和ZEN及其衍生物(ZAN、α-ZOL和β-ZOL)。玉米中,伏马毒素(FB1、FB2和FB3)污染较普遍,ZEN、DON及其乙酰化修饰物(15-ADON和3-ADON)、TeA和黄曲霉毒素(AFB1、AFB2)也有较多检出。稻谷中,污染毒素则主要为黄曲霉毒素AFG1、链格孢霉毒素(Ten和TeA)、伏马毒素(FB1、FB2和FB3)、赭曲霉毒素(OTA、OTB和OTC)、DON和ZEN。与谷物相比,果蔬中真菌毒素的整体污染水平较低,番茄和桃中检出率较高的毒素均为伏马毒素(FB1、FB2和FB3)、赭曲霉毒素(OTA、OTB 和OTC)和链格孢毒素(ALT、Ten和TeA)。Table 3
表3
表3不同农产品样品中真菌毒素的污染水平
Table 3
| 真菌毒素 Mycotoxin | 小麦 Wheat | 玉米 Maize | 稻谷 Rice | 番茄 Tomato | 桃 Peach | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 检出率Detection rate (%) | 均值 Mean (μg∙kg-1) | 检出率 Detection rate (%) | 均值 Mean (μg∙kg-1) | 检出率 Detection rate (%) | 均值 Mean (μg∙kg-1) | 检出率 Detection rate (%) | 均值 Mean (μg∙kg-1) | 检出率 Detection rate (%) | 均值 Mean (μg∙kg-1) | |
| AFB1** | 1.70 | 0.12 | 9.30 | 1.18 | 2.00 | 0.19 | - | - | 0.70 | 0.10 |
| AFB2** | 6.70 | 0.17 | 14.70 | 0.55 | 6.70 | 0.17 | 1.30 | 0.10 | - | - |
| AFG1 | - | - | 1.30 | 0.12 | 0.70 | 0.16 | - | - | - | - |
| AFG2** | - | - | - | - | 10.70 | 0.23 | - | - | - | - |
| SMC** | 4.20 | 0.11 | 2.00 | 0.21 | 10.70 | 0.23 | 2.00 | 0.21 | 1.30 | 0.35 |
| OTA | 6.70 | 0.31 | 7.30 | 0.52 | 15.30 | 0.29 | 10.70 | 0.30 | 12.00 | 0.25 |
| OTB* | 5.00 | 0.11 | 5.30 | 0.28 | 14.00 | 0.32 | 6.70 | 0.15 | 8.70 | 0.15 |
| OTC | 3.30 | 0.11 | 4.70 | 0.13 | 6.00 | 0.19 | 9.30 | 0.29 | 8.00 | 0.27 |
| ALT | - | - | 5.30 | 0.46 | 5.30 | 0.33 | 3.30 | 0.31 | 6.00 | 0.24 |
| Ten** | 100.00 | 20.50 | 3.30 | 0.11 | 50.00 | 0.67 | 2.70 | 0.11 | 2.70 | 0.13 |
| TeA** | 75.00 | 63.33 | 27.30 | 3.62 | 79.30 | 27.61 | 5.30 | 0.49 | 8.00 | 0.37 |
| DA | 0.80 | 0.10 | - | - | - | - | 0.70 | 0.13 | - | - |
| FB1** | 55.00 | 22.91 | 66.00 | 422.36 | 83.30 | 19.93 | 13.30 | 4.49 | 19.30 | 1.95 |
| FB2** | 41.70 | 4.68 | 65.30 | 84.05 | 36.70 | 6.00 | 10.00 | 1.60 | 15.30 | 1.23 |
| FB3** | 29.20 | 5.12 | 59.30 | 40.46 | 30.70 | 2.64 | 8.00 | 1.11 | 11.30 | 0.77 |
| DAS** | - | - | 2.00 | 0.21 | 6.00 | 0.21 | - | - | - | - |
| NEO | - | - | - | - | 1.30 | 0.17 | - | - | - | - |
| GLI* | - | - | 3.30 | 12.13 | 0.70 | 1.06 | - | - | 0.70 | 1.14 |
| CPA** | 7.50 | 1.40 | 4.70 | 1.24 | - | - | - | - | - | - |
| T-2 | 0.80 | 0.17 | 0.70 | 0.23 | 2.00 | 0.86 | 0.70 | 0.11 | 1.30 | 0.11 |
| HT-2 | - | - | - | - | 0.70 | 1.22 | - | - | - | - |
| DON** | 81.70 | 104.74 | 21.30 | 17.77 | 22.00 | 31.24 | - | - | - | - |
| FUS-X** | 4.20 | 2.44 | 0.70 | 2.18 | 12.00 | 6.67 | - | - | - | - |
| 15-ADON** | - | - | 24.00 | 9.35 | 2.00 | 0.33 | - | - | - | - |
| 3-ADON** | 39.20 | 3.76 | 16.00 | 2.21 | 4.00 | 0.83 | - | - | - | - |
| D3G** | 38.30 | 5.32 | 0.70 | 2.52 | 2.70 | 1.27 | - | - | - | - |
| PAT | - | - | - | - | 0.70 | 2.48 | - | - | - | - |
| CIT | 0.80 | 0.14 | 0.70 | 0.33 | 2.70 | 0.31 | 1.30 | 0.10 | 1.30 | 0.20 |
| MPA* | - | - | 0.70 | 0.26 | 3.30 | 5.61 | - | - | 0.70 | 0.32 |
| ZEN** | 28.30 | 8.93 | 42.70 | 2.90 | 29.30 | 3.06 | 4.70 | 0.39 | 9.30 | 0.24 |
| ZAN** | 10.80 | 0.14 | 2.00 | 0.21 | 2.70 | 0.24 | 1.30 | 0.13 | - | - |
| α-ZOL** | 14.20 | 0.73 | - | - | 0.70 | 0.43 | 0.70 | 0.21 | - | - |
| β-ZOL** | 15.00 | 1.86 | 0.70 | 1.01 | 2.70 | 0.54 | 0.70 | 0.26 | - | - |
| α-ZAL | - | - | - | - | 0.70 | 0.23 | 0.70 | 0.11 | - | - |
| β-ZAL | - | - | - | - | 0.70 | 0.28 | 0.70 | 0.16 | - | - |
| PCA | - | - | - | - | 0.70 | 0.55 | - | - | - | - |
新窗口打开|下载CSV
采用卡方检验对不同农产品中真菌毒素的检出率进行比较,发现其污染情况存在一定差异。黄曲霉毒素中,AFB1和AFB2在玉米中检出率最高,而AFG2仅在稻谷中检出。赭曲霉毒素中,仅OTB在不同农产品中的检出率存在显著差异(P=0.031)。链格孢霉毒素中,Ten在小麦中污染比较严重,检出率和平均浓度均极显著高于其他农产品(P<0.01);而TeA在小麦和稻谷中的污染比较严重。伏马毒素中,FB1检出率最高的农产品为稻谷,最低为番茄,而其污染浓度最高的农产品则为玉米。DON仅在谷物中有检出,小麦中DON的污染水平又极显著高于玉米和稻谷(P<0.01)。DON乙酰化修饰物15-ADON和3-ADON也只在谷物中检出,且分别在玉米和小麦中检出最高。隐蔽型毒素D3G污染情况与原型DON一致,在小麦中污染水平最高;进一步对DON和D3G的含量进行相关性分析,结果显示两者间存在显著正相关(r=0.311,P<0.01)。ZEN在谷物中的污染水平明显高于果蔬,检出率最高农产品为玉米,浓度最高则为小麦;ZEN衍生物ZAN、α-ZOL和β-ZOL也主要在小麦中被检出。除上述主要污染毒素外,SMC、DAS、GLI、CPA、FUS-X和MPA等毒素虽然仅在部分样品中发现,但其检出率也表现出一定的统计学差异(P<0.05)。
2.4 不同地区农产品中真菌毒素的污染水平比较
分别利用卡方检验和单因素方差分析将不同地区各类农产品中普遍污染的主要真菌毒素的检出率和浓度水平进行比较分析(图2、3)。图2
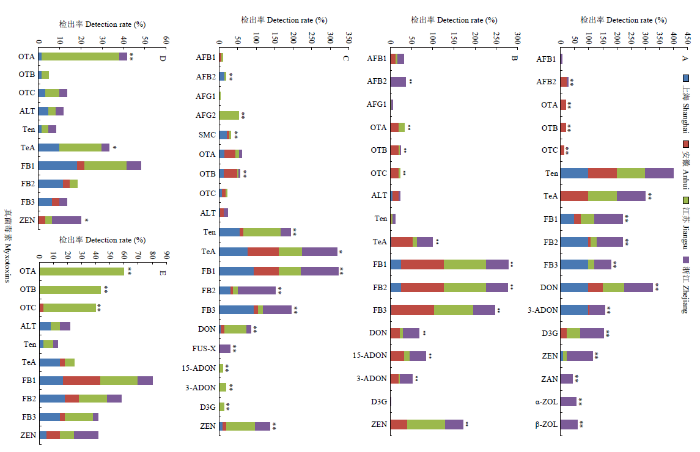 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同地区农产品中主要真菌毒素的检出率
A:小麦;B:玉米;C:稻谷;D:番茄;E:桃。*和**分别代表显著性水平为P<0.05和P<0.01。下同
Fig. 2The detection rate of main mycotoxins in agro-products from different areas
A: wheat; B: maize; C: rice; D: tomato; E: peach. * and ** indicate the level of significance at P<0.05 andP<0.01, respectively. The same as below
图3
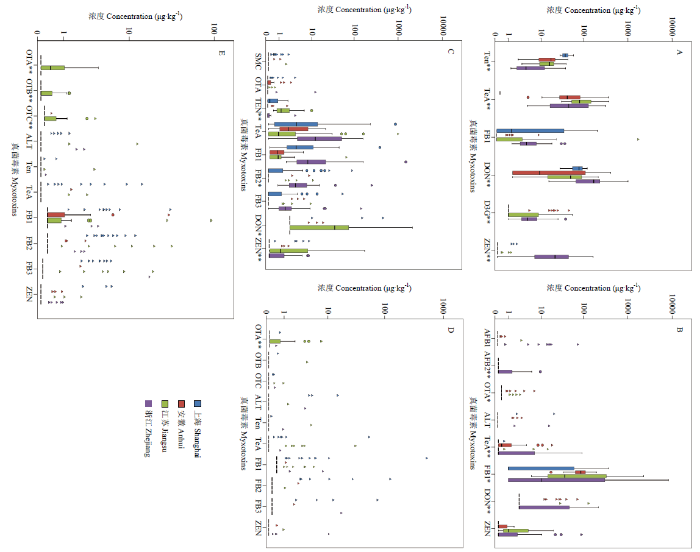 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同地区农产品中主要真菌毒素的污染浓度
A:小麦;B:玉米;C:稻谷;D:番茄;E:桃
Fig. 3The concentration of main mycotoxins in agro-products from different areas
A: wheat; B: maize; C: rice; D: tomato; E: peach
小麦中,除AFB1和Ten外,各真菌毒素的检出率均存在显著的地区差异(图2-A),主要污染毒素的浓度水平也有所差别(图3-A)。黄曲霉毒素中,AFB1仅在2份浙江省样本中检出,AFB2则主要污染安徽省样本。赭曲霉毒素(OTA、OTB和OTC)仅在安徽省样本中检出。链格孢霉毒素中,Ten在不同地区间的浓度水平存在极显著差异(P<0.01),其中上海样本浓度最高,为39.1 μg∙kg-1;TeA在除上海市外的3个地区均100.0%检出,但地区间浓度水平无统计学差异(P=0.202)。伏马毒素中,FB1在浙江省样本中检出率最高(100.0%),而浓度水平最高则为江苏省样本(59.0 μg∙kg -1),但地区间浓度差异无统计学意义(P=0.474);FB2和FB3情况类似。DON和ZEN均在浙江地区样本中污染严重,平均浓度分别达到204.8和38.90 μg∙kg -1,极显著高于其他地区样本(P<0.01);DON修饰物(3-ADON和D3G)和ZEN衍生物(ZAN、α-ZOL和β-ZOL)也表现出一定的地区差异。
4个地区玉米样本中真菌毒素污染状况见图2-B和图3-B,大部分毒素呈现出明显的地区差异。黄曲霉毒素中,AFB1在除上海外的3个地区均有一定检出,AFB2仅在浙江样本中检出,AFG1则在江苏和浙江两地区少量样本中检出。赭曲霉毒素(OTA、OTB和OTC)主要在安徽和江苏两地区样本中检出,但仅有OTA的浓度水平差异具有统计学意义(P=0.014)。链格孢霉毒素中,TeA在浙江地区样本中污染最为严重,平均浓度达到7.49 μg∙kg -1,极显著高于其他地区(P<0.01)。伏马毒素中,FB1在安徽和江苏两地区样本中的检出率均为100.0%,平均浓度分别为833.90和289.76 μg∙kg -1,显著高于其他两地区(P<0.05);FB2和FB3类似。DON则为浙江地区污染最严重,其检出率(38.3%)和均值浓度(34.76 μg∙kg -1)均极显著高于其他地区(P<0.01)。ZEN在安徽、江苏和浙江样本均有检出,但其污染水平无地区间差异(P=0.110)。
图2-C和图3-C是不同地区稻谷样本中真菌毒素污染状况对比。黄曲霉毒素中,不同地区样本中AFB2和AFG2的检出率均存在极显著差异(P<0.01),但浓度水平均无统计学差异(P>0.05)。同样,SMC主要在上海地区样本中检出,但其浓度水平未显著高于其他地区(P=0.121)。赭曲霉毒素中,OTB在不同地区的检出率存在极显著差异(P<0.01),但3种毒素浓度水平均未表现出地区间差异(P>0.05)。链格孢霉毒素中,Ten在江苏省样本中污染最严重,检出率(100.0%)和浓度水平(1.96 μg∙kg-1)均极显著高于其他地区(P<0.01)。伏马毒素中,FB1和FB3的浓度水平未表现明显差异,而FB2在浙江地区样本中的污染浓度(21.75 μg∙kg -1)则极显著高于其他3个地区(P<0.01)。DON和ZEN污染最严重的均为江苏地区样本,检出率和平均浓度均极显著高于其他地区(P<0.01);DON乙酰化修饰物5-ADON和3-ADON、隐蔽型毒素D3G主要污染江苏地区样本,ZEN衍生物ZAN、α-ZOL、β-ZOL、α-ZAL和β-ZAL也只在江苏地区个别样本中检出。
由于果蔬(番茄和桃)中真菌毒素的污染情况相对较轻,虽然赭曲霉毒素、链格孢霉毒素、伏马毒素和ZEN在多个地区样本中有一定检出,但大多数毒素未表现出明显的地区差异(图2-D、E,图3-D、E)。番茄中,OTA在36.7%的江苏地区样本中检出,平均浓度为1.06 μg∙kg -1,极显著高于其他地区(P<0.01);TeA和ZEN虽然各地区检出率存在不同,但两毒素的浓度水平均未表现出明显差异(P>0.05)。桃中,赭曲霉毒素在江苏地区污染相对严重,OTA、OTB和OTC的检出率和平均浓度均极显著高于其他地区(P<0.01);其他毒素在4个地区样本中的污染水平则无统计学差异。
2.5 不同农产品中真菌毒素的污染水平与产地温、湿度的相关性
气候条件是影响农产品中真菌毒素产生的关键因素,采用Spearman相关对农产品中真菌毒素的含量与其产地2019年平均温、湿度的相关性进行分析(表4)。结果显示小麦中Ten含量与温度,DON含量与温度和湿度,ZEN含量与湿度呈正相关;玉米中TeA、FB1和DON的含量均与温度和湿度正相关;稻谷中FB1含量与温度正相关,而ZEN的含量则与温度负相关。但果蔬中所有毒素的含量与温、湿度均无相关性。Table 4
表4
表4不同农产品中主要真菌毒素的含量与产地温、湿度的相关性
Table 4
| 真菌毒素 Mycotoxin | 小麦 Wheat | 玉米 Maize | 稻谷 Rice | 番茄 Tomato | 桃 Peach | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 温度 Temperature | 湿度Humidity | 温度 Temperature | 湿度Humidity | 温度 Temperature | 湿度Humidity | 温度 Temperature | 湿度Humidity | 温度 Temperature | 湿度Humidity | |
| OTA | -0.039 | -0.138 | -0.021 | 0.018 | 0.017 | 0.030 | -0.147 | -0.120 | -0.127 | -0.078 |
| Ten | 0.354** | 0.117 | 0.128 | 0.083 | -0.107 | -0.144 | -0.097 | 0.011 | 0.040 | -0.025 |
| TeA | -0.172 | -0.174 | 0.203* | 0.165* | 0.007 | 0.051 | 0.062 | 0.034 | 0.043 | 0.086 |
| FB1 | -0.068 | 0.073 | 0.176* | 0.173* | 0.198* | 0.142 | 0.028 | 0.047 | -0.064 | -0.089 |
| DON | 0.227* | 0.269** | 0.232** | 0.214** | -0.132 | -0.101 | / | / | / | / |
| ZEN | 0.140 | 0.389** | 0.126 | 0.109 | -0.165* | -0.111 | 0.068 | 0.007 | 0.093 | 0.069 |
新窗口打开|下载CSV
3 讨论
农产品中真菌毒素的污染水平受多种因素的影响,除最主要的气候条件和地理环境外,宿主的品种及其对产毒真菌侵染的抗性,产毒真菌种群的类型和分布,农作物收获、加工和储运的方法及条件等均可能影响真菌的生长和毒素的产生[17,18]。本研究发现长三角地区的不同农产品(小麦、玉米、稻谷、番茄和桃)均易受真菌毒素污染,36种真菌毒素在75.3%的农产品中检出,呈“多种类、共分布”的特点,但与既往调查结果相比,大部分真菌毒素的污染水平相对较低。如本次调查发现玉米样品中黄曲霉毒素和伏马毒素污染比较普遍,其中AFB1的污染水平(9.30%,1.18 μg∙kg -1)高于陕西省(5%,0.02 μg∙kg -1)[19]、低于山东省(18.08%,7.62 μg∙kg -1)[20]和河北省(23%,11.8 μg∙kg -1)[21]的筛查结果;FB1、FB2和FB3的污染水平(59.3%—66.0%,40.46—422.36 μg∙kg-1)分别高于陕西省(70.0%—80.5%,22.1—102 μg∙kg-1)[19]和烟台市(19.78%—32.97%,2.2—16.97 μg∙kg-1)[22],低于山东省(83.85%—92.5%,197.71—1 798.69 μg∙kg-1)[20],与甘肃、宁夏、内蒙古和山东四省的平均数据(29.6% —36.5%,181—522 μg∙kg -1)相似[23]。此外,谷物中OTA的污染水平(6.7%—15.3%,0.29—0.52 μg∙kg-1)低于上海市谷物及制品(21%,0.94 μg∙kg -1)[24]、济南市玉米样品(38%,1.67 μg∙kg -1)[25]和南方及东北6省稻谷样品(4.87%,0.85 μg∙kg -1)[26]中的结果;两种镰刀菌毒素DON和ZEN在小麦和玉米中的污染水平(21.3%—81.7%,2.90—104.74 μg∙kg-1)也低于多数文献报道的数据[10,11,19,27-31]。值得一提的是,本次调查发现在稻谷中DON的检出率为22.0%,均值为31.24 μg∙kg -1,而其他研究发现大米中DON污染水平较低[32],可能是由于脱壳、碾米等加工过程中稻谷表层的部分毒素已被除去[12]。除传统真菌毒素外,多个新型真菌毒素和隐蔽型毒素也在本研究中被检出,其中污染最为普遍的为链格孢霉毒素和隐蔽型毒素D3G。链格孢霉毒素是农作物在生长、收获、运输和贮藏过程中被链格孢菌(Alternaria alternata)侵染导致霉变所产生的一类新型真菌毒素,具有急性毒性、亚急性毒性、致畸致癌性等[12]。本研究调查了3种链格孢霉毒素的污染情况,ALT在除小麦外的农产品中有少量检出;TeA和Ten在5种农产品中均有检出,尤其在小麦中污染最严重。小麦中TeA的检出率为100.0%,均值为20.5 μg∙kg-1,污染水平类似于2016—2017年河南省小麦粉(91.2%,0.50—134.23 μg∙kg-1)[33],低于2015年安徽省小麦样本(100%,289 μg∙kg -1)[34];而Ten的检出率为75.0%,均值为63.33 μg∙kg -1,高于河南(45.6%,0.05—17.42 μg∙kg-1)和安徽(77%,43.8 μg∙kg -1)样本中的水平。此外,链格孢霉毒素在果蔬中污染较为普遍,而本研究中番茄和桃中ALT、TeA和Ten的检出率和平均浓度均低于相关文献报道[35,36]。
隐蔽型真菌毒素是真菌毒素在植物体内经修饰后的产物,往往与原型毒素共存于农产品中,其进入人和动物体内后可被代谢水解,释放出原型毒素从而威胁人畜健康[37]。最常见的隐蔽型毒素为D3G,本研究发现其污染情况类似于原型毒素DON,主要在小麦中存在,检出率为38.3%,平均浓度为5.32 μg∙kg -1,低于李凤琴等[38]、马皎洁等[27]、朱群英等[39]和DONG等[40]的研究结果;进一步研究也发现D3G与DON的污染水平存在显著正相关,与多个文献报道结果相似[40,41,42]。目前,美国已将D3G与DON的比例(D3G/DON)作为小麦抗赤霉病毒素的重要评估指标[43];欧洲食品安全局(European Food Safety Authority,EFSA)下的食物链污染物小组(CONTAM Panel)也提出在进行风险评估时,隐蔽型毒素应和原型毒素同样对待[44]。本研究的结果进一步验证了隐蔽型毒素D3G在农产品中的污染,其安全风险不容忽视。
农产品中多种真菌毒素的混合污染情况已成为全世界关注和重视的问题。程天笑等[29]、胡佳薇等[19]、马皎洁等[27]、宫春波等[22]在我国不同地区的小麦、玉米等农产品中均同时检出了黄曲霉毒素、伏马毒素、DON和ZEN等多种真菌毒素;TEBELE等[45]对南非的玉米、玉米糊、高粱、小麦等农产品进行了调查,并检出12种真菌毒素;KAMALA等[46]从坦桑尼亚的玉米样本中检出11种真菌毒素,其中87%的样品中含有一种以上真菌毒素;JUAN等[47]也发现超过1/3的突尼斯小麦样品存在3种及以上真菌毒素,最多一份样本中存在7种真菌毒素。在本次调查研究中,超过1/2的农产品受到多种真菌毒素污染,1/3的谷物样品检出5种以上真菌毒素,单样本最大检出毒素量达到23种,说明长三角地区农产品中混合污染情况比较严重。多种真菌毒素混合污染下,一些毒素的毒性往往增强或形成累积效应[48],因此,进行多种真菌毒素的累积风险评估,并在此基础上实施监测与防控变得愈发重要[49]。
本次调查研究发现真菌毒素的污染水平表现出明显的农产品类型差异,如黄曲霉毒素(AFB1和AFB2)和伏马毒素(FB1、FB2和FB3)主要污染玉米,而链格孢霉毒素(Ten和TeA)、DON和ZEN等在小麦中的污染水平最高,体现了不同农作物中易感染毒素各不相同。另一方面,本研究中不同地区的多种真菌毒素的污染水平也存在显著差异,如浙江省小麦样本中,DON和ZEN两种镰刀菌毒素的污染水平均显著高于其他地区。据浙江省气候公报,2019年全省平均气温为17.1℃,年平均降雨量为1 958.5 mm,比常年同期偏多3成,降水总量创近50年新高,并且均高于上海(16.0℃,1 576.8 mm)、安徽(16.6℃,944 mm)和江苏(16.1℃,1 045.4 mm)。进一步的相关性分析也表明小麦中DON和ZEN的含量与样品产地的平均温度和/或湿度正相关。因此,高温、多雨的气候条件有利于禾谷镰刀菌等产毒真菌的生长及毒素的产生[17],可能是造成该地区小麦中镰刀菌毒素污染水平相对偏高的主要原因。考虑到本次研究中采用的温、湿度为产地全年平均数值,存在较大误差,在后续工作中需对样品的种植、运输和存储等环境条件进行连续跟踪观测,从而得到更准确和合理的结果。另外,具体采样时间的差异和调查样本代表性的影响也必须考虑。尽管本次调查收集了720份农产品,但分布到各地区的样本量仍然偏少,不能完全代表各地实际的污染情况。因此,在今后的研究中需继续加强大样本、大范围的长期监测,进一步了解长三角地区农产品中真菌毒素的污染状况。
4 结论
我国长三角地区市场小麦、玉米、稻谷、番茄和桃等农产品受多种真菌毒素的污染,并呈现出一定的样品种类和地区等差异。农产品中主要检出毒素主要包括黄曲霉毒素、赭曲霉毒素、链格孢霉毒素、伏马毒素、DON和ZEN等,其污染水平总体相对较低,但单一样品受到多种毒素混合污染的情况比较严重。在后续工作中,应继续开展长三角地区不同真菌毒素,特别是新型毒素、隐蔽型毒素和毒素代谢产物的污染监测,全面反映农产品中真菌毒素实际污染情况。针对农产品中多种真菌毒素复合污染规律不清、毒性机制不明的不利局面,进一步加强不同真菌毒素的联合毒性研究,加快构建混合污染累积暴露评估模型,对居民日常暴露真菌毒素的健康风险作出更准确和科学的判断,为不同真菌毒素复合污染限量标准的制(修)订提供科学依据,防范农产品质量安全风险,保障农产品质量安全。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1016/j.fct.2013.07.047URL [本文引用: 1]
DOI:10.1016/j.envpol.2019.02.091URL [本文引用: 1]
DOI:10.1021/cr050001fURL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1080/19440049.2014.996787URL [本文引用: 1]
DOI:10.3109/15569543.2013.871563URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.foodcont.2013.06.042URL [本文引用: 1]
DOI:10.3390/toxins12030200URL [本文引用: 2]
DOI:10.1016/j.fct.2014.10.018URL [本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 4]
[本文引用: 2]
[本文引用: 2]
DOI:10.1007/s13593-016-0374-xURL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
DOI:10.1016/j.foodcont.2013.01.031URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.foodcont.2014.09.029URL [本文引用: 1]
[本文引用: 3]
[本文引用: 3]
DOI:10.1016/j.foodchem.2014.02.058URL
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/crf3.2017.16.issue-5URL
[本文引用: 1]
DOI:10.1111/jfds.2017.82.issue-3URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3390/toxins8110308URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3390/toxins9070228URL [本文引用: 1]
DOI:10.1080/10408398.2019.1578944URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3920/WMJ2016.2158URL [本文引用: 2]
DOI:10.1016/j.foodcont.2012.01.056URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.2903/j.efsa.2014.3802URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.foodcont.2015.02.002URL [本文引用: 1]
DOI:10.1016/j.fct.2017.02.037URL [本文引用: 1]
DOI:10.3920/WMJ2016.x001URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
