 ,, 刘敏, 潘婷敏, 龚国淑
,, 刘敏, 潘婷敏, 龚国淑 ,四川农业大学农学院,成都 611130
,四川农业大学农学院,成都 611130Mating Type and Fertility of Cochliobolus heterostrophus Causing Southern Corn Leaf Blight in Sichuan Province
SUN XiaoFang ,, LIU Min, PAN TingMin, GONG GuoShu
,, LIU Min, PAN TingMin, GONG GuoShu ,College of Agronomy, Sichuan Agricultural University, Chengdu 611130
,College of Agronomy, Sichuan Agricultural University, Chengdu 611130通讯作者:
责任编辑: 岳梅
收稿日期:2020-10-11接受日期:2020-11-24网络出版日期:2021-06-16
| 基金资助: |
Received:2020-10-11Accepted:2020-11-24Online:2021-06-16
作者简介 About authors
孙小芳,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1199KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
孙小芳, 刘敏, 潘婷敏, 龚国淑. 四川玉米小斑病菌交配型组成与育性分析[J]. 中国农业科学, 2021, 54(12): 2547-2558 doi:10.3864/j.issn.0578-1752.2021.12.006
SUN XiaoFang, LIU Min, PAN TingMin, GONG GuoShu.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】玉米(Zea mays)是最重要的农作物之一,广泛用于食品、饲料、工业和能源等方面,然而病害的发生给玉米优质高产带来了严重威胁。由Cochliobolus heterostrophus(无性型:Bipolaris maydis)引起的玉米小斑病(southern corn leaf blight)是玉米生产上不容忽视的重要病害,在世界各玉米产区均有发生[1,2,3]。目前小斑病是我国黄淮海夏玉米区的主要病害,在东北和西南地区也普遍发生,近年来在福建等南方丘陵区的鲜食玉米上发生严重,一般年份减产5%—15%,重发年份可以引起20%—30%的减产[4,5,6]。长期以来,对该病的防治主要以培育抗病品种为主,辅以化学药剂,但由于病菌群体内生理分化明显、变异频繁,导致品种抗性丧失,防治难度大[6,7,8,9,10]。有性生殖是导致病菌变异的重要途径之一,影响病原菌的群体结构,在遗传变异中起着重要作用。明确小斑病菌自然群体的交配型和空间分布情况,以及菌株的有性生殖能力(育性)是进行小斑病菌有性生殖研究的前提条件。因此,开展小斑病菌交配型与育性分析,探索小斑病菌有性世代在自然界存在的可能性,对阐明有性生殖在小斑病菌遗传变异中的作用具有重要意义。【前人研究进展】真菌的有性生殖由交配型位点(mating-type locus,MAT)控制,如酿酒酵母(Saccharomyces cerevisiae)及构巢曲霉(Aspergillus nidulans)的互补交配型分别以MATα和MAT a表示,粗糙脉孢霉(Neurospora crassa)的交配型分别被命名为MAT a和MAT A,其他子囊菌的交配型一般以MAT1-1和MAT1-2表示[11,12,13]。DRECHSLER将自然发病的玉米叶片保湿培养,首次获得了玉米小斑病菌的有性世代[14],TURGEON等首次克隆得到玉米小斑病菌的交配型基因MAT1-1和MAT1-2,分别编码α-box DNA结合域和HMG-box DNA结合域[15]。交配型种类及其分布影响真菌的交配策略,交配型比例的失衡会造成有性生殖发生的稀缺。引起马铃薯晚疫病的致病疫霉(Phytophythora infestans)为异宗配合卵菌,在瑞士发现A2交配型以前,除墨西哥以外的其他国家只存在A1交配型,不能进行有性生殖[16];20世纪80年代以后在原本仅存在A1交配型的地区,由于A2交配型菌株的引入,使得致病疫霉群体的有性生殖成为可能,之后有性生殖相继被报道,成为该病原生活史的重要部分[17]。稻瘟病菌(Magnaporthe grisea)群体的交配型分布和育性水平存在显著差异,一些地区只有一种交配型,即使环境有利,也不存在有性重组的机会,有性重组可能不是这些地区稻瘟病菌群体变异的主要来源,但在印度喜马拉雅地区到中国云南南部山区发现稻瘟病菌群体两种交配型菌株均有分布,且存在较大比例的雌性可育菌株,可能存在有性生殖[18,19,20,21]。玉米小斑病菌同稻瘟病菌一样,属于典型的无性繁殖真菌,有性世代在自然界鲜有发现,但在人工培养中能够大量诱导产生,即使是室内长期保存的无性产孢能力减弱的菌株依然保存有性生殖的能力。玉米小斑病菌是异宗配合子囊菌,只有在MAT1-1和MAT1-2两种交配型的菌株同时存在时才有可能进行有性生殖,因此首先要明确菌株群体的交配型组成。通过设计交配型特异性引物,运用PCR方法检测子囊菌的交配型已在多种重要植物病原菌的有性生殖研究中应用,如玉米大斑病菌(Setosphaeria turcica)[22,23]、新月弯孢(Cochliobolus lunatus)[24]、灰霉病菌(Botryotinia fuckeliana)[25,26]、小麦白粉病菌(Blumeria graminis f. sp. tritici)[27]等。目前玉米小斑病菌自然种群的交配型组成及空间分布情况鲜有报道,代玉立等建立了小斑病菌交配型的多重PCR检测方法,并对福建省102个玉米小斑病菌的交配型进行检测,MAT1-1和MAT1-2菌株分别占比36.3%和63.7%,存在交配型分布不均衡的现象[10,23]。【本研究切入点】玉米小斑病是四川省玉米常发病害之一,近年来,在玉米叶斑类病害中,小斑病的发生普遍率和严重度均为最高[28]。四川生态环境复杂多样,特别是在现有的小麦、玉米轮作系统下推行秸秆还田和免耕等模式,田间复杂的环境则更可能发生着有性生殖。目前,四川玉米小斑病菌自然群体的交配型组成及空间分布情况未见报道,菌株的育性结构尚不明确,育性在时空间是否存在差异仍有待探究。【拟解决的关键问题】于2013—2018年大量收集玉米小斑病菌田间菌株,应用多重PCR技术对小斑病菌的交配型进行检测,并通过与标准菌株对峙杂交的方法对小斑病菌群体的育性进行分析,以期明确小斑病菌自然群体的交配型和空间分布情况,以及育性水平,为探明小斑病菌有性世代在自然界存在的可能性提供依据。1 材料与方法
1.1 材料
供试菌株:544个待测玉米小斑病菌菌株为2013—2018年从四川、云南等18个市(州)103个采集地采集,经常规组织分离后单孢纯化所得,每个菌株均来自不同的单病斑样本,菌株由四川农业大学植物病理实验室保存。为了减少继代培养对菌株育性测定结果的影响,本研究使用的所有菌株均是从斜面保存的一代菌株中活化而来。根据地理来源将544个菌株划分为6个类群,四川中部地区227个菌株,分别来自成都、眉山;四川东部地区58个菌株,分别来自内江、遂宁、南充、广安、巴中、达州;四川西部地区13个菌株,分别来自雅安、甘孜;四川南部地区66个菌株,分别来自乐山、自贡、宜宾、泸州;四川北部地区163个菌株,分别来自德阳、绵阳、广元;另有来自云南南部西双版纳州的17个菌株。马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂粉10 g,蒸馏水1 L;马铃薯葡萄糖(potato dextrose,PD)培养液:马铃薯200 g,葡萄糖20 g,蒸馏水1 L;Sach’s培养基:KNO3 1.0 g,NaCl 0.5 g,MgSO4·7H2O 0.5 g,Ca(NO3)2·4H2O 0.5 g,CaCO3 0.5 g,Ca3(PO4)2 0.5 g,FeCl3 0.06 g,琼脂粉15 g,蒸馏水1 L,以玉米叶片为诱导基物,调节pH至6。
主要试剂:Ezup柱式真菌基因组DNA抽提试剂盒,生工生物工程(上海)股份有限公司;2×Taq PCR Master Mix、DNA Marker DL 2000,南京诺唯赞生物科技有限公司;PCR扩增引物由生工生物工程(上海)股份有限公司合成。
主要仪器:NanoDropTM 2000超微量分光光度计,美国Thermo Fisher Scientific公司;Bio-Rad PowerPac 3000凝胶电泳仪,Bio-Rad Universal Hood II凝胶成像仪,美国伯乐公司;Zeiss Axio Imager Z2荧光显微镜,德国卡尔蔡司公司。
1.2 供试菌株DNA的提取
菌株接种到PDA培养基上,25℃黑暗培养5—7 d后,用直径5 mm的打孔器在菌落边缘打孔,取3—5个菌饼接种到盛有150 mL PD培养液的锥形瓶中,置于26℃下120 r/min振荡培养4 d,用无菌纱布过滤菌丝体,再用无菌滤纸将菌丝体的水分吸干,于液氮中速冻。参照Ezup柱式真菌基因组DNA抽提试剂盒的方法从冻干菌丝中提取菌株基因组DNA。1.3 交配型的分子鉴定
以NCBI数据库中玉米小斑病菌的交配型基因MAT1-1(Accession number:AF029913)和MAT1-2(Accession number:AF027687)序列为参照,使用软件Primer Premier 5.0设计特异性多重PCR引物:ChMAT1(5′-GCACCTGAGCGATTTCTT-3′)为上游引物,ChMAT1-1(5′-CATCTTCATCGGCTCCAA-3′)为MAT1-1下游引物,ChMAT1-2(5′-GGCGGATTG ACTCAGTGTTG-3′)为MAT1-2下游引物。PCR反应体系为15 μL,菌株DNA 1 μL,体系内3个引物各0.5 μL,2×Taq PCR Master Mix 7.5 μL,ddH2O 5 μL。扩增程序:95℃预变性3 min,94℃变性40 s,53℃复性60 s,72℃延伸1.5 min,30个循环,72℃延伸7 min。同时设不加模板DNA的反应体系为阴性对照。扩增产物经1.2%琼脂糖凝胶电泳检测,根据电泳条带大小来区分菌株的交配型。1.4 育性分析
根据交配型PCR检测结果,从小斑病菌群体中随机选取不同地理来源的MAT1-1和MAT1-2菌株各10株,进行相反交配型菌株的两两配对杂交,筛选出一对高配合力的菌株作为标准菌株,再以标准菌株与田间待测菌株杂交,进行育性分析。有性杂交以Sach’s培养基为基础培养基,以玉米叶片为诱导基物。在9 cm的培养皿中加入15 mL Sach’s培养基,在培养基凝固前将1张4 cm×2 cm的灭菌成熟玉米叶片放置于皿中央培养基上。待培养基凝固后将两个相反交配型的菌株分别接种在距叶缘0.5 cm的两侧,24℃下黑暗培养25—30 d。当标准菌株间对峙杂交产生成熟假囊壳时,在解剖镜下检查待测菌株与标准菌株对峙产生的假囊壳,统计假囊壳产生量,并随机挑选20—30个假囊壳置于载玻片上,盖上盖玻片,轻轻压碎后在光学显微镜下观察子囊、子囊孢子的发育情况。试验重复3次,每次每个配对杂交培养3皿。育性由待测菌株与标准菌对峙杂交时产生的假囊壳及子囊数量来衡量。将形成假囊壳,且能够产生子囊孢子的菌株界定为可育菌株;将不能形成假囊壳,或只产生空的假囊壳的菌株界定为不育菌株。育性分级标准见表1。
Table 1
表1
表1玉米小斑病菌有性杂交的育性分级标准
Table 1
| 假囊壳数量 Number of pseudothecia (dish) | 假囊壳的形成能力等级 Pseudothecium-forming level | 每个假囊壳中子囊的数量 Number of asci per pseudothecium | 育性等级 Fertility level |
|---|---|---|---|
| >200 | 高High | 0 | 不育Sterile |
| 1-100 | 低Low | ||
| 101-200 | 中等Medium | ||
| >200 | 高High | ||
| 100-200 | 中等 Medium | 0 | 不育Sterile |
| 1-200 | 低Low | ||
| >200 | 中等Medium | ||
| 1-100 | 低Low | 0 | 不育Sterile |
| ≥1 | 低Low | ||
| 0 | 不育Sterile | — | 不育Sterile |
新窗口打开|下载CSV
1.5 育性的遗传分化
根据育性分析结果,在高育性菌株群体中选择MAT1-1和MAT1-2菌株各10株,进行两两配对杂交;在低育性菌株群体中选择MAT1-1菌株8株与MAT1-2菌株11株,进行两两配对杂交。以标准菌株对峙杂交为对照,24℃下黑暗培养25—30 d,统计假囊壳产生量,检测子囊、子囊孢子的发育情况。方法同1.4。1.6 数据分析
采用SPSS 21.0软件进行试验数据的统计分析,应用Duncan氏新复极差法进行差异显著性检验。卡方检测χ2是在MAT1-1﹕MAT1-2的理论比率1﹕1,自由度为1的基础之上计算得出。2 结果
2.1 玉米小斑病菌有性世代的形态特征
通过相反交配型菌株的室内对峙杂交成功诱导出玉米小斑病菌的有性世代(图1)。成熟的假囊壳约在对峙杂交的25—30 d内形成,呈黑色,近球状,大小约300—600 μm,顶口处有喙,不同的杂交组合产生的假囊壳大小和形态稍有差异。假囊壳内一般几个到几百个子囊不等,子囊棍棒状,基部有短柄,大小(144—203)μm×(23—31)μm。子囊内常产生1—8个子囊孢子,大多数子囊内含有2—6个子囊孢子,子囊孢子线状,隔膜6—9个,在子囊内螺旋形盘绕,大小(155—350)μm×(5—9)μm。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1玉米小斑病菌有性世代的形态特征
A:以小麦秆为诱导基物产生的假囊壳Pseudothecia on wheat straw;B:以玉米叶片为诱导基物产生的假囊壳Pseudothecia on maize leaf;C:正在释放子囊孢子的假囊壳A mature pseudothecium liberating the ascospores;D、E:子囊和子囊孢子Cylindrical and straight curved asci with ascospores coiling in a close helix;F:1个子囊中的8个子囊孢子Flagelliform ascospores from one ascus
Fig. 1Sexual generation of C. heterostrophus
2.2 玉米小斑病菌的交配型分析
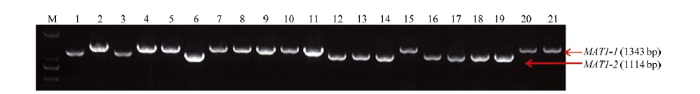
利用多重PCR检测供试玉米小斑病菌的交配型,MAT1-1菌株扩增得到大小为1 343 bp的片段,MAT1-2菌株扩增得到大小为1 141 bp的片段(图2)。PCR检测结果显示,544个待测菌株中286个MAT1-1菌株,出现频率为52.57%;258个MAT1-2菌株,出现频率为47.43%。两种交配型比例为1.11﹕1,卡方检验符合1﹕1分布(χ2=1.441,P=0.230)。没有检测到同时含有两种交配型基因或两种交配型基因全部缺失的菌株。根据菌株来源,对各地玉米小斑病菌交配型进行统计,结果见表2。除甘孜州外,两种交配型的菌株在各采样区域均有分布,且同一田块甚至同一病叶可分离到两种交配型的菌株。四川中部、东部、西部、南部和北部地区小斑病菌MAT1-1和MAT1-2出现频率分别为54.63%、45.37%;51.72%、48.28%;61.54%、38.46%;56.06%、43.94%;49.08%、50.92%。云南南部地区MAT1-1和MAT1-2出现频率分别为41.18%和58.82%。各地区两种交配型的频率稍有不同,推测小斑病菌在当地发生有性杂交的机率是不同的,但均未偏离1﹕1。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2玉米小斑病菌交配型的多重PCR检测
M:Marker DL2000;2、4、5、7—11、15、20、21:11株交配型MAT1-1的玉米小斑病菌菌株 Eleven MAT1-1 isolates of C. heterostrophus;1、3、6、12—14、16—19:10株交配型MAT1-2对玉米小斑病菌菌株 Ten MAT1-2 isolates of C. heterostrophus
Fig. 2Multiple PCR detection of the mating types of C. heterostrophus
Table 2
表2
表2四川省17个市(州)及云南省西双版纳州玉米小斑病菌交配型分布情况
Table 2
| 采样区 Sampling region | 采样点数 Number of collection sites | 测试菌株数Number of tested isolates | MAT1-1 | MAT1-2 | MAT1-1﹕MAT1-2 | |||
|---|---|---|---|---|---|---|---|---|
| 测试菌株数 Number of tested isolates | 比例 Percentage (%) | 测试菌株数Number of tested isolates | 比例 Percentage (%) | |||||
| 四川中部 Central Sichuan | 成都Chengdu | 15 | 161 | 85 | 52.80 | 76 | 47.20 | 1.12﹕1 |
| 眉山Meishan | 11 | 66 | 39 | 59.09 | 27 | 40.91 | 1.44﹕1 | |
| 总计Total | 26 | 227 | 124 | 54.63 | 103 | 45.37 | 1.2﹕1 | |
| 四川东部 Eastern Sichuan | 内江Neijiang | 4 | 11 | 7 | 63.64 | 4 | 36.36 | 1.75﹕1 |
| 遂宁Suining | 4 | 11 | 3 | 27.27 | 8 | 72.73 | 1﹕2.67 | |
| 南充Nanchong | 6 | 16 | 11 | 68.75 | 5 | 31.25 | 2.2﹕1 | |
| 广安Guang’an | 5 | 12 | 5 | 41.67 | 7 | 58.33 | 1﹕1.4 | |
| 巴中Bazhong | 2 | 3 | 2 | 66.70 | 1 | 33.30 | 2﹕1 | |
| 达州Dazhou | 3 | 5 | 2 | 40.00 | 3 | 60.00 | 1﹕1.5 | |
| 总计Total | 24 | 58 | 30 | 51.72 | 28 | 48.28 | 1.07﹕1 | |
| 四川西部 Western Sichuan | 雅安Yaan | 9 | 11 | 6 | 54.55 | 5 | 45.45 | 1.2﹕1 |
| 甘孜州Garze | 1 | 2 | 2 | 100.00 | 0 | 0 | / | |
| 总计Total | 10 | 13 | 8 | 61.54 | 5 | 38.46 | 1.6﹕1 | |
| 四川南部 Southern Sichuan | 自贡Zigong | 2 | 5 | 3 | 60.00 | 2 | 40.00 | 1.5﹕1 |
| 乐山Leshan | 8 | 40 | 23 | 57.50 | 17 | 42.50 | 1.35﹕1 | |
| 宜宾Yibin | 3 | 7 | 5 | 71.43 | 2 | 28.57 | 2.5﹕1 | |
| 泸州Luzhou | 3 | 14 | 6 | 42.86 | 8 | 57.14 | 1﹕1.33 | |
| 总计Total | 16 | 66 | 37 | 56.06 | 29 | 43.94 | 1.28﹕1 | |
| 四川北部 Northern Sichuan | 德阳Deyang | 8 | 84 | 36 | 42.86 | 48 | 57.14 | 1﹕1.33 |
| 绵阳Mianyang | 11 | 56 | 29 | 51.79 | 27 | 48.21 | 1.07﹕1 | |
| 广元Guangyuan | 7 | 23 | 15 | 65.22 | 8 | 34.78 | 1.88﹕1 | |
| 总计Total | 26 | 163 | 80 | 49.08 | 83 | 50.92 | 1﹕1.04 | |
| 云南南部 Southern Yunnan | 西双版纳州Xishuangbanna | 1 | 17 | 7 | 41.18 | 10 | 58.82 | 1﹕1.43 |
新窗口打开|下载CSV
2.3 标准菌株的筛选
根据菌株交配型的PCR检测结果,分别在两种交配型的菌株中随机挑选不同地理来源的10个菌株进行两两对峙杂交,在100个配对杂交组合中,假囊壳产生量大于200/皿的占比29.00%(表3)。其中,DY-12-1-2(MAT1-2)与10个MAT1-1交配型菌株杂交,假囊壳产生量大于200/皿的有9个组合;MSRS-2-3(MAT1-1)与10个MAT1-2交配型菌株杂交,假囊壳产生量大于200/皿的有7个组合。且这些具有高假囊壳形成能力的组合均能产生较多的子囊和子囊孢子,表明MSRS-2-3(MAT1-1)和DY-12-1-2(MAT1-2)均具有较高的有性世代形成能力,适合作为标准菌株。因此,选择MSRS-2-3(MAT1-1)和DY-12-1-2(MAT1-2)用作标准菌株。Table 3
表3
表3玉米小斑病菌田间菌株的对峙杂交假囊壳产生情况
Table 3
| 测试菌株 Tested isolate | MAT1-2 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 9-10-7-2 | A10 | B73-2-2 | C33 | DY-12-1-2 | CZ-1-2 | S33-1-1 | YN-1-1 | YN-3-3 | ZJ-10-2 | ||
| MAT1-1 | 9-5-1 | ++ | + | + | ++ | ++ | + | ++ | |||
| C24 | + | ++※ | ++ | +# | + | + | + | + | ++ | ||
| MSRS-2-3 | ++ | ++ | ++ | ||||||||
| CZ-10-2 | ++ | ++ | ++ | + | ++ | ++ | ++ | ||||
| D4-4-1 | ++ | ++ | ++ | + | ++ | ++ | ++ | ||||
| M17-1-2 | ++ | ++ | ++ | ++ | ++ | ++ | |||||
| T91-1-2 | ++ | ++ | ++ | ++ | ++ | ++ | ++ | ||||
| YN-3-2 | ++ | ++ | ++ | ++ | ++ | ++ | ++ | ++ | |||
| YN-6-1 | ++ | ++ | ++ | ++ | ++ | ++ | ++ | ++ | ++ | ||
| ZJ-7-1 | ++ | ++ | ++ | ++ | ++ | ++ | ++ | ++ | |||
新窗口打开|下载CSV
2.4 育性分析
18个市(州)的544个玉米小斑病菌田间菌株与标准菌株对峙杂交有性世代形成情况见表4。有511个菌株能够与标准菌株杂交形成假囊壳,占比93.93%,不能形成假囊壳的菌株仅有33株,占比6.07%。各菌株间假囊壳形成量有很大的差异,从几个到几百个不等,其中低假囊壳形成能力的菌株228株,占比41.91%,为主要类群。其次为中等假囊壳形成能力的菌株178株,占比32.72%;高假囊壳形成能力的菌株仅105株,占比19.30%。能够杂交产生子囊孢子的可育菌株有483株,占比88.79%;61个参试菌株不能与标准菌株杂交形成子囊孢子,为不育菌株,占比11.21%。可育菌株与不育菌株的频率差异极显著(P<0.01)。就交配型组成而言,在可育菌株群体中,MAT1-1交配型菌株有251个,占比51.97%,MAT1-2交配型菌株有232个,占比48.03%,两种交配型分布差异不显著。就育性结构而言,高育性菌株67株,占比12.32%;中等育性菌株149株,占比27.39%;低育性菌株267株,占比49.08%,为主要类群。来自甘孜州的2个菌株均表现为不育,其他各地区菌株的可育率在60%—100%。来自成都、德阳、广元、绵阳、内江、自贡和云南西双版纳的菌株可育率均达到90%以上,其中内江、自贡和西双版纳菌株可育率为100%。在菌株量大于20株的成都、德阳、广元、乐山、眉山和绵阳采样区,高育性菌株率为8.70%—18.75%,中等育性菌株率为12.50%—34.78%,低育性菌株率为42.24%—65.00%,不育菌株率为4.76%—18.75%。Table 4
表4
表4四川省17个市(州)及云南省西双版纳州玉米小斑病菌有性世代形成情况
Table 4
| 采样区 Sampling region | 测试菌 株数 Number of tested isolates | 不同假囊壳形成能力的菌株数(出现频率) Number of isolates with different pseudothecium-forming levels (Frequency, %) | 可育菌株数 (出现频率)Number of fertile isolates (Frequency, %) | 不同育性水平的菌株数(出现频率) Number of isolates with different fertility levels (Frequency, %) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 高 High | 中 Medium | 低 Low | 无 Absent | 高 High | 中 Medium | 低 Low | 不育 Sterile | ||||
| 四川中部 Central Sichuan | 成都Chengdu | 161 | 33 (20.50) | 59 (36.65) | 65 (40.37) | 4 (2.48) | 145 (90.06) | 21 (13.04) | 56 (34.78) | 68 (42.24) | 16 (9.94) |
| 眉山Meishan | 66 | 11 (16.67) | 20 (30.30) | 29 (43.94) | 6 (9.09) | 59 (89.39) | 6 (9.09) | 19 (28.79) | 34 (51.52) | 7 (10.61) | |
| 总计Total | 227 | 44 (19.38) | 79 (34.80) | 94 (41.41) | 10 (4.41) | 204 (89.87) | 27 (11.89) | 75 (33.04) | 102 (44.93) | 23 (10.13) | |
| 四川东部 Eastern Sichuan | 内江Neijiang | 11 | 0 (0) | 4 (36.36) | 7 (63.63) | 0 (0) | 11 (100.00) | 0 (0) | 4 (36.36) | 7 (63.63) | 0 (0) |
| 遂宁Suining | 11 | 0 (0) | 3 (27.27) | 8 (72.73) | 0 (0) | 8 (72.73) | 0 (0) | 3 (27.27) | 5 (45.45) | 3 (27.27) | |
| 南充Nanchong | 16 | 4 (25.00) | 3 (18.75) | 8 (50.00) | 1 (6.25) | 13 (81.25) | 3 (18.75) | 3 (18.75) | 7 (43.75) | 3 (18.75) | |
| 广安Guang’an | 12 | 2 (16.67) | 2 (16.67) | 6 (50.00) | 2 (16.67) | 9 (75.00) | 1 (8.33) | 3 (25.00) | 5 (41.67) | 3 (25.00) | |
| 巴中Bazhong | 3 | 0 (0) | 1 (33.30) | 1 (33.30) | 1 (33.30) | 2 (66.67) | 0 (0) | 1 (33.33) | 1 (33.33) | 1 (33.33) | |
| 达州Dazhou | 5 | 0 (0) | 1 (20.00) | 2 (40.00) | 2 (40.00) | 3 (60.00) | 0 (0) | 1 (20.00) | 2 (40.00) | 2 (40.00) | |
| 总计Total | 58 | 6 (10.34) | 14 (24.14) | 32 (55.17) | 6 (10.34) | 46 (79.31) | 4 (6.90) | 15 (25.86) | 27 (46.55) | 12 (20.69) | |
| 四川西部Western Sichuan | 雅安Yaan | 11 | 4 (36.36) | 4 (36.36) | 2 (18.18) | 1 (9.09) | 9 (81.82) | 2 (18.18) | 2 (18.18) | 5 (45.45) | 2 (18.18) |
| 甘孜州Garze | 2 | 0 (0) | 0 (0) | 0 (0) | 2 (100.00) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 2 (100.00) | |
| 总计Total | 13 | 4 (30.77) | 4 (30.77) | 2 (15.38) | 3 (23.08) | 9 (69.23) | 2 (15.38) | 2 (15.38) | 5 (38.46) | 4 (30.77) | |
| 四川南部Southern Sichuan | 自贡Zigong | 5 | 0 (0) | 5 (100.00) | 0 (0) | 0 (0) | 5 (100.00) | 0 (0) | 0 (0) | 5 (100.00) | 0 (0) |
| 乐山Leshan | 40 | 8 (20.00) | 9 (22.5) | 23 (57.50) | 0 (0.00) | 35 (87.50) | 4 (10.00) | 5 (12.50) | 26 (65.00) | 5 (12.50) | |
| 宜宾Yibin | 7 | 2 (28.57) | 1 (14.29) | 2 (28.57) | 2 (28.57) | 5 (71.43) | 0 (0) | 0 (0) | 5 (71.43) | 2 (28.57) | |
| 泸州Luzhou | 14 | 0 (0) | 4 (28.57) | 7 (50.00) | 3 (21.43) | 10 (71.43) | 0 (0) | 4 (28.57) | 6 (42.86) | 4 (28.57) | |
| 总计Total | 66 | 10 (15.15) | 19 (28.79) | 32 (48.48) | 5 (7.58) | 55 (83.33) | 4 (6.06) | 9 (13.64) | 42 (63.64) | 11 (16.67) | |
| 四川北部 Northern Sichuan | 德阳Deyang | 84 | 15 (17.86) | 35 (41.67) | 32 (38.10) | 2 (2.38) | 80 (95.24) | 9 (10.71) | 26 (30.95) | 45 (53.57) | 4 (4.76) |
| 绵阳Mianyang | 56 | 11 (19.64) | 17 (30.36) | 23 (41.07) | 5 (8.93) | 51 (91.07) | 9 (16.07) | 12 (21.43) | 30 (53.57) | 5 (8.93) | |
| 广元Guangyuan | 23 | 5 (21.74) | 5 (21.74) | 11 (47.83) | 2 (8.70) | 21 (91.30) | 2 (8.70) | 5 (21.74) | 14 (60.87) | 2 (8.70) | |
| 总计Total | 163 | 31 (19.02) | 57 (34.97) | 66 (40.49) | 9 (5.52) | 152 (93.25) | 20 (12.27) | 43 (26.38) | 89 (54.60) | 11 (6.75) | |
| 云南南部 Southern Yunnan | 西双版纳州Xishuangbanna | 17 | 10 (58.82) | 5 (29.41) | 2 (11.76) | 0 (0) | 17 (100.00) | 10 (58.82) | 5 (29.41) | 2 (11.76) | 0 (0) |
新窗口打开|下载CSV
按地理来源分区,四川中部、东部、西部、南部、北部地区小斑病菌的可育率和高育性菌株率分别为89.87%、11.89%;79.31%、6.90%;69.23%、15.38%;83.33%、6.06%;93.25%、12.27%。云南南部地区的菌株可育率和高育性菌株率分别为100.00%和58.82%。以上结果表明不同地理来源的菌株群体育性结构不同。
2.5 交配型和育性水平的年度动态变化
统计2013—2018年玉米小斑病菌交配型和育性组成,由表5可知,随着时间的变化,小斑病菌两种交配型的比例和育性水平出现波动,但变化不大。就交配型结构而言,各年间两种交配型菌株的频率没有明显差异,说明6个时间群体的交配型结构是一致的。就育性结构而言,2013年和2014年菌株可育率均低于80%,可能是由于菌株保存时间较长,导致育性降低;2018年菌株可育率为88.76%,2015—2017年菌株可育率在93.33%—94.87%,保持较高的育性水平。Table 5
表5
表5不同年份玉米小斑病菌交配型及有性世代形成情况
Table 5
| 采样年份 Sampling year | 采样点数 Number of collection sites | 测试菌株数 Number of tested isolates | MAT1-1菌株数Number of isolates of MAT1-1 | MAT1-2菌株数Number of isolates of MAT1-2 | MAT1-1﹕MAT1-2 | 可育菌株数Number of fertile isolates | 可育菌株率 Percentage of fertile isolates (%) | 不同育性水平的菌株数(出现频率) Number of isolates with different fertility levels (Frequency, %) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 高 High | 中 Medium | 低 Low | 不育 Sterile | ||||||||
| 2013 | 29 | 113 | 63 | 50 | 1.13﹕1 | 88 | 77.88 | 8 (7.08) | 23 (20.35) | 57 (50.44) | 25 (22.12) |
| 2014 | 9 | 28 | 14 | 14 | 1﹕1 | 22 | 78.57 | 4 (14.29) | 8 (28.57) | 10 (35.71) | 6 (21.43) |
| 2015 | 16 | 60 | 28 | 32 | 1﹕1.14 | 56 | 93.33 | 4 (6.67) | 26 (43.33) | 26 (43.33) | 4 (6.67) |
| 2016 | 18 | 39 | 17 | 22 | 1﹕1.29 | 37 | 94.87 | 4 (10.26) | 11 (41.03) | 22 (43.59) | 2 (5.13) |
| 2017 | 23 | 215 | 123 | 92 | 1.34﹕1 | 201 | 93.49 | 26 (12.09) | 59 (27.44) | 116 (53.95) | 14 (6.51) |
| 2018 | 8 | 89 | 41 | 48 | 1﹕1.17: | 79 | 88.76 | 21 (23.60) | 22 (24.72) | 36 (40.45) | 10 (11.24) |
| 总计Total | 103 | 544 | 286 | 258 | 1.11﹕1 | 483 | 88.79 | 67 (12.32) | 149 (27.39) | 267 (49.08) | 61 (11.21) |
新窗口打开|下载CSV
2.6 育性的遗传分化
在高育性菌株的100个配对杂交组合中,假囊壳产生量大于200/皿的组合占比69.00%,假囊壳产生量在100—200/皿之间的组合占比22.00%,假囊壳产生量少于100/皿的组合占比9.00%(表6)。其中,B73-2-2(MAT1-2)与CZ-1-1(MAT1-1)菌株杂交虽产生了大量的假囊壳,但是假囊壳内只有极少量的子囊和子囊孢子;ZJ-10-2(MAT1-2)、J-A(MAT1-2)分别与MAT1-1的10个高育性菌株杂交时,均有4对杂交组合产生的假囊壳少于100个/皿;DJY-1-2A(MAT1-2)与10个MAT1-1菌株杂交时,出现了3种不同等级的假囊壳产生情况。Table 6
表6
表6高育性菌株间对峙杂交假囊壳的产生情况
Table 6
| 测试菌株 Tested isolate | MAT1-1 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| CZ-4-1 | CZ-1-1 | 18LS-3-3 | D4-1-3 | 18CZ-3-2 | JY-2-1-1 | YN-3-2 | N1-1 | 18LS-3-10 | GY-4-2-1 | ||
| MAT1-2 | B73-2-2 | ※ | |||||||||
| J-A | ++ | ++ | +※ | + | ++ | + | ++ | + | |||
| YN-5-3 | |||||||||||
| DJY-1-2A | ++ | ++ | ++ | + | ++ | ++ | |||||
| MY-13-2-2 | ++ | ++ | |||||||||
| 18CZ-2-2 | |||||||||||
| ZJ-10-2 | + | ++ | + | + | ++ | ++ | ++ | + | |||
| MY-11-2-3 | ++ | ||||||||||
| CZ-5-2 | ++ | ++ | ++ | ||||||||
| RS-1A | ++ | ++ | ++ | ||||||||
新窗口打开|下载CSV
在低育性菌株的88个配对杂交组合中,出现3对假囊壳产生量大于200/皿的组合,占比3.41%;假囊壳产生量在100—200/皿之间的组合占比42.05%;假囊壳产生量少于100/皿的组合占比47.73%;有6个杂交组合未能产生假囊壳,占比6.82%(表7)。18LS-2-5(MAT1-2)与D4-3-1(MAT1-1)的杂交组合没有产生子囊孢子,但与CZ-7-1-1(MAT1-1)的杂交组合产生大量假囊壳且形成丰富的子囊孢子。D4-3-1(MAT1-1)与8个MAT1-2菌株杂交时,有5对组合未能产生假囊壳。GY-6-1-2(MAT1-1)与8个MAT1-2菌株杂交时,虽有假囊壳产生,但无子囊孢子形成。MS-6-1-1(MAT1-1)与8个MAT1-2菌株杂交时,有7对组合仅能形成空的假囊壳。
Table 7
表7
表7低育性菌株间对峙杂交假囊壳的产生情况
Table 7
| 测试菌株 Tested isolate | MAT1-1 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| XD-1-2-1 | J1-3 | WJ-1-3 | GY-6-1-2 | GY-1-1-1 | D4-3-1 | X3-1-1 | MS-6-1-1 | CZ-7-1-1 | QL-1-2A | MS-7-1-1 | ||
| MAT1-2 | RS-2-2 | + | + | ++ | +# | + | +# | ++ | +# | ++# | + | ++ |
| 18LS-2-5 | ++ | ++ | ++ | +# | ++ | – | ++ | + | ++ | ++ | ||
| YLS-3-3 | + | + | ++ | +# | + | – | +# | +# | + | + | ||
| 18LS-2-3 | ++ | ++ | + | +# | ++# | +# | + | +# | ++# | ++# | ++# | |
| GH-5-1-1 | ++※ | + | + | +# | +# | – | +# | +# | ++# | + | + | |
| P4-1-1 | + | + | + | +# | +# | – | – | +# | +# | ++# | ++ | |
| ZJ-8-1 | ++ | ++ | ++ | +# | ++ | ++# | ++ | ++# | ++ | ++ | ||
| JY-1-2-1 | + | ++ | ++ | +# | ++ | – | + | +# | ++ | ++ | ++ | |
新窗口打开|下载CSV
比较高育性菌株群体间和低育性菌株群体间杂交有性世代的产生情况,可见,高育性菌株群体整体保持了较高的假囊壳和子囊孢子产生能力,而低育性菌株群体整体有性生殖能力较低,说明通过与标准菌株对峙杂交的方法来判断菌株群体的育性是可行的。但在低育性群体中也会出现高配合力的杂交组合,表明有性生殖是一个复杂的过程,菌株间可能会存在互补效应。
3 讨论
交配型和育性是真菌群体遗传结构研究的重要组成部分。由交配型基因控制的交配型种类及其分布影响着真菌有性生殖的策略,但交配型偏离现象在异宗配合真菌中普遍存在,如稻瘟病菌[18-21,29]、玉米大斑病菌[30,31]、球孢白僵菌(Beauveria bassiana sensu lato)[32]等,意味着有性生殖在这些群体中发生的概率很低。有研究表明,异宗配合的子囊菌失去有性生殖能力的原因可能在于失去了某种特定的交配型,或因生境发生重大变化造成的定向选择对某一交配型群体的无性型特别有利,导致这一交配型比例的猛增,从而改变交配型结构,进而导致有性生殖策略发生改变[15,33]。本研究结果表明,四川、云南玉米小斑病菌自然群体中MAT1-1和MAT1-2两种交配型的菌株普遍存在,没有出现某一种交配型缺失或占绝对优势的现象,不同年份间交配型的结构也保持一致。在同一病叶上能够分离到两种交配型的菌株,意味着在自然条件下这些地区玉米小斑病菌极有可能存在有性生殖,有性重组可能是玉米小斑病菌遗传多样性形成的一种潜在机制。但各个地区小斑病菌两种交配型的比例稍有不同,因而小斑病菌在各地通过有性杂交而出现变异的机率是不同的。本试验中交配型测定的结果表明自然条件下未见小斑病菌的有性态并不是由某些地域范围内某一种交配型类型的缺失造成的,因而进一步探索菌株群体的育性结构对小斑病菌有性生殖发生的影响。胡旭章等开展的55对小斑病菌的种内杂交,仅有一对产生了成熟的子囊孢子,表现出低育性的特征[34]。本研究中544株玉米小斑病菌与标准菌株对峙杂交,88.79%的菌株能够产生成熟的子囊孢子,保持了较高的可育率,说明四川、云南的小斑病菌有较强的有性生殖能力。但菌株群体内出现育性的分化,不同地理来源的菌株育性结构稍有不同,推测菌株的育性水平可能与地理来源有关。育性结构的差异进一步说明病菌在不同地区发生有性生殖的机率不同。试验中部分采样点和菌株分布存在不均匀的现象,菌株的育性结构后续仍需进一步研究验证。
在育性分析中,一个菌株的育性能力是由标准菌株和测试菌株互作决定的,测试菌株与标准菌株的配合力强弱是关键,因此需要选择合适的标准菌株。在稻瘟病菌群体育性分析中,发现由于标准菌株的不同造成同一组稻瘟病菌株的育性结果差异很大[35]。造成这些差异的原因可能有两种:一是不同标准菌株和待测菌株之间的亲和力不同,二是由所选用的标准菌株的交配能力强弱差异。本研究中表现为低育性或不育的菌株可能只是与标准菌株之间弱的亲和性反映。因此,利用多对不同遗传背景的高育性的标准菌株进行育性测定,更能反映菌株群体的育性水平。在小斑病菌的研究中发现,高育性的菌株间配对易形成假囊壳,高育性和低育性的菌株配对不一定形成假囊壳,低育性的菌株配对一般不形成假囊壳[36]。本研究中也发现小斑病菌中普遍存在菌株的亲和性差异。高育性菌株在与标准菌株配对时均产生了较多的假囊壳和子囊孢子,但高育性菌株之间相互杂交时不一定都能产生较多的有性世代;相反一些低育性菌株之间杂交,也会出现产生较多假囊壳和子囊孢子的情况。高育性菌株间杂交不能形成丰富的有性世代,推断是某些因素抑制了有性世代的发生,而低育性菌株之间的杂交大量产生有性世代可能是两菌株之间的互补效应。小斑病菌假囊壳形成、子囊孢子的发育过程观察发现当亲本都含有Tox1时会导致子囊孢子发育中断[37,38],说明小斑病菌有性生殖是一个复杂的过程,除受到交配型基因调控外,菌株间的亲和性还受到众多其他基因的调控[39,40,41,42,43,44]。
生殖模式影响植物病原菌种群遗传动态和进化格局,进而影响防控策略。交配型和育性是玉米小斑病菌重要的群体特征,明确玉米小斑病菌群体的交配型和育性情况,对深入探讨玉米小斑病菌有性态在自然界中的发生机制及解析异宗配合真菌遗传变异具有重要意义。四川省目前大力推广的秸秆还田,为玉米小斑病菌提供了良好的生存和越冬条件,在两种交配型菌株普遍存在的情况下,田间有性生殖可能正在发生。后续应开展更大范围的玉米小斑病菌的交配型检测和育性分析,一方面分析小斑病菌发生有性重组的可能性,另一方面可以筛选高育性菌株,组建用于分析特定无毒基因的有性杂交组合,为开展小斑病菌的遗传研究提供试验材料,为研究小斑病菌的无毒性遗传规律打下基础。
4 结论
四川玉米小斑病菌自然群体中MAT1-1和MAT1-2两种交配型的菌株普遍存在且均衡分布,多数为可育菌株,室内诱导能够获得大量的有性世代,有性重组可能是玉米小斑病菌遗传多样性形成的一种潜在机制。尽管未见自然条件下小斑病菌有性世代的报道,但有性生殖可能正在发生,并在小斑病菌遗传变异中起着重要作用。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1146/annurev.py.10.090172.000345URL [本文引用: 1]
DOI:10.1007/s13225-011-0139-4URL [本文引用: 1]
DOI:10.1007/s00203-017-1426-6URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/jph.2017.165.issue-10URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1094/PDIS-03-19-0650-REURL [本文引用: 2]
DOI:10.1146/annurev-genet-110410-132536URL [本文引用: 1]
DOI:10.1016/j.fgb.2011.02.005URL [本文引用: 1]
DOI:10.1016/j.fbr.2017.05.003URL [本文引用: 1]
[本文引用: 1]
[本文引用: 2]
DOI:10.1094/PHYTO.1998.88.3.190URL [本文引用: 1]
DOI:10.1094/PHYTO-99-1-0082URL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1111/j.1365-294X.2012.05469.xURL [本文引用: 1]
DOI:10.1111/nph.2014.201.issue-4URL [本文引用: 1]
DOI:10.1038/s41396-018-0100-6URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1007/s10658-017-1393-4URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1094/PDIS-04-18-0707-REURL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3390/pathogens9030229URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1094/PHYTO-12-15-0311-RURL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/mec.2009.18.issue-6URL [本文引用: 1]
DOI:10.1016/S0953-7562(09)81218-5URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1080/00275514.1959.12024792URL [本文引用: 1]
DOI:10.1139/g88-003URL [本文引用: 1]
DOI:10.1016/j.fgb.2007.08.007URL [本文引用: 1]
DOI:10.1007/s004380050813URL [本文引用: 1]
DOI:10.1006/fgbi.1998.1094URL [本文引用: 1]
DOI:10.1128/EC.3.6.1653-1663.2004URL [本文引用: 1]
DOI:10.1371/journal.ppat.1002542URL [本文引用: 1]
DOI:10.1016/j.fgb.2014.07.010URL [本文引用: 1]
DOI:10.1016/j.funbio.2017.05.008URL [本文引用: 1]
