 ,, 史亚兴
,, 史亚兴 ,, 卢柏山
,, 卢柏山 ,, 武莹, 刘亚, 王元东
,, 武莹, 刘亚, 王元东 ,, 杨进孝
,, 杨进孝 ,, 赵久然
,, 赵久然 ,北京市农林科学院玉米研究中心/玉米DNA指纹及分子育种北京市重点实验室,北京 100097
,北京市农林科学院玉米研究中心/玉米DNA指纹及分子育种北京市重点实验室,北京 100097Creation of New Maize Variety with Fragrant Rice Like Flavor by Editing BADH2-1 and BADH2-2 Using CRISPR/Cas9
ZHANG Xiang ,, SHI YaXing
,, SHI YaXing ,, LU BaiShan
,, LU BaiShan ,, WU Ying, LIU Ya, WANG YuanDong
,, WU Ying, LIU Ya, WANG YuanDong ,, YANG JinXiao
,, YANG JinXiao ,, ZHAO JiuRan
,, ZHAO JiuRan ,Maize Research Center, Beijing Academy of Agriculture and Forestry Sciences/Beijing Key Laboratory of Maize DNA Fingerprinting and Molecular Breeding, Beijing 100097
,Maize Research Center, Beijing Academy of Agriculture and Forestry Sciences/Beijing Key Laboratory of Maize DNA Fingerprinting and Molecular Breeding, Beijing 100097通讯作者:
责任编辑: 李莉
收稿日期:2021-01-25接受日期:2020-02-20网络出版日期:2021-05-16
| 基金资助: |
Received:2021-01-25Accepted:2020-02-20Online:2021-05-16
作者简介 About authors
张翔,E-mail:
史亚兴,E-mail:
卢柏山,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (3919KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张翔, 史亚兴, 卢柏山, 武莹, 刘亚, 王元东, 杨进孝, 赵久然. 利用CRISPR/Cas9技术编辑BADH2-1/BADH2-2创制香米味道玉米新种质[J]. 中国农业科学, 2021, 54(10): 2064-2072 doi:10.3864/j.issn.0578-1752.2021.10.003
ZHANG Xiang, SHI YaXing, LU BaiShan, WU Ying, LIU Ya, WANG YuanDong, YANG JinXiao, ZHAO JiuRan.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】随着消费水平的提高,香味这一品质性状深受消费者的青睐。例如香米,由于其所具有的独特香味,表现出更高的商品价值。玉米是中国第一大作物,但具有独特香味的香型玉米品种或种质却鲜有报道。因此,香型玉米品种的培育还有待进一步加强,发掘和创制新型优质香型玉米种质资源是其重要途径。【前人研究进展】2-AP是重要的香味物质。已有研究表明,水稻香味基因位于第8染色体上,由1个隐性基因控制。BRADBURY等[1]研究最先发现,水稻香味是由编码甜菜碱脱氢酶(betaine aldehyde dehydrogenase,BADH)的OsBADH2突变引起的。OsBADH2由15个外显子和14个内含子组成,其蛋白包含503个氨基酸。在香米中,该基因在第7个外显子产生了8 bp的缺失和3个SNP(此基因型被命名为badh2.1)。badh2.1的蛋白发生提前终止,OsBADH2原有功能丧失[1]。BADH2影响2-AP合成的机制虽然还没有得到非常明确的解析,但一般认为,OsBADH2正常情况下会抑制2-AP的合成。这种抑制作用是通过消耗2-AP合成前体γ-氨基丁醛(γ-amino butyraldehyde,GABald)实现的。OsBADH2可以将GABald转化为γ-氨基丁酸(γ-amino butyric acid,GABA)。当OsBADH2无法发挥正常功能时,2-AP合成前体GABald发生积累,从而引起水稻体内2-AP的含量增加,使稻米具有香味[2,3]。除了水稻外,在大豆、高粱和黄瓜中,均发现了BADH2同源基因突变能够产生的香型品种。香型大豆和黄瓜的BADH2由于SNP导致氨基酸变化[4,5,6];香型高粱的BADH2发生1 444 bp的片段缺失[7]。在明确香味基因的基础上,科研人员开始利用RNAi方法或基因组编辑技术抑制水稻BADH2的表达,进而实现香型种质的创制,大大提高了育种效率[8,9,10]。基因组编辑技术主要依赖人工内切核酸酶(sequence-specific nucleases,SSNs)及一系列功能模块,在目标基因组区域进行碱基或DNA片段的缺失、插入及碱基替换等操作。继锌指核酸酶(Zinc-finger nuclease,ZFN)和转录激活因子样效应因子核酸酶(transcription activator-like effector nuclease,TALEN)之后,CRISPR/Cas9核酸酶作为新一代基因编辑技术,具有简单、高效等优点,迅速被成功应用于动物和植物中。DONG等[11]利用CRISPR/Cas9技术对玉米Sh2和Wx进行同时敲除,证明此方法可快速育成甜糯玉米品种;SHI等[12]利用CRISPR/Cas9对玉米内源基因ARGOS8的启动子进行了编辑,提高了该基因的表达量,进而增加了玉米的耐旱性;ZHANG等[13]利用基因编辑技术敲除了玉米SD1,成功实现了对玉米株高的调节;SVITASHEV等[14]通过对玉米MS26和MS45的定点编辑,快速育成了玉米雄性不育材料。SHAN等[15]利用TALEN技术定点敲除OsBADH2,使稻米获得香味性状,实现了香米的快速精准创制。这些成功的基因编辑育种成果,充分证明了CRISPR/Cas9基因编辑技术在玉米和水稻定向遗传改良中的高效性。【本研究切入点】目前,在玉米中尚未发现由BADH2突变产生的香型玉米材料。筛选自然变异及传统的诱变方法存在不可预期性高、效率低及筛选工作量大等不足。【拟解决的关键问题】本研究以北京市农林科学院玉米研究中心自主选育而成的优良自交系京724为研究材料,利用CRISPR/Cas9技术敲除玉米2个BADH2同源基因,进而获得2-AP含量显著升高的双基因敲除突变株系,为香型玉米品种开发提供种质资源。1 材料与方法
1.1 试验材料
玉米自交系京724[16],由北京市农林科学院玉米研究中心自主选育而成,为玉米杂交品种京科968的母本。B104自交系由北京市农林科学院玉米研究中心保存。1.2 BADH家族成员进化分析
利用Ensembl在线BLAST工具,将水稻OsBADH2(Os08g0424500)蛋白序列与拟南芥、水稻和玉米的蛋白序列库进行比对。使用Clustal W对获得的蛋白质序列进行多序列比对。从UniProt数据库获得OsBADH2蛋白的结构域信息(UniProt ID:Q84LK3),结合多序列比对结果,剔除缺失BADH重要结构域的蛋白序列。最后,使用MEGA7进行进化分析。进化树使用Neighbor-joining方法,检验方法选择 bootstrap method,重复1 000次,置换模型选择poisson model。1.3 载体构建
骨架载体见电子附图1,在WU等[17]报道的SpCas9n-pBE基础骨架之上进行如下改造:(1)使用限制性内切酶KpnⅠ和HindⅢ将该骨架的表达盒1替换成prZmU6-2+tRNA+esgRNA+polyT(此序列由南京金斯瑞公司合成)。序列的两端分别含有KpnⅠ和HindⅢ酶切位点,可从合成质粒直接酶切获得该片段;esgRNA前含有2个相邻的BsaⅠ酶切位点,后期用于连接靶点序列;(2)使用限制性内切酶SnaBⅠ和AscⅠ将表达盒2中的Cas9n&PmCDA1&UGI+t35s替换为Cas9+t35s,其中Cas9以Cas9n为模板,引入碱基突变,将氨基酸10A突变为10D;(3)使用限制性内切酶AscⅠ和AvrⅡ将表达盒3的prZmUbi1+hpt+ t35s替换为prZmUbi1+PMI+tNos(PMI+tNos由南京金斯瑞公司合成)。载体构建所用引物见电子附表1。附图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT附图1CRISPR/Cas9载体示意图
Supplementary Fig.1Diagram of the map of CRISPR/Cas9
Table 1
电子附表1
电子附表1本研究所使用引物
Table 1
| 引物名称 Primer name | 引物序列 Primer sequence (5’-3’) | 目的 Purpose |
|---|---|---|
| Cas9-F1 | TTGCAGTACGTAATGGACTACAAGGACCACGACG | 构建骨架载体表达盒2 Construction of cassette2 |
| Cas9-R1 | AGTATCGGTCTCATGTCGAGTCCGATGGAATATTTCTTATCGG | |
| Cas9-F2 | CTTATCGGTCTCAGACATTGGCACGAATAGCGTCG | |
| Cas9-R2 | TTTCAGACTAGTCTATTTCTTCTTCTTAGCCTGTCC | |
| t35s-F | TATCGTACTAGTCTGAAATCACCAGTCTCTCTCTACAA | |
| t35s-R | CCACCAGGCGCGCCCCACTGGATTTTGGTTTTAGG | |
| prZmUbi-F | CGTCCGCCTAGGCTGCAGTGCAGCGTGAC | 构建骨架载体表达盒3 Construction of cassette3 |
| prZmUbi-R | ATTTCATGGATCCCTGCAGAAGTAACACCAAACA | |
| PMI-03-F | ATTTCATGGATCCATGCAGAAGCTGATCAACA | |
| tNos-R | AGCAGCCCTGCAGGGATCTAGTAACATAGATGACACCGC | |
| Target1-F | TGCATCTCCGAAGAGAGCCTATTG | |
| Target1-R | AAACCAATAGGCTCTCTTCGGAGA | |
| BH2-1-F | GAGGAAACCTGAGCTGGCTAA | ZmBADH2-1靶点突变检测 Mutation detection of ZmBADH2-1 target site |
| BH2-1-R | ATGGTGATGAGGAAAGTTATCGA | |
| BH2-2-F | AGTGTGCAATTTTTTTTCCAGTTT | ZmBADH2-2靶点突变检测 Mutation detection of ZmBADH2-2 target site |
| BH2-2-R | GGCCCAACAAATACGTGAAA | |
| PMI-F | TTCGCCCTGACCCCCT | T0代转基因阳性植株检测 T0 Transgenic plants detection |
| PMI-R | TGGCAGGATATATTGTGGTGTAA | |
| BH-2-1-F | CTTGCCGATCCCTAGCGA | ZmBADH2-2靶点突变检测 Mutation detection of ZmBADH2-2 target site |
| BH-2-1-R | CGAGACCTAGCGCATCAG |
新窗口打开|下载CSV
利用CRISPR-GE[18]在线工具(
1.4 转基因阳性植株的获得
使用构建好的CRISPR/Cas9载体转化农杆菌菌株EAH105,使用PMI特异引物PMI-F/PMI-R(电子附表1)鉴定转化阳性克隆。阳性农杆菌株转化玉米自交系京724的愈伤组织[19],用PMI筛选得到的再生组织培养玉米幼苗,即为T0植株。提取T0植株的基因组DNA,用PMI特异引物PMI-F/PMI-R进行PCR扩增,能扩增出1.2 kb目的片段的植株即为T0转基因阳性植株。所有T0转基因阳性植株自交获得T1种子。1.5 靶位点突变检测
为检测靶位点的突变情况,分别在ZmBADH2-1及ZmBADH2-2的靶点两侧设计引物对,对T0转基因阳性植株基因组DNA进行PCR扩增。ZmBADH2-1靶点扩增引物为BH2-1-F/BH2-1-R;ZmBADH2-2靶点扩增引物为BH2-2-F/BH2-2-R(电子附表1)。PCR产物经1%琼脂糖凝胶电泳、割胶回收后进行Sanger测序。测序峰图在靶点附近位置出现双峰的植株即为T0突变植株。使用R语言工具TIDE[20]对测序峰图ab1文件进行分析,可获得突变体植株靶点的突变类型(插入/缺失的碱基数量);进一步使用CRISPR-GE[18]中的DSDecodeM在线工具和R语言工具sangerseqR[21]可分析获得突变体植株靶点具体的突变基因型。1.6 香味物质2-AP含量测定
参照SHAN等[15]研究,分别取野生型对照京724和基因编辑突变体成熟种子各3 g,水稻品种日本晴和稻花香种子各2 g,碾磨成粉后测定香味物质2-AP含量。以2,4,6-三甲基吡啶作为内标,每个材料3个生物学重复。测定试验由中国科学院遗传与发育研究所代谢组学平台完成。使用R语言对检测结果进行分析,使用LSD进行多重比较,Bonferroni法进行P值校正。2 结果
2.1 玉米基因组中含有2个BADH2同源基因
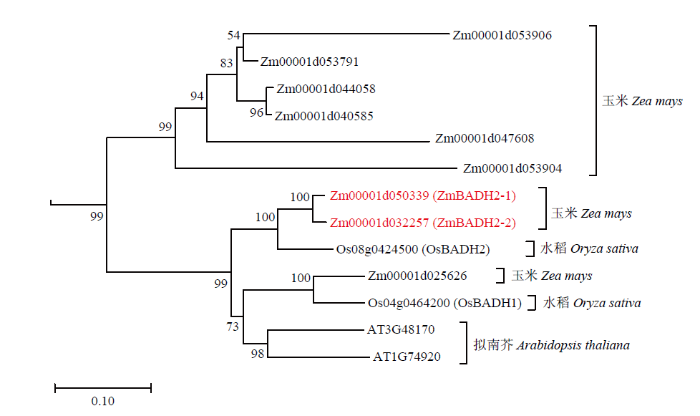
使用OsBADH2蛋白序列,与拟南芥、水稻和玉米的蛋白质序列库进行比对,对所获得的基因进行系统进化分析(图1),结果显示,玉米中有2个基因与水稻OsBADH2位于同一进化分支中,它们是Zm00001d050339和Zm00001d032257,在蛋白序列上分别与OsBADH2有90%和89%的同源性。将这两个基因分别命名为ZmBADH2-1(Zm00001d050339)和ZmBADH2-2(Zm00001d032257)。ZmBADH2-1位于第4染色体,由15个外显子组成,编码505个氨基酸;ZmBADH2-2位于第1染色体,同样具有15个外显子,翻译后的蛋白含有506个氨基酸(图2-A)。通过MaizeGDB(图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1水稻、玉米及拟南芥BADH基因家族系统进化树
红色字体表示玉米ZmBADH2-1(Zm00001d050339)和ZmBADH2-2(Zm00001d032257)
Fig. 1The phylogenetic tree of Oryza sativa, Zea mays and Arabidopsis thaliana BADH gene family
Red words represented maize ZmBADH2-1 (Zm00001d050339) and ZmBADH2-2 (Zm00001d032257)
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2ZmBADH2-1和ZmBADH2-2靶点设计(A)及突变类型(B)分析
下划线表示靶点序列,红色字体表示PAM序列,绿色字体代表碱基插入,-:碱基缺失,蓝色字体表示碱基替换
Fig. 2Diagram of the sgRNA design (A) and mutation analysis (B) on ZmBADH2-1 and ZmBADH2-2
The nucleotides with underline represented target sequence, the nucleotides with red font represented PAM sequence, the nucleotides with green font indicated bases of insertion, -: Base deletions, blue words indicated base substitutions
2.2 靶点设计
基于水稻中的研究得知,香味是隐性性状。玉米2个BADH2同源基因可能存在功能冗余,因此,需要将ZmBADH2-1和ZmBADH2-2 2个基因同时敲除,才可能够获得香型玉米突变体。根据CRISPR/Cas9技术的原理,结合京724中ZmBADH2-1和ZmBADH2-2的编码区序列,设计一条20 bp特异性较好的sgRNA靶点序列Target1。Target1同时位于ZmBADH2-1和ZmBADH2-2的第4个外显子上(图2-A),含有该sgRNA的CRISPR/Cas9载体可以同时在这两个基因中引入缺失/插入突变。已有研究表明水稻OsBADH2在第7个外显子产生了8 bp的缺失,导致蛋白序列提前终止,基因功能丧失,产生香米[1]。因此,推断京724中ZmBADH2-1和ZmBADH2-2同时在第4个外显子上产生突变,导致ZmBADH2s蛋白提前终止或氨基酸缺失,更有可能使得基因功能丧失,进而产生香味性状。2.3 T0阳性植株目标基因靶点序列突变类型分析
将含有目标CRISPR/Cas9载体的农杆菌转化京724的愈伤组织,获得28株T0阳性植株。对ZmBADH2-1和ZmBADH2-2 Target1靶点上下游区域进行扩增后测序,结果显示,有10株T0阳性植株中ZmBADH2-1和ZmBADH2-2均发生突变。在这些突变体中,2个ZmBADH2s的靶点都发生了编辑。进一步对测序结果分析发现,10个突变体的ZmBADH2-1和ZmBADH2-2靶点区域均产生了双等位或多等位突变,突变类型包括碱基缺失、碱基插入及碱基替换(图2-B)。所有这些突变导致ZmBADH-1和ZmBADH-2蛋白序列提前终止或氨基酸缺失等变化(电子附图2)。附图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT附图2基因编辑介导的碱基突变导致ZmBADH2-1和ZmBADH2-2蛋白异常
Supplementary Fig.2Gene-editing induced mutations caused abnormalities of ZmBADH2-1and ZmBADH2-2 protein sequences
2.4 基因编辑株系香味物质2-AP的含量测定
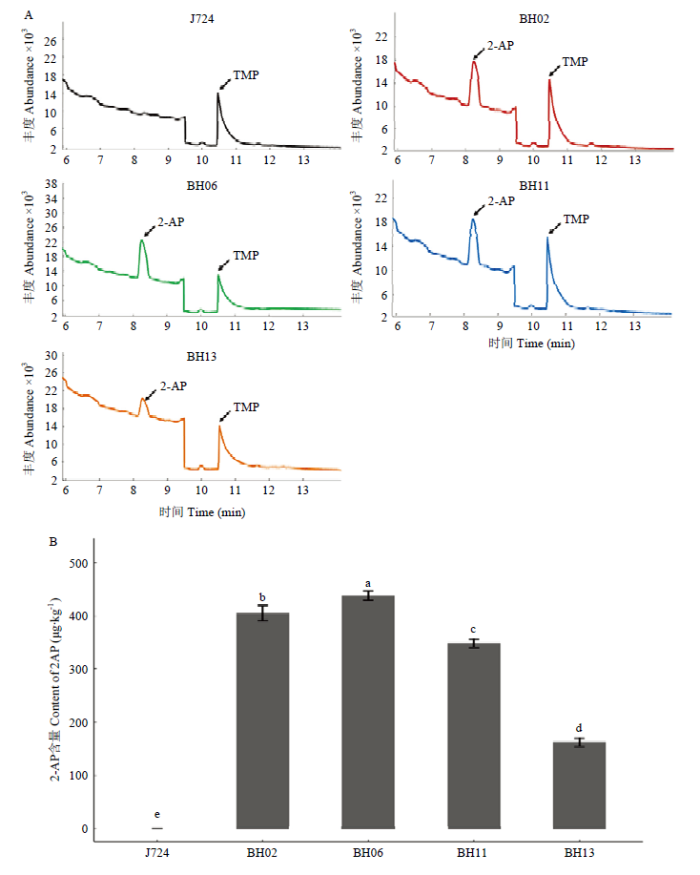
10个ZmBADH2-1/ZmBADH2-2共敲除突变体T1种子均表现出嗅觉可辨的明显香味,暗示T0靶基因突变稳定遗传到T1种子中,且基因功能丧失。随机选择BH02、BH06、BH11和BH13 4个基因编辑株系的T1种子(电子附图3),用于进一步检测种子中2-AP的含量。对这4个编辑株系T1植株的靶点进行PCR扩增后测序,结果显示,T0产生的基因突变稳定遗传至T1代,因此,推测这些T0自交获得的T1种子中,2个基因都产生了功能缺失或弱化,籽粒中2-AP含量升高,产生香味。附图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT附图3Zmbadh1/Zmbadh2双突变体T1代种子
Supplementary Fig.3T1 seeds of Zmbadh1/Zmbadh2 double mutants
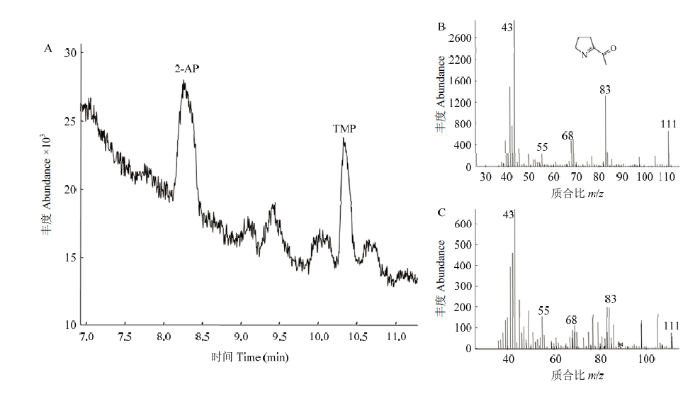
为了明确玉米突变体株系T1种子中是否存在香稻中同样成分的2-AP,选择香稻品种稻花香种子作为对照。由图3-A可见,稻花香种子中的2-AP可以获得有效分离,保留时间约为8.3 min。2-AP质谱图显示,其分子离子峰m/z 111,特征碎片峰m/z 68和83等与已有研究结果一致[24](图3-B)。在BH02株系中,同一时间内获取的质谱结果与稻花香中2-AP质谱图一致(图3-B和图3-C),说明玉米ZmBADH2双基因敲除突变体籽粒中存在与香稻同样成分的2-AP。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3稻花香种子2-AP色谱图(A)及稻花香种子(B)与BH02基因编辑株系T1种子(C)中的2-AP质谱图
Fig. 3Chromatography of 2-AP in Daohuaxiang seeds (A) and mass spectra of 2-AP in Daohuaxiang (B) and T1 seeds of BH02 line (C)
含量测定结果显示,京724对照中未检测到2-AP,4个基因编辑株系的2-AP含量均高于京724野生型对照品种(P<0.01,图4)。其中,BH06中的2-AP含量最高,为438.29 μg·kg-1;BH02和BH11次之,分别为404.63和348.65 μg·kg-1(图4-B)。因此,利用基因编辑技术使玉米2个BADH2同源基因发生突变,可获得香味性状改良的玉米种质材料。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4基因编辑株系籽粒中2-AP色谱图(A)及含量(n=3,平均数±标准差)
小写字母代表各株系间2-AP含量在P<0.01水平差异极显著
Fig. 4The chromatogram (A) and contents of 2-AP (B) in the seeds of gene-editing lines (n=3, mean±SD)
Lower case letters represented significant difference (P<0.01) in 2-AP contents of different gene editing lines
3 讨论
香味是提升作物品质的一个重要性状,是品质改良的重要内容之一,具有香味的作物品种深受消费者青睐。例如香米的种植及选育,不但历史悠久,而且成果颇丰,各国均有香稻种植。著名的香米品种在国内有东北的稻花香,国外有印度的Basmati、泰国的茉莉香型香米等[25]。这些香稻品种都具有很高的经济价值。香稻的种质资源极其丰富,极大地方便了香稻选育。玉米是世界上最重要的食粮之一,现今全世界约有三分之一人口以玉米作为主要食粮。随着玉米育种及配套加工产业的发展,玉米的食用品质不断改善,鲜食玉米和新的玉米食品如玉米片、玉米面、玉米渣、速食玉米等产品,在国内外市场上很受欢迎。如果能在现有玉米品种中加入香味性状,在满足消费者对高品质玉米相关产品需求的基础上,更可以产生巨大的经济附加值。然而在玉米中却一直没有发现具有独特香味的玉米种质,也没有香型玉米品种育成的报道。基因编辑技术在水稻、小麦、玉米和大豆等作物中的应用[12-13, 26-30],显示出该技术在性状定向遗传改良方面更加高效。本研究通过基因编辑技术,创制出了新的玉米香型材料。与编辑前的材料相比,香型玉米材料种子中2-AP含量明显提高(图4),同时具有明显的香味。此突变体材料为香型玉米育种提供了重要的种质基础。水稻、黄瓜和高粱等物种的BADH2突变,都可以产生相应的香型种质。通过敲除玉米BADH同源基因可提高香味物质2-AP含量(图4),说明玉米中BADH2也是控制香味性状的关键基因。基于这些研究结果,进一步推测该基因影响2-AP合成的机制可能在很多单、双子叶作物中都是类似的。因此,通过基因编辑技术敲除BADH2同源基因创制香型种质的策略可能是通用的,即其他作物,例如小麦中,也同样有可能创制、培育出新的香型种质或品种,进而加速香型品种的培育速度。
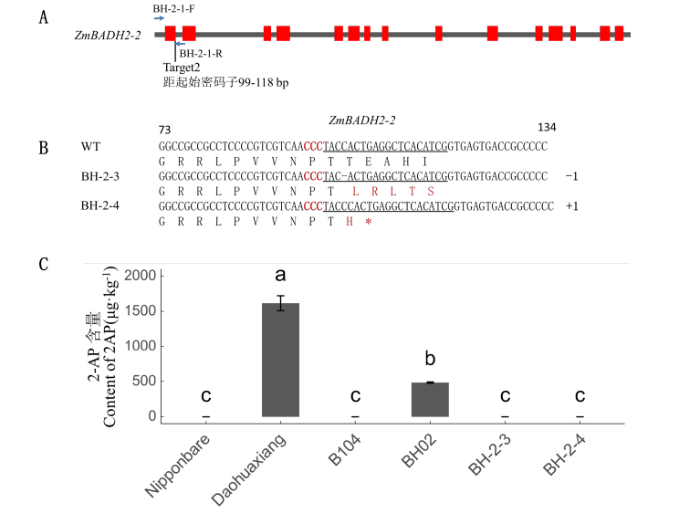
在水稻等物种中,一个BADH2突变即可产生香味突变体。而玉米中的情况则有所不同。前期工作中,在玉米自交系B104中获得ZmBADH2-2的单基因敲除突变体。由于第一外显子上发生碱基的插入和缺失,ZmBADH2-2编码区序列产生了移码(电子附图4-B)。但BH-2-3和BH-2-4这两个ZmBADH2-2单基因编辑株系的T2籽粒,并没有表现出明显的嗅觉可辨的香味,也没有检测到2-AP的存在(电子附图4-C),单独敲除ZmBADH2-2未能创制出香味玉米新种质。本研究中发现,在玉米中存在2个玉米BADH2同源基因(图 1)。考虑到2个ZmBADH2s间蛋白同源性非常高(97%),因此推断ZmBADH2-1单独敲除后,能够产生香味的可能性非常低。但ZmBADH2-1单独敲除,究竟是与ZmBADH2-2单独敲除一样无香味产生,还是有香味产生,亦或是ZmBADH2-1发挥主要作用,需要进一步的试验证明。由于BADH2控制的香味性状为隐性,如果获得香型玉米材料,必须2个玉米BADH2同时发生功能缺失突变,且同时纯合,这将大大增加通过常规手段获得香型玉米种质的难度,这可能也是到目前为止尚未有香味玉米种质材料报道的原因。基于此,通过基因编辑技术对2个基因同时进行定点突变是获得香型玉米种质的一种高效途径。
附图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT附图4T2代Zmbadh2-2纯合突变株系突变形式及2-AP含量分析
A:ZmBADH2-2靶点设计示意图。突变检测引物见电子附
Supplementary Fig.4Mutations and 2-AP content of Zmbadh2-2 mutants
A: Diagram of the sgRNA design of ZmBADH2-2. Primers used to detect mutation were shown in supplementary table 1. B: Mutations of two gene editing line on ZmBADH2-2. C: 2-AP content of Nipponbare, Daohuaxiang, B104 maize inbred line, Zmbadh2-1/Zmnadh2-2 double mutant line BH02 and two gene editing line of Zmbadh2-2 mutant in B104 background. Lower case letters represented significant difference (P<0.01) in 2-AP contents of different gene editing lines
基因突变对农艺性状的影响对生产实践来说至关重要。本研究中,从T1种子来看,目前并未观察到ZmBADH2-1和ZmBADH2-2同时突变对玉米种子性状有不利的影响(电子附图3)。为了对玉米这两个基因同时突变是否影响玉米其他的农艺性状进行更准确地评价,后续需要进行1—2代的繁种,并开展较大规模的田间试验。
CRISPR/Cas9引发的突变具有一定的随机性,对于一个特定靶点的编辑会产生一系列不同的等位突变。同一基因相同靶点的不同突变形式,在性状表现上可能会出现一定的差异。SHAN等[15]在香米突变体创制时发现,同一靶点的3种等位突变间,2-AP含量变化幅度可达20%—50%。本研究中,2个ZmBADH2同源基因在10个编辑株系中分别获得了多种不同的突变类型,其中ZmBADH2-1包含有21种,ZmBADH2-2有18种(图2),而这些株系间,种子中2-AP的含量也存在显著差异。BH13的2-AP含量(161.82 μg·kg-1)最低,可能是由于BH785的ZmBADH2-2中存在一个缺失3 bp的非移码突变,部分T1种子ZmBADH2s蛋白功能缺失不完全,或者仅仅是蛋白功能弱化所引起的。后续的育种过程中,可以进一步筛选不同的突变形式,以获得不同香味梯度、满足不同需求的基因型组合。此外,未来还可以将香味性状与甜、糯等性状进行组合,培育出食用品质更佳的新型玉米品种。
4 结论
利用CRISPR/Cas9基因编辑技术,可对玉米ZmBADH2-1和ZmBADH2-2 2个香味同源基因进行同时定点突变,双突变体籽粒中香味物质2-AP含量显著高于对照京724。基因编辑可创制全新的香型玉米种质,快速实现玉米香味性状的定向改良。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1111/pbi.2005.3.issue-3URL [本文引用: 3]
DOI:10.1021/jf0108720URL [本文引用: 1]
DOI:10.1186/s12284-016-0113-6URL [本文引用: 1]
DOI:10.1007/s00122-010-1467-6URL [本文引用: 1]
DOI:10.1007/s11032-010-9523-0URL [本文引用: 1]
[本文引用: 1]
DOI:10.1007/s00122-013-2180-zURL [本文引用: 1]
[本文引用: 1]
DOI:10.1111/pbr.2012.131.issue-5URL [本文引用: 1]
DOI:10.1186/1471-2229-8-100URL [本文引用: 1]
DOI:10.1111/pbi.v17.10URL [本文引用: 1]
DOI:10.1111/pbi.2017.15.issue-2URL [本文引用: 2]
DOI:10.3389/fpls.2020.01048URL [本文引用: 2]
DOI:10.1038/ncomms13274URL [本文引用: 1]
DOI:10.1111/pbi.2015.13.issue-6URL [本文引用: 3]
DOI:10.1186/s12870-020-02728-2URL [本文引用: 1]
DOI:10.3389/fgene.2019.00379URL [本文引用: 1]
DOI:10.1016/j.molp.2017.06.004URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1002/dvdy.v243.12URL [本文引用: 1]
DOI:10.1111/tpj.2019.97.issue-6URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1371/journal.pone.0154027URL [本文引用: 1]
DOI:10.1038/ncomms12617URL
DOI:10.1111/pbi.2018.16.issue-1URL
DOI:10.1038/s41587-020-0728-4URL [本文引用: 1]
