 ,1, 解屹1, 宋丽云1, 申莉莉1, 李莹1, 王勇2, 刘明宏3, 刘东阳2, 王小彦3, 赵存孝4, 王凤龙
,1, 解屹1, 宋丽云1, 申莉莉1, 李莹1, 王勇2, 刘明宏3, 刘东阳2, 王小彦3, 赵存孝4, 王凤龙 ,1, 杨金广
,1, 杨金广 ,1
,1Screening and Large-Scale Preparation of dsRNA for Highly Targeted Degradation of Tobacco Mosaic Virus (TMV) Nucleic Acids
XU Xiang ,1, XIE Yi1, SONG LiYun1, SHEN LiLi1, LI Ying1, WANG Yong2, LIU MingHong3, LIU DongYang2, WANG XiaoYan3, ZHAO CunXiao4, WANG FengLong
,1, XIE Yi1, SONG LiYun1, SHEN LiLi1, LI Ying1, WANG Yong2, LIU MingHong3, LIU DongYang2, WANG XiaoYan3, ZHAO CunXiao4, WANG FengLong ,1, YANG JinGuang
,1, YANG JinGuang ,1
,1通讯作者:
责任编辑: 岳梅
收稿日期:2020-06-10接受日期:2020-07-11网络出版日期:2021-03-16
| 基金资助: |
Received:2020-06-10Accepted:2020-07-11Online:2021-03-16
作者简介 About authors
徐翔,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1445KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
徐翔, 解屹, 宋丽云, 申莉莉, 李莹, 王勇, 刘明宏, 刘东阳, 王小彦, 赵存孝, 王凤龙, 杨金广. 高效靶向降解烟草花叶病毒核酸的dsRNA筛选与大量制备[J]. 中国农业科学, 2021, 54(6): 1143-1153 doi:10.3864/j.issn.0578-1752.2021.06.006
XU Xiang, XIE Yi, SONG LiYun, SHEN LiLi, LI Ying, WANG Yong, LIU MingHong, LIU DongYang, WANG XiaoYan, ZHAO CunXiao, WANG FengLong, YANG JinGuang.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】烟草花叶病毒(tobacco mosaic virus,TMV)属正单链RNA病毒,具有广泛的寄主范围,可侵染茄科、十字花科、葫芦科和菊科等多种主要的经济作物,给农业生产造成巨大损失[1]。在烟草上,由TMV侵染引起的烟草病毒病可造成烟叶产量损失达30%—50%,个别地块甚至绝产,危害十分严重。除种植抗病品种外,生产上尚无有效的防治措施进行控制。通过筛选靶向抗TMV的双链RNA (double- stranded RNA,dsRNA)并实现其大量制备,可为后续研究dsRNA诱导RNA干扰(RNA interference,RNAi)防治植物病毒病提供物质基础,同时应用小RNA测序比较短链siRNA(small interference RNA,siRNA)富集区的变化特征,可为利用该策略筛选特异性片段防治植物病毒病的研究提供理论依据。【前人研究进展】RNAi属于转录后基因沉默(post- transcriptional gene silencing,PTGS),是由dsRNA诱导产生的基因沉默现象,dsRNA被RNase Ⅲ家族的Dicer蛋白切割成siRNA,不同来源的dsRNA被Dicer酶切割后,通过与不同的AGO蛋白结合而行使功能[2]。siRNA解链后与AGO蛋白结合形成RISC复合体(RNA-induced silencing complex,RISC),降解序列互补的目标mRNA,在RNA水平上调控基因的表达[3]。siRNA是sRNA(small RNA,sRNA)的主要组成部分,sRNA广泛存在于植物中,并且种类多样,多是利用不同的RNA双链为前体切割而成的一类siRNA[4]。RNA沉默过程中还存在级联放大效应,即以siRNA中的一条链为引物,以mRNA为模板,在RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRP)的作用下合成新的次级siRNA,进而引发后续的循环扩大反应[5]。自然界中植物本身能够表达病毒的部分基因组来免疫病毒或类病毒,鉴于此,用转基因的方式实现了内源基因的沉默。HAMEED等将3种马铃薯病毒——马铃薯X病毒(potato virus X,PVX)、马铃薯Y病毒(potato virus Y,PVY)、马铃薯S病毒(potato virus S,PVS)基因序列设计成600 bp反向重复序列载体,将其转入到马铃薯细胞中,该载体可以表达出具有发夹结构的双链RNA,获得对这3种病毒均有抗性的马铃薯转基因株系[6]。但是转基因体系可能存在严重的脱靶效应[7],因此难以获得具有强抗性的转基因品系。与转基因的方法相比,利用原核系统表达dsRNA来干扰病毒的侵染,减轻病毒病的危害,这一方法避开了转基因工作量大、周期长、费时费力的弊端,并且可以针对多种病毒,同时混合多种病原的dsRNA,与转基因植物相比优势明显,更加利于推广。常见的植物病毒病多是由RNA病毒引起的,因此植物体内的RNAi机制本身就是一道天然抗病屏障,如何将该原理用于生产从而实现对病毒病的防治是近些年的研究热点[8]。2003年,TENLLADO等[9]利用体外喷施dsRNA的方法防治植物病毒病,开启了RNAi农药的研究热潮。该研究采用大肠杆菌(Escherichia coli)特异性菌株初步建立了dsRNA的细菌大量生产体系和粗提方法,针对辣椒轻斑驳病毒(pepper mild mottle virus,PMMoV)的PMMoV IR 54基因,在烟草叶面上直接施用菌液粗提液,发现可诱导烟草对PMMoV的抗性;AALTO等[10]利用噬菌体?6、T7 RNA聚合酶和RNA依赖性RNA聚合酶来大规模生产用于RNAi的dsRNA;解昆仑等[11]利用超声波振碎的方法提取dsRNA,发现HC-Pro基因片段dsRNA对小西葫芦黄花叶病毒病的防治效果可达95%,显著降低植株的发病率、延迟植株发病时间。【本研究切入点】在烟田生产中利用dsRNA溶液预防TMV的侵染已有研究,将菌液超声波破碎后作为药液施用,具有良好的防治效果[12]。对于利用小RNA测序技术探究dsRNA抑制TMV致病机理的研究鲜见报道。【拟解决的关键问题】筛选高效抑制TMV侵染的dsRNA片段,构建原核表达载体实现该dsRNA的量化生产,同时利用小RNA深度测序技术探索small RNA表达特点。1 材料与方法
试验于2019—2020年在中国农业科学院烟草研究所完成。1.1 样品准备
供试植物、菌株及质粒:烟草花叶病毒普通株系(TMV-C)、TMV-30B侵染性克隆、本氏烟(Nicotiana benthamiana)、三生烟(Nicotiana tabacum var. Samsun NN)由中国农业科学院烟草研究所植物保护研究中心保存。烟株均在人工气候室中培养,条件为光周期L﹕D=16 h﹕8 h,25℃,光合有效辐射100 μmol·m-2·s-1,相对湿度约80%。供试大肠杆菌DH5α购自北京全式金生物技术有限公司。大肠杆菌HT115、L4440质粒由福建农林大学植物病毒研究所馈赠。试剂:PCR产物胶回收试剂盒、质粒小提试剂盒、RNA提取试剂盒购自北京全式金生物技术有限公司;pCE2 TA/Blunt-Zero vector购自诺唯赞公司;in vitro Transcription T7 Kit、S1 Nuclease、RNA反转录试剂盒和一步法荧光定量PCR试剂盒购自TaKaRa公司;蛋白提取试剂盒、SuperSignal West Pico Trial Kit购自Solarbio公司;异丙基-β-D-硫代半乳糖苷(isopropyl- β-D-thio-galactopyranoside,IPTG)、LB培养基、氨苄青霉素、四环素、Tris、NaCl、EDTA、苯酚、氯仿、异戊醇、SDS、β-巯基乙醇购自北京国药集团化学试剂有限公司;试验引物于派森诺生物科技有限公司合成。
1.2 dsRNA的体外转录制备
根据TMV各基因功能选定CP、MP、P126、RdRP851-1238、RdRP1461-1774、RdRP1573-2330 6段序列(图1)并设计引物(表1),通过在线BLSAT程序(图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1TMV基因片段示意图
Fig. 1Schematic diagram of TMV gene fragment
Table 1
表1
表1本研究所用引物
Table 1
| 引物 Primer | 引物序列 Primer sequence (5′-3′) | 产物长度 Expected size (bp) | 引物用途 Use of primer |
|---|---|---|---|
| TMVCP-F | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGATGTCTTACAGTATCACTACTCC-3′ | 548 | 克隆带启动子的CP基因 CP gene with promoter fragment cloning |
| TMVCP-R | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGAGTTGCAGGACCAGAGG-3′ | ||
| TMVMP-F | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGGGAAAGAGCCGACGAG-3′ | 401 | 克隆带启动子的MP基因 MP gene with promoter fragment cloning |
| TMVMP-R | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGGCAAGCCTGATTGACATA-3′ | ||
| TMVP126-F | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGTCTTACCGTCGATGTTT-3′ | 709 | 克隆带启动子的P126基因 P126 gene with promoter fragment cloning |
| TMVP126-R | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGGTTCTTGTTCGGCACT-3′ | ||
| TMVRdRP851-1238F | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGCTTACTTCCCGGCCTCTA-3′ | 456 | 克隆带启动子的RdRP851-1238基因 RdRP851-1238 gene with promoter fragment cloning |
| TMVRdRP851-1238R | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGGCTTTCGCCTGGTATGTT-3′ | ||
| TMVRdRP1461-1774F | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGATTTCGCTGGCGTTTG-3′ | 381 | 克隆带启动子的RdRP1461-1774基因 RdRP1461-1774 gene with promoter fragment cloning |
| TMVRdRP1461-1774R | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGCTGCCGTCATTGGGTC-3′ | ||
| TMVRdRP1573-2330F | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGTGACCTTCCACGACAGA-3′ | 825 | 克隆带启动子的RdRP1573-2330基因 RdRP1573-2330 gene with promoter fragment cloning |
| TMVRdRP1573-2330R | 5′-ATTCTCTAGAAGCTTAATACGACTCACTATAGGGAGCGCCACATGATACTT-3′ | ||
| L4440-dsRdRP1461-1774F | 5′-GGAGACCGGCAGATCTATTTCGCTGGCGTTTGGG-3′ | _ | 重组表达载体的构建 Construction of recombinant expression vector |
| L4440-dsRdRP1461-1774R | 5′-TATAGGGCGAATTGGGTACCCTGCCGTCATTGGGTCAAC-3′ | ||
| L4440-F | 5′-CTTTATAGTCCTGTCGGGTTTCGC-3′ | _ | 重组表达载体测序 Sequencing of recombinant expression vector |
| L4440-R | 5′-GGCGAGAAAGGAAGGGAAGAAAG-3′ | ||
| Actin-F | 5′-CAAGGAAATCACCGCTTTGG-3′ | _ | Actin基因转录水平的检测 Detection of Actin gene transcript level |
| Actin-R | 5′-AAGGGATGCGAGGATGGA-3′ | ||
| TMV-F | 5′-GAGTAGACGACGCAACGG-3′ | _ | TMV CP基因转录水平检测 Detection of TMV CP transcript level |
| TMV-R | 5′-CCAGAGGTCCAAACCAAAC-3′ |
新窗口打开|下载CSV
1.3 不同dsRNA对TMV的抑制检测
TMV抑制试验:以PBS处理为阴性对照,待烟株长至适当大小,选取大小一致的同位叶,分别浸润体外转录合成的dsRNA,每株300 μg,浸润24 h后,通过摩擦接种TMV。每个处理进行3次生物学重复,25℃、16 h·d-1光照培养。接种后2、3 d取样,于液氮中迅速冷冻,提取病毒接种叶片总RNA和总蛋白,于-80℃条件下保存备用。qRT-PCR检测:Trizol法提取叶片总RNA后,检测RNA浓度和纯度达到预定标准,合成cDNA。以Actin为内参,以浸润PBS样品的CT值为标准1,用相对CT法公式2-??CT,ABI 7500上进行qRT-PCR反应,计算不同处理叶片的相对RNA积累量。
Western blot检测:提取处理叶总蛋白,保持上样蛋白浓度一致,进行SDS-聚丙烯酰胺凝胶电泳和转膜。取出PVDF膜封闭1 h,按1﹕2 000稀释TMV-CP一抗,4℃孵育过夜,按1﹕5 000稀释HRP标记的二抗,摇床上孵育2 h。TBST洗膜后涂抹发光液ECL(SuperSignal West Pico Trial Kit),于化学发光成像分析仪中成像拍照。
TMV-30B抑制试验:为进一步筛选TMV病毒防治中的高效dsRNA,待烟株长至适当大小,先浸润不同dsRNA及PBS,24 h后接种TMV-30B。25℃、16 h·d-1光照培养。TMV-30B接种3、5 d后,于紫外灯下观察荧光并拍照。
三生烟枯斑试验:为进一步验证TMV病毒防治中的高效dsRNA,待三生烟株长至适当大小,先浸润dsRNA及PBS,12 h后接种TMV病毒。TMV接毒后3 d观察枯斑数量并拍照。
small RNA深度测序分析:本氏烟叶片分别浸润RdRP1461-1774 dsRNA或PBS,24 h后接种TMV,接毒后72 h取浸润叶于液氮中速冻,送美吉生物公司进行small RNA测序,质控合格后获得的small RNA序列与TMV RdRP全长核酸序列进行bowtie比对。利用比对结果,统计在TMV RdRP全长核酸序列上每单位长度的small RNA表达丰度count计数值并绘图。
1.4 dsRNA的原核表达及大量制备
表达载体构建:根据RdRP1461-1774基因片段cDNA序列及L4440载体的酶切位点,Premier 5.0设计扩增引物L4440-dsRdRP1461-1774F和L4440- dsRdRP1461-1774R及测序引物(表1),利用高保真酶扩增 RdRP1461-1774基因片段,凝胶电泳鉴定片段长度,产物胶回收;回收产物与pCE2 TA/Blunt-Zero vector连接并转化DH5α感受态,阳性克隆送至派森诺生物科技有限公司测序;测序正确的克隆,抽提质粒与L4440质粒分别用Bgl II、Kpn Ⅰ内切酶进行双酶切,产物经凝胶电泳回收大小约为381和2 624 bp目的条带。回收的DNA片段用T4酶连接,连接产物转化至DH5α感受态,阳性克隆做菌液PCR,并抽提质粒做双酶切鉴定,鉴定正确的菌液送派森诺生物科技有限公司测序。测序正确的重组质粒转化至HT115感受态细胞中,阳性克隆做菌液PCR,并抽提质粒做双酶切鉴定,鉴定正确的菌液制成甘油菌保存于-80℃备用。重组载体诱导表达及提取纯化:取保存的菌液接入10 mL LB培养基(Amp+Tet)中培养至OD600=0.4,加入20 μL的IPTG(终浓度为0.4 mmol·L-1)诱导5 h后离心去部分上清液,超声破碎裂解细胞。以转化空载体L4440的HT115菌液为对照,按照上述同样的方法进行培养。破碎后菌液加入500 μL 2×STE溶液(pH 8.0)、500 μL苯酚/氯仿/异戊醇(25﹕24﹕1)、15 μL β-巯基乙醇、50 μL 10% SDS,涡旋3 min,8 000 r/min离心10 min,取上清用无水乙醇调至终浓度为17%,注入CF-11纤维素柱中。用含17%乙醇的1×STE溶液洗柱后,继续用不含乙醇的1×STE溶液洗柱,于核酸紫外检测仪下检测并收集核酸洗脱液。洗脱液加入等体积的预冷异丙醇,-20℃沉淀30 min。12 000 r/min离心15 min,沉淀用75%乙醇洗涤,溶于30 μL无菌水,取少量电泳检测,其余样品于-20℃保存。
柱提dsRNA的酶解与鉴定:提取菌液核酸后,用RNase-Free DNase处理,去除残存的DNA,然后加S1 Nuclease检验是否得到dsRNA,按照上述PCR方法对柱提dsRNA特异性进行检测。
三生烟枯斑试验:按照上述接毒试验操作,将柱提的核酸喷施在三生烟上,接TMV 3 d后观察叶片上出现的枯斑数量。
2 结果
2.1 TMV dsRNA的体外转录制备
选取TMV(基因序列号:NC_001367.1)的全基因组序列为参考序列,围绕TMV编码的3个基因,设计了6对引物,通过体外转录分别制备6段dsRNA,即CP、MP、P126、RdRP851-1238、RdRP1461- 1774、RdRP1573-2330(图2),片段大小分别为480、333、641、388、313和746 bp,与预期目的基因大小相符。图2
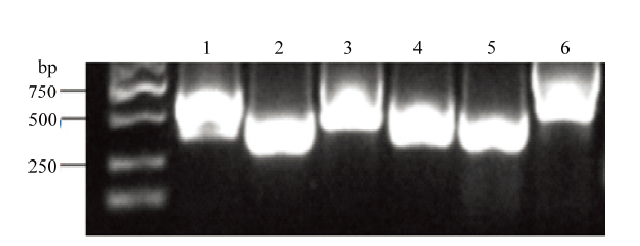 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2目的基因dsRNA电泳图
Fig. 2dsRNA electrophoresis of target genes
1: CP dsRNA; 2: MP dsRNA; 3: P126 dsRNA; 4: RdRP851-1238 dsRNA; 5: RdRP1461-1774 dsRNA; 6: RdRP1573-2330 dsRNA
2.2 不同dsRNA对TMV致病力的影响
为确定不同dsRNA对TMV的抑制效果,以TMV CP基因表达量为统一衡量标准,qRT-PCR检测结果表明,与空白对照(浸润缓冲液)相比,不同dsRNA浸润处理后,TMV侵染第3天的叶片中病毒CP基因表达量显著低于空白对照中TMV CP基因表达量,但不同dsRNA对病毒CP基因表达量的影响有明显差异,其中RdRP1461-1774 dsRNA、MP dsRNA和RdRP1573-2330 dsRNA对TMV CP基因的抑制作用更显著(图 3)。以上结果表明,本研究设计的TMV基因组不同区域dsRNA均可提升烟株抗TMV侵染的能力,暗示在TMV侵染早期,植株叶片中浸润dsRNA能够抑制和延缓靶向病毒的侵染。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同dsRNA处理对野生型TMV表达量的影响
利用邓肯氏多重极差测验法进行方差分析(SPSS 软件),柱上不同小写字母表示差异显著(α=0.05)
Fig. 3Effects of different dsRNA treatments on the expression of wild-type TMV
Analysis of variance (SPSS software) was conducted using Duncan’s multiple range test, different lowercase letters on the bars indicate significant difference (α=0.05)
为进一步验证TMV基因组不同区域dsRNA对TMV CP蛋白表达量的影响,通过Western blot技术对TMV CP蛋白表达量进行了定量检测分析,结果表明(图4),TMV CP dsRNA、MP dsRNA、P126 dsRNA、RdRP851-1238 dsRNA、RdRP1461-1774 dsRNA、RdRP1573-2330 dsRNA处理后,TMV CP蛋白表达量显著低于正常对照组的表达量,这与CP基因在RNA水平的表达趋势基本一致。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4不同dsRNA处理后接毒的叶片中病毒CP蛋白含量
1:Marker,2—8:分别为PBS、TMV CP dsRNA、MP dsRNA、P126 dsRNA、RdRP851-1238 dsRNA、RdRP1461-1774 dsRNA、RdRP1573-2330 dsRNA浸润后接毒的TMV CP蛋白表达量
Fig. 4Expression of CP protein of virus in infected leaves after different dsRNA treatments
The expression of TMV CP protein after infiltration of PBS, TMV CP dsRNA, MP dsRNA, P126 dsRNA, RdRP851-1238 dsRNA, RdRP1461-1774 dsRNA, RdRP1573-2330 dsRNA
为进一步验证TMV基因组不同区域dsRNA确实抑制TMV在烟草内的侵染复制,利用TMV-30B为抑制靶标,将CP基因水平和蛋白水平表达差异显著性最强的两个dsRNA,RdRP1461-1774 dsRNA和MP dsRNA分别浸润烟草后,接种TMV-30B,与空白对照(浸润缓冲液)相比,RdRP1461-1774 dsRNA和MP dsRNA两个处理组样本的绿色荧光区域明显少于对照组(图5),第5天对照组叶片开始萎蔫皱缩,而处理组未出现萎蔫现象,说明RdRP1461-1774 dsRNA和MP dsRNA能够延缓叶片萎蔫的时间,且RdRP1461-1774 dsRNA处理组叶片荧光区域更小。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5本氏烟不同dsRNA处理后接种TMV-30B症状
Fig. 5Symptoms of TMV-30B inoculation after different dsRNA treatments of N. benthamiana
为进一步解释RdRP1461-1774 dsRNA可介导植物降解TMV基因组核酸,对初始侵染病毒RNA具有降解作用,利用TMV免疫枯斑寄主三生烟为研究材料,浸润RdRP1461-1774 dsRNA后,接种TMV病毒3 d后,结果显示浸润RdRP1461-1774 dsRNA的植株其枯斑数量明显低于空白对照组,且边缘并未出现萎蔫现象(图6),暗示RdRP1461-1774 dsRNA可介导植物降解TMV侵染初始RNA。
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6三生烟叶片浸润dsRNA后接种TMV 3 d的症状
Fig. 6Symptoms of Samsun NN leaves infiltrated with dsRNA after 3 d of TMV inoculation
2.3 dsRNA的原核表达及大量制备
重组构建了L4440-dsRdRP1461-1774原核表达质粒,经Bgl Ⅱ和Kpn Ⅰ双酶切后,可分别检测到约381、2 624 bp目的条带(图7中1泳道),片段大小与预期相符,结合序列测定,显示RdRP1461- 1774 dsRNA原核表达重组表达质粒构建成功。RdRP1461-1774 dsRNA原核表达重组表达质粒转化到DE3感受态细胞中,通过IPTG诱导,结果显示,与L4440空载体对照相比,由含重组L4440- dsRdRP1461-1774表达载体的菌液所提取的核酸经RNase-Free DNase和S1 Nuclease消化处理(图7中2—6泳道),目的条带(约400 bp处)明显,证明L4440-dsRdRP1461-1774菌液经诱导后成功表达出dsRNA,大小约为381 bp,PCR结果显示有特异性目的条带(图7中7泳道),以上结果证明RdRP1461-1774 dsRNA可通过原核表达体系实现大量制备和工业化生产。柱提的核酸喷施在三生烟叶上接种TMV 3 d后,处理组仅出现零星的斑点,而对照组叶片出现大范围密集斑点,处理组叶片枯斑数量少于对照组叶片(图8)。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7重组载体表达及鉴定电泳图
Marker:2000 bp DNA marker;1:L4440-dsRdRP1461-1774重组载体的双酶切验证Identification of L4440-dsRdRP1461-1774 recombinant vector by double restriction endonuclease digestion;2:L4440-dsRdRP1461-1774菌液提取的核酸Nucleic acid extracted from L4440-dsRdRP1461-1774 bacterial solution;3:RNase-Free DNase处理过的L4440-dsRdRP1461-1774菌液核酸RNase-Free DNase treated L4440-dsRdRP1461-1774 bacterial solution nucleic acid;4:S1 Nuclease处理过的L4440-dsRdRP1461-1774菌液核酸S1 Nuclease treated L4440-dsRdRP1461-1774 bacterial solution nucleic acid;5:RNase-Free DNase、S1 Nuclease处理过的L4440- dsRdRP1461-1774菌液核酸RNase-Free DNase, S1 Nuclease treated L4440-dsRdRP1461-1774 bacterial solution nucleic acid;6:RNase-Free DNase、S1 Nuclease处理过的L4440菌液核酸样品RNase-Free DNase, S1 Nuclease-treated L4440 bacterial solution nucleic acid sample;7:菌液PCR检测 Fragments amplified by PCR from bacterial culture
Fig. 7Expression and identification of recombinant vector
图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8TMV接种3 d后的枯斑三生烟
Fig. 8Samsun NN after 3 d of TMV inoculation
2.4 RdRP1461-1774 dsRNA喷施烟草后生成的siRNA分析
近年来的小RNA组的高通量深度测序结果表明,植物细胞中80%以上的小RNA为siRNA[13],因此,为解释RdRP1461-1774 dsRNA通过物理浸润可在叶面内实现RNAi,以浸润PBS后TMV侵染烟叶为对照,通过small RNA深度测序,对RdRP1461- 1774 dsRNA浸润后接毒叶片进行了分析,正值和负值分别代表从正义链和反义链中提取的small RNA的覆盖数。结果显示,PBS浸润接毒后产生的小RNA峰度值为6 000(图9-A),而外源RdRP1461-1774 dsRNA浸润接毒后峰度值高达90 000(图9-B)。对照组的siRNA是由TMV感染引入的dsRNA前体加工而来,测序结果中正义链和反义链以大致相等的频率产生siRNA(图9-A),而RdRP1461-1774 dsRNA浸润处理组中,靶向核苷酸区域的small RNA峰度值显著高于对照组峰度值。以上数据证明Dicer酶成功酶解dsRNA,产生了大量siRNA,呈现高峰值表达。另外由图9-B可知,外源dsRNA浸润接毒后siRNA的反义链累积量骤增,对应的正义链累积量骤减。图9
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9Small RNA测序与个性化分析图
Fig. 9Small RNA sequencing and personalized analysis map
3 讨论
RNAi技术在病毒防治方面早有研究[12,14],但在将这些应用产业化之前,对于高效作用片段的筛选研究较少,靶片段的选取仍然是RNAi的重点,在很大程度上影响RNAi的效果。本研究所使用的病毒靶标基因筛选的方法,可以作为同类型RNAi防治病毒病的方法参考,通过比较基因功能获得一批候选的dsRNA后,用生物学方法评估其抗病毒能力,在此基础上筛选高效降解TMV靶向核酸的dsRNA,最终筛选出TMV基因组中RdRP基因上一段长313 bp的高效作用片段。病毒核酸复制酶的核心功能是合成全长的病毒基因组RNA,是特异性依赖于病毒RNA的RNA聚合酶(RdRP)[15],有研究表明与植物病原病毒外壳蛋白相比,转病毒的复制酶基因能够赋予感病寄主植物相对较高的抗病毒能力[16],推测干扰RdRP段基因能够更好地抑制病毒的侵染[17],该片段dsRNA能够高效与靶基因结合,降低染病植株TMV的表达量,实现对植株的靶向RNAi保护。利用RNAi技术防治植物病毒病,防治效果首先取决于高效dsRNA片段的筛选,另外如何将dsRNA高效递送至植物体内也是近年来的研究热点[18,19]。植物体内dsRNA酶解为小RNA诱导内源靶基因的沉默,引起植物抗病毒的RNAi过程[20]。双链RNA被Dicer识别降解,不会被翻译成蛋白质,避免了外源蛋白质在植株体内的积累,具有较高的生物安全性[21]。酶解成的siRNA一条链与AGO蛋白形成诱导沉默复合物,复合体通过碱基互补配对识别靶基因,介导降解、翻译抑制或组蛋白甲基化等,导致特异性的基因沉默,即使互补区不完全配对,也会导致翻译抑制[22]。而小RNA不仅可以从外源基因的表达中获得,植物本身也会产生内源RNA[23]。随着测序技术的进步,已经发现越来越多的内源性小RNA。这类小RNA前体一般有两种来源,一种是互补DNA的区段分别被转录下来形成的正义、反义双链,或者从染色体上不同位置转录来的互补双链[24],总之合成dsRNA的双链均是从基因组上复制下来,天然存在并互补,这种转录途径一般在高盐或者细菌病原体入侵时被诱导产生,当病毒成功侵染植物细胞后,病毒的核酸需要利用植物的蛋白质合成系统完成自我复制,病毒侵染的植物细胞内会产生病毒来源的小分子RNA(vsiRNA),vsiRNA对于宿主基因表达的调控程度可能取决于vsiRNA的丰度[25],本研究的测序结果也显示TMV侵染时正义链和反义链以大致相等的频率产生小RNA,小RNA参与了植物的免疫调节反应,作为效应分子在病毒进入植物体内后利用RNAi机制沉默病毒靶基因[26]。将RNAi技术应用于烟草抗TMV基因工程研究,必定会带动其他植物抗病毒的相关理论问题和应用实践研究。
利用T7启动子体外转录合成dsRNA是目前的主流合成技术,但该技术生产dsRNA具有成本高,操作繁琐等特点,严重限制了dsRNA的量化生产。考虑到体外转录制备的dsRNA量非常少,满足不了田间病毒防治的剂量需求,为此,针对RdRP1461-1774 dsRNA开展了原核表达体系构建,以期实现低成本制备[27,28],利用原核表达技术实现dsRNA的高效量产。利用原核系统表达dsRNA来干扰病毒的侵染,减轻病毒病的危害,通过叶面喷施dsRNA来防治病毒病是一种环境友好型思路[29],符合当下对绿色农业的推进政策。本研究仅限于浸润及喷施裸dsRNA的方法来防治病毒病,针对dsRNA可能存在的降解问题,后续可以考虑用纳米材料修饰以提高其稳定性[30],针对田间生长时常有多种病毒病混合发生的现象,也可以考虑混合多种病原dsRNA,防治多种病毒病,更加利于推广[31]。
4 结论
通过比较dsRNA介导植物靶向抗TMV侵染的效果,最终选定TMV基因中RdRP基因上一段长313 bp的高效作用片段RdRP1461-1774。同时构建了RdRP1461-1774基因片段的dsRNA原核表达系统,实现其低成本的高效量产,为后续研究dsRNA诱导RNAi防治植物病毒病提供了物质基础。通过小RNA深度测序技术,对外源性dsRNA干扰TMV侵染机理进行了探究,明确dsRNA通过物理浸润可在叶面内实现RNAi全过程,且物理浸润的外源性dsRNA会改变TMV侵染的small RNA表达特征和富集带。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
URL [本文引用: 1]

烟草病毒病害在我国烟草上的危害日趋严重。本文是作者对我国烟草病毒病防治研究的理性思考,通过对我国烟草病毒病防治研究的历史回顾、近年严重发生的原因分析,提出了今后该方面研究的重点。
URL [本文引用: 1]

烟草病毒病害在我国烟草上的危害日趋严重。本文是作者对我国烟草病毒病防治研究的理性思考,通过对我国烟草病毒病防治研究的历史回顾、近年严重发生的原因分析,提出了今后该方面研究的重点。
DOI:10.1146/annurev.cellbio.042308.113417URLPMID:19575669 [本文引用: 1]

Small RNAs of 20-30 nucleotides guide regulatory processes at the DNA or RNA level in a wide range of eukaryotic organisms. Many, although not all, small RNAs are processed from double-stranded RNAs or single-stranded RNAs with local hairpin structures by RNase III enzymes and are loaded into argonaute-protein-containing effector complexes. Many eukaryotic organisms have evolved multiple members of RNase III and the argonaute family of proteins to accommodate different classes of small RNAs with specialized molecular functions. Some small RNAs cause transcriptional gene silencing by guiding heterochromatin formation at homologous loci, whereas others lead to posttranscriptional gene silencing through mRNA degradation or translational inhibition. Small RNAs are not only made from and target foreign nucleic acids such as viruses and transgenes, but are also derived from endogenous loci and regulate a multitude of developmental and physiological processes. Here I review the biogenesis and function of three major classes of endogenous small RNAs in plants: microRNAs, trans-acting siRNAs, and heterochromatic siRNAs, with an emphasis on the roles of these small RNAs in developmental regulation.
DOI:10.1038/nrg2504URLPMID:19148191 [本文引用: 1]

Since the discovery in 1993 of the first small silencing RNA, a dizzying number of small RNA classes have been identified, including microRNAs (miRNAs), small interfering RNAs (siRNAs) and Piwi-interacting RNAs (piRNAs). These classes differ in their biogenesis, their modes of target regulation and in the biological pathways they regulate. There is a growing realization that, despite their differences, these distinct small RNA pathways are interconnected, and that small RNA pathways compete and collaborate as they regulate genes and protect the genome from external and internal threats.
DOI:10.1038/nrm2632URLPMID:19165215 [本文引用: 1]

Small RNAs of 20-30 nucleotides can target both chromatin and transcripts, and thereby keep both the genome and the transcriptome under extensive surveillance. Recent progress in high-throughput sequencing has uncovered an astounding landscape of small RNAs in eukaryotic cells. Various small RNAs of distinctive characteristics have been found and can be classified into three classes based on their biogenesis mechanism and the type of Argonaute protein that they are associated with: microRNAs (miRNAs), endogenous small interfering RNAs (endo-siRNAs or esiRNAs) and Piwi-interacting RNAs (piRNAs). This Review summarizes our current knowledge of how these intriguing molecules are generated in animal cells.
DOI:10.1101/gad.1410506URLPMID:16600909 [本文引用: 1]

Small RNAs are riboregulators that have critical roles in most eukaryotes. They repress gene expression by acting either on DNA to guide sequence elimination and chromatin remodeling, or on RNA to guide cleavage and translation repression. This review focuses on the various types of post-transcriptional small RNA-directed pathways in plants, describing their roles and their regulations.
DOI:10.1007/s12033-017-9995-9URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.tplants.2013.04.001URLPMID:23684690 [本文引用: 1]

Plants employ multiple layers of innate immunity to fight pathogens. For both RNA and DNA viruses, RNA silencing plays a critical role in plant resistance. To escape this antiviral silencing-based immune response, viruses have evolved various counterdefense strategies, the most widespread being production of viral suppressors of RNA silencing (VSRs) that target various stages of the silencing mechanisms. Recent findings from in planta analyses have provided new insights into the mode of action of VSRs and revealed that plants react to the perturbation of the silencing pathways brought by viral infection by deploying a battery of counter-counterdefense measures. As well as discussing which experimental approaches have been most effective in delivering clear and unambiguous results, this review provides a detailed account of the surprising variety of offensive and defensive strategies set forth by both viruses and hosts in their struggle for survival.
DOI:10.1186/1472-6750-3-3URLPMID:12659646 [本文引用: 1]

BACKGROUND: Double-stranded RNA (dsRNA) is a potent initiator of gene silencing in a diverse group of organisms that includes plants, Caenorhabditis elegans, Drosophila and mammals. We have previously shown and patented that mechanical inoculation of in vitro-transcribed dsRNA derived from viral sequences specifically prevents virus infection in plants. The approach required the in vitro synthesis of large amounts of RNA involving high cost and considerable labour. RESULTS: We have developed an in vivo expression system to produce large amounts of virus-derived dsRNAs in bacteria, with a view to providing a practical control of virus diseases in plants. Partially purified bacterial dsRNAs promoted specific interference with the infection in plants by two viruses belonging to the tobamovirus and potyvirus groups. Furthermore, we have demonstrated that easy to obtain, crude extracts of bacterially expressed dsRNAs are equally effective protecting plants against virus infections when sprayed onto plant surfaces by a simple procedure. Virus infectivity was significantly abolished when plants were sprayed with French Press lysates several days before virus inoculation. CONCLUSION: Our approach provides an alternative to genetic transformation of plant species with dsRNA-expressing constructs capable to interfere with plant viruses. The main advantage of this mode of dsRNA production is its simplicity and its extremely low cost compared with the requirements for regenerating transgenic plants. This approach provides a reliable and potential tool, not only for plant protection against virus diseases, but also for the study of gene silencing mechanisms in plant virus infections.
DOI:10.1261/rna.348307URLPMID:17237359 [本文引用: 1]

The discovery of RNA interference (RNAi) has revolutionized biological research and has a huge potential for therapy. Since small double-stranded RNAs (dsRNAs) are required for various RNAi applications, there is a need for cost-effective methods for producing large quantities of high-quality dsRNA. We present two novel, flexible virus-based systems for the efficient production of dsRNA: (1) an in vitro system utilizing the combination of T7 RNA polymerase and RNA-dependent RNA polymerase (RdRP) of bacteriophage 6 to generate dsRNA molecules of practically unlimited length, and (2) an in vivo RNA replication system based on carrier state bacterial cells containing the 6 polymerase complex to produce virtually unlimited amounts of dsRNA of up to 4.0 kb. We show that pools of small interfering RNAs (siRNAs) derived from dsRNA produced by these systems significantly decreased the expression of a transgene (eGFP) in HeLa cells and blocked endogenous pro-apoptotic BAX expression and subsequent cell death in cultured sympathetic neurons.
DOI:10.3864/j.issn.0578-1752.2020.08.008URL [本文引用: 1]

【目的】小西葫芦黄花叶病毒(Zucchini yellow mosaic virus,ZYMV)是危害西瓜最为普遍的病毒,在西瓜上利用外源喷施病毒基因dsRNA的方法实现对ZYMV的预防和治疗。【方法】首先以实验室已有的ZYMV病毒序列为依据,针对其不同的基因片段,利用NCBI数据库找出与其相似的序列。随后利用软件DNAMAN8对序列进行多重比对分析,找出其保守区域,根据分析结果选择长度介于200—350 bp的ZYMV 3′UTR、6K2、HC-Pro、P3、NIb 5个基因片段,同时选择长度为190 bp的GUS基因片段作为对照。PCR扩增得到这6个片段后,利用同源重组的方法将它们插入到含有双T7启动子的L4440载体中,并利用RNAⅢ酶缺陷型大肠杆菌HT115建立原核表达系统生产dsRNA,采用超声波破碎的方法释放dsRNA,利用TE(10 mmol·L -1 Tris-HCl和1 mmol·L -1 EDTA)缓冲液溶解dsRNA,最后比较和分析IPTG使用浓度、诱导时间以及超声波破碎时间对dsRNA表达和释放的影响。在西瓜植株上采用喷施的方法施用dsRNA,设计先喷施dsRNA后接种病毒的预防试验和先接种病毒后喷施dsRNA的治疗试验,通过统计分析接种病毒后21 d发病率的方法评价dsRNA预防和治疗ZYMV的效果。【结果】针对ZYMV的3′UTR、6K2、HC-Pro、P3、NIb 5个基因片段以及GUS基因片段建立了能够高效稳定表达和释放dsRNA的生产体系。在IPTG诱导浓度为8 mmol·L -1,诱导时间为7 h,在宁波新芝牌超声波细胞破碎仪3ø的档位和60%的输出功率条件下破碎15 min,细胞可以有效产生和释放dsRNA。在对ZYMV的预防试验中发现,喷施GUS基因片段的dsRNA以及TE缓冲液的西瓜植株发病率均为100%的情况下,对ZYMV防治效果最好的是HC-Pro基因片段,接种ZYMV 21 d后防治效果可达到95%,防治效果相对较差的是NIb基因片段,但也可达到80%。在此基础上对HC-Pro片段预防和治疗ZYMV的效果进行了深入分析,结果发现在喷施HC-Pro片段的dsRNA后第3、5、7天接种ZYMV,植株发病率分别为16%、63%、63%,在接种ZYMV后第1、3、5、7天分别喷施HC-Pro片段的dsRNA,无明显的治疗效果,仅起到延迟植株发病的效果。【结论】建立了针对ZYMV不同基因片段的dsRNA原核表达体系,并发现基于HC-Pro基因片段产生的dsRNA对ZYMV防治效果最好,可显著降低植株的发病率、延迟植株发病时间,具有应用潜力。
DOI:10.3864/j.issn.0578-1752.2020.08.008URL [本文引用: 1]

【目的】小西葫芦黄花叶病毒(Zucchini yellow mosaic virus,ZYMV)是危害西瓜最为普遍的病毒,在西瓜上利用外源喷施病毒基因dsRNA的方法实现对ZYMV的预防和治疗。【方法】首先以实验室已有的ZYMV病毒序列为依据,针对其不同的基因片段,利用NCBI数据库找出与其相似的序列。随后利用软件DNAMAN8对序列进行多重比对分析,找出其保守区域,根据分析结果选择长度介于200—350 bp的ZYMV 3′UTR、6K2、HC-Pro、P3、NIb 5个基因片段,同时选择长度为190 bp的GUS基因片段作为对照。PCR扩增得到这6个片段后,利用同源重组的方法将它们插入到含有双T7启动子的L4440载体中,并利用RNAⅢ酶缺陷型大肠杆菌HT115建立原核表达系统生产dsRNA,采用超声波破碎的方法释放dsRNA,利用TE(10 mmol·L -1 Tris-HCl和1 mmol·L -1 EDTA)缓冲液溶解dsRNA,最后比较和分析IPTG使用浓度、诱导时间以及超声波破碎时间对dsRNA表达和释放的影响。在西瓜植株上采用喷施的方法施用dsRNA,设计先喷施dsRNA后接种病毒的预防试验和先接种病毒后喷施dsRNA的治疗试验,通过统计分析接种病毒后21 d发病率的方法评价dsRNA预防和治疗ZYMV的效果。【结果】针对ZYMV的3′UTR、6K2、HC-Pro、P3、NIb 5个基因片段以及GUS基因片段建立了能够高效稳定表达和释放dsRNA的生产体系。在IPTG诱导浓度为8 mmol·L -1,诱导时间为7 h,在宁波新芝牌超声波细胞破碎仪3ø的档位和60%的输出功率条件下破碎15 min,细胞可以有效产生和释放dsRNA。在对ZYMV的预防试验中发现,喷施GUS基因片段的dsRNA以及TE缓冲液的西瓜植株发病率均为100%的情况下,对ZYMV防治效果最好的是HC-Pro基因片段,接种ZYMV 21 d后防治效果可达到95%,防治效果相对较差的是NIb基因片段,但也可达到80%。在此基础上对HC-Pro片段预防和治疗ZYMV的效果进行了深入分析,结果发现在喷施HC-Pro片段的dsRNA后第3、5、7天接种ZYMV,植株发病率分别为16%、63%、63%,在接种ZYMV后第1、3、5、7天分别喷施HC-Pro片段的dsRNA,无明显的治疗效果,仅起到延迟植株发病的效果。【结论】建立了针对ZYMV不同基因片段的dsRNA原核表达体系,并发现基于HC-Pro基因片段产生的dsRNA对ZYMV防治效果最好,可显著降低植株的发病率、延迟植株发病时间,具有应用潜力。
[D].
[本文引用: 2]
[D].
[本文引用: 2]
DOI:10.1371/journal.pbio.0050057URLPMID:17298187 [本文引用: 1]

Eukaryotes contain a diversified set of small RNA-guided pathways that control genes, repeated sequences, and viruses at the transcriptional and posttranscriptional levels. Genome-wide profiles and analyses of small RNAs, particularly the large class of 24-nucleotide (nt) short interfering RNAs (siRNAs), were done for wild-type Arabidopsis thaliana and silencing pathway mutants with defects in three RNA-dependent RNA polymerase (RDR) and four Dicer-like (DCL) genes. The profiling involved direct analysis using a multiplexed, parallel-sequencing strategy. Small RNA-generating loci, especially those producing predominantly 24-nt siRNAs, were found to be highly correlated with repetitive elements across the genome. These were found to be largely RDR2- and DCL3-dependent, although alternative DCL activities were detected on a widespread level in the absence of DCL3. In contrast, no evidence for RDR2-alternative activities was detected. Analysis of RDR2- and DCL3-dependent small RNA accumulation patterns in and around protein-coding genes revealed that upstream gene regulatory sequences systematically lack siRNA-generating activities. Further, expression profiling suggested that relatively few genes, proximal to abundant 24-nt siRNAs, are regulated directly by RDR2- and DCL3-dependent silencing. We conclude that the widespread accumulation patterns for RDR2- and DCL3-dependent siRNAs throughout the Arabidopsis genome largely reflect mechanisms to silence highly repeated sequences.
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
URLPMID:18954886 [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1021/acsami.5b05232URLPMID:26291176 [本文引用: 1]

In spite of devastating impact of mosquito borne pathogens on humans, widespread resistance to chemical insecticides and environmental concerns from residual toxicity limit mosquito control strategies. We tested three nanoparticles, chitosan, carbon quantum dot (CQD), and silica complexed with dsRNA, to target two mosquito genes (SNF7 and SRC) for controlling Aedes aegypti larvae. Relative mRNA levels were quantified using qRT-PCR to evaluate knockdown efficiency in nanoparticle-dsRNA treated larvae. The knockdown efficiency of target genes correlated with dsRNA mediated larval mortality. Among the three nanoparticles tested, CQD was the most efficient carrier for dsRNA retention, delivery, and thereby causing gene silencing and mortality in Ae. aegypti.
[D].
[本文引用: 1]
[D].
[本文引用: 1]
URL [本文引用: 1]

在植物中,起始于双链RNA的长度为21~24个核苷酸的小RNA,能够诱发两种形式的表观遗传学基因沉默。转录后基因沉默 (Post-transcriptional gene silencing,PTGS),可以介导细胞质中同源mRNA的降解;转录基因沉默 (Transcriptional gene silencing,TGS),则主要通过小RNA介导同源启动子区的DNA甲基化,从而抑制基因转录。文中针对PTGS和TGS通路的区别与联系、沉默传递研究的现状及内源与外源基因沉默的异同点等问题进行探讨。
URL [本文引用: 1]

在植物中,起始于双链RNA的长度为21~24个核苷酸的小RNA,能够诱发两种形式的表观遗传学基因沉默。转录后基因沉默 (Post-transcriptional gene silencing,PTGS),可以介导细胞质中同源mRNA的降解;转录基因沉默 (Transcriptional gene silencing,TGS),则主要通过小RNA介导同源启动子区的DNA甲基化,从而抑制基因转录。文中针对PTGS和TGS通路的区别与联系、沉默传递研究的现状及内源与外源基因沉默的异同点等问题进行探讨。
DOI:10.1155/2013/783253URLPMID:24278785 [本文引用: 1]

Two important hallmarks of RNA silencing in plants are (1) its ability to self-amplify by using a mechanism called transitivity and (2) its ability to spread locally and systemically through the entire plant. Crucial advances have been made in recent years in understanding the molecular mechanisms of these phenomena. We review here these recent findings, and we highlight the recently identified endogenous small RNAs that use these advantageous properties to act either as patterning signals in important developmental programs or as a part of regulatory cascades.
URLPMID:23330790 [本文引用: 1]
DOI:10.1016/j.cell.2012.03.002URLPMID:22445173 [本文引用: 1]

Eukaryotes have evolved complex mechanisms to repair DNA double-strand breaks (DSBs) through coordinated actions of protein sensors, transducers, and effectors. Here we show that approximately 21-nucleotide small RNAs are produced from the sequences in the vicinity of DSB sites in Arabidopsis and in human cells. We refer to these as diRNAs for DSB-induced small RNAs. In Arabidopsis, the biogenesis of diRNAs requires the PI3 kinase ATR, RNA polymerase IV (Pol IV), and Dicer-like proteins. Mutations in these proteins as well as in Pol V cause significant reduction in DSB repair efficiency. In Arabidopsis, diRNAs are recruited by Argonaute 2 (AGO2) to mediate DSB repair. Knock down of Dicer or Ago2 in human cells reduces DSB repair. Our findings reveal a conserved function for small RNAs in the DSB repair pathway. We propose that diRNAs may function as guide molecules directing chromatin modifications or the recruitment of protein complexes to DSB sites to facilitate repair.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
URLPMID:27456838 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
