 ,, 杨海丽, 李佳璐, 杨永恒, 张蓉, 程文强, 成磊, 赵永聚
,, 杨海丽, 李佳璐, 杨永恒, 张蓉, 程文强, 成磊, 赵永聚 ,西南大学动物科学技术学院/重庆市牧草与草食家畜重点实验室/重庆市草食动物资源保护与利用工程技术研究中心,重庆 400715
,西南大学动物科学技术学院/重庆市牧草与草食家畜重点实验室/重庆市草食动物资源保护与利用工程技术研究中心,重庆 400715Expression Patterns of TETs and Programmed Cell Death Related Genes in Oviduct and Uterus of Early Pregnancy Goats
ZHAO Le ,, YANG HaiLi, LI JiaLu, YANG YongHeng, ZHANG Rong, CHENG WenQiang, CHENG Lei, ZHAO YongJu
,, YANG HaiLi, LI JiaLu, YANG YongHeng, ZHANG Rong, CHENG WenQiang, CHENG Lei, ZHAO YongJu ,College of Animal Science and Technology, Southwest University/Chongqing Key Laboratory of Forage & Herbivore/Chongqing Engineering Research Center for Herbivores Resource Protection and Utilization, Chongqing 400715
,College of Animal Science and Technology, Southwest University/Chongqing Key Laboratory of Forage & Herbivore/Chongqing Engineering Research Center for Herbivores Resource Protection and Utilization, Chongqing 400715通讯作者:
责任编辑: 林鉴非
收稿日期:2020-03-12接受日期:2020-07-10网络出版日期:2021-02-16
| 基金资助: |
Received:2020-03-12Accepted:2020-07-10Online:2021-02-16
作者简介 About authors
赵乐,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1452KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
赵乐, 杨海丽, 李佳璐, 杨永恒, 张蓉, 程文强, 成磊, 赵永聚. TETs与细胞程序性死亡相关基因在山羊妊娠早期输卵管及子宫角的表达[J]. 中国农业科学, 2021, 54(4): 845-854 doi:10.3864/j.issn.0578-1752.2021.04.015
ZHAO Le, YANG HaiLi, LI JiaLu, YANG YongHeng, ZHANG Rong, CHENG WenQiang, CHENG Lei, ZHAO YongJu.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】输卵管是受精卵及早期胚胎发育的起始点,山羊的胚胎附植发生在配种后的第16—19天[1,2,3],子宫与胚胎发育的同步性是胚胎能否成功附植的前提,而输卵管与子宫内膜细胞死亡平衡在早期胚胎的发育过程中具有重要作用[4]。TET(ten-eleven translocation)家族蛋白在调控生殖细胞生长、胚胎及胎盘发育、子宫内膜异位等过程中都具有重要的作用[5,6,7]。因此明确TETs及细胞程序性死亡相关基因在妊娠早期山羊输卵管及子宫角中的表达规律及相互关系,对于妊娠早期胚胎发育调控的研究具有一定的理论参考。【前人研究进展】谭强等通过分析不同妊娠阶段TET1与Wnt信号通路相关基因的表达,发现TET1可能通过Wnt信号通路调控早期胎儿发育[8]。此外,大量研究发现TET家族蛋白与细胞凋亡密切相关[9,10,11,12]。细胞程序性死亡是细胞死亡的一种重要形式,主要由细胞凋亡、焦亡、自噬等形式组成。其中细胞凋亡主要由Caspase3、Caspase6、Caspase7、Caspase8、Caspase9等介导,通常伴随细胞核固缩、核凝聚和核碎裂。细胞焦亡依赖于Caspase1、Caspase4、Caspase11作用于底物Gasdermin D(GSDMD)进而诱发焦亡,并伴随大量炎性因子的释放[13]。研究发现牛、羊、鼠等妊娠早期输卵管及子宫凋亡基因显著增高[14,15,16],而且子宫内膜细胞的凋亡在胚胎侵袭过程中具有重要作用[17]。细胞焦亡作为一种新的细胞程序性死亡方式,具有多种生理作用。研究表明由Caspase1引起的滋养层细胞、子宫内膜细胞及羊水中的细胞焦亡可能诱发早产[18,19,20]。【本研究切入点】TET家族蛋白与妊娠早期输卵管及子宫内膜细胞程序性死亡相关基因是否具有相互关系尚不明确,而且对于细胞焦亡是否参与妊娠早期胚胎附植还不明晰,其在妊娠早期子宫角和输卵管中的表达规律也不清楚。【拟解决的关键问题】选取繁殖力高的重庆地方山羊品种合川白山羊为研究对象,主要检测了TETs 与细胞程序性死亡相关基因在山羊空配19 d和妊娠19 d输卵管和子宫角中的表达规律及其相关性,以期为进一步研究调控妊娠早期胚胎发育及附植的分子机制奠定基础。1 材料与方法
试验于 2019 年 5 月至 2020 年 1 月在西南大学、重庆市牧草与草食家畜重点实验室及重庆市草食动物资源保护与利用工程技术研究中心完成。1.1 试验动物与样品采集
选取1.5岁合川白山羊母羊6只,饲养于西南大学养殖场,全舍饲,每天给料两次,自由采食和饮水。将其随机分为两组即空配19 d(C19)组和妊娠19d(P19)组。首先对合川白山羊进行同期发情处理,处理方式为放置阴道栓13d结合肌肉注射孕马血清促性腺激素。发情后空配组用试情布挡住配种公羊生殖器,使其不能进行配种,妊娠组的发情母羊早、中、晚连续配种3次,以母羊最后一次接受交配的时间记为0 d,配种19 d后剖腹产摘除山羊整个子宫及卵巢。取一侧子宫角,横向取多个1 cm3大小样品浸泡在4%多聚甲醛中,用于组织形态观察,同时取另一侧子宫角及输卵管放于冻存管中,并迅速置于液氮中用于相关基因的表达检测。1.2 H.E染色试验
用4%多聚甲醛固定子宫角组织,然后进行梯度脱水、透明及浸蜡,将浸好的组织,迅速放入含有部分融蜡的包埋底座中,进行包埋。将包埋好的组织固定于切片机上,连续切成厚度为8μm的薄片,贴片后进行苏木精染色及伊红染色,脱水后利用中性树胶封片,室温晾干后进行观察拍照。1.3 基因表达检测
1.3.1 总RNA提取和cDNA第一条链合成 采用Trizol法提取总RNA,使用核酸测定仪检测RNA浓度和OD260/280值,对RNA完整性进行琼脂糖凝胶电泳检测,选取浓度适中、完整性较好的RNA,将浓度调至500 ng·μL-1,使用ABM反转录试剂盒合成第一链cDNA,-20℃保存。多余的RNA样品-80℃保存备用。1.3.2 qRT-PCR 利用Primer Premier 5.0设计WNT5a、OPN、NF-kB、Caspase9、GSDMD、BCL2、BAX、NLRP3、Caspase1、TNF-α、VEGFA、TET1、TET2、TET3、β-actin引物序列(表1),由华大公司合成。用qRT-PCR检测妊娠早期输卵管及子宫角中基因的相对表达量(表2)。
Table 1
表1
表1qRT-PCR引物序列
Table 1
| 基因名称 Gene name | 引物序列(5'→3') Primer sequence(5'→3') | 产物长度 Product size (bp) |
|---|---|---|
| β-actin | F:TGATATTGCTGCGCTCGTGGT R:GTCAGGATGCCTCTCTTGCTC | 189 |
| WNT5a | F:GCAAGGGCAATGTCTTCCA R:TTCATACCTAGCGACCACCAA | 104 |
| OPN | F: GTTAAACCGACCAGTTCTGGCA R: GTTGTCATCAGTTTCCTCAGAGG | 148 |
| NF-kB | F: GTGTAAAGAAGCGGGACTTGG R: GCGGTTGTCAAAGATGGGATG | 203 |
| Caspase9 | F: CAATAGCAACCCTGAGACGGA R: AAAGCCTGGGAAGGTGGAGTA | 130 |
| GSDMD | F: TTATTGGCTCTGACTGGGACG R: GGCAAAGCTGAAGCACGAAC | 128 |
| BCL2 | F: GAAACCCCGCCACGAATTA R: CCAGCCAACAGTACGGAACAA | 96 |
| BAX | F: TCTCCCCGAGAGGTCTTTTT R: TGATGGTCCTGATCAACTCG | 151 |
| NLRP3 | F: CCGTCTGGGTGAGAGCGTGAA R: TCCTGTTGGCTCCTGTGTTCCT | 78 |
| Caspase1 | F: GGATACAATAAATGGCTTGCTGG R: CTCGGGCTTTATCCATAGTTGT | 110 |
| TNF-α | F: CCACGTTGTAGCCAACATCAG R: AGATGAGGTAAAGCCCGTCAG | 134 |
| VEGFA | F: GTGACCCAGCACAGTTCCTCTT R: TTCCGGGCTCGGTGATTTAG | 74 |
| TET1 | F: CATCACTGTCCGTCTTTGGA R: ACTTTCCTGTGCCTTTGTGG | 126 |
| TET2 | F: GATACCATCTCCGTCTCCCATT R: CTTGCTGTCTCCATTCACTTCC | 109 |
| TET3 | F: CCTTCTCCTTCGGTTGTTCCTG R: CACTTCTTCCTCTTTGGGGTTGTC | 113 |
新窗口打开|下载CSV
Table 2
表2
表2qRT-PCR反应体系
Table 2
| 组成成分 Components | 10 μL反应体系 10 μL reaction |
|---|---|
| Nuclease-Free Water | 3.4 μL |
| cDNA | 1 μL |
| Forward primer | 0.3 μL |
| Reverse primer | 0.3 μL |
| EvaGreen2x qPCR MasterMix | 5 μL |
| Total | 10 μL |
新窗口打开|下载CSV
反应条件为95℃变性10 min,95℃ 15 s,58℃退火1 min,39个循环,采用默认设置自动生成Ct值。每个样品每组设置3个重复。
数据标准化处理参考Pfaffl2-ΔΔt方法:
ΔCt= Ct(参考样品目的基因)- Ct(参考样品β-actin基因)
ΔΔCt=Ct(目标样品中目的基因)- Ct(目标样品内参基因)-ΔCt
根据上述公式计算基因的相对表达量,结果用平均值±标准差表示。
1.4 数据分析
结果利用 SPSS 23.0软件t-test进行基因差异表达分析,所得结果利用平均数±标准差(Mean ± SD)的形式表示。P<0.05 表示差异显著,用“*”表示,P<0.01表示差异极显著,用“**”表示,用 Bivariate Correlations进行基因表达的相关性分析。2 结果
2.1 子宫角的组织形态变化
剖腹产采集子宫角组织,H.E染色后观察结果发现,与C19组相比(图1-A, B),P19组山羊子宫角内膜腺体增多、变大,形态多样,子宫内膜皱襞增多(图1-C, D)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1山羊子宫角组织形态
A:C19山羊子宫(4×);B:C19山羊子宫(10×);C:P19山羊子宫(4×);D:P19山羊子宫(10×)
Fig. 1The morphology of goat uterine horn
A: C19 goat uterine horn (4×); B: C19 goat uterine horn (10×);C: P19 goat uterine horn (4×); D: P19 goat uterine horn (10×)
2.2 胚胎附植标志基因在子宫角中的表达
qRT-PCR研究结果表明OPN在P19组山羊子宫角中的表达量极显著高于C19组(P<0.01),但VEGFA及WNT5a基因无显著变化(图2)。图2
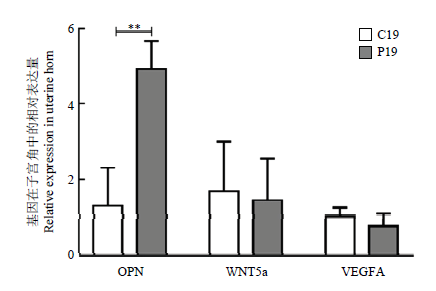 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2附植关键基因在子宫角的表达
Fig. 2The expression of blastocyst implantation-related genes in goat uterine horn
* P0.05;** P0.01。下同 The same as below
2.3 TETs在输卵管及子宫角的表达
由图3可知TETs在山羊子宫角及输卵管中均有表达,但TET3在两种组织中的表达量相对较低。和C19组相比,TET2表达在P19组山羊的输卵管中显著升高,而且显著高于两组中TET1(P<0.01)和TET3(P<0.01)的表达(图3-A)。在山羊C19组和P19组子宫角中TET1及TET2的表达量极显著高于C19组和P19 组中TET3的表达(P<0.01),但在C19组和P19组山羊子宫角中TET1及TET2间的表达量无显著差异(图3-B)。图3
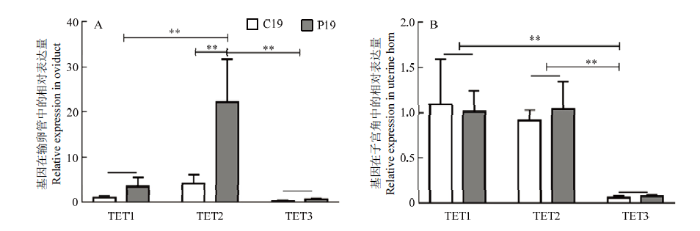 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3TETs在输卵管及子宫角的表达变化
Fig. 3The TETs family genes expression in goat oviduct and uterine horn
2.4 细胞程序性死亡相关基因在输卵管和子宫角中的表达
2.4.1 凋亡相关基因在输卵管及子宫角中的表达 胚胎附植过程受到凋亡信号通路的影响,而细胞凋亡平衡对于胚胎侵袭至关重要。本研究发现,凋亡关键基因Caspase9的表达量在P19组山羊输卵管中显著升高(P<0.05, 图4-A)。而在山羊子宫角中,BAX/BCL2的表达量在P19组显著增加(P<0.05, 图4-B),其它基因的表达量无显著变化。图4
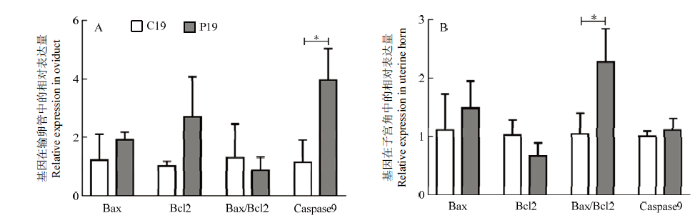 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4凋亡相关基因在输卵管和子宫角中的表达
Fig. 4The apoptosis-related genes expression in goat oviduct and uterine horn
2.4.2 细胞焦亡相关基因在输卵管及子宫角中的表
达 细胞焦亡作为一种近几年发现的细胞程序性死亡方式,它的发生是否对输卵管、子宫及早期胚胎的发育具有调节作用还少有研究,因此笔者检测了焦亡相关基因在输卵管及子宫角中的表达,探究其是否在早期胚胎发育中具有作用。结果显示,和C19组相比,P19组山羊输卵管中细胞焦亡关键基因Caspase1(P<0.01)和GSDMD(P<0.05)都显著增加, NLRP3(P=0.06)基因表达增加但不显著(图5-A)。在山羊子宫角组织中,细胞焦亡相关基因的表达无显著差异(图5-B)。
图5
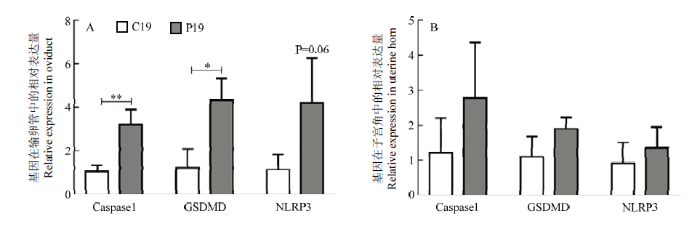 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5焦亡关键基因在输卵管及子宫角的表达
Fig. 5The pyroptosis-related genes expression in goat oviduct and uterine horn
2.4.3 炎症相关基因在输卵管及子宫角中的表达 细胞焦亡的发生通常伴有大量促炎症因子的表达。因此我们还检测了两组山羊子宫角和输卵管中炎症相关基因NF-kB和TNF-α的表达。结果显示,在山羊输卵管中P19组NF-kB的表达量极显著增高(P<0.01)(图6-A),但是在子宫角中这两个炎症相关基因的表达无显著差异(图6-B)。
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6炎症相关基因在输卵管及子宫角的表达
Fig. 6The inflammation-related genes expression in goat oviduct and uterine horn
2.5 TETs与细胞程序性死亡相关基因之间的相关性分析
2.5.1 TETs与细胞程序性死亡相关基因在输卵管组织中的相关性分析 由表3可见,通过相关性分析发现,TET1与Bax呈负相关,而与其余细胞程序性死亡相关基因呈正相关,其中与TNF-α(P<0.05)、Bcl2(P<0.05)呈显著正相关。TET2与所有细胞程序性死亡相关基因呈正相关,其中与NF-kB(P<0.01)、Caspase9(P<0.05)显著正相关。TET3与所有基因均呈正相关,与NF-kB极显著正相关(P<0.01)。表明TETs参与妊娠早期输卵管中凋亡及炎症相关基因的表达调控,而P19组中高表达的TET2可能起主要作用。由于TETs之间的表达补偿作用,其表达量也具有一定的相关性,TET2与TET3的表达呈极显著正相关(P<0.01)。而细胞程序性死亡相关基因之间的表达量也具有一定联系。其中,TNFa与Bcl2显著正相关(P<0.05),Bax与GSDMD显著正相关(P<0.05),Caspase9与NF-kB(P<0.05)、Caspase1(P<0.05)、NLRP3(P<0.01)、GSDMD(P<0.01)显著正相关,Caspase1与NLRP3(P<0.01)、GSDMD(P<0.01)显著正相关,NLRP3与GSDMD (P<0.05)显著正相关,提示凋亡相关基因、焦亡相关基因和炎症相关基因在妊娠早期输卵管中的表达具有一定的相互关系。综上结果表明,TETs可能参与调控妊娠早期输卵管中凋亡及炎症相关基因的表达,而且提示妊娠早期输卵管中细胞凋亡、焦亡及炎症相关基因的表达通常伴有协同性。Table 3
表3
表3妊娠早期输卵管TETs与细胞程序性死亡相关基因之间的相关性分析
Table 3
| TET2 | TET3 | NFkB | TNFa | BAX | Bcl2 | Caspase9 | Caspase1 | NLRP3 | GSDMD | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| TET1 | r | 0.657 | 0.667 | 0.657 | 0.829* | -0.086 | 0.829* | 0.371 | 0.314 | 0.257 | 0.429 |
| p | 0.156 | 0.148 | 0.156 | P<0.05 | 0.872 | P<0.05 | 0.468 | 0.544 | 0.623 | 0.397 | |
| TET2 | 0.928** | 1.000** | 0.714 | 0.486 | 0.657 | 0.829* | 0.714 | 0.771 | 0.771 | ||
| P<0.01 | P<0.01 | 0.111 | 0.329 | 0.156 | P<0.05 | 0.111 | 0.072 | 0.072 | |||
| TET3 | 0.928** | 0.696 | 0.522 | 0.667 | 0.696 | 0.696 | 0.638 | 0.754 | |||
| P<0.01 | 0.125 | 0.288 | 0.148 | 0.125 | 0.125 | 0.173 | 0.084 | ||||
| NF-kB | 0.714 | 0.486 | 0.657 | 0.829* | 0.714 | 0.771 | 0.771 | ||||
| 0.111 | 0.329 | 0.156 | P<0.05 | 0.111 | 0.072 | 0.072 | |||||
| TNFa | 0.086 | 0.886* | 0.543 | 0.657 | 0.6 | 0.6 | |||||
| 0.872 | P<0.05 | 0.266 | 0.156 | 0.208 | 0.208 | ||||||
| Bax | 0.314 | 0.771 | 0.771 | 0.714 | 0.829* | ||||||
| 0.544 | 0.072 | 0.072 | 0.111 | P<0.05 | |||||||
| Bcl2 | 0.657 | 0.714 | 0.6 | 0.771 | |||||||
| 0.156 | 0.111 | 0.208 | 0.072 | ||||||||
| Caspase9 | 0.886* | 0.943** | 0.943** | ||||||||
| P<0.05 | P<0.01 | P<0.01 | |||||||||
| Caspase1 | 0.943** | 0.943** | |||||||||
| P<0.01 | P<0.01 | ||||||||||
| NLRP3 | 0.886* | ||||||||||
| P<0.05 | |||||||||||
新窗口打开|下载CSV
2.5.2 TETs与细胞程序性死亡相关基因在子宫角组织中的相关性分析 相关性分析表明(表4),TET1、TET2、TET3均与VEGFA呈现负相关, TET1、TET3与WNT5a呈现负相关,其中TET3与VEGFA(P<0.05)、WNT5a(P<0.01)显著负相关。此外,TNF-α与Bax极显著正相关(P<0.01),Caspase1与NLRP3极显著正相关(P<0.01),而焦亡关键基因GSDMD与Bax(P<0.05)、Caspase1(P<0.01)、NLRP3(P<0.05)显著正相关,表明在子宫角中细胞焦亡相关基因的表达具有一致性而且常伴随细胞凋亡的发生。胚胎附植关键基因OPN与Caspase1(P<0.01)、NLRP3(P<0.05)、GSDMD(P<0.05)显著正相关。妊娠早期子宫角中细胞焦亡的发生可能参与胚胎附植,但仍需进一步的研究证明。
Table 4
表4
表4妊娠早期子宫角TETs、细胞程序性死亡基因及附植相关基因之间的相关性分析
Table 4
| TET2 | TET3 | NFkB | TNFa | BAX | Bcl2 | Caspase9 | Caspase1 | NLRP3 | GSDMD | OPN | WNT5a | VEGFA | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TET1 | r | -0.771 | 0.486 | -0.257 | 0.086 | 0.029 | 0.143 | -0.143 | 0.371 | 0.429 | 0.257 | 0.257 | -0.429 | -0.086 |
| p | 0.072 | 0.329 | 0.623 | 0.872 | 0.957 | 0.787 | 0.787 | 0.468 | 0.397 | 0.623 | 0.623 | 0.397 | 0.872 | |
| TET2 | -0.200 | 0.371 | 0.371 | 0.314 | -0.086 | 0.600 | -0.257 | -0.429 | 0.029 | -0.200 | 0.086 | -0.029 | ||
| 0.704 | 0.468 | 0.468 | 0.544 | 0.872 | 0.208 | 0.623 | 0.397 | 0.957 | 0.704 | 0.872 | 0.957 | |||
| TET3 | 0.314 | 0.314 | 0.143 | 0.143 | 0.600 | 0.029 | -0.086 | 0.086 | 0.200 | -0.943** | -0.886* | |||
| 0.544 | 0.544 | 0.787 | 0.787 | 0.208 | 0.957 | 0.872 | 0.872 | 0.704 | P<0.01 | P<0.05 | ||||
| NFkB | 0.714 | 0.600 | 0.600 | 0.714 | -0.086 | -0.029 | 0.086 | -0.029 | -0.543 | -0.314 | ||||
| 0.111 | 0.208 | 0.208 | 0.111 | 0.872 | 0.957 | 0.872 | 0.957 | 0.266 | 0.544 | |||||
| TNFa | 0.943** | 0.257 | 0.771 | 0.429 | 0.371 | 0.657 | 0.371 | -0.486 | -0.143 | |||||
| P<0.01 | 0.623 | 0.072 | 0.397 | 0.468 | 0.156 | 0.468 | 0.329 | 0.787 | ||||||
| BAX | 0.029 | 0.600 | 0.657 | 0.600 | 0.829* | 0.600 | -0.257 | -0.029 | ||||||
| 0.957 | 0.208 | 0.156 | 0.208 | P<0.05 | 0.208 | 0.623 | 0.957 | |||||||
| Bcl2 | 0.200 | -0.486 | -0.257 | -0.429 | -0.600 | -0.429 | 0.086 | |||||||
| 0.704 | 0.329 | 0.623 | 0.397 | 0.208 | 0.397 | 0.872 | ||||||||
| Caspase9 | -0.029 | -0.200 | 0.257 | 0.086 | -0.714 | -0.600 | ||||||||
| 0.957 | 0.704 | 0.623 | 0.872 | 0.111 | 0.208 | |||||||||
| Caspase1 | 0.943** | 0.943** | 0.943** | 0.086 | 0.086 | |||||||||
| P<0.01 | P<0.01 | P<0.01 | 0.872 | 0.872 | ||||||||||
| NLRP3 | 0.829* | 0.829* | 0.143 | 0.257 | ||||||||||
| P<0.01 | P<0.05 | 0.787 | 0.623 | |||||||||||
| GSDMD | 0.886* | -0.029 | 0.029 | |||||||||||
| P<0.05 | 0.957 | 0.957 | ||||||||||||
| OPN | -0.029 | -0.200 | ||||||||||||
| 0.957 | 0.704 | |||||||||||||
| WNT5a | 0.771 | |||||||||||||
| 0.072 |
新窗口打开|下载CSV
3 讨论
输卵管及子宫作为重要的生殖组织,在胚胎早期发育、胚胎附植,胎盘发生等过程中具有十分重要的作用。研究发现牛、羊、鼠等在妊娠早期输卵管及子宫凋亡基因显著增高[14,15,16],表明输卵管及子宫内膜细胞死亡可能在输卵管及子宫内膜生理形态结构的形成、附植前的胚胎发育、附植发生及胎盘形成过程中具有重要作用。本研究通过对C19组和P19组山羊子宫角组织进行H.E染色观察,在P19组山羊子宫角H.E切片中观察到子宫内膜腺体增多、变大,形态多样,与杨雪等的研究结果基一致[21]。
OPN在胚胎附植及胎盘发育过程中具有重要作用,OPN的表达异常通常会导致妊娠的失败[22],因此也经常作为胚胎附植的标记基因。本研究同样发现OPN在P19组山羊子宫角中的表达远高于C19组,与前人研究结果一致[23]。此外,相关性分析表明胚胎附植关键基因OPN与细胞焦亡相关基因Caspase1、NLRP3、GSDMD显著正相关,推测细胞焦亡可能对早期胚胎的附植具有一定的影响。
TETs作为主要的去甲基化酶,具有广泛的生理调控作用。前期我们的研究也发现TET1在山羊的胚胎及胎盘发育过程中具有重要作用,其中TET1与Wnt 信号通路中的部分基因在胚胎发育过程中呈现显著相关[8],而且TET1能够通过影响Wnt信号通路及MMP家族中的相关基因进而影响胎盘滋养层细胞的迁移和侵袭能力[24,25]。O'DOHERTY等通过对牛胚胎附植前后子宫内膜甲基化合成酶DNMT家族的研究,发现DNA甲基化可能与牛的胚胎附植相关[26],而限饲同样会改变猪胚胎附植期子宫内膜基因的甲基化水平[27],进而影响胚胎的发育。本研究通过对C19组及P19组山羊子宫角和输卵管中去甲基化酶TET1、TET2、TET3的表达进行分析,发现TET3在P19组及C19组山羊子宫角和输卵管中的表达较低,而在P19组山羊输卵管中TET2的表达量显著高于TET1和TET3。哺乳动物有2次主要的甲基化波动,一次发生在配子发育过程中,另一次则在受精后[28]。受精卵及妊娠早期胚胎运行至输卵管涉及到一波去甲基化过程,而本研究发现在P19组山羊输卵管中TET2显著增高,基因的相关性分析表明,TET2与TET3、NF-kB、Caspase9具有显著正相关,暗示TET2可能通过影响DNA的甲基化,进而调控山羊输卵管、受精卵及早期胚胎发育过程中的细胞凋亡。此外,胚胎发育早期处于一种低氧状态,BOMFIM等在体外利用常氧及低氧培养模式模拟体内早期胚胎发育的内环境,同样发现低氧显著抑制甲基化合成酶DNMT家族的表达水平[29],进而使其处于低甲基化状态。相比较而言,本研究发现子宫角中主要表达TET1和TET2,而对于胚胎附植期TET1及TET2在子宫角中的调控作用还有待于进一步研究。
细胞死亡对于维持输卵管及子宫内膜细胞死亡平衡至关重要。而细胞凋亡参与妊娠早期胚胎着床是目前研究较多也较为公认的重要因素之一[30]。本试验同样发现在C19组及P19组山羊子宫角和输卵管中凋亡基因的表达量呈现增高趋势。其中,Caspase9在山羊P19组输卵管中的表达量显著高于C19组,山羊P19组子宫角中BAX/BCL2的表达量显著高于C19组,这也与SUZUKI 等在牛子宫组织中的研究基本一致,进一步佐证了细胞凋亡参与妊娠早期子宫角的调控[4]。而细胞焦亡是一种近几年发现的细胞程序性死亡方式,与细胞凋亡具有相同点,但细胞焦亡通常依赖于半胱天冬氨酸蛋白酶-1(caspase-1)的激活引起质膜的破裂,而导致细胞内容物的释放,进而引起炎症反应[31]。本研究发现,山羊C19组及P19组子宫角和输卵管中Caspase-1、NLRP3、GSDMD均有不同程度的增加,其表达趋势也与SUZUKI 等在牛子宫组织中的研究结果相似[4]。通过对基因的相关性分析表明,细胞焦亡关键基因GSDMD在输卵管中与Bax、Caspase9、Caspase1、NLRP3显著正相关,在子宫角中与Bax、Caspase1、NLRP3显著正相关,推测细胞凋亡与焦亡的发生对输卵管、子宫及早期胚胎的发育可能具有协同性,其细胞焦亡可能对于早期胚胎的发育同样具有调控作用。
TET家族蛋白作为主要的去甲基化酶分子,通过调控凋亡及炎症相关基因的甲基化状态,进而影响配子及胚胎的发育。ZHANG等的研究表明TET可能通过影响卵母细胞及早期胚胎的凋亡,影响胚胎发育[32]。目前对于细胞焦亡是否参与早期胚胎的发育调控尚不可知。本研究检测了TETs及细胞程序性死亡相关基因(BAX、BCL2、Caspase-9、Caspase-1等)在山羊子宫及输卵管中的表达并对其进行了相关性分析,分析表明TETs与细胞程序性死亡部分基因具有一定的相关性,TETs可能参与调控妊娠早期输卵管中凋亡及炎症相关基因的表达,而基因间的相关性分析表明,其细胞凋亡与焦亡的发生对妊娠早期输卵管及子宫角的发育可能具有协同性,本研究对早期胚胎发育的调控机制提供了一定的参考,而对于TETs及细胞焦亡参与妊娠早期胚胎发育的具体分子机制仍需要进一步探索。
4 结论
本研究明确了TETs与细胞程序性死亡相关基因在妊娠早期山羊输卵管及子宫角的表达规律及相互关系,发现TETs可能参与调控妊娠早期输卵管中凋亡及炎症相关基因的表达,为进一步研究TETs在早期胚胎发育的调控机制提供了一定的参考,此外,细胞焦亡的发生在早期胚胎附植过程中具有重要作用。但对于TETs是如何通过影响细胞凋亡或焦亡的发生,进而影响早期胚胎发育的调控机制将是下一步的研究的重点。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
