A Discussion on the Diffusion Pathway of Leymus Chinensis in the Natural Grassland of China Based on Differentiation in the Phenotypes and Genotypes
YANG YunFei1, XIN XiaoPing2, LI JianDong1责任编辑: 林鉴非
收稿日期:2019-09-28接受日期:2019-12-18网络出版日期:2020-07-01
| 基金资助: |
Received:2019-09-28Accepted:2019-12-18Online:2020-07-01
作者简介 About authors
杨允菲,E-mail: yangyf@nenu.edu.cn

摘要
关键词:
Abstract
Keywords:
PDF (851KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
杨允菲, 辛晓平, 李建东. 基于表型与遗传分化的羊草在中国草原扩散途径的探讨[J]. 中国农业科学, 2020, 53(13): 2541-2549 doi:10.3864/j.issn.0578-1752.2020.13.003
YANG YunFei, XIN XiaoPing, LI JianDong.
羊草(Leymus chinensis (Trin.) Tzvel.)是欧亚大陆草原广布种,对土壤质地、土壤盐碱度和土壤水分等诸多环境因子均具有广泛的生态适应性[1]。羊草在显域的栗钙土和黑钙土生境,以及隐域的草甸土、盐化草甸土、碱化草甸土和风沙土生境均生长良好,是欧亚大陆草原区东部草甸草原、干旱草原及草甸常见的重要建群种之一[1,2]。羊草营养价值高,各种家畜均喜食,因此,不同类型的羊草草地均为优良的割草场和放牧场[1,3]。羊草重要的经济价值使其成为广泛的基础理论研究、应用基础研究和开发利用研究的共同对象。根据对中国知网-CNKI数据库检索,截至撰稿时检索到把羊草放在题目中的期刊论文为1 559篇,1978年以后,特别是2002年以后连续每年都有50篇以上论文发表;博士和硕士论文自2001年上网以来的连续19年间,把羊草放在题目中的学位论文为321篇,平均每年约17篇。尽管在羊草的基础研究中从分子到生态系统的各生物层次均有大量报道,但对于羊草的起源与进化、羊草在中国草地的扩散途径,以及不同类型羊草草地的系统形成过程尚未见报道。本文通过对羊草学名的文献追踪,参考了羊草在赖草属中的系统演化位置及赖草属起源研究成果,以羊草形态、生理的趋异适应和分子遗传分化的研究文献为依据,综合分析了两种羊草生态型的进化地位,推断了中国草原一定范围内羊草的扩散途径,为植物分类学进一步开展羊草的起源与进化,以及植被生态学深入开展不同类型羊草草地的系统形成过程的研究提供参考。
1 羊草学名与属名的历史变更
每一种植物都有民间传称的俗名,尤其是常见的植物往往与家养动物相联系,如羊草(Leymus chinensis (Trin.) Tzvelev)就是指羊喜食的牧草,还有更多象形性的俗称,如马齿苋(Portulaca oleracea L.)、猪毛蒿(Artemisia scoparia Waldst. et Kit.)、狗尾草(Setaria viridis (L.) Beauv.)等。但按照植物演化的亲缘关系以及在系统发育中位置来对每一种植物做出正确鉴定和科学分类时,归于哪一个属乃至使用什么种名则经常发生异议,甚至几经易名。在对不同地区植物二名命名法的学名(scientific name)中,当属名已经由前人确定,分类学家经常以植物某器官的显著特征或模式标本采集地作为种名。据资料记载,羊草曾经有5个属名的历史变更和5个种名,相继参与的植物分类****多达15人次[4]。打开中国植物志依次浏览,不难发现中国大多数常见植物都是由外国人命名,许多植物的最初命名时间都是在19世纪中叶。追溯中国植物的科学分类历史,尽管中华民族的祖先在7 000年前就从禾本科植物中培育出黍、稷、稻等重要作物。在2 500年前春秋时期编写的《诗经》中就提到130多种植物[5];在2 220年前汉代留下的中国第一部药学典籍《神农本草经》就记载药用植物252种[6];在南北朝时期,医药学家陶弘景(公元456—536年)按照植物习性和栽培植物类别,把《本草经集注》中的730种药用植物分为草、木、果、米、谷等类[5];在16世纪,明朝医药学家李时珍编著的《本草纲目》(1596)中收录药用植物1 892种,至今仍被西方人誉为 “东方医学巨典”[6]。但是,在19世纪以前,西方科学极少传入封建的旧中国。
进入18世纪中叶,西方的科学规范得到了广泛推行。当瑞典生物分类学家卡尔·冯·林奈(Carl von Linne(1707—1778)于1753年出版了《植物种志》(Species Plantarom)以后,他所创建的二名命名法命名植物种名(species name)得到了普遍认可,并于1867年8月在法国巴黎举行的第一次国际植物学会议通过了《国际植物命名法规》(International Code of Botanical Nomenclature),在植物命名的优先权等事宜上,规定了以《植物种志》出版的时间1753年5月1日作为种子植物和蕨类植物名称合格发表(valid publication)的起始日期[5]。由于《植物种志》中收录合格名称植物7 700种,因此,许多世界广布种植物的命名人均署名为 Linne。这也意味着所有中国植物的历史记录均为俗名,中国的全部植物均需要冠以合格名称。
出于掠夺资源的目的,从18世纪中叶到20世纪中叶的200年间,以沙俄为首的英、法、美、德、日等资本主义强国,以各种身份来中国做生物资源考察和收集[7,8],最早沙俄驻北京东正教使节团从1733年开始就利用往返之便沿途采集植物标本,寄回彼得堡,并且在北京周围调查植物、药材,研究经济植物;1830年德国血统的俄国植物学家宾奇(Alexander von Andrejewitsch von Bunge, 1803-1890年)作为教士使节团的成员来到北京,在北京西山、大白寺, 以及北京到长城的沿途采得植物标本420种带回俄国,从1833开始,先后发表植物名录及新种、新属的描述,在印刷的小册子“宾奇博士1831年在中国北部所采植物名录,1833”(A . Bunge,Enumeraito plantarum, quas in China boreali collegit Dr. Al. Bunge anno 1831)中,羊草被列入72号,并成为模式标本。由此可知,羊草的模式标本是由俄国植物学家BUNGE于1831年采于中国的北京近康台的草原[4]。
羊草有5个属名的历史变更和5个种名 [4],大体的经历是:1833年,由德国植物学家TRINIUS与BUNGE联合命名的羊草(Triticum chinense Trin. ex Bunge)最初被放在小麦属(Triticum),意思为中国麦草;1852年由TRINIUS又联合其他****将羊草再次给出新的种名Triticum pseudoagropyron Trin. ex Griseb.,意思为假冰麦草;1856年又有****对假冰麦草的属名做了更改,改为Elymus pseudoagropyron(Trin. ex Griseb.)Turcz.,意思为假冰披碱草;1884年又有****将假冰麦草的属名更改为Agropyron pseudoagropyron(Trin. ex Griseb.)Franch.,意思为假冰草;1901年和1930年分别有不同****将羊草放在冰草属并给出新的种名Agropyron uninerve Candargy和Agropyron berezovcanum Prodan;1932年有****将羊草放在披碱草属并给出新的种名Elymus regelii Roshev;1934年有****再次对假冰麦草属名更改为赖草属Aneurolepidium pseudoagropyron(Trin. ex Griseb.)Nevski.,意思为假冰赖草;此后,不同****相继将羊草在赖草属的种名恢复为“中国”,即Aneurolepidium chinensis(Trin.)Ohwi(1937年),意思均为中国赖草;1941年,我国****耿以礼把假冰披碱草做了种名的更改,改为Elymus chinensis(Trin.)Keng,意思为中国披碱草;1949年有****在中国披碱草的基础上做了3个变型的命名,依次为Elymus chinensis f. altus Melderis,Elymus chinensis f. macrochaetus Melderis,Elymus chinensis f. pumilus Melderis;1960年,赖草属重新框定后,有****将假冰麦草的属名更改为Leymus pseudoagropyron(Trin. ex Griseb.)Tzvelev。而现在采用的羊草是1968年俄国****TZVELEV对中国麦草最初的属名更改的Leymus chinensis (Trin.) Tzvelev。
2 羊草在赖草属中的系统演化位置及赖草属起源
羊草为赖草属(Leymus Hochst.)植物。在赖草属植物的系统演化研究中,羊草在赖草属的位置有不同的界定,根据植物体表型性状的演化趋势,将赖草属划分为3个组:多穗组(Sect. Leymus)最原始,少穗组(Sect. Aphanoneuron)较进化,单穗组(Sect. Anisopyrum)最高级。其中,有的研究者把羊草划归最进化的Sect.Anisopyrum 中[9],有的则划归较进化的Sect. Aphanoneuron中[10]。但将外部形态特征与细胞学资料有机结合对赖草属类群组修订后,在新界定的多穗组(Sect.Racemosus)、少穗组(Sect.Leymus)和单穗组(Sect.Anisopyrum)中,羊草大多被划分为介于二者之间的较进化Sect.Leymus中[11,12,13,14,15],并且根据其性状多处于初生与次生的两极之间。通过对中国境内18种赖草属植物内部转录间隔区(internal transcribed spacer,ITS)序列分析,羊草定位在演化层次居少穗组偏下的位置(图1)[16]。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1基于 ITS 序列构建的赖草属系统发育树[16]
Fig. 1The phylogenetic tree of prediction in Leymus based on ITS sequences
中国境内赖草属植物有 3 组 40 种(含变种),主要分布于长白山、燕山、太行山、子午岭、西倾山和横断山脉一线以西以北的广大区域。其中,多穗组和单穗组主要分布于西北的广大地区,少穗组分布范围广,几乎遍及国内整个属的分布区,并且推测中国赖草属的分布中心是阿尔泰地区[12]。最新研究表明,赖草属在新疆西北部阿尔泰地区分布相对密集,在欧-亚森林植物亚区很小的范围就有22 种,既有赖草属中最原始的大赖草(L. racemosus),也有演化水平最高的皮山赖草(L. pishanicus),由此判断新疆的阿尔泰地区是现代赖草属的物种多度中心和遗传多样性中心,也极有可能是赖草属的起源中心,通过与外类群(披碱草属)演化关系的综合分析,进一步推断出赖草属起源时间大约在第三纪渐新世(Oligocene)。渐新世大约开始于3 400万年前,终于2 300万年前。在渐新世末期,青藏高原不断隆升、气候与环境发生巨变,赖草属在中国境内地质活动较为剧烈的时期发生了大量的适应性分化,推断当赖草属在中国境内扩散到华北地区后,再分两支,一支扩散到东北地区,另一支扩散到华东地区[15]。
3 羊草遗传多样性及其趋异适应特征
羊草的广布性使其生长环境复杂多变,不同生境羊草叶色普遍具有灰绿型和黄绿型[17,18,19,20,21],不仅相同生境两种生态型羊草在形态特征、生理特征和分子遗传特征均发生明显分化[22,23,24,25,26],而且这种分化在同质园的子代保持稳定[27,28,29,30]。3.1 形态特性分化
在中国羊草草地分布区,不同类型的天然草地羊草种内变异多样性程度较高,在叶色、穗型和叶片的宽窄等方面都存在着不同程度的变异。羊草的叶色分化成灰绿色和黄绿色二种类型,并有大量的中间型(淡灰绿色、深绿色)。两种叶色的羊草在各地均有不同程度的混生,在移栽后都保持了原有叶色不变 [17]。羊草的穗状花序分化为三种类型:(1)花序每个节的小穗全部单生,称单生型;(2)花序下部与上部每个节小穗单生,中部着生2枚小穗或全部2枚小穗,称对生型;(3)花序中部每个节3—4枚小穗聚生,称多生型[17]。两种叶色的羊草均有3种穗型的分化,在羊草分布区6个采集地的同质园小区连续3年观测中,不同地区种源的羊草种群的穗型在年份间的变异均较大。其中,除了科尔沁南部的伊胡塔种群在3个年份均以多穗型比率最高外,其他5个地区的种群在观测第一年普遍以多穗型比率最高,后两年又普遍以单穗型比率最高(表1)[17]。羊草穗型是一种不稳定的表型特征。
Table 1
表1
表1同质园条件下不同地区种源羊草种群穗型比率的年际变化(根据文献[17]整理)
Table 1
| 种源地 Collected region | 年份 Year | 单生型 Single | 对生型 twin | 多生型 multiple | 合计 Total |
|---|---|---|---|---|---|
| 松嫩平原南部(长岭种马场) Southern Songnen plain (Changling stud farm) | 1982 | 18.50 | 29.25 | 52.25 | 100 |
| 1983 | 53.75 | 42.50 | 8.75 | 100 | |
| 1984 | 58.95 | 33.98 | 7.08 | 100 | |
| Mean±SD | 43.73±22.01 | 35.24±6.71 | 22.69±25.61 | 100 | |
| 松辽平原腹地(长春) Songliao plain interland (Changchun) | 1982 | 9.75 | 24.75 | 65.50 | 100 |
| 1983 | 58.89 | 35.18 | 5.93 | 100 | |
| 1984 | 50.25 | 36.00 | 13.75 | 100 | |
| Mean±SD | 39.03±27.26 | 31.98±6.27 | 28.39±32.27 | 100 | |
| 科尔沁南部(伊胡塔) Southern Kerqin(Ihuta) | 1982 | 8.75 | 41.75 | 49.50 | 100 |
| 1983 | 27.00 | 26.00 | 47.00 | 100 | |
| 1984 | 8.50 | 17.25 | 74.25 | 100 | |
| Mean±SD | 14.75±10.61 | 28.3±12.41 | 56.92±15.06 | 100 | |
| 科尔沁中部(高林屯种畜场) Central Kerqin (Gaolintun breeding farm) | 1982 | 16.00 | 32.50 | 51.50 | 100 |
| 1983 | 35.25 | 52.75 | 12.00 | 100 | |
| 1984 | 33.50 | 38.00 | 28.50 | 100 | |
| Mean±SD | 28.25±10.64 | 41.08±10.47 | 30.67±19.84 | 100 | |
| 科尔沁西部(嘎达苏种畜场) Western Kerqin (Gaddasu breeding farm) | 1982 | 16.50 | 24.50 | 59.00 | 100 |
| 1983 | 74.00 | 22.75 | 3.25 | 100 | |
| 1984 | 58.50 | 26.00 | 15.50 | 100 | |
| Mean±SD | 49.67±29.75 | 24.42±1.63 | 25.92±29.30 | 100 | |
| 呼伦贝尔(海拉尔) Hulunbeier(Hailar) | 1982 | 18.75 | 18.75 | 62.50 | 100 |
| 1983 | 96.25 | 2.25 | 1.50 | 100 | |
| 1984 | 82.25 | 16.50 | 1.25 | 100 | |
| Mean±SD | 65.75±41.30 | 12.50±8.95 | 21.75±35.29 | 100 |
新窗口打开|下载CSV
3.2 生理特性分化
羊草的生理特性分化不仅与表型分化有着密切的联系,也存在地理种群的变异。在同一生境下,灰绿色和黄绿色羊草对光强度、气温、相对湿度、叶温、气孔扩散阻力的响应、光合生理等方面均有显著差异,灰绿型的光合速率和蒸腾速率相对较高[18],在干旱胁迫下,灰绿型羊草植株含水率、叶绿素含量、氮含量、脯氨酸含量都高于黄绿型羊草种群,而细胞膜透性小于黄绿型羊草种群,黄绿型羊草的耐旱能力均强于灰绿型[19]。在盐碱胁迫下,两种生态型羊草的电解质外渗率、脯氨酸、植株含水率、植株鲜重等均为显著或极显著差异,灰绿型羊草的耐盐碱能力均强于黄绿型[20,21],光合生产能力和生理适应性也均优于黄绿型[22]。大量试验表明,灰绿型和黄绿型羊草对干旱和盐碱环境有不同的适应策略,在光合生理生态特性、抗干旱、耐盐碱胁迫等方面具有稳定遗传差异。研究也表明,干旱胁迫处理下,不同地理种群羊草在SOD、POD活性及MDA含量均具有较大的差异,在生理特性上也存在明显的分化。其中,松嫩平原盐碱化草地的羊草抗旱性最强,荒漠草原的羊草抗旱性也较强,呼伦贝尔湖边草甸的羊草抗旱性最弱[23]。3.3 遗传特性分化
在松嫩平原,RAPD分析中灰绿型羊草种群的多态位点百分率高于黄绿型[24],在局域环境下,采用稳定性强,重复性好的AFLP标记技术,对松嫩平原长岭腰井子牧场2个灰绿型和1个黄绿型羊草种群的69个样本测定中,共扩增出593个AFLP位点,其中148个为多态性的位点,平均多态性的位点比率为25%,经遗传距离聚类分析,两种叶色羊草存在明显的遗传分化,其中灰绿型的羊草较黄绿型羊草具有更高的遗传多样性[25]。相比之下,在全国羊草不同分布地区,包括吉林省西部、黑龙江省中南部的松嫩平原、河北坝上、内蒙古高原东北部的呼伦贝尔、内蒙古东部的西辽河平原等不同羊草种群研究中,仅用8对AFLP引物组合就在27个样本中共扩增出537个AFLP位点。其中,多态性带占61.3%,总的多态性比率为78.84%[26]。在同质园条件下,来自于黑龙江、吉林、辽宁、内蒙古、河北和北京的205份灰绿型羊草和88份黄绿型羊草,同质园条件下10个质量性状和27个数量性状上,灰绿型羊草比黄绿型羊草具有更高的遗传变异性(P<0.05)[27],这些研究的结果一并表明,虽然局域环境羊草从AFLP位点同样获得了较高的遗传多态性,但广域性羊草则具有更高的遗传多态性。另有研究表明,不同地理原位之间羊草种群的许多个体性状存在较大差异,并且在形态、解剖、生理、同工酶及 DNA(RAPD)水平上也都存在差异;经同质园栽培试验这些差异是可以遗传的,证明不同地理种群羊草之间存在遗传分化。内蒙古高原4个样地从东到西水分递减,水因子是影响分化的主导因子,而松嫩平原盐碱地的羊草种群在各个层次上都明显区别于内蒙古样地,可以认为是土壤理化特性的差异所致[28]。
另据报道,在中国东北草原样带(43°14′N—44°36′N)900 km大尺度经度(124°16′E—114°51′E)下,基于 15 对微卫星标记遗传距离构建的邻接树,将梯度取样的18 个样地灰绿型羊草种群分为东-西两大分支(2 组)[29]。其中组I 涵盖所有 10 个东部的草甸草原种群,组 II 包括其余 8 个西部的典型草原和荒漠草原所有种群(图2-A)。东部组I 各遗传多样性指标和平均期望杂合度均显著高于西部组Ⅱ。而基于 17 个数量性状(营养株高、生殖株高、叶长、叶宽、叶面积、脯氨酸、可溶性糖、叶绿素含量等)的聚类分组结果,18个羊草种群也被分为两组,组I 包括 9个种群(01—09);组Ⅱ包括其余 9个种群(图2-B)[29]。由此首先证明了东-西部种群间存在表型分化,但两种聚类结果的分界点略有差异,是羊草种群表型变异呈连续渐进所致。从中性分子遗传分化系数(FST = 0.041)显著低于数量性状分化系数(QST = 0.221)的统计结果也表明,气候的趋异性影响是导致羊草种群表型分化的重要原因之一[29]。
图2
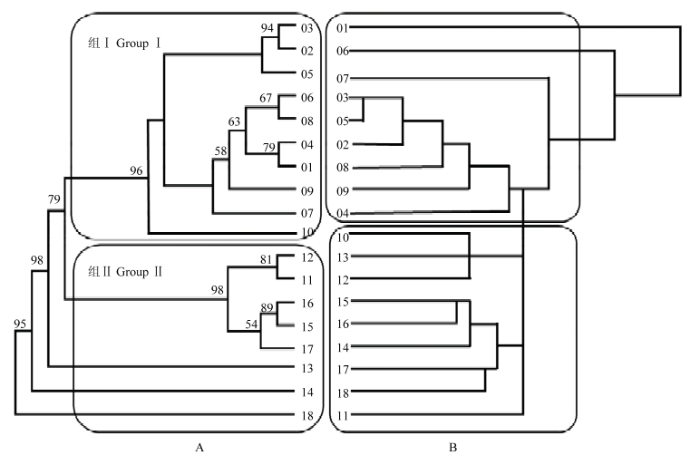 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2灰绿型羊草种群15 个微卫星标记的邻接树(A)和 17 个表型性状(B)的聚类树[29]
Fig. 2Clustering analyses of 15 microsatellite loci(A)by neighbor-joining method and 17 quantitative traits(B)in L. chinensis populations of gray-green type
而在上述大尺度经度同时具有两种生态型的9个样地的18个种群中,基于 15 个微卫星位点的邻接树聚类,大体分成 3 支,9 个灰绿型种群聚为一支;黄绿型种群则划分成 2 部分: YG08 和 YG09 独立聚成一支,且与 GG08 和 GG09 遗传距离较远;其他7个黄绿型种群聚为一支;其中,大部分地理距离较近的种群优先聚在一起(图 3)[30]。在两种生态型的遗传统计中,预期杂合度,香农多样性指数和均匀度指数的平均值均以灰绿型显著高于黄绿型,并且从东到西均具有相同的逐渐减小的趋势[30]。
图3
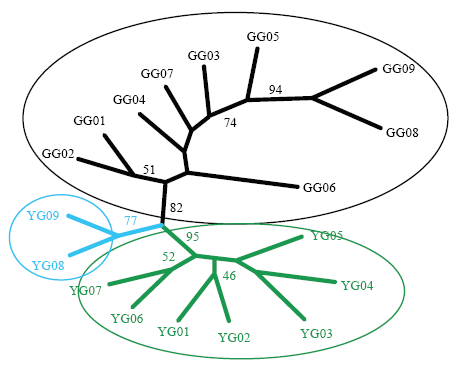 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3灰绿型(GG)和黄绿型(YG)羊草种群15 个微卫星标记的邻接树[30]
Fig. 3Clustering analyses of 15 microsatellite loci by neighbor-joining method in L. chinensis populations of gray-green type (GG) and yellow-green type(YG)
4 羊草生态型进化及扩散途径
在中国羊草草地分布区,尽管灰绿型羊草和黄绿型羊草经常混合生长,但是在栗钙土壤和风沙土壤的羊草草原和羊草草甸草原多以黄绿型羊草占更大比例,而在草甸土壤和盐碱土壤的羊草草甸则以灰绿型羊草占更大比例,在松嫩平原盐碱化羊草草甸,经常可以看到大小不等的黄绿型羊草无性系斑块镶嵌分布于灰绿型羊草为主的群落中[21]。上述关于灰绿型和黄绿型羊草在表型和分子上遗传分化的研究表明,无论是原位取样测定[24-26,28-30],还是同质园条件下测定[27,28,29,30],灰绿型羊草比黄绿型羊草具有更高的遗传变异。如果以遗传变异或遗传多样性大小判断其进化地位,则在中国羊草分布区,无论是大范围内还是小范围内,黄绿型羊草的遗传多样性普遍较小,灰绿型羊草的遗传多样性普遍较大,意味黄绿型羊草较原始,灰绿型羊草较进化。在大量生理生态试验研究中,获得了天然和试验种群两种生态型羊草均发生了显著的生理特征变异[18-19,23],由此也佐证了灰绿型羊草是对极端干旱或盐碱条件变化适应而从黄绿型羊草中变异出来的气候或土壤生态型。如果将耐干旱和耐盐碱的叶片细胞膜透性(电解质外渗率)这一生理特性加以比较,则在干旱胁迫下,黄绿型羊草耐受程度显著强于灰绿型羊草[21],而在盐、碱和混合盐胁迫下普遍以灰绿型羊草耐受程度显著强于黄绿型羊草[20]。以此可以推断,灰绿型和黄绿型羊草两个生态型分化既存在气候因素也存在土壤因素,但主导生态因子是土壤盐碱。
关于羊草的起源和扩散途径,目前尚未引起植物分类****重视,根据现有的研究积累,特别是在东北草原样带研究中,从形态特征和分子遗传特征均获得了诸多重要科学信息,包括从内蒙古高原中部到松嫩平原中部的9个样地(图4,红色点)的灰绿型羊草种群(GG9)的遗传多样性指数显著高于(P<0.05)黄绿型羊草种群(YG9),并在15 个微卫星位点的邻接树上聚在一组中[30];无论是9个样地(GG9,YG9),还是在该样带18个样地(图4,绿色点GG18),灰绿型和黄绿型羊草遗传多样性均呈从东到西逐渐减小,其遗传距离与地理距离呈为极显著的正相关关系(GG9:R2 = 0.53,P<0.01;GY9:R2 = 0.79,P<0.01;GG18:R2 = 0.417,P<0.01)[29,30],既表现为两种生态型羊草种群间的遗传变异均因地理距离增加而增大,也意味着在该样带中,西部种群比东部种群原始,最西部的18(9)号样地最原始。由此也可以进一步断定,在中国境内900 km大范围经度带(E:114°51′—124°16′)和小范围纬度带(N:43°14′—44°36′)内,灰绿型和黄绿型羊草均具有从西到东的扩散过程(图4,蓝箭头)。
图4
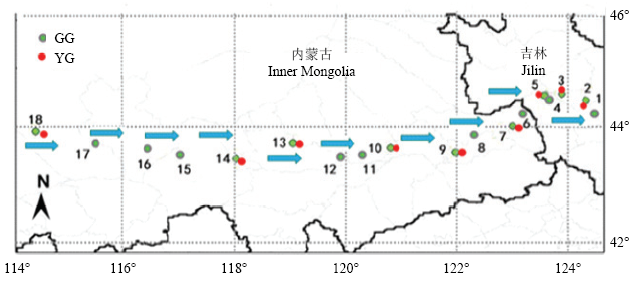 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4两个生态型羊草的取样点分布
GG:灰绿型;YG:黄绿型(依据文献[29,30]绘制)。箭头表示羊草自西向东的扩散方向和过程
Fig. 4Sampling point distribution of two ecotypes of Leymus chinensis
GG: gray-green type; YG: yellow-green type (drawn according to reference [29-30]). The arrow indicates the direction and process in which the leymus diffuses from west to east
前面已经推断,灰绿型羊草是对主导生态因子土壤盐碱的长期适应而从黄绿型羊草分化出来的耐盐碱进化生态型,从东北草原样带分子遗传多样性的变化规律看,其分化的区域仍然是草原带西部。对于松嫩平原盐碱草甸以灰绿型羊草占更大比例,是因为在群落构建中,该生境限制了黄绿型羊草的生长而使灰绿型羊草或者在竞争中取胜,或者容易在盐碱生境中定居与扩张。应该说,任何群落构建,尤其放在地质时间的历史发展中,种子传播并不是限制条件,如龙卷风和沙尘暴均可以使一个地方连同种子的表土空投到遥远的地方,而环境筛和种间关系才具有决定作用。这也可以从相距几百公里乃至几千公里隐域性植被的相同群落在植物组成上大体相同得到解释。对于羊草的起源和两个生态型分化地,以及羊草在中国草原,乃至在欧亚大陆草原的扩散途径,有待进一步研究。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
URL [本文引用: 1]

对国产赖草属15个种的叶片表皮进行了光镜观察,发现下表皮呈现的微形态差异可以把国产类群划分为3个群体,并参照各群体所具的外部形态特征,3个群体应分别属于前人组群划分中的3个组,即多穗组(sect. Leymus)、少穗组(sect. Aphanoneuron (Nevski) Tzvelev)和单穗组(sect. Anisopyrum (G riseb.) Tzvelev)。同时,根据叶表皮性状的递变趋势,分析了3个国产组的亲缘关系。结果表明:多穗组最原始,单穗组最高级,少穗组演化居中;单穗组与少穗组亲缘关系直接,与多穗组关系间接。
URL [本文引用: 1]

对国产赖草属15个种的叶片表皮进行了光镜观察,发现下表皮呈现的微形态差异可以把国产类群划分为3个群体,并参照各群体所具的外部形态特征,3个群体应分别属于前人组群划分中的3个组,即多穗组(sect. Leymus)、少穗组(sect. Aphanoneuron (Nevski) Tzvelev)和单穗组(sect. Anisopyrum (G riseb.) Tzvelev)。同时,根据叶表皮性状的递变趋势,分析了3个国产组的亲缘关系。结果表明:多穗组最原始,单穗组最高级,少穗组演化居中;单穗组与少穗组亲缘关系直接,与多穗组关系间接。
DOI:10.7525/j.issn.1673-5102.2007.06.006URL [本文引用: 1]

通过标本研究和野外考察,对中国赖草属(Leymus Hochst.)进行了分类修订。结果在中国共确认了3组、33种、7变种赖草属植物,其中多穗组包含4种,少穗组包含24种、7变种,单穗组包含5种,新报道的3个种和新修订的4个类群(即3个新组合和1个新名称)皆隶于少穗组。同时对赖草属的研究简史、属的形态特征和一些类群的地理分布也分别作了简要介绍。
DOI:10.7525/j.issn.1673-5102.2007.06.006URL [本文引用: 1]

通过标本研究和野外考察,对中国赖草属(Leymus Hochst.)进行了分类修订。结果在中国共确认了3组、33种、7变种赖草属植物,其中多穗组包含4种,少穗组包含24种、7变种,单穗组包含5种,新报道的3个种和新修订的4个类群(即3个新组合和1个新名称)皆隶于少穗组。同时对赖草属的研究简史、属的形态特征和一些类群的地理分布也分别作了简要介绍。
URL [本文引用: 2]

确认了中国区域有赖草属植物20种, 2变种,划分为3个组,即多穗组、少穗组和单穗组,其中,多穗组为新组。编制了新的分种检索表,报道了种的地理分布,推测了中国赖草属植物的分布中心。
URL [本文引用: 2]

确认了中国区域有赖草属植物20种, 2变种,划分为3个组,即多穗组、少穗组和单穗组,其中,多穗组为新组。编制了新的分种检索表,报道了种的地理分布,推测了中国赖草属植物的分布中心。
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]

采用徒手刮削法对国产赖草属中多穗组、少穗组和单穗组主要代表种的叶表皮微形态特征进行了观察。结果显示:(1)赖草属3组植物的叶表皮皆由长细胞、气孔器细胞、短细胞和刺毛组成,表现为典型的狐茅型;同时,3组植物在长细胞的长度与宽窄,气孔器的大小与分布及副卫细胞的形状,短细胞的丰缺与着生形式,刺毛的数量、体积与类型等性状上存在明显差异。(2)根据3组植物叶表皮性状的演化趋势,对各组的演化关系和系统位置分析表明,多穗组最原始,少穗组较进化,单穗组最高级;多穗组可能直接派生了较进化的少穗组,并在少穗组的基础上进而产生了最高级的单穗组。多穗组、少穗组和单穗组的这一系统关系与利用外部形态特征所获得的演化趋势基本一致。
URL [本文引用: 1]

采用徒手刮削法对国产赖草属中多穗组、少穗组和单穗组主要代表种的叶表皮微形态特征进行了观察。结果显示:(1)赖草属3组植物的叶表皮皆由长细胞、气孔器细胞、短细胞和刺毛组成,表现为典型的狐茅型;同时,3组植物在长细胞的长度与宽窄,气孔器的大小与分布及副卫细胞的形状,短细胞的丰缺与着生形式,刺毛的数量、体积与类型等性状上存在明显差异。(2)根据3组植物叶表皮性状的演化趋势,对各组的演化关系和系统位置分析表明,多穗组最原始,少穗组较进化,单穗组最高级;多穗组可能直接派生了较进化的少穗组,并在少穗组的基础上进而产生了最高级的单穗组。多穗组、少穗组和单穗组的这一系统关系与利用外部形态特征所获得的演化趋势基本一致。
[本文引用: 2]
[本文引用: 2]
[D].
[本文引用: 2]
[D].
[本文引用: 2]
[本文引用: 5]
[本文引用: 5]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 4]
[本文引用: 4]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[D].
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[D].
[本文引用: 3]
[D].
[本文引用: 3]
[本文引用: 4]
[本文引用: 4]
[本文引用: 8]
[本文引用: 9]
