 ,中国农业科学院北京畜牧兽医研究所,北京 100193
,中国农业科学院北京畜牧兽医研究所,北京 100193Cloning MsSQE1 from Alfalfa and Functional Analysis in Saponin Synthesis
KANG JunMei, ZHANG QiaoYan, JIANG Xu, WANG Zhen, ZHANG TieJun, LONG RuiCai, CUI HuiTing, YANG QingChuan ,Institute of Animal Science, Chinese Academy of Agricultural Science, Beijing 100193
,Institute of Animal Science, Chinese Academy of Agricultural Science, Beijing 100193通讯作者:
责任编辑: 李莉
收稿日期:2019-07-2接受日期:2019-09-24网络出版日期:2020-01-16
| 基金资助: |
Received:2019-07-2Accepted:2019-09-24Online:2020-01-16
作者简介 About authors
康俊梅,Tel:010-62816357;E-mail:kangjunmei@caas.cn。

摘要
关键词:
Abstract
Keywords:
PDF (7501KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
康俊梅, 张俏燕, 蒋旭, 王珍, 张铁军, 龙瑞才, 崔会婷, 杨青川. 紫花苜蓿MsSQE1的克隆及对皂甙合成的功能分析[J]. 中国农业科学, 2020, 53(2): 247-260 doi:10.3864/j.issn.0578-1752.2020.02.003
KANG JunMei, ZHANG QiaoYan, JIANG Xu, WANG Zhen, ZHANG TieJun, LONG RuiCai, CUI HuiTing, YANG QingChuan.
0 引言
【研究意义】皂甙又称皂苷、皂素和碱皂体,是普遍存在于自然界的一类糖苷类化合物,包括三萜类化合物、甾醇和类固醇。皂甙主要分布于高等植物中,尤其是中草药(如人参、雷公藤、三七、甘草等)的有效成分,具有良好的降胆固醇、降血脂、抗炎、抗癌、抗菌、杀虫等生物学活性[1,2,3,4]。因此,在药用植物中提取纯化皂甙得到了广泛应用,并对皂甙生物合成途径相关酶及调控机制开展了大量研究[5]。紫花苜蓿营养价值丰富,是公认的高蛋白饲草,并富含有维生素和矿物质。此外,苜蓿含有丰富的次生代谢产物,如苜蓿皂甙(alfalfa saponins),由于其药用功效,被视为保健品的原料,具有潜在的开发价值[6,7]。关于苜蓿皂甙的提取纯化与含量测定方面已有相关研究,但苜蓿皂甙合成的分子机制研究甚少。因此,开展苜蓿皂甙合成途径中关键基因的功能研究,对苜蓿皂甙的开发应用具有重要的指导作用。【前人研究进展】鲨烯环氧酶(squalene eposidases,SQE),又称鲨烯单加氧酶,在甲羟戊酸(mevalonic acid,MVA)途径中催化鲨烯C=C双键的环氧化反应,生成2,3-氧化鲨烯。这一反应是三萜皂甙合成途径中第一个氧化反应,生成甾醇及三萜类物质的前体物质,故鲨烯环氧酶的活性和含量决定了下游产物的量[8]。在三萜代谢途径中SQE的作用至关重要。由于SQE负责氧化还原反应,其蛋白质结构含有氧化还原反应所需要的辅助因子——黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)结合位点[9]。SQE不仅在植物次生代谢中起重要作用,而在动物和微生物中也是药物抑制病原菌生长和降低胆固醇的关键酶[10,11]。目前,许多生物的SQE基因被克隆,并进行功能分析,如植物中有拟南芥[12,13]、人参[14,15]、三七[16,17,18]、南非醉茄[19]、雷公藤[20,21]、甘草[22]、绞股蓝[23]、白桦[24]、罗汉果[25],微生物有酵母[26,27]、牛樟芝[28],动物有鼠[29]等。不同物种中,鲨烯环氧酶基因的拷贝形式是不同的。在酵母和小鼠中,SQE基因是以单拷贝形式存在的[26-27,29]。在植物中,SQE基因通常以基因家族的形式存在,例如在拟南芥基因组中,发现6个SQE基因成员,其中SQE1-3编码有活性的鲨烯环氧酶,而SQE4-6编码的蛋白则没有催化功能[12]。在药用植物人参中发现SQE基因家族有2个成员,均具有生物活性,在MeJA诱导下,PgSQE1的表达上调,而PgSQE2的表达却受到抑制[14,15]。三七中SQE家族的2个成员PnSQE1和PnSQE2也存在组织特异性表达模式,而且用MeJA诱导4年生三七植株发现,PnSQE1的表达量在24 h达到最高,PnSQE2表达量无明显变化,推测PnSQE1可能在皂甙、甾醇类次生代谢物的合成途径中起催化作用[16,17,18]。也有研究表明,体外诱导增加SQE的mRNA表达,三萜类物质生成量随之増加,降低SQE的mRNA表达,三萜类物质的生物合成受到抑制。人参鲨烯环氧酶基因的RNAi高效植物表达载体pMHZ111-SQE转化人参愈伤组织中,发现人参皂甙含量大幅度下降。进一步证实了SQE基因与皂甙的合成有关[14]。【本研究切入点】目前,有关皂甙生物合成途径的关键基因及其功能研究主要集中在中草药植物,如人参、刺五加、三七等,还有模式植物拟南芥等,关于苜蓿皂甙合成的相关研究鲜见报道。【拟解决的关键问题】本研究克隆了苜蓿MsSQE1,对其编码的蛋白进行亚细胞定位和原核表达分析,研究其在不同组织和诱导条件下的表达模式及对皂甙含量的影响,通过研究在苜蓿中过表达MsSQE1对苜蓿皂甙含量的影响,进一步验证其在皂甙合成中的作用机制,以期为利用基因工程手段培育高皂甙含量的苜蓿品种奠定理论基础。1 材料与方法
1.1 试验材料与培养
紫花苜蓿中苜1号(Medicago sativa L. Zhongmu No.1)由中国农业科学院畜牧所饲草育种课题组育成。挑选饱满的中苜1号种子萌发1周,移入霍格兰氏营养液中,置于光照培养箱(16 h昼/8 h夜,24℃昼/20℃夜,相对湿度40%)培养4周。取部分幼苗分别收获根、茎、叶组织,另取部分幼苗进行15 W紫外照射30 min、ABA(100 µmol·L-1)、GA3(50 µmol·L-1)和MeJA(200 µmol·L-1)胁迫处理,在不同时间点收集地上部分组织,所有植物样品冷冻于液氮中备用。中苜1号种子经75%酒精溶液和0.1% HgCl2溶液消毒后,用无菌水洗涤7次后放置在无菌湿润滤纸上,室温黑暗培养2 d后,将发芽的种子移入1/2 SH培养瓶中,培养4周(条件同上),获得无菌苗用于遗传转化。1.2 MsSQE1的克隆
根据已知蒺藜苜蓿鲨烯环氧酶基因的CDS序列,利用Primer 5.0设计引物P1和P2(表1),以紫花苜蓿第一链cDNA为模板进行PCR扩增。PCR扩增程序为94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 2 min,30个循环;72℃ 5 min。PCR产物用1%的琼脂糖凝胶电泳检测后回收,与pEASY-T3克隆载体连接,转化大肠杆菌感受态细胞Trans-T1,挑取阳性克隆送北京天一辉远公司测序。Table 1
表1
表1本研究所用引物序列
Table 1
| 引物名称 Primer name | 引物序列 Sequence of primer (5′-3′) | 用途 Function |
|---|---|---|
| P1 | GTTCTTTGAGATGGATTATCAGTAT | ORF分离 ORF isolation |
| P2 | AAATGACATGAATACTACAGTGACA | |
| SQE1-PE-SPt-f | GAAAAGAAGAAAACAGGTTCAAGTT | 原核表达 Prokaryotic expression |
| SQE1-PE-f | ATGGATTATCAGTATATTCTTGGAGGG | |
| SQE1-PE-r | ATGGACAGGAGGCATTCTGTAATAT | |
| SQE1-GFP-f | CCctcgagATGGATTATCAGTATATTCTTGGAGGG | 亚细胞定位 Subcellular localization |
| SQE1-GFP-r | TGgtcgacATGGACAGGAGGCATTCTGTAATAT | |
| SQE1-RTf-1 | GCAAAGGCTCCTCTCACCATAG | 实时荧光定量 PCR/qRT-PCR |
| SQE1-RTr-1 | GCACATCAACCAAACAGCGAAT | |
| Actin-s | CAAAAGATGGCAGATGCTGAGGAT | 内参基因 House-keeping gene |
| Actin-a | CATGACACCAGTATGACGAGGTCG | |
| SQE1-P1 | tctagaATGGATTATCAGTATATTCTTGGAGGG | 扩增目的基因 Amplification of target genes |
| SQE1-P2 | ggatccTTAATGGACAGGAGGCATTCTGTAATATGC | |
| 35S-f | ACTATCCTTCGCAAGACCCTTCCTC | 转基因株系的鉴定 Identification of transgenic lines |
| SQE1-r | TTAATGGACAGGAGGCATTCTGTAAT |
新窗口打开|下载CSV
1.3 MsSQE1的生物信息学分析
通过NCBI/BLAST(https://blast.ncbi.nlm.nih.gov/ Blast.cgi)搜索同源序列并比对分析;用DNAMAN软件进行蛋白多重序列比对。应用MEGA 6.0软件进行系统进化树分析。利用SOPMA(http://npsa-pbil.ibcp. fr/cgi-bin/npsa_automat.pl?page=npsa_sopm.html)程序分析蛋白质序列的氨基酸组成,分子量等理化性质。借助生物学软件SignalP 4.1Server(http://www.cbs.dtu. dk/services/SignalP/)进行信号肽预测。采用TMHMM Server在线软件(http://www.cbs.dtu.dk/services/ TMHMM-2.0/)预测蛋白质的跨膜区、疏水性和蛋白质的结构组成。1.4 MsSQE1的亚细胞定位
通过在线软件TargetP 1.1(http://www.cbs.dtu.dk/ services/TargetP/)和PSORT prediction(http://psort.hgc. jp/form.html)预测目标基因编码蛋白的亚细胞定位。利用Primer 5.0设计引物SQE1-GFP-f/SQE1-GFP-r(含有XhoⅠ和SalⅠ酶切位点,表1),扩增MsSQE1编码序列,确定序列的正确性,通过双酶切将目的片段整合到pA7-GFP,构建35S启动下的瞬时表达载体35S::MsSQE-GFP和35S::GFP,通过基因枪轰击法,转入到洋葱表皮细胞。25°C培育24 h,然后用共聚焦显微镜观测并拍照(Olympus FV500,日本)。1.5 原核表达分析
由于SQE1编码蛋白N端存在信号肽,信号肽的存在会影响编码蛋白在大肠杆菌中的表达。故原核表达采用2种方案,一是将SQE1的整个编码区序列插入原核表达载体;二是将SQE1编码区N末端截掉信号肽(25个氨基酸序列),再插入原核表达载体。因此,设计2对引物SQE1-PE-f/SQE1-PE-r(扩增全长SQE1编码区)和SQE1-PE-f/SQE1-PE-SPt-f(扩增去掉信号肽的序列),分别扩增目标编码区序列,然后连接到pEASY-E2载体中。将2种原核表达重组子pEASY-E2-MsSQE1和pEASY-E2-MsSQE1ΔN25,以及pEASY-E2-Control分别转入大肠杆菌Transetta(DE3)。然后加入终浓度为1.0 mmol·L-1的IPTG,在30℃诱导重组蛋白表达5 h,收集菌体并提取蛋白,处理好的蛋白样品用10% SDS-PAGE检测,凝胶用G-250考马斯亮蓝染色,脱色后拍照。1.6 MsSQE1的表达分析
苜蓿样品总RNA的提取采用植物RNA提取试剂盒(详细步骤见说明书),紫外分光光度计测定RNA的浓度(NanoDrop 2000)。采用qRT-PCR检测苜蓿不同组织根、茎、叶中MsSQE1的相对表达水平,同时测定苜蓿幼苗受紫外辐射、ABA、GA3和MeJA诱导后,在不同时间点地上部分MsSQE1的相对表达量。取1 μg总RNA,以SQE1-RT-f1/SQE1-RT-r1和Actin-f/Actin-r为引物(表1),看家基因β-actin作内参,采用ABI公司的7300 Real Time PCR System进行扩增,设置3个生物学重复。1.7 MeJA诱导条件下皂甙含量的测定
取MeJA处理组中不同时间点地上部分样品粉碎后经石油醚脱脂,-80℃冻干70 h,取出后过60目筛,置于干燥器中保存。称取30 mg冻干样品各3份,用1 mL 70%乙醇在超声清洗机中提取30 min,4℃过夜,再次超声30 min。3 300 r/min离心30 min,取上清液100 μL注入预处理过的SPE柱,分别用5 mL水和5 mL 30%甲醇冲洗后,再以甲醇洗脱4次,每次1 mL。合并洗脱液置于10 mL具塞试管中进行比色测定,具体方法参考徐琅等[30]方法。以空白平行样作对照,用分光光度计在545 nm处测定各管中溶液的吸光度,计算总皂苷含量。1.8 超表达载体构建及苜蓿遗传转化
设计含酶切位点XbaⅠ和BamHⅠ的引物SQE1-P1/SQE1-P2(表1),以cDNA第一链为模板进行PCR扩增,PCR产物回收后连接到pEASY-T3载体。经测序确定序列的正确性,并提取重组质粒pEASY-T3-MsSQE1。用XbaⅠ和BamHⅠ快速限制性内切酶对pBI121和重组子pEASY-T3-MsSQE1进行双酶切,在T4连接酶的作用下将目的基因编码区序列插入到植物超表达载体pBI121中,构建目的基因超表达载体pBI121-MsSQE1,并转化农杆菌EHA105。采用农杆菌侵染法转化紫花苜蓿中苜1号,具体操作参考COSSON 等[31]方法。1.9 过表达MsSQE1转基因紫花苜蓿的鉴定及对皂甙含量的影响
以抗性T0转基因植株的总DNA为模板,用pBI121上35S启动子的上游引物35S-f和MsSQE1的下游引物SQE1-r进行PCR扩增,鉴定阳性转基因苜蓿,转空载体pBI121再生株系的DNA为阴性对照,pBI121-SQE1质粒为阳性对照。利用qRT-PCR检测阳性转基因紫花苜蓿,转空载体苜蓿地上部分MsSQE1的表达水平(方法同1.6),同时测定其总皂苷含量(方法同1.7)。2 结果
2.1 MsSQE1的克隆及序列分析
以紫花苜蓿DNA为模板,P1/P2为引物进行PCR扩增,得到一条约1 800 bp的条带,经测序分析发现该基因的最大开放阅读框为1 578 bp,编码525个氨基酸(图1)。同源性分析发现,其氨基酸序列与蒺藜苜蓿的同源性最高(98.9%),与水稻、拟南芥、衣藻和动物中鲨烯环氧酶氨基酸序列的同源性分别为81.4%、80%、57.4%和44.6%(图2)。通过氨基酸序列比对发现,不同物种均具有2个典型的FAD绑定结构域,这两个结构域高度保守,表明是鲨烯环氧酶的活性中心。系统进化树分析显示,该基因编码的SQE与蒺藜苜蓿MtSQE1的亲缘关系最近,属于SQE1基因(图2),命名为MsSQE1。MsSQE1与蒺藜苜蓿的3个SQEs、大豆的2个SQEs属于同一分支,表明亲缘关系较近。据报道拟南芥AtSQE1-3具有鲨烯环氧酶活性功能,而AtSQE4-6则没有酶活性,系统进化树分析显示MsSQE1与AtSQE1-3同属于一个大的分支上,而与AtSQE4-6属于不同的分支,暗示MsSQE1具有鲨烯环氧酶活性。衣藻、酵母与动物的SQE均单独一个分支,表明亲缘关系较远(图3)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1MsSQE1的克隆与cDNA全序列
A:MsSQE1的PCR扩增;B:MsSQE1的cDNA全序列
Fig. 1Cloning and full sequence of MsSQE1 from alfalfa
A: PCR Amplification of MsSQE1; B: Full sequence of MsSQE1
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2代表性物种SQE1氨基酸序列的多重比对
MsSQE:紫花苜蓿M. sativa;MtSQE:蒺藜苜蓿M. truncatula;OsSQE:水稻O. sativa;AtSQE:拟南芥A. thaliana;CrSQE:衣藻C. reinhardtii;HsSQE:人H. sapiens。黑色方框代表预测的跨膜结构域;黑色下划线表示FAD结合域 The predicted transmembrane domain was boxed; FAD binding domain was underlined in black
Fig. 2Sequence alignment of the representative squalene epoxidase amino acid sequences from the indicated species
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3紫花苜蓿与其他物种SQE的系统进化树
Zm01g028299、Zm01g047998:玉米Zea mays;Os03g0231800、Os03g0231700:水稻 Oryza sativa;Gm15g061800、Gm13g253100:大豆Glycine max;MsSQE:紫花苜蓿Medicago sativa;Mt04g092640、Mt06g035065、Mt06g034955:蒺藜苜蓿 Medicago truncatula;A4A49-24460、A4A49-34922:烟草Nicotiana tabacum;Pt07g007600v3、Pt02g114500v3:杨树Populus trichocarpa;Ta02g059900、Ta02g235500:小麦Triticum aestivum;At02g22830、At04g37760、At01g58440、At05g24140、At05g24150、At05g24160:拟南芥Arabidopsis thaliana;Cr17g734644v5:衣藻Chlamydomonas reinhardtii;YGR175C:酵母Saccharomyces cerevisiae;Q14534、E7EVQ6:人Homo_sapiens
Fig. 3Phylogenetic tree of SQE protein sequences from alfalfa and other species
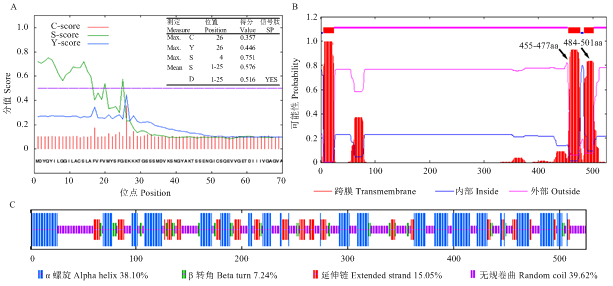
通过SOPMA在线软件预测表明,MsSQE1二级结构以α-螺旋与无规则卷曲为主,其中α-螺旋为38.10%,无规则卷曲为39.62%,β-转角为7.24%,延伸链为15.05%。理化性质分析MsSQE1蛋白分子量为56.97 kD,理论等电点为8.59。借助SignalP 4.1 Server软件分析MsSQE1序列结果显示,SQE1蛋白序列第26位谷氨酸残基具有最高的原始剪切位点分值0.357和第4位谷氨酰胺残基具有最高的信号肽分值0.751,推测MsSQE1序列前25个氨基酸可能组成一个信号肽,在跨膜运输中起信号识别作用,信号肽剪切位点位于第25—26位氨基酸。TMHMM Server在线软件分析显示,MsSQE1有3个跨膜螺旋区(TM helix),第一个跨膜螺旋区从第5个氨基酸残基到第24个氨基酸残基,方向由外向内;第二个从第455个氨基酸残基到第477个氨基酸残基,方向由内向外;第三个从第484个氨基酸残基到第501个氨基酸残基,方向由外向内(图3)。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4MsSQE1蛋白的结构分析
A:蛋白信号肽预测,C-score:原始剪切位点的分值;S-score:信号肽的分值;Y-score:综合剪切位点的分值;mean S:信号肽分值的平均值;D:识别分值;B:跨膜结构预测;C:二级结构分析
Fig. 4Analysis of the secondary structure of MsSQE1 protein
A: The prediction of signal peptide of MsSQE1, C-score: Raw cleavage site score; S-score: Signal peptide score; Y-score: Combined cleavage site score; mean S: The average S-score of the possible signal peptide; D: Discrimination score; B: The prediction of transmembrane regions of MsSQE1; C: Analysis of the secondary structure of MsSQE1
2.2 亚细胞定位
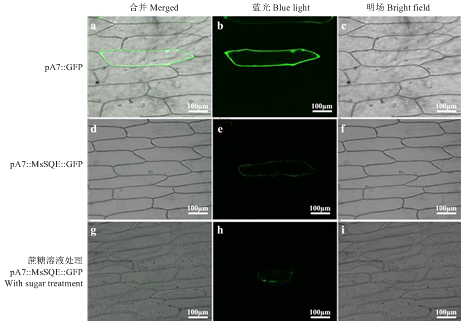
利用PSORT prediction软件预测MsSQE1蛋白主要定位在内质网膜、质膜、高尔基体和内质网腔。为了验证MsSQE1蛋白的亚细胞定位,采用基因枪轰击法将含有MsSQE1编码序列的瞬时表达载体pA7-MsSQE1-GFP转入洋葱表皮,在35S强启动子驱动下,MsSQE1-GFP融合蛋白在洋葱表皮细胞中过量表达,用激光共聚显微镜观察融合蛋白的荧光信号确定MsSQE1在细胞内的表达部位。结果显示,转空载体pA7-GFP的细胞,荧光信号分布在整个细胞的膜和细胞核上;而转化了pA7-MsSQE1-GFP的细胞,只有细胞膜上有微弱的荧光信号,同时经过细胞失水发生质壁分离时观测荧光信号,同样融合蛋白只有在细胞膜上有微弱的表达。由于试验方法的局限性,不能观测到细胞器的结构,无法确定高尔基体、内质网膜上是否能表达。结合软件预测结果,MsSQE1蛋白可能是分泌性蛋白,主要集中在分泌途径上,分布在内质网膜、质膜、高尔基体及内质网腔内。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图535S::MsSQE1-GFP在洋葱表皮细胞中的亚细胞定位分析
a—c:35::GFP转化洋葱表皮绿色荧光蛋白分布情况;d—f:35S::MsSQE1-GFP转化洋葱表皮细胞绿色荧光蛋白分布情况;g—i:转化了35S::MsSQE1-GFP的洋葱表皮细胞在细胞失水(0.3 g·mL-1蔗糖)条件下绿色荧光蛋白的分布。Bar=100 µm
Fig. 5Subcellular localization of 35S::MsSQE1-GFP in onion epidermal cell
a-c: Images of onion epidermal cells expressing 35S::GFP taken under GFP fluorescence; d-f: Images of onion epidermal cells expressing 35S::MsSQS-GFP taken under GFP fluorescence; g-i: Images of dehydrated (0.3 g·mL-1 sucrose ) onion epidermal cells expressing 35S::MsSQS-GFP taken under GFP fluorescence. Bar=100 µm
2.3 原核表达分析
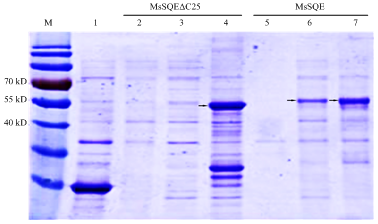
对不同植物的SQE结构分析表明,SQE蛋白具有3个跨膜结构域,分别位于N末端(1个)和C末端(2个),暗示SQE蛋白是位于内质网膜与质膜上的膜蛋白[19]。为了解MsSQE1的催化功能,需要获得一定量的可溶性蛋白,前人研究证实截掉跨膜结构域可以增加可溶性蛋白的表达量。因此,构建MsSQE1全长编码区和N末端截短(N-terminal truncated)25个氨基酸的MsSQE1原核表达重组子。同时,构建了在pEASY-E2表达载体内插入一段对照基因序列,作为空白对照,命名为pEASY-E2- Control。将3种重组子转入大肠杆菌Transetta(DE3)中,在T7启动子作用下,用1.0 mmol·L-1的IPTG诱导重组蛋白在大肠肝菌中大量表达,分别提取菌液蛋白,离心后分别取上清和沉淀进行SDS-PAGE电泳分析。结果(图6)显示,经过IPTG诱导后pEASY-E2-MsSQE1上清液总蛋白和沉淀物总蛋白中均在55—60 kD检测到目标重组蛋白条带,而转化了pEASY-E2-MsSQE1ΔN25大肠杆菌只能在其沉淀总蛋白中检测到分子量大约55 kD的目标重组蛋白条带。因此,MsSQE1蛋白可在大肠杆菌中大量表达,且可检测到可溶性蛋白。而N末端截短25个氨基酸后,MsSQE1蛋白依然可在大肠杆菌中表达,但均为包涵体蛋白。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6SDS-PAGE分析大肠杆菌中紫花苜蓿鲨烯环氧酶的表达
M:蛋白分子质量标准;1:转化了pEASY-E2-Control的大肠杆菌总蛋白(经过IPTG诱导表达5 h);2:转化了pEASY-E2-MsSQE1ΔN25的大肠杆菌总蛋白(未经IPTG诱导表达);3:转化了pEASY-E2-MsSQE1ΔN25大肠杆菌上清蛋白(经过IPTG诱导表达5 h);4:转化了pEASY-E2-MsSQE1ΔN25大肠杆菌沉淀蛋白(经过IPTG诱导表达5 h);5:转化了pEASY-E2-MsSQE1的大肠杆菌总蛋白(未经IPTG诱导表达);6:转化了pEASY-E2- MsSQE1大肠杆菌上清蛋白(经过IPTG诱导表达5 h);7:转化了pEASY-E2-MsSQE1大肠杆菌沉淀蛋白(经过IPTG诱导表达5 h);箭头表示MsSQE1蛋白的表达
Fig. 6Expression analysis of MsSQE1/MsSQE1ΔN25 by SDS-PAGE in E.coli
M: Protein ladder; 1: Total protein expressed by E.coli. harboring pEASY-E2-Control(inducted 5 h with IPTG inducement); 2: Total protein expressed by E.coli. harboring pEASY-E2-MsSQE1ΔN25 (without IPTG inducement); 3: Soluble protein expressed by E.coli. harboring pEASY-E2- MsSQE1ΔN25 (inducted 5 h with IPTG inducement); 4: Inclusion membrane protein expressed by E.coli. harboring pEASY-E2- MsSQE1ΔN25 (inducted 5 h with IPTG inducement); 5: Total protein expressed by E.coli. harboring pEASY-E2- MsSQE1(without IPTG inducement); 6: Soluble protein expressed by E.coli. harboring pEASY-E2-MsSQE1(inducted 5 h with IPTG inducement); 7: Inclusion membrane protein expressed by E.coli. harboring pEASY-E2-MsSQE1 (inducted 5 h with IPTG inducement)); Arrows represent expression of MsSQE1 protein
2.4 MsSQE1组织差异性表达及在不同诱导条件下的表达分析
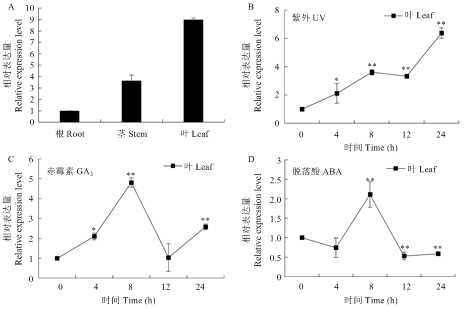
不同植物中SQE1的组织差异性表达存在较大差异。为了解紫花苜蓿不同组织中MsSQE1的表达模式,以4周龄苜蓿叶、茎、根各组织样品的反转录cDNA为模板,进行荧光定量PCR分析,检测MsSQE1在紫花苜蓿不同组织中的转录水平。结果显示,MsSQE1在叶中表达量最高,其次是茎,根中表达量最低,叶中的表达量是根中的8.99倍,茎中的表达量是根中的3.63倍(图7-A)。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7MsSQE1在紫花苜蓿不同组织及诱导条件下叶中的表达水平
A:MsSQE1在紫花苜蓿不同组织中的表达分析;B、C、D:在UV、GA3和ABA诱导下MsSQE1在紫花苜蓿叶中的表达水平,*和**分别代表P<0.05 和P<0.01(t检验)。下同
Fig. 7Expression analysis of MsSQE1 in the indicated alfalfa tissues and under different conditions
A: Analysis of the relative expression level of MsSQE1 in the indicated alfalfa tissues using qRT-PCR; B, C, D: Relative expression level of MsSQE1 in alfalfa seedlings treated with UV, GA3 or ABA, * and ** indicate P<0.05 and P<0.01, respectively (Student’s t-test). The same as below
利用qRT-PCR检测UV辐射和外源激素诱导下紫花苜蓿叶中MsSQE1的转录水平。结果显示,在15 W紫外灯照射20 min后,不同时间点MsSQE1在叶中的表达量呈上升趋势,在时间点24 h时表达量最大是对照的6.28倍(图7-B);GA3(50 µmol·L-1)诱导处理24 h,叶中MsSQE1的转录水平受到诱导,表达量上调,8 h时表达量最大,是对照的4.8倍(图7-B);在ABA (100 µmol·L-1)诱导下,MsSQE1在叶中的表达水平先下降再升高又下降,8 h时表达量最高是对照的2.1倍(图7-B),12 h时表达量最低是对照的0.53倍,暗示MsSQE1受ABA诱导表达模式比较复杂。
2.5 MeJA处理下MsSQE1在苜蓿中的表达及对皂甙含量的影响
为验证MsSQE1在MeJA诱导下的表达模式。用MeJA(200 µmol·L-1)处理4周龄紫花苜蓿144 h,结果显示,不同时间点MsSQE1在紫花苜蓿叶中的表达量变化差异较大(图8-A)。随着胁迫时间的延长,叶中MsSQE1表达量先升高后降低,呈现出2个表达高峰值,第一个峰值是8 h时表达量是对照的9.19倍,24 h时表达量下降到最低是对照的2.60倍,随后表达量又不断提高,144 h时表达量达到最大值是对照的18.39倍。同时,测定了在MeJA诱导下紫花苜蓿叶中的总皂苷含量,结果表明总皂甙含量也呈现上升的趋势(图8-B),与对照相比皂甙含量增加了15.7%—66.9%,其中4和24 h达到显著水平(P<0.5),48、96和144 h达到极显著水平(P<0.1)。图8
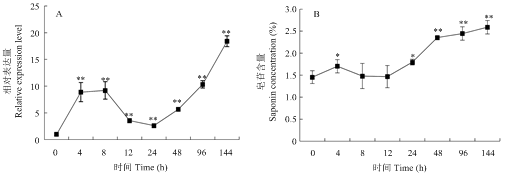 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8紫花苜蓿在MeJA诱导下MsSQE1的相对表达量(A)和总皂苷含量的变化(B)
Fig. 8The relative expression level of MsSQE1 (A) and the change of saponin concertation(B) in different tissues induced by MeJA in alfalfa
2.6 苜蓿中过表达MsSQE1对皂甙含量的影响
为了验证MsSQE1在苜蓿皂苷合成途径中的功能,构建了植物高效表达载体pBI-121-MsSQE1,采用农杆菌介导法转化了紫花苜蓿,通过卡那霉素筛选获得66株抗性植株。经阳性鉴定结果显示,MsSQE1已成功转入紫花苜蓿基因组中(图9-A)。随机挑选3个转基因株系,提取总RNA,利用qRT-PCR检测MsSQE1的转录水平,同时取地上部分进行总皂苷含量的测定。结果表明,过表达MsSQE1苜蓿与对照植株相比MsSQE1的表达水平显著上调,分别是对照的3.11、4.67和9.45倍(图9-B)。转基因株系中总皂苷含量也相应的增加,分别比对照提高了14.26%、23.24%和28.05%(图9-C)。表明过表达MsSQE1对苜蓿总皂甙含量的积累有重要的作用。图9
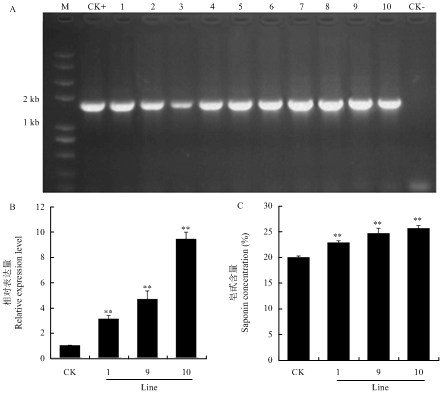 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9转基因苜蓿的鉴定及过表达MsSQE1对苜蓿总皂甙含量的影响
A:阳性转基因植株鉴定;B:qRT-PCR测定MsSQE1的相对表达量;C:转基因植株总皂甙含量测定;CK+:pBI-121-MsSQE1质粒(阳性对照);CK-:转空载体pBI-121苜蓿植株(阴性对照);1—10:抗性转化植株;1、9、10:过表达MsSQE1的转基因紫花苜蓿
Fig. 9Identification of transgenic alfalfa and effect of overexpression MsSQE1 on total saponin content of alfalfa
A: Verification of positive transgenic plants; B: Analysis of the relative expression level of MsSQS by qRT-PCR in the three representative transgenic lines; C: Content of total saponins in the indicated transgenic lines. CK+: Plasmid harboring 35S::MsSQS (positive control); CK-: pBI-121 empty vector (negative control); 1-10: Regenerated alfalfa plants resistant to kanamycin; 1,9,10: Three independent transgenic alfalfa lines. Bars represent the mean ± SD of three biological replicates
3 讨论
皂甙是一种天然的表面活性糖苷,包括三萜苷类和类固醇物质,许多植物中都存在这类物质。由于三萜皂苷在保健食品和生物制药等方面具有重要的潜在应用价值。因此,在许多植物尤其是药用植物(人参、三七等)中得到了广泛研究。本研究重点对苜蓿皂甙生物合成途径中的鲨烯环氧酶进行功能分析。鲨烯环氧酶(SQE)是三萜类和甾醇类物质生物合成途径中的一种关键限速酶,能够在分子氧和还原辅酶Ⅱ(NADPH)参与下,催化角鲨烯转变成环氧化鲨烯,而环氧化鲨烯又是三萜类皂甙的重要中间产物。本研究首次从紫花苜蓿中克隆了MsSQE1,该基因编码蛋白氨基酸序列与其他物种SQE序列的保守性分析表明,6个不同物种均具有2个保守的FAD绑定结构域,而且不同物种2个结构域高度保守,表明这两个典型的结构域是SQE的活性中心,是合成甾醇和三萜类物质特有的结构。序列结构分析显示,其编码的蛋白序列前25个氨基酸可能组成一段引导蛋白跨膜转移(定位)的N-末端疏水性氨基酸序列,同时C端有2个跨膜结构域,暗示鲨烯环氧酶是一种膜结合蛋白,属于高度保守的SQE家族,而且具有酶特有的结构。有研究报道,截掉酶蛋白氨基酸序列末端的跨膜结构域,可以增加可溶性蛋白的表达量[20,25,28],从而增加酶的活性。本研究截短了N末端的25个氨基酸序列,研究结果表明,去掉N末端的跨膜结构域,没有增加可溶性蛋白的表达量反而降低了其表达,那么去掉C末端的跨膜结构域是否会增加可溶性蛋白的表达,有待进一步研究。为了验证MsSQE1的亚细胞定位,通过绿色荧光蛋白的洋葱表皮瞬时表达分析,发现只有非核部分有微弱的荧光信号,同时经过细胞失水发生质壁分离时观测荧光信号,同样融合蛋白只在细胞膜上有微弱的表达。由于试验条件的局限性观测不到细胞器的结构,所以无法确定内质网膜和高尔基体膜上是否能表达。拟南芥AtSQE1亚细胞定位分析表明,AtSQE1定位于内质网膜上[12]。结合软件预测分析推断,MsSQE1可能定位于内质网膜或质膜。MsSQE1不同组织特异性表达分析表明,MsSQE1在叶中的表达水平优于在茎和根中的表达。这个研究结果与睡茄、三七和白桦的组织差异性表达的结果相一致[17,19,24]。由此推测,紫花苜蓿叶片可能是甾醇、三萜类物质生物合成的场所。人参中PgSQE1在所有器官中都大量积累,而PgSQE2仅在叶柄和花芽中弱表达并优先表达。原位杂交分析表明,PgSQE1和PgSQE2的mRNAs均优先聚集在叶柄的维管束组织和树脂管中[14,15]。
在高等植物中,普遍认为GA3、ABA与MeJA等生长调节物质作为信号因子,在防御反应、开花、衰老以及次生代谢等方面具有重要的调节作用。因此,通常采用这些信号调节因子诱导处理来分析次生代谢物生物合成的作用机制。已有文献报道,SQE受GA3、ABA等外界条件的诱导表达[24]。本研究用GA3(50 µmol·L-1)诱导处理24 h,苜蓿地上部分MsSQE1的转录水平显著上升,8 h时表达量达到最高;在ABA (100 µmol·L-1)诱导下,同样是8 h时地上部分表达量最高,但其他时间点表达量低于对照,其作用的分子机制有待深入探讨。MeJA是一种常用的诱导剂,在拟南芥[12]、人参[15]、三七[16,17]、雷公藤[20]、白桦[24]和柴胡[32]等植物均证实在MeJA诱导下,SQE的表达水平显著上调。本研究紫花苜蓿在MeJA诱导下,MsSQE1的表达水平也显著上升,同时测定了苜蓿总皂甙的含量,有趣的是总皂苷含量随着MsSQE1表达水平的提高同样呈现上升的趋势,总皂苷含量与对照比增加了15.7%—66.9%。在人参根中发现SQE与人参皂苷合成量高度相关,MeJA可诱导PgSQE表达上调,同时增加三萜类化合物的合成量[15]。药用植物雷公藤的TwSQE1与TwSQE2同样受到MeJA的诱导表达,MeJA诱导后,TwSQE1的表达水平显著提高,而TwSQE2表达水平增幅较小[20,21]。桦树BpSQE也受ABA与MeJA的诱导表达,进一步证实MeJA与ABA通过促进BpSQE的表达对次生代谢的生物合成进行调节[24]。
为了进一步验证MsSQE1对苜蓿皂甙生物合成的功能,将MsSQE1在苜蓿中过表达。通过分析过表达MsSQE1的转基因紫花苜蓿与转空载体植株中MsSQE1的相对表达水平,结果显示转基因植株中MsSQE1的表达量比对照显著提高,而且转基因苜蓿总皂苷含量也相应的增加,与对照相比,提高了14.26%—28.05%,结果暗示转基因苜蓿中总皂甙含量与MsSQE1的转录水平具有显著的相关性。综上所述,MsSQE1编码一种特定的鲨烯环氧酶,该酶是苜蓿皂甙合成的关键酶,对苜蓿总皂甙的合成具有重要的调节作用。
4 结论
从紫花苜蓿中克隆了皂甙生物合成中的关键限速酶基因鲨烯环氧酶基因(MsSQE1)。不同物种的MsSQE1均具有2个高度保守结构域,并且还具有酶特有的结构。MsSQE1对苜蓿皂甙的合成具有正向调控作用。叶片可能是紫花苜蓿甾醇、三萜类物质生物合成的场所。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 1]
[本文引用: 4]
[本文引用: 5]
[本文引用: 3]
[本文引用: 4]
[本文引用: 2]
[本文引用: 3]
[本文引用: 4]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 5]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
