 ,1, 庞鑫1, 贾莉1, 樊海苗1
,1, 庞鑫1, 贾莉1, 樊海苗1Effects of Milk Replacer Feeding Level on Hematology Index and Gut Barrier Function in Lambs
LI YanJun1, NIU XiaoLin2, ZHANG Qian2, WANG GuoXiu1, LI FaDi1,2, LI Fei2, LI Chong ,1, PANG Xin1, JIA Li1, FAN HaiMiao1
,1, PANG Xin1, JIA Li1, FAN HaiMiao1通讯作者:
责任编辑: 林鉴非
收稿日期:2019-07-8接受日期:2019-08-23网络出版日期:2020-01-16
| 基金资助: |
Received:2019-07-8Accepted:2019-08-23Online:2020-01-16
作者简介 About authors
李彦军,Tel:18893721015;E-mail:1963771334@qq.com。

摘要
关键词:
Abstract
Keywords:
PDF (466KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李彦军, 牛骁麟, 张千, 王国秀, 李发弟, 李飞, 李冲, 庞鑫, 贾莉, 樊海苗. 代乳粉水平对羔羊血液指标和肠道屏障功能的影响[J]. 中国农业科学, 2020, 53(2): 409-417 doi:10.3864/j.issn.0578-1752.2020.02.015
LI YanJun, NIU XiaoLin, ZHANG Qian, WANG GuoXiu, LI FaDi, LI Fei, LI Chong, PANG Xin, JIA Li, FAN HaiMiao.
0 引言
【研究意义】在现代肉羊舍饲养殖中,由于母羊泌乳量不足、产羔数过多、乳房炎、母羊产后瘫痪等原因,羔羊人工哺乳的应用非常广泛。目前我国养羊模式正在从传统的散养模式向现代化集约化规模化的方向转型,通过人工哺乳实现羔羊早期断奶,可以缩短母羊的繁殖周期,提高母羊利用效率,增加年产羔数,降低培育成本,从而提高肉羊饲养的经济效益。代乳料在肉羊养殖中的应用加快了优良种羊的培育,对母羊多胎多产和体弱母羊提高羔羊成活率都具有重要意义[1]。合理利用代乳粉饲喂早期断奶羔羊有利于羔羊生长发育,提高羔羊抗病力,增强体质,降低羔羊的发病率[2]。因此代乳粉的合理利用对于提高羔羊成活率和生产性能具有重要意义。【前人研究进展】适宜的营养水平和饲喂水平是代乳粉在羔羊生产中的合理应用的关键。岳喜新研究了羔羊代乳粉蛋白水平对早期断奶羔羊生长性能、消化代谢、血清生化指标等的影响,认为代乳粉的蛋白质水平为25%时羔羊增重效果最好[3]。江喜春等研究认为中等能量水平的代乳粉有利于羔羊的生长发育,代乳粉总能水平为19.0 MJ·kg-1较好[4]。但生产中代乳粉通常定量饲喂,而不同养殖场代乳粉饲喂水平差异较大,因此代乳粉饲喂水平对羔羊生长发育比营养水平更加重要。岳喜新等研究了代乳粉饲喂水平对早期断奶羔羊生长发育、营养物质消化代谢及血清生化指标的影响,认为0—50日龄羔羊的代乳粉饲喂水平为体重的2%为宜[5]。上述羔羊代乳粉适宜营养水平或饲喂水平的研究主要针对羔羊生产性能。然而有研究表明,最佳生长性能的养分需要量与最佳免疫系统和肠道健康发育的养分需要量可能并不相同[6]。初生动物免疫系统没有完全建立,来源于母体的被动免疫提供幼龄动物的早期保护,而养分的摄入对于免疫系统的建立以及维持免疫调控和免疫反应之间的平衡非常关键[6]。 BALLOU 等研究发现高代乳粉饲喂水平增加了脂多糖(LPS)处理后犊牛抗病能力,表明提高代乳粉饲喂水平可以改善犊牛的免疫功能[7]。而JOHNSTON等报道认为犊牛营养对免疫反应的影响可以忽略不计[8]。鉴于免疫系统的复杂性和众多生理因素的影响,早期营养和饲喂方式对幼龄反刍动物免疫系统发育的影响仍不清楚[8,9,10]。同时肠道屏障是动物免疫防御系统中最为庞大的部分。肠道屏障是指肠道能够防止肠内的有害物质如细菌和毒素穿过肠粘膜进入人体内其他组织、器官和血液循环的结构和功能的总和,包括肠粘膜上皮、肠粘液、肠道菌群、肠道免疫等。肠道屏障功能的建立对幼龄动物非常重要。有研究表明,断奶应激会影响羔羊、犊牛和仔猪的肠道屏障功能,这是断奶导致幼龄动物健康问题的主要原因之一[11,12,13,14]。然而代乳粉饲喂水平影响羔羊免疫功能和肠道屏障功能的研究鲜有报道。【本研究切入点】幼龄动物免疫功能和肠道屏障功能发育非常重要,养分的摄入对于免疫系统的建立以及维持免疫调控和免疫反应之间的平衡非常关键,但最佳生长性能的养分需要量与最佳免疫系统和肠道健康发育的养分需要量可能并不相同。提高代乳粉饲喂水平有可能促进羔羊免疫功能,但肠道健康发育所需的最适养分需要量和最佳代乳粉饲喂水平仍无定论。【拟解决的关键问题】首先通过研究代乳粉饲喂水平对羔羊血液学指标动态变化规律的影响来分析系统免疫发育规律,进而从羔羊肠道组织形态、抗氧化指标、免疫指标和肠道屏障功能相关基因表达量等方面分析代乳粉饲喂水平对羔羊肠道屏障功能的影响。1 材料与方法
1.1 试验设计和试验动物饲养管理
试验动物选自民勤中天羊业有限公司,按照初生重接近原则,选用16只初生重接近的初生湖羊公羔,随机均分为2组,分别为对照组(CON,初生重3.37±0.77kg)和高代乳粉饲喂水平组(H,初生重3.39±0.79kg),CON组代乳粉每日饲喂量(干物质)为羔羊体重的2%,H组每日代乳粉饲喂量(干物质)为羔羊体重的4%。所有羔羊从3日龄开始训练饲喂代乳粉,7日龄完全用代乳粉替代母乳,并开始补饲开食料。代乳粉由北京精准动物营养研究中心生产,含23%蛋白质和12%脂肪。代乳粉溶解于5倍重量的温水,每天用奶瓶分3次人工饲喂(09:00, 15:00 和 21:00)。所有羔羊均单笼饲养,自由采食开食料,自由饮水。开食料参考肉羊饲养标准(NYT816-2004)配制,配方及营养成分见表1。Table 1
表1
表1开食料配方及营养成分(风干基础)
Table 1
| 原料 Ingredients | 配比Proportion (%) | 营养成分Chemical composition | ||
|---|---|---|---|---|
| 苜蓿草粉 Alfalfa meal | 18.50 | 干物质 DM (%) | 90.96 | |
| 玉米 Corn | 21.00 | 消化能 DE (MJ·kg-1) | 13.01 | |
| 膨化玉米 Extruded corn | 22.30 | 粗蛋白质 CP (%) | 19.50 | |
| 麸皮 Bran | 6.00 | 钙 Ca(%) | 0.66 | |
| 豆粕 Soybean meal | 21.50 | 磷 P(%) | 0.31 | |
| 膨化大豆 Extruded-soybean | 4.00 | 中性洗涤纤维 NDF(%) | 18.87 | |
| 玉米蛋白粉 Corn gluten meal | 5.00 | |||
| 石粉 Limestone | 0.30 | |||
| 预混料 Premix | 1.00 | |||
| 食盐 Salt | 0.40 | |||
| 合计 Total | 100.00 | |||
新窗口打开|下载CSV
1.2 样品采集
分别于21、28、35、42和49日龄,在早晨饲喂之前通过颈静脉穿刺采集羔羊血液样品。每次都由同一位经验丰富的操作员抽取血液,收集到5mL K2-乙二胺四乙酸(K2EDTA)抗凝采血管中,用于血常规指标分析。羔羊于49日龄采用颈静脉放血法屠宰。羔羊屠宰后立即采集回肠中段和结肠中段(结肠袢圆心处)组织样品,在液氮中快速冷冻并储存在-80℃下用于抗氧化指标和免疫指标测定,以及肠道组织总RNA提取。同时采集回肠中段和结肠中段样品,固定在4%多聚甲醛中用于组织形态学分析。1.3 测定指标
1.3.1 羔羊血液学指标动态变化规律 使用血液分析仪(PROKAN PE6800,Prokan Electronics Inc,中国深圳)分析采集到5mL K2-乙二胺四乙酸(K2EDTA)抗凝采血管中的血液样品总白细胞数、中性粒细胞数、中间细胞数、淋巴细胞数、红细胞数和血红蛋白的浓度。1.3.2 肠道组织形态将4%多聚甲醛固定的回肠和结肠肠道组织样品包埋在石蜡中切片(5μm),采用H.E(苏木精-伊红)染色。采用光学显微镜观察切片,在每个切片中随机选择12个完整的肠绒毛,使用图像分析系统确定绒毛高度、绒毛宽度、隐窝深度和肌层厚度。1.3.3 肠道组织抗氧化指标和免疫指标分析将采集的回肠和结肠组织样品在液氮中研磨后加入预冷的1×PBS缓冲液,充分匀浆后3 000r/min低温离心10min取上清,制成10%组织提取液。使用总SOD(超氧化物歧化酶)、GSH-Px(谷胱甘肽过氧化氢酶)、MDA(丙二醛)、IgA(免疫球蛋白A)测定试剂盒(中国南京建成生物工程研究所),通过自动酶标仪(Thermo Scientific,Wilmington,USA)测定总SOD、GSH-Px活性和MDA、IgA浓度。1.3.4 肠道组织屏障功能相关基因表达使用TaKaRa MiniBEST Universal RNA Extraction Kit(Takara, Kusatsu, Japan)提取回肠组织和结肠组织总RNA,并使用Transcript First-Strand cDNA Synthesis SuperMix试剂盒(TransGen Biotech,Beijing,China)反转录为cDNA。使用Primer 5.0软件(PREMIER Biosoft International,Palo Alto,CA)设计肠道紧密连接蛋白(Claudin1、Claudin4和Occludin)、Toll样受体-4(TLR4)和肿瘤坏死因子-α(TNF-α)基因引物,并通过将扩增片段连接到T载体克隆后提取质粒梯度稀释的方法验证引物特异性和扩增效率(表2)。通过Roche LightCycler 480 II荧光定量PCR仪(Roche Diagnostics,Mannheim,Germany)分析基因表达水平。PCR程序为:95℃30s;然后进行40个循环:95℃ 5秒,55℃30秒,72℃30秒。采用β-Actin作为内参,采用2-ΔΔCT法进行数据分析[15]。Table 2
表2
表2荧光定量PCR引物序列
Table 2
| 基因 Gene | 检索号 Gene bank number | 引物序列 Primer sequence | 片段长度 Size (bp) | 扩增效率 Amplification efficiency |
|---|---|---|---|---|
| Claudin-1 | NM_001185016.1 | F: 5' AATACATTGAGGTCACCGAGTA 3' | 191 | 98.93% |
| R: 5' GATTAGGCAAGGAAAGGCAC 3' | ||||
| Claudin-4 | NM_001185017.1 | F: 5' GCCTTCATCGGCAGCAACAT 3' | 115 | 92.75% |
| R: 5' CCAGCAGCGAGTCGTACACCTT 3' | ||||
| Occludin | XM_012145891.2 | F: 5' AGTGGTAACTTGGAGACGCTTTC 3' | 107 | 95.17% |
| R: 5' CCTCCCGTCGTGTAGTCTGTT 3' | ||||
| TLR4 | NM_001135930.1 | F: 5' GGTTTCAGGAATGCCACTT 3' | 142 | 98.14% |
| R: 5' CTTTCACCTCTGCCATACTTT 3' | ||||
| TNFα | NM_001114186.1 | F: 5' ACGGCGTGGAGCTGAAA 3' | 132 | 92.18% |
| R: 5' CTGATGGTGTGGGTGAGGAA 3' | ||||
| β-Actin | NM_001009784.2 | F: 5' TCCGTGACATCAAGGAGAAGC 3' | 266 | 91.82% |
| R: 5' CCGTGTTGGCGTAGAGGT 3' |
新窗口打开|下载CSV
1.4 数据统计与分析
试验数据经Excel处理后,用SPSS19.0统计软件一般线性模型对血液学指标进行双因素方差分析,分析代乳粉饲喂水平和日龄及交互作用对各项指标的影响;采用ANOVA过程分析各组不同日龄间血液学指标差异,采用LSD法进行多重比较;采用t检验分析两组间肠道组织形态、抗氧化和免疫指标以及基因表达水平差异显著性。P<0.05为差异显著,P>0.05则差异不显著。2 结果
2.1 代乳粉饲喂水平对羔羊血液学指标动态变化规律的影响
代乳粉饲喂水平以及代乳粉饲喂水平和日龄的交互作用对羔羊21—49 d白细胞数、淋巴细胞数、中性粒细胞数、中性粒细胞/淋巴细胞、红细胞数以及血红蛋白浓度均无显著影响(表3,P>0.05)。日龄对羔羊淋巴细胞数、中性粒细胞/淋巴细胞、红细胞数和血红蛋白浓度有显著影响(P<0.05)。CON组和H组羔羊49d淋巴细胞数均显著高于21和28d(P<0.05);H组49d中性粒细胞/淋巴细胞显著低于21和28d(P<0.05);CON组49d红细胞数和血红蛋白浓度均显著高于28和35d(P<0.05),H组49d红细胞数显著高于其它日龄而血红蛋白浓度显著高于28d(P<0.05)。Table 3
表3
表3代乳粉饲喂水平对羔羊血液学指标动态变化规律的影响
Table 3
| 项目 Items | 处理组 Treatment | 日龄(d) | 标准误 SEM | P值 P value | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 21 | 28 | 35 | 42 | 49 | 饲喂水平 Treatment | 日龄 Age | 饲喂水平×日龄 Treatment × Age | |||
| 白细胞 Leukocyte (×109cells/L) | CON | 8.28 | 8.31 | 9.20 | 8.28 | 9.86 | 0.297 | 0.839 | 0.615 | 0.954 |
| H | 8.33 | 8.26 | 8.34 | 8.91 | 9.48 | |||||
| 淋巴细胞 Lymphocyte (×109cells/L) | CON | 3.52b | 3.32b | 4.01ab | 4.32ab | 5.47a | 0.153 | 0.763 | <0.001 | 0.966 |
| H | 3.57b | 3.57b | 3.86ab | 4.32ab | 5.88a | |||||
| 中性粒细胞 Neutrophil (×109cells/L) | CON | 3.49 | 3.69 | 3.68 | 2.75 | 3.30 | 0.200 | 0.592 | 0.738 | 0.908 |
| H | 3.36 | 3.37 | 3.44 | 3.25 | 2.40 | |||||
| 中性粒细胞/淋巴细胞NLR | CON | 1.02 | 1.12 | 1.03 | 0.66 | 0.61 | 0.062 | 0.813 | 0.034 | 0.972 |
| H | 1.05a | 1.04a | 0.99ab | 0.78ab | 0.44b | |||||
| 红细胞 Red blood cells (×1012cells/L) | CON | 8.47ab | 7.91b | 7.94b | 8.37ab | 9.22a | 0.080 | 0.920 | <0.001 | 0.696 |
| H | 8.11b | 7.80b | 8.22b | 8.45b | 9.40a | |||||
| 血红蛋白浓度Hemoglobin concentration (g·L-1) | CON | 122.64ab | 109.79b | 111.94b | 116.67ab | 127.43a | 1.346 | 0.705 | 0.001 | 0.698 |
| H | 114.72ab | 108.71b | 115.00ab | 116.43ab | 127.92a | |||||
Different lowercase letters in row represent significant differences (P<0.05), same lowercase letters in row represent no significant differences (P>0.05). The same as below
新窗口打开|下载CSV
2.2 代乳粉饲喂水平对羔羊肠道组织形态的影响
代乳粉饲喂水平对49日龄羔羊回肠绒毛高度、隐窝深度以及结肠隐窝深度有显著影响(表4),H组回肠绒毛高度显著高于CON组(P<0.05),回肠和结肠隐窝深度显著低于CON组(P<0.05)。代乳粉饲喂水平对羔羊回肠和结肠绒毛宽度和肌层厚度均无显著影响(P>0.05)。Table 4
表4
表4代乳粉饲喂水平对羔羊肠道组织形态的影响
Table 4
| 项目Item | CON | H | P值 P value | |
|---|---|---|---|---|
| 回肠 Ileum | 肠绒毛高度Villus height (μm) | 349.58±39.01 | 429.77±62.51 | 0.041 |
| 肠绒毛宽度Villus width (μm) | 104.43±23.06 | 130.49±37.13 | 0.219 | |
| 隐窝深度Crypt depth(μm) | 158.63±28.27 | 114.46±15.71 | 0.027 | |
| 肌层厚度Muscle layer thickness (μm) | 173.06±47.28 | 175.40±15.44 | 0.919 | |
| 结肠 Colon | 肠绒毛高度Villus height (μm) | 371.99±44.80 | 350.01±74.85 | 0.544 |
| 肠绒毛宽度Villus width (μm) | 86.79±3.98 | 75.80±23.36 | 0.544 | |
| 隐窝深度Crypt depth (μm) | 190.09±52.96 | 135.58±27.37 | 0.041 | |
| 肌层厚度Muscle layer thickness (μm) | 167.97±39.30 | 164.22±31.93 | 0.859 |
新窗口打开|下载CSV
2.3 代乳粉饲喂水平对羔羊肠道组织抗氧化指标和免疫指标的影响
代乳粉饲喂水平显著影响了回肠和结肠组织MDA含量和IgA含量(表5),H组羔羊回肠和结肠MDA含量和IgA含量均显著低于CON组(P<0.05)。代乳粉饲喂水平对回肠和结肠GSH-Px活性和SOD活性均无显著影响(P>0.05)。Table 5
表5
表5代乳粉饲喂水平对羔羊肠道组织抗氧化指标和免疫指标的影响
Table 5
| 项目Item | CON | H | P值P value | |
|---|---|---|---|---|
| 回肠 Ileum | MDA(nmol·g-1) | 14.02±5.00 | 6.59±3.14 | 0.029 |
| GSH(U·g-1) | 448.72±75.27 | 452.33±77.20 | 0.936 | |
| SOD(U·g-1) | 1236.01±203.75 | 1246.15±117.87 | 0.929 | |
| IgA(mg·g-1) | 0.37±0.06 | 0.15±0.09 | 0.005 | |
| 结肠 Colon | MDA(nmol·g-1) | 61.49±14.56 | 26.03±13.84 | 0.003 |
| GSH(U·g-1) | 405.04±102.68 | 396.40±105.56 | 0.907 | |
| SOD(U·g-1) | 1134.25±218.65 | 932.68±141.25 | 0.111 | |
| IgA(mg·g-1) | 0.90±0.21 | 0.56±0.23 | 0.015 |
新窗口打开|下载CSV
2.4 代乳粉饲喂水平对羔羊肠道屏障功能相关基因表达的影响
代乳粉饲喂水平对羔羊回肠和结肠Claudin1、Occludin和TLR4表达量无显著影响(图1,P>0.05)。H组羔羊结肠Claudin4表达量显著低于CON组(P<0.05),但回肠Claudin4表达量两组间无显著差异(P>0.05)。H组回肠和结肠TNF-α表达量均显著低于CON组(P<0.05)。图1
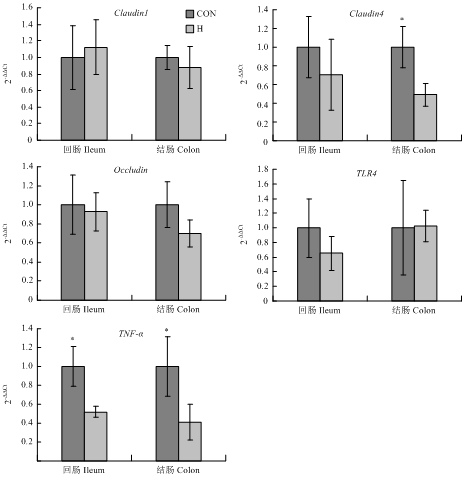 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1代乳粉饲喂水平对羔羊肠道屏障功能相关基因表达的影响
Fig. 1Effect of milk replacer feeding level on the expression of intestinal barrier function-related genes in lambs
3 讨论
产生羔羊免疫功能尤其是适应性免疫功能发育不完善,养分摄入水平对于免疫系统的建立以及维持免疫调控和免疫反应之间的平衡非常关键。由于动物有根据能量需要量调节采食量的调节机制,在自由采食开食料的条件下,本试验高代乳粉饲喂水平组羔羊开食料干物质日均采食量(98.82±38.22 g·d-1)显著低于对照组(168.00±69.33 g·d-1)(P<0.05),但总干物质日均采食量(371.43±50.97 g·d-1)与对照组(304.31±69.33 g·d-1)无显著差异(P>0.05)。在两组羔羊总干物质采食量无显著差异的条件下,本试验从系统免疫功能出发首先研究了代乳粉饲喂水平对羔羊血液学指标动态变化规律的影响,进而针对肠道屏障功能分析了代乳粉饲喂水平对肠道组织形态、抗氧化指标、免疫指标和肠道屏障功能相关基因表达的影响。血液白细胞具有产生抗体的作用、机体损伤的治愈能力、抵御病原体入侵的能力、对疾病的免疫抵抗力等功能。其中特异性炎症反应条件下淋巴细胞数量升高,而非特异性炎症反应会造成外周血细胞水平改变,导致中性粒细胞数量升高、淋巴细胞数量降低以及中性粒细胞淋巴细胞比升高[16]。同时有研究表明应激条件下中性粒细胞数量会显著升高[17]。本试验代乳粉饲喂水平对白细胞数量、淋巴细胞数量和中性粒细胞数量以及中性粒细胞淋巴细胞比均无显著影响。尽管有研究表明,养分的摄入对调控免疫系统功能非常重要,养分缺乏或过量摄入都会对免疫功能和病原易感性产生不利影响[6],但本试验结果表明,体重2%的代乳粉饲喂量已经能够满足羔羊系统免疫发育需要,且4%的代乳粉饲喂量也不会过量并产生不良影响。JOHNSTON的研究也表明断奶犊牛的营养对免疫反应的影响很小[8]。本试验21—49d羔羊淋巴细胞数、红细胞数、血红蛋白浓度随日龄逐渐增加,49日龄时显著较高,而中性粒细胞淋巴细胞比49日龄时显著较低。由于淋巴细胞与适应性免疫功能关系密切,而早期羔羊缺乏发达的适应性免疫系统,本试验结果表明49日龄前羔羊适应性免疫功能仍在不断发育过程中。
白细胞源于中枢免疫器官,分化发育后经过血液进入肠道组织,进而通过淋巴、血液进行再循环,系统免疫功能与肠粘膜免疫功能关系密切。尽管本试验代乳粉饲喂水平对血液中各种白细胞数量均没有产生显著影响,但我们发现代乳粉饲喂水平显著影响了肠道屏障功能。肠道屏障是指肠道能够防止肠内的有害物质如细菌和毒素穿过肠粘膜进入体内其他组织、器官和血液循环的结构和功能的总和,包括肠粘膜上皮、肠粘液、肠道菌群、肠道免疫等。首先,代乳粉饲喂水平影响了羔羊回肠和结肠组织形态,高饲喂水平组回肠绒毛高度显著高于对照组,回肠和结肠隐窝深度显著低于对照组。覆盖于小肠表面上的上皮细胞层构成了肠道的物理屏障。肠上皮细胞快速和持续的更新动力依赖于隐窝处的Lgr5阳性(Lgr5+)特异标记的底部柱状细胞(crypt base columnar cell,CBC细胞),CBC细胞分裂增殖后产生的子代细胞继续分化为“短暂扩增细胞”(transit amplifying cell,TA细胞)并继续向上迁移分化[18]。如果肠上皮细胞的损伤增加,更新不及时,肠绒毛高度就会降低。肠干细胞位于隐窝基底部,不断增殖分化,并离开隐窝,移动至绒毛来替代损伤的肠上皮细胞,隐窝加深则表明肠干细胞在频繁增殖分化,这也是肠上皮细胞受损的标志[19]。有研究表明断奶应激会导致仔猪肠粘膜损伤,其典型特征主要表现为肠绒毛高度降低和隐窝深度增加[12,13]。本试验结果表明高代乳粉饲喂水平条件下,羔羊肠绒毛发育较好,且肠粘膜不易受到损伤。
肠粘膜损伤的机制有可能是氧化损伤或免疫反应增加。有研究表明应激条件下仔猪氧自由基产生增多,抗氧化能力下降,同时也表现出肠道粘膜绒毛高度下降,隐窝加深和消化酶活性下降[13,20]。也有研究通过转录组测序发现断奶影响了RIG样受体和NOD样受体通路,同时断奶主要激活了干扰素和胱门蛋白酶家族基因,从而认为断奶激活了免疫和炎症反应,是导致小肠粘膜损伤的主要原因[21]。本试验进而分析了肠道抗氧化性能和肠道粘膜免疫中的优势性抗体IgA含量。试验结果表明,尽管代乳粉饲喂水平对肠道组织SOD和GSH-Px活力的影响不显著,但高代乳粉饲喂水平显著降低了回肠和结肠组织MDA含量。通常认为,氧化损伤是活性氧自由基的产生与机体清除体内氧自由基的能力失衡所导致的[22,23],脂质过氧化反应形成脂质过氧化产物如MDA,使细胞膜的流动性和通透性发生改变,最终导致细胞结构和功能的改变,会导致不可修复细胞死亡。MDA是脂质过氧化,也是细胞氧化损伤的一个重要检测指标。本试验结果表明,高代乳粉饲喂水平可以显著降低肠道组织氧化损伤。同时本试验高代乳粉饲喂水平组羔羊肠道IgA含量显著较低。肠道粘膜固有层中分布有大量分泌IgA的浆细胞,每日产生的IgA数量达3—4g,远超其他类别的抗体,因此IgA是粘膜免疫系统中的优势抗体。肠道IgA可以抑制微生物粘附,中和微生物产生的毒素或酶,还能对进入上皮细胞间及固有层的细胞LPS(脂多糖)和病毒发挥中和作用。由于相当一部分IgA的产生依赖于微生物成分活化的固有免疫系统,因此高代乳粉饲喂水平组肠道IgA浓度较低的原因可能是由于相对于对照组肠粘膜损伤程度较低,共生微生物与入侵微生物数量较少。
高代乳粉饲喂水平组羔羊肠绒毛发育较好损伤程度较低的原因可能是氧化损伤以及免疫反应较低。笔者进一步分析了与肠粘膜机械屏障有关的紧密连接蛋白基因的表达量,以及主要的细菌模式识别受体TLR4和细胞因子TNF-α的表达量。研究结果表明,代乳粉饲喂水平对Claudin1和Occludin这两种紧密连接蛋白基因表达量以及TLR4表达量没有显著影响,但高代乳粉饲喂水平组Claudin4和TNF-α表达量显著低于对照组。Claudin4是主要的肠道上皮细胞的紧密连接蛋白,是决定肠粘膜通透性和物理屏障功能的关键性因素。一旦其发生变异、减少或缺失可引起肠上皮细胞之间的通透性增加,导致病原侵入,因此紧密连接蛋白基因表达量是衡量肠上皮屏障功能的重要指标[24]。有研究表明,肠绒毛受损时,肠道上皮细胞分化增加以补充受损的细胞,紧密连接蛋白的表达量有可能会相应增加[11],本试验对照组羔羊肠道隐窝深度显著较高,同时Claudin4表达量较高,与上述研究结果相一致,证明了对照组肠粘膜损伤程度较高。细菌入侵后,Toll样受体作为主要的细菌分子模式识别受体可以识别特定微生物分子成分,进而启动信号转导,介导炎症反应,促进细胞因子产生。本试验代乳粉饲喂水平对羔羊肠道TLR4表达量没有显著影响,但高代乳粉饲喂水平组回肠TNF-α表达量显著较低,该结果与肠道IgA浓度相一致,均表明高代乳粉饲喂水平组羔羊肠道免疫反应程度较低。综合血液学指标、肠道组织形态、抗氧化和免疫指标以及肠道屏障功能相关基因表达水平可以看出,低代乳粉饲喂水平条件下肠粘膜损伤的原因可能是氧化损伤导致肠上皮细胞死亡,同时肠上皮细胞分化增加,而肠道紧密连接和物理屏障的损伤增加了病原侵入的风险,进而导致肠道免疫反应增加。本试验结果提示在生产中可以通过提高早期羔羊代乳粉饲喂水平促进羔羊肠道健康发育,但肠道健康发育所需的最适养分需要量和最佳代乳粉饲喂水平仍需进一步研究。
4 结论
代乳粉饲喂水平对羔羊血液学指标无显著影响,但高代乳粉饲喂水平可以促进肠绒毛发育,降低隐窝深度,降低回肠和结肠组织MDA含量,并且减少肠道免疫反应。生产中可以通过提高早期羔羊代乳粉饲喂水平促进羔羊肠道健康发育。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
