 ,, 马青
,, 马青 ,西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100
,西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100Functional Analysis of Gene ShARPC5 Involved in Tomato Resistance to Powdery Mildew
FENG ChanJing, SUN GuangZheng, WANG Yang ,, MA Qing
,, MA Qing ,College of Plant Protection, Northwest A&F University/State Key Laboratory of Crop Stress Biology for Arid Areas, Yangling 712100, Shaanxi
,College of Plant Protection, Northwest A&F University/State Key Laboratory of Crop Stress Biology for Arid Areas, Yangling 712100, Shaanxi通讯作者:
责任编辑: 岳梅
收稿日期:2019-07-10接受日期:2019-08-21网络出版日期:2020-01-01
| 基金资助: |
Received:2019-07-10Accepted:2019-08-21Online:2020-01-01
作者简介 About authors
冯婵婧,E-mail:fcj413@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (1985KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
冯婵婧, 孙广正, 王阳, 马青. 番茄ShARPC5抗白粉病功能分析[J]. 中国农业科学, 2020, 53(1): 65-73 doi:10.3864/j.issn.0578-1752.2020.01.006
FENG ChanJing, SUN GuangZheng, WANG Yang, MA Qing.
0 引言
【研究意义】番茄白粉菌(Oidium neolycopersici)是一种活体营养寄生菌,能在番茄叶表面、背面、叶柄和花萼上产生白粉病斑,但不侵染果实。它通过影响植物的叶片使叶片失去生长活力,能导致产量(果实)损失高达50%[1]。目前,在温室和大田中对番茄白粉病的控制主要依赖于化学农药。然而,化学药剂不仅增加病原菌抗药性,也通过果实中农药的残留对环境和人体造成危害[2]。大多数栽培番茄易受白粉菌侵染,控制番茄白粉病的有效策略是培育抗性品种。【前人研究进展】目前,野生番茄品种中一些抗性基因已经被鉴定并转入栽培番茄,包括5个显性基因(Ol-1、Ol-3、Ol-4、Ol-5、Ol-6)、1个隐性基因(ol-2)和3个多基因抗性数量性状基因座(quantitative trait locus,QTLs)[3]。研究发现抗性基因介导的对番茄白粉病的抗病性与过敏性坏死(hypersensitive response,HR)有关[3]。当细胞产生HR时,未受感染的邻近细胞显示肌动蛋白微丝(actin filaments,AFs)聚集现象[4]。AFs是形成肌动蛋白细胞骨架的主要结构元件,既能将质膜和细胞壁上的物质通过囊泡的靶向输送转运到生长位点,也能特异性的转运防卫相关物质形成抵御病原菌侵入的屏障[5,6]。肌动蛋白组成的关键步骤是肌动蛋白成核,而肌动蛋白成核在很大程度上受ARP2/3(actin-related protein 2 and 3)复合体的活性调节,这能确保AFs正确形成[7]。ARP2/3复合体包含7个亚基,分别为ARP2、ARP3、ARPC1-ARPC5。该复合体是一种高度保守的肌动蛋白调节剂,能核化与质膜区域相关的分支状的肌动蛋白网络,也能促进特定细胞器和细胞骨架的耦合、在核内和细胞质间提供某种形式的物理连续性[8]。ARP2/3复合体不同亚基在发育过程中起着不同的作用。例如,ARP2对膜结合是必不可少的[9];ARP3在体内定位于肌动蛋白成核部位[10];ARPC1或ARPC2的缺失导致酿酒酵母的致死性和生存能力严重下降;拟南芥(Arabidopsis thaliana)ARP3或ARPC5的功能丧失导致根毛短小且弯曲[11,12];ARPC4是控制ARP2/3复合体组装和稳定性的最关键亚基[9];ARPC4和ARPC5在介导与ABA-和H2O2-诱导的保卫细胞肌动蛋白动力学中起关键作用[13]。【本研究切入点】ARP2/3复合体的亚基除了能够参与植物生长发育和结构组成,较少的研究证实其参与植物的抗病性[14]。西北农林科技大学植物保护学院植物病害综合治理团队发现白粉菌(On-Lz)与番茄Moneymaker(MM)(Solanum lycopersicum)形成亲和互作,而与番茄LA1777(S. habrochaites)非亲和互作,在非亲和互作体系中番茄ARPC5受白粉菌诱导显著上调表达,推测其可能参与抗白粉菌侵染的过程。【拟解决的关键问题】通过对ShARPC5进行克隆、生物信息学分析、差异性诱导表达、VIGS分析、烟草瞬时表达、拟南芥过量表达以及酵母突变体异源互补等方面的研究,为进一步揭示其抗病机制打下基础。1 材料与方法
试验于2016—2018年在西北农林科技大学植物保护学院植物病害综合治理实验室完成。1.1 试验材料
番茄白粉菌菌株On-Lz采自甘肃省兰州市,分离保存在栽培番茄(Moneymaker,MM)上,生长温度(20±3)℃,相对湿度(70±5)%,16 h光照/8 h黑暗。番茄MM和On-Lz构成亲和互作体系,LA1777和On-Lz构成非亲和互作体系。番茄种子消毒后,在25℃、95%相对湿度和3 500 lx光照下生长[15]。生态型拟南芥Columbia-0(Col-0)购自拟南芥生物资源中心(Ohio)。按照WU等[16]的方法对拟南芥种子进行消毒和催芽。发芽和生长分别在21℃和19℃生长室,8 h光照/16 h黑暗,相对湿度为70%。
1.2 生物信息学分析
以拟南芥ARPC5(序列号:NP_567216.1)氨基酸序列作为指示查询序列在SGN Tomato Combined数据库(http://solgenomics.net/tools/blast/)TBLASTN程序、GenBank的BLASTN(http://blast.ncbi.nlm.nih. gov/blast.cgi)程序搜索同源序列。利用NCBI(http:// www.ncbi.nlm.nih.gov/gorf/gorf.html)的BLAST程序和基因开放式阅读框(ORF)分析ShARPC5的cDNA序列。使用DNAMAN6.0进行多序列比对。用MEGA 6.0软件的邻近法进行系统发育分析。蛋白质结构域预测使用RCSB PDB蛋白质数据库(https://www.rcsb. org/)。利用ProtComp程序(v.9.0,http://linux1.softberry. com/berry.phtml)预测ShARPC5蛋白亚细胞定位。1.3 烟草瞬时过表达
利用ShARPC5-TF(5′-AGCATCGATTCCCGGGTCGACATGGCTGAGATTGTCGAAGCAGATA-3′,下划线为载体同源臂)和ShARPC5-TR(5′-AACCGT TCATCGGCGGTCGACTCACACAGTATTCACAGTGTCAGCA-3′,下划线为载体同源臂)扩增ShARPC5的ORF,将扩增产物同源重组到PGR106载体的SalI酶切位点,由CaMV35S启动子驱动。参照LU等[17]的方法将重组质粒pGR106:ShARPC5或pGR106:GFP(阴性对照)电转至根癌农杆菌GV3101中,将转化子处理后在黑暗中培养2—3 h,然后注射到烟草叶片,接种后5—7 d对表型进行观察。1.4 病毒诱导基因沉默
利用ShARPC5-VF(5′-AGAAGGCCTCCATGGG GATCCCGAAGGCATAATCACAAGAATCG-3′,下划线为载体同源臂)和ShARPC5-VR(5′-CGTGAGCTC GGTACCGGATCCCAGCAAGACAACGCAGTATGCA-3′,下划线为载体同源臂)扩增ShARPC5基因片段,重组TRV2:ShARPC5质粒。参照LIU等[18]的方法,将TRV1和TRV2:ShARPC5农杆菌混合菌液注射到番茄LA1777植株叶片。TRV2:ShPDS(ShPDS序列登录号:NM 001247166)作为阳性对照。接种病毒30 d,观察沉默ShPDS植株的光漂白症状。在叶片上接种On-Lz 7 dpi(days post inoculation)观察叶片侵染表型。参照SUN等[19]的方法在7—14 dpi统计病害严重度,计算病情指数(DI),病情指数(DI)=[Σ(某一病害严重度的发病植物叶片数×病害严重度)/(调查总植株叶片数×最高病级)]×100。利用THORDAL- CHRISTENSEN等[20]的方法对植物叶片进行3,3-二氨基联苯胺(DAB)和台盼蓝染色,分别于6、18、24、48、72 hpi(hours post inoculation)在分生孢子侵染点处检测植物产生HR和H2O2的形成率,形成率=(HR或H2O2在侵染点处形成个数/总侵染点数)×100%。1.5 拟南芥过量表达
利用ShARPC5-AF(5′-GTCCATGGTACCCGGG GATCCATGGCTGAGATTGTCGAAGCA-3′,下划线为载体同源臂)和ShARPC5-AR(5′-ACGGGGGACT CTAGAGGATCCTCACACAGTATTCACAGTGTCAGCA-3′,下划线为载体同源臂)扩增ShARPC5的ORF区段,重组到双元载体pCAMBIA3301的BamHI限制酶(Promega)位点,由CaMV35S启动子驱动。将pCAMBIA3301-ShARPC5转化到农杆菌GV3101,然后通过浸花法将其导入Col-0野生型拟南芥中[21]。转基因T1代植株用含卡那霉素(25 μg·mL-1)的0.5×MS培养基/1%琼脂进行阳性筛选。催芽2周后,将抗卡那霉素幼苗移栽到土壤中。从自交的T1株系中获得卡那霉素抗性的T2代植株,T2代植株生长90 d(每个处理3—4株),然后测定转基因株系对On-Lz的抗性。同时,上述T2代植株通过使用特异性引物(LP-CGGTT CTCCAAATGAAGACTT,RP-AATTGAGACTTTTC AAAGGTAATA)PCR检测确认为转基因植株。为了量化病原菌生长状况,在7 dpi统计每个病斑的分生孢子数。1.6 实时荧光定量PCR(qRT-PCR)分析
为了评估在番茄MM和LA1777上接种病菌后ARPC5表达量的变化,在0、12、18、24、36、48、72和96 hpi采样,提取RNA,反转为cDNA,然后进行qRT-PCR。VIGS试验中,在0、24、48和72 hpi检测沉默效率以及PR1b1(PR1)和Glucanase A(PR2)、Chitinase 3(PR3)表达量,GAPDH作为内参基因。拟南芥转基因植物在0、24、48、72 hpi取样进行qRT-PCR,以UBQ10为内参基因(表1)。Table 1
表1
表1qRT-PCR反应中的基因及引物
Table 1
| 基因 Gene | 引物序列Primer sequence | |
|---|---|---|
| 正向引物Forward primer sequence (5′-3′) | 反向引物Reverse primer sequence (5′-3′) | |
| ShARPC5/SlARPC5 | CGAAGGCATAATCACAAGA | CAGCAAGACAACGCAGTA |
| PR1b1 | CATCCCGAGCACAAAAC | TGAAGTCACCACCACCCT |
| Glucanase A | CTTTTACTTGTTGGGCTTCT | ACTTCCTTTGAGGGCATT |
| Chitinase 3 | ACGCCATCCCCTAAAGA | TGGACCCATCCCACATT |
| GAPDH (Control) | CTGGTGCTGACTTCGTTGTTG | GCTCTGGCTTGTATTCATTCTCG |
| AtARPC5 | CGGAATGCTCAATGCTCT | CGGTCCCCAGTAGAAAGTC |
| UBQ10 (Control) | AGAAGTTCAATGTTTCGTTTCATGTAA | TTACGAATCCGAGGGAGCCATTG |
新窗口打开|下载CSV
使用Biozol总RNA提取试剂盒提取总RNA,Qubit 2.0 Fluorometer计算RNA浓度。使用单链cDNA合成试剂盒和oligo (dT)18引物将总RNA(1 μg)用于第一链cDNA合成。采用IQTM5 real-time PCR系统进行qRT-PCR扩增。在qRT-PCR反应中,将2 μL总cDNA添加到含有10 μL 2×SYBR混合液的20 μL PCR反应液中,上下游引物各0.4 μL(10 μmol·L-1),dH2O 7.2 μL。qRT-PCR反应条件:在95℃预变性10 min,随后在95℃变性15 s,40个周期,55℃退火30 s,72℃延伸30 s。定量结果通过2-∆∆CT法计算。试验进行3次生物学重复。
1.7 数据分析
采用SPSS 19.0软件对数据进行统计分析,应用Duncan氏新复极差法进行差异显著性检验,P<0.05表示两组处理间差异显著。2 结果
2.1 番茄ARPC5鉴定和序列分析
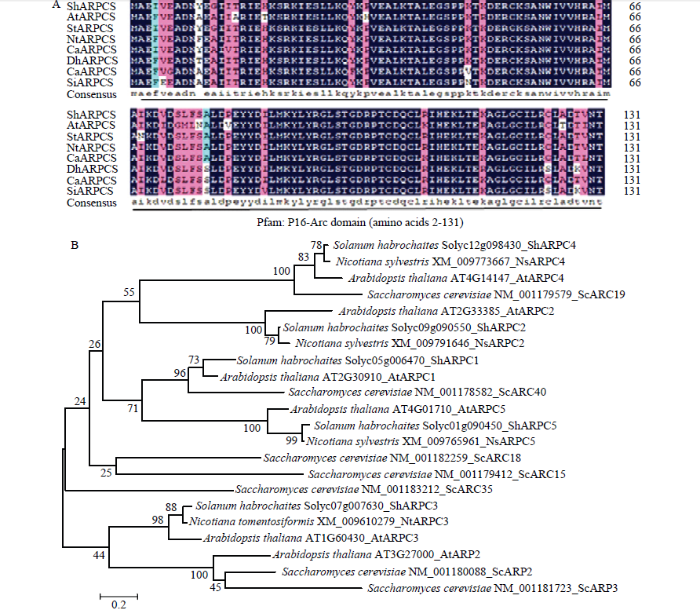
利用拟南芥ARPC5作为探索基因,从番茄LA1777中克隆到767个核苷酸的基因片段。ShARPC5(Solyc01g090450.3)的开放阅读框(399 bp)编码132个氨基酸,分子量约为15 kD。ShARPC5与AtARPC5和NtARPC5具有高度的序列相似性(图1),其同源性分别为86.36%和97.73%。SMART和RCSB PDB程序分析显示,ShARPC5具有保守的Pfam:P16-Arc结构域(氨基酸2—131),其遗传关系与AtARPC5和NtARPC5密切相关。ProtComp 9.0程序预测ShARPC5蛋白具有不同的细胞定位,包括质膜、胞外、细胞质、线粒体、内质网、过氧化物酶体、高尔基体和叶绿体。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1番茄ARP2/3复合体亚基ShARPC5的序列分析
A:ShARPC5的多重氨基酸序列比对以及氨基酸序列的特征。氨基酸序列中黑色部分表示同源性达到100%,粉色表示同源性≥75%,青色表示同源性≥50% Multiple protein sequence alignment of ShARPC5 and characterized members of ARPC5 proteins. Black boxes indicate regions of 100% homology, pink boxes indicate ≥75% homology level, and cyan boxes highlight ≥50% homology level;B:ShARPC5系统进化分析,在不同的基因名称后显示各基因登录号 Evolutionary analysis of ShARPC5. Accession numbers are shown after the gene names
Fig. 1Sequence analysis of tomato actin related protein 2 and 3 (ARP2/3) complex subunit 5 (ShARPC5)
2.2 ARPC5差异性诱导表达
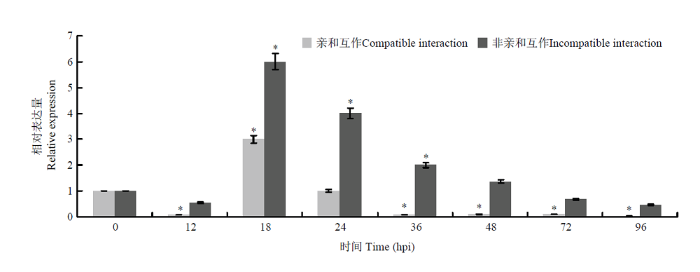
为了确定ARPC5的表达量,用qRT-PCR检测番茄与病原菌互作时ARPC5的mRNA表达量。在非亲和互作中,与0 hpi相比,ARPC5在18—36 hpi显著上调表达(P<0.05),在18 hpi的表达量达到峰值(图2),为对照的6倍。此外,在亲和互作中,ARPC5表达量在18 hpi显著高于对照(0 hpi),12 hpi以及36—96 hpi表达量显著低于对照(P<0.05)。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2qRT-PCR分析番茄叶片ARPC5表达量
Fig. 2ARPC5 expression in tomato leaves analyzed by qRT-PCR
2.3 沉默ShARPC5对番茄抗病性的影响
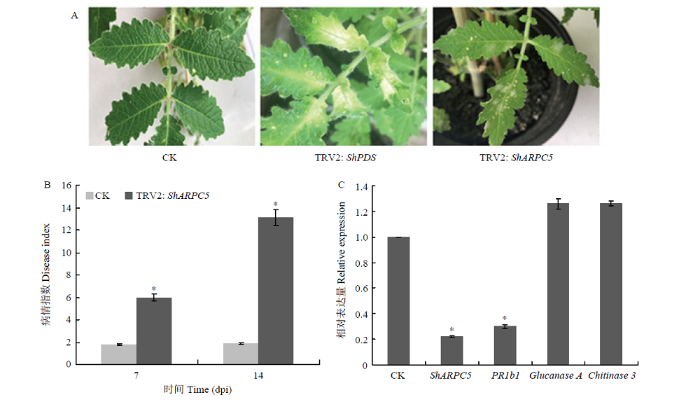
为了确定ShARPC5在病原菌侵染番茄中的作用,利用烟草脆裂病毒(Tobacco rattle virus,TRV)诱导沉默ShARPC5验证基因功能。接种TRV2:ShPDS的叶片在接种后30 d出现光漂白的表型(图3-A),证实TRV-VIGS沉默系统的稳定性。与对照相比,沉默ShARPC5植株显示出明显的白粉病病斑,沉默株的病情指数更高,在7和14 dpi分别达到6.0和13.1(图3-B)。在24 hpi ShARPC5的沉默效率达到78%(图3-C),且沉默株中PR1b1显著下调表达(P<0.05)。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3在番茄上沉默ShARPC5对On-Lz菌株侵染能力的影响
A:不同处理(对照株、沉默ShPDS植株、沉默ShARPC5植株)接种白粉菌7 d后的表型观察Infection phenotypes of CK (TRV2), TRV2:ShPDS, TRV2:ShARPC5 tomato leaves at 7 dpi;B:对照株和沉默ShARPC5植株在接种白粉菌后7和14 d的病情指数Disease indexes of CK and TRV2:ShARPC5 plants at 7 and 14 dpi, respectively;C:对照株和沉默株接种白粉菌后24 h ShARPC5和PRs基因表达量变化Relative mRNA transcript levels of ShARPC5 and PRs at 24 hpi (determined by qRT-PCR)
Fig. 3Effect of silencing of ShARPC5 in tomato LA1777 plants on the infection ability of On-Lz strain
2.4 沉默ShARPC5对番茄防卫反应的影响
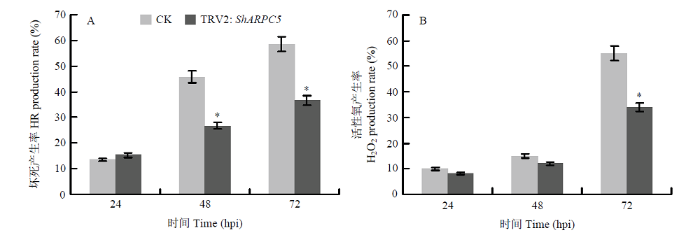
通过显微观察病原菌侵染番茄叶片后植物上产生的HR和H2O2变化进一步研究ShARPC5如何参与番茄抗病性。在48和72 hpi,沉默ShARPC5的植株上HR形成率显著低于对照,分别为26%和36%(图4-A);在72 hpi,沉默株上的H2O2形成率显著低于对照(P<0.05),仅为34%(图4-B)。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4沉默ShARPC5对番茄防卫反应的影响
A:对照植株和沉默植株接种白粉菌后24、48和72 h坏死产生率HR production rate of TRV2 (CK) or TRV2:ShARPC5 tomato leaves at 24, 48, and 72 hpi, respectively;B:对照植株和沉默植株接种白粉菌后24、48和72 h H2O2产生率H2O2 production rate of CK or TRV2:ShARPC5 tomato leaves at 24, 48, and 72 hpi, respectively
Fig. 4Effect of silencing of ShARPC5 on tomato defense responses
2.5 烟草瞬时表达ShARPC5分析
为了进一步检测ShARPC5的功能,基于PVX瞬时植物表达系统,使用本氏烟(Nicotiana benthamiana)评估ShARPC5是否诱导植物细胞坏死。用表达PGR106:GFP的农杆菌侵染烟草叶片不能诱导产生细胞坏死,但是用转PGR106:ShARPC5的农杆菌侵染烟草叶片产生明显的细胞坏死(图5)。同样,用表达PGR106:BAX的农杆菌侵染叶片也能产生坏死。图5
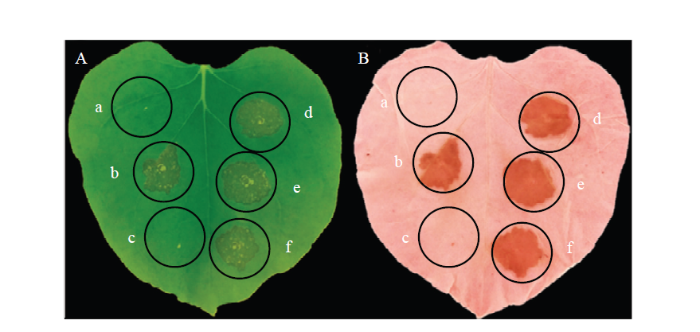 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5 ShARPC5诱导本氏烟产生过敏性坏死
A:农杆菌介导的瞬时表达在接种7 d后叶片的表型Leaf phenotypes at 7 dpi with Agrobacterium tumefaciens-expressing constructs;B:A中的烟草叶片用1﹕1的乙醇和冰醋酸脱色后的表型Leaf inoculation phenotypes after clearing in ethanol/acetic acid (1﹕1, v/v) for 2 days
Fig. 5Hypersensitive necrosis induced by ShARPC5 in N. benthamiana
a: pGR106:GFP (CK); b: pGR106:ShARPC5; c: Buffer; d: pGR106:GFP:BAX; e: pGR106:ShARPC5:BAX; f: Buffer-BAX
2.6 过表达ShARPC5对拟南芥抗病性的影响
为了检测ARPC5在拟南芥上的抗病性,分别在野生型Col-0拟南芥和野生型Col-0转化pCAMBIA3301- ShARPC5植株上接种On-Lz。过表达(over-expression,OE)ShARPC5拟南芥植株抗病性增强,植株叶片上几乎未发现白粉病病斑(图6-A)。显微观察发现,与对照相比,在野生型Col-0转化pCAMBIA3301- ShARPC5植株上单个病斑分生孢子数显著减少(图6-B,P<0.05)。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6过表达ShARPC5拟南芥的抗病性
A:野生型Col-0转化pCAMBIA3301-ShARPC5植株上接种On-Lz 7 d后表型观察Infection phenotypes of WT Col-0 transgenic plants expressing pCAMBIA3301-ShARPC5. Images were taken at 7 dpi;B:野生型Col-0转化pCAMBIA3301-ShARPC5植株上接种On-Lz 7 d后植株上单病斑分生孢子数Quantitative assessment of conidiation on WT Col-0 plants expressing pCAMBIA3301-ShARPC5. Images were taken at 7 dpi
Fig. 6Resistance of over-expression of ShARPC5 in A. thaliana against On-Lz
3 讨论
通过核苷酸和氨基酸序列比对,表明番茄ARPC5与拟南芥和烟草ARPC5具有高度相似性,这些蛋白具有类似的保守的P16-ARC结构域,推测ARPC5在这3个物种上行使相似的功能,包括对生物和非生物胁迫的响应。作为植物的防御信号,本研究结果证明了番茄在遭受白粉菌侵染时ShARPC5所起的作用。为了确定ShARPC5是否参与植物与病原菌的互作过程,本研究检测了番茄被白粉菌侵染后植物中ShARPC5表达量的变化。在病原菌侵染初期,非亲和互作的番茄ShARPC5能快速上调表达,尤其在18 hpi,可能在早期的激活防御信号中,ShARPC5表达量的增加与病原菌初生吸器的大量形成有关。相反,在亲和互作体系中,除了18—24 hpi,其余时间点的表达量较对照均显著下调。因此,ShARPC5可能是番茄抗病的关键调节因子。
VIGS是一种广泛使用的反向遗传学技术,特点是使用简单、快速和稳定[22]。沉默ShARPC5后,沉默效率不能达到100%可能与农杆菌的转化效率、病毒的感染效率、沉默片段的选择以及该基因在植物发育中的多种功能有关[23]。沉默株更加感病说明ShARPC5是ARP2/3复合体介导的番茄抗白粉病的关键亚基。研究表明该抗病性可能与ARP2/3复合体介导的肌动蛋白聚合有关,该复合体也在植物防御信号级联反应中起作用[24,25]。此外,拟南芥异源过表达ShARPC5时,转基因植株比对照Col-0植株的抗病性更强,说明ARPC5蛋白功能具有保守性。并且沉默ShARPC5后,植物的长势并不会受影响,因此该基因可以作为一个抗番茄白粉病育种的优势抗病基因。
植物细胞微丝骨架能在病原菌侵染初期作出快速识别和反应。如TaADF7能介导微丝骨架的动态变化,通过小麦积累ROS和产生HR抗条锈病[26]。本研究发现番茄LA1777植株接种白粉菌后能快速诱导产生HR和H2O2,而沉默株产生HR和H2O2迟缓,抗病能力减弱。事实上,微丝骨架的重排与激活植物防卫信号有关,包括氧迸发和诱导细胞坏死、抗病基因的表达、侵染点处乳突的形成等[27],推测ARP2/3复合体能通过调节HR和H2O2积累量发挥抗病作用。微丝骨架可以调节细胞器的移动[28],而叶绿体、线粒体和过氧化物酶体等细胞器是产生活性氧的主场所[29],因此ShARPC5可能在ETI途径中通过介导细胞器的移动积累活性氧。沉默ShARPC5后,沉默株上的表达量显著下调表达,说明在白粉菌侵染植株的早期,植株能够激活先天免疫反应通过PTI途径阻止病原菌的侵染。本研究阐明了ShARPC5在番茄响应生物胁迫时作出的反应,包括产生ROS和HR,以及诱导病程相关蛋白基因(PR1b1)的表达。结合番茄ShARPC3的功能研究[14],说明ARP2/3复合体在病原菌侵染过程中参与抗病作用。
4 结论
番茄ARPC5包含一个保守的P16-Arc结构域。ARPC5可能通过诱导植物产生过敏性坏死和活性氧以及调节防卫基因的表达参与番茄抗白粉病,是一个潜在重要的抗病基因。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
