 ,1,2, 李刚3, 金刚4, 周瑞阳
,1,2, 李刚3, 金刚4, 周瑞阳 ,1,*, 刘冬梅5, 汤丹峰3, 廖小芳4, 刘一丁1, 赵艳红4, 王颐宁1
,1,*, 刘冬梅5, 汤丹峰3, 廖小芳4, 刘一丁1, 赵艳红4, 王颐宁1Creation of male sterile germplasm using the partial length gene of HcPDIL5-2a in kenaf
ZHOU Bu-Jin ,1,2, LI Gang3, JIN Gang4, ZHOU Rui-Yang
,1,2, LI Gang3, JIN Gang4, ZHOU Rui-Yang ,1,*, LIU Dong-Mei5, TANG Dan-Feng3, LIAO Xiao-Fang4, LIU Yi-Ding1, ZHAO Yan-Hong4, WANG Yi-Ning1
,1,*, LIU Dong-Mei5, TANG Dan-Feng3, LIAO Xiao-Fang4, LIU Yi-Ding1, ZHAO Yan-Hong4, WANG Yi-Ning1通讯作者:
收稿日期:2020-03-17接受日期:2021-01-13网络出版日期:2021-06-12
| 基金资助: |
Received:2020-03-17Accepted:2021-01-13Online:2021-06-12
| Fund supported: |
作者简介 About authors
E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (5223KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
周步进, 李刚, 金刚, 周瑞阳, 刘冬梅, 汤丹峰, 廖小芳, 刘一丁, 赵艳红, 王颐宁. 利用红麻HcPDIL5-2a非全长基因创制雄性不育新种质[J]. 作物学报, 2021, 47(6): 1043-1053. doi:10.3724/SP.J.1006.2021.04069
ZHOU Bu-Jin, LI Gang, JIN Gang, ZHOU Rui-Yang, LIU Dong-Mei, TANG Dan-Feng, LIAO Xiao-Fang, LIU Yi-Ding, ZHAO Yan-Hong, WANG Yi-Ning.
红麻属于锦葵科木槿属一年草本作物, 耐旱、耐渍、耐盐碱, 抗逆性强, 生长速度快, 生物量大; 广泛用于造纸、可降解农膜及纺织麻袋、地毯及其他高档面料等[1,2,3], 被誉为21世纪最具发展潜力的生态环保型作物。
红麻以收获营养体(茎秆或韧皮纤维)为栽培目的, 杂种优势十分显著, 其杂交种比常规品种增产可高达30% [4,5], 但红麻雄性不育系的创制长期以来是红麻育种的难点。早在1976年, 印度的Ugale首先报道了红麻细胞质雄性不育(cytoplasmic male sterile, CMS)现象, 但此后未见进一步报道[6], 也未见红麻杂交种在生产上推广利用。为利用红麻杂种优势, 中国农业科学院麻类研究所发明了红麻化学杀雄杂交制种技术, 但因成本太高只得利用杂种二代[7]。2001年, 周瑞阳在海南陵水冬繁的红麻野生种UGP3 (引自中国农业科学院麻类研究所)中发现了1株雄性不育突变体UG93S, 并于2004年鉴定了红麻CMS系K03A, 2007年又鉴定了P3A、763A、917A、F3A、L23A和722A等6个CMS系, 选育出红麻三系杂交种“红优1号” [8]。此后, 中国农业科学院麻类研究所也报道了红麻细胞质雄性不育突变体的发现[9]。
作物的杂种优势及抗性表现具有明显的细胞质效应, 因此创造多种CMS种质是作物杂种优势利用的重要目标。为此, 本团队在研究UG93S细胞质雄性不育机制的基础上, 开发出不育细胞质的分子标记[10,11], 并对现有种质资源进行筛选发现, 源于非洲的红麻野生种ZB90、KN250和KN142 (引自中国农业科学院麻类研究所)群体中均携带有不育细胞质, 但其表现型为雄性可育, 说明细胞核存在恢复基因阻碍了CMS性状的表达。由于红麻是常异花授粉作物, 所有品种资源在引进前均未进行自交提纯, 遂采用连续自交的方法分离出了新的红麻CMS种质ZB90S、KN142S和KN250S, 并选育出一系列相应细胞质的CMS系[11,12,13,14]。
由于自然存在的CMS种质十分有限, 按照育种家的意志创造CMS种质是作物杂种优势利用研究的热点和难点。前人研究表明, 蛋白质二硫键异构酶(protein disulphide isomerase, PDI)及其类蛋白(protein disulphide isomerase-like, PDIL)属于硫氧还蛋白超家族中的一员[15], 在内质网初生肽链折叠中起着关键作用, 具有氧化、还原和二硫键异构化等功能; 同时作为分子伴侣介导蛋白酶的正确装配[16]。研究表明, PDI及其PDIL参与种子萌发与发育[17]、逆境响应[18]、雄性不育[19,20]等多种生物学过程。在水稻中, 随着温度的升高, PDI家族基因表达量明显上调; 与此同时, 当PDI家族基因表达受到抑制时, 其表现出高温下花粉败育、结实率下降[19]; 在拟南芥tms1-1突变体中, 由于TMS1基因(包含PDI结构域和DNA J结构域)缺失而表现出温敏雄性不育[20]。但在杂交种生产中尚未见到此类雄性不育种质的利用, 也未见到利用该类基因创造CMS种质的报道。
为探索简便高效的作物转基因雄性不育种质创新方法, 本团队进行了长期的探索。李刚[21]利用iTRAQ技术, 对红麻不育系L23A及保持系L23B线粒体蛋白质差异比较分析发现, PDIL蛋白在不育系中显著上调。金刚等[22]利用同源克隆和RACE技术克隆到一个红麻HcPDIL5-2a (Hca.16G0019600), 半定量RT-PCR结果表明, HcPDIL5-2a在不育系花药中的表达量高于保持系, 但在不育系根、花瓣、茎和叶等组织中的表达量低于保持系。表明HcPDIL5-2a在不育系小孢子败育过程中具有重要的功能。其生物信息学分析表明, HcPDIL5-2a包含1个酶活性中心WCGHC结构域a、2个底物结合结构域b和b’、Ca2+结合结构域c。基于生物信息学分析分别构建红麻HcPDIL5-2a基因(简称“H”基因)和HcPDIL5-2a非全长基因(去除酶活性中心WCGHC结构域a, 保留结构域b和b’、结构域c, 简称“PH”基因)超量表达载体并转化水稻发现, H基因超量表达的转基因植株形态正常并且可育, 但PH基因超量表达的转基因植株育性明显较低[22]。为此, 本研究采用花粉管通道法将该PH基因超量表达载体导入红麻保持系722B, 以期创制红麻雄性不育系种质, 并为建立作物转基因雄性不育种质创新与方法体系奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 供试品种为保持系722B (其原始材料722引自中国农业科学院麻类研究所), 完全叶。由于完全叶对裂叶为隐形性状, 以便于鉴别是否有生物学混杂。材料于2010年7月种植于广西大学实验实习农场。1.1.2 载体质粒 红麻HcPDIL5-2a非全长基因(partial length HcPDIL5-2a, 简称“PH”)、质粒载体PBI121-PH-GFP6由本课题组金刚博士构建(图1)[12]。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1PBI121-PH-GFP 质粒载体图谱
Fig. 1Plasmid vector map of PBI121-PH-GFP
1.2 方法
1.2.1 花粉管通道法转化722B 选取生长健壮、无病虫害的红麻植株, 将次日要开放的花蕾, 使用棉线等将花蕾顶部扎紧使其不能正常开放, 以防外来花粉污染; 花开之日早上6:00, 松开棉线, 用卫生纸蘸取花粉涂抹到柱头上完成自交, 然后继续用棉线等捆扎花瓣, 继续防止外来花粉污染; 自花授粉3~5 h后即可形成花粉管通道, 此时即可去掉塑料夹子或棉线等捆扎物, 使花瓣张开, 同时用经过严格消毒处理过的微量进样器吸取PBI121-PH-GFP植物表达载体质粒10 μL, 将针头沿着花粉管插入至子房中, 并将质粒注入子房中即完成超表达载体的微量注射; 待上述注射PBI121-PH-GFP植物表达载体质粒的果实自然成熟后, 单株上的同类种子合并编号, 即获得T0代种子。1.2.2 NPT II PCR检测 根据NPT II序列设计PCR扩增引物, 引物序列: NPTII-F (5°-TGACTGGG CACAACAGACAAT-3°), NPTII-R (5°-CGGCGATAC CGTAAAGCAC-3°)。PCR反应体系包含5 μL 2× Rapid Taq Master Mix (Vazyme, 中国南京)、NPT II-F和NPT II-R各0.3 μL、1 μL基因组DNA (50 ng μL-1), 加入ddH2O至总体积10 μL。PCR反应程序为95℃预变性5 min; 95℃变性30 s, 50.5℃退火30 s, 72℃延伸45 s, 32个循环; 72℃延伸10 min; 4℃保温5 min。
1.2.3 石蜡切片观察 在红麻现蕾期, 按照花蕾直径(bud diameter, BD, mm)大小分为11级, 分别为BD<1.0、1.0≤BD<1.5、1.5≤BD<2.0、2.0≤BD<2.5、2.5≤BD<3.0、3.0≤BD<3.5、3.5≤BD<4.0、4.0≤BD<4.5、4.5≤BD<5.0、5.0≤BD<5.5、BD≥5.5。剥去萼片、花瓣, 在卡诺固定液中4℃固定24 h, 取出花蕾, 70%酒精保存备用。按照石蜡切片程序: 梯度酒精(50%、70%、80%、90%、95%、100%、100%)脱水, 每级梯度15 min; 梯度TO (酒精︰TO = 2︰1、酒精︰TO = 1︰2、TO、TO)透明, 每级梯度5 h; 梯度石蜡(TO︰石蜡 = 2︰1、TO︰石蜡 = 1︰2、石蜡、石蜡)透蜡, 前3级梯度5 h, 第4级梯度15 d; 石蜡包埋并切片, 切片厚度为10 μm; 铁矾-苏木精染色; 最后于莱卡DMI3000B显微镜观察照相。
1.2.4 数据分析 采用SPSS Statistics 21.0软件进行数据统计分析。
2 结果与分析
2.1 红麻转基因细胞核雄性不育(GMS)种质创新
2.1.1 转基因GMS突变体的发现及其形态特征2010年10月在广西大学实验实习农场将质粒载体PBI121-PH-GFP通过花粉管通道法, 转化至红麻保持系722B中, 并收获T0代种子。2011年在海南陵水播种上述T0代种子获得T1代植株, 结果发现了2株雄性不育株, 因其不育性表现低温敏, 遂命名为722THS-1及722THS-2, 突变率为0.36%。
将获得的2个细胞核雄性不育(genetic male sterility, GMS)突变体722THS与野生型722B及其CMS系722A (UG93S细胞质)比较发现, 在株高、株型、叶型叶色等方面, 突变型与野生型722B没有差异; 但是, 突变型的花器官与野生型722B存在明显区别。主要表现为: 722THS花药较饱满, 但不能正常开裂散粉。而CMS系722A花药干瘪无花粉, 野生型722B的花药正常开裂散粉(图2)。说明722THS为一种新的雄性不育种质。为保存该种质, 在南宁和海南播种进行了扦插繁殖。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2红麻雄性不育突变体722THS与野生型722B及其CMS系722A花的形态特征
Fig. 2Morphological characteristics of the flowers from 722THS, 722HB, and 722A in kenaf
2.1.2 转基因GMS小孢子发育过程的比较观察
为鉴定GMS突变型722THS小孢子败育特征, 本研究利用石蜡切片的方法分别观察花粉母细胞时期、四分体时期、单核期及双核期等4个时期花药的结构。花粉母细胞时期: 722THS和722B两者的发育较为相似, 即花粉母细胞位于花粉囊腔的中央体积较大、细胞核明显、细胞质浓厚, 同时由内到外依次被绒毡层细胞、中间层、外皮层和内皮层紧密包裹(图3-A, B)。四分体时期: 722THS和722B小孢子及花药发育基本一致, 即花粉母细胞经过减数分裂形成四分体结构, 并被透明的胼胝质壁所包裹; 中间层细胞逐渐压缩, 绒毡层细胞膨大, 细胞质比较浓厚(图3-C, D)。单核期: 722THS和722B小孢子及花药发育同样无差异, 即花粉囊腔变大, 绒毡层细胞开始降解; 包裹四分体的胼胝质被降解并释放出小孢子; 小孢子近圆形、体积明显增大、外壁增厚表面出现棘突, 同时开始出现中央大液泡, 细胞核逐渐被液泡挤向细胞壁(图3-E, F)。双核期: 722THS和722B小孢子表现出明显的差异(图3-G, H)。两者的花粉囊腔进一步变大, 花药绒毡层基本降解完全, 小孢子都呈现出近圆形壁表面有棘突; 但是, 722THS小孢子细胞质明显比较稀薄(图3-H, 箭头)。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3红麻突变体722THS及野生型722B小孢子发育观察
Fig. 3Microspore development observation of mutant 722THS and wild type 722B in kenaf
2.1.3 转基因GMS遗传特征 为分析红麻722THS突变体的遗传规律, 2011年在海南将722THS与其野生型722B杂交。2011年7月, 在南宁播种1/2种子, 结果发现, 所有杂交F1代均表现正常可育; 2012年1月, 海南陵水播种上年留存的1/2种子, 也表现正常可育; 2012年7月, 在南宁播种F2代, 同样表现正常可育(表1), 未见到不育株分离。是外源基因丢失?还是不育表现为隐形性状, 并表现海南冬繁不育、南宁夏繁可育的低温敏感特征?尚不清楚。
Table 1
表1
表1红麻722THS/722B杂交F1和F2育性统计
Table 1
| 杂交组合 Cross | 可育株数 Number of fertile plants | 不育株数 Number of sterile plants |
|---|---|---|
| 722THS-1/722B | 86 | 0 |
| 722THS-2/722B | 113 | 0 |
| (722THS-1/722B)自交 (722THS-1/722B) selfing | 130 | 0 |
| (722THS-2/722B)自交 (722THS-2/722B) selfing | 95 | 0 |
新窗口打开|下载CSV
为检测外源基因是否丢失, 本研究在海南省陵水县播种2012年南宁722THS自然杂交F1代, 其中4株雄性不育植株, 利用标记基因NPT II引物进行PCR检测发现, 4个不育株均能扩增出目的条带(图4), 表明外源基因没有丢失, 不育与外源基因有关。
图4
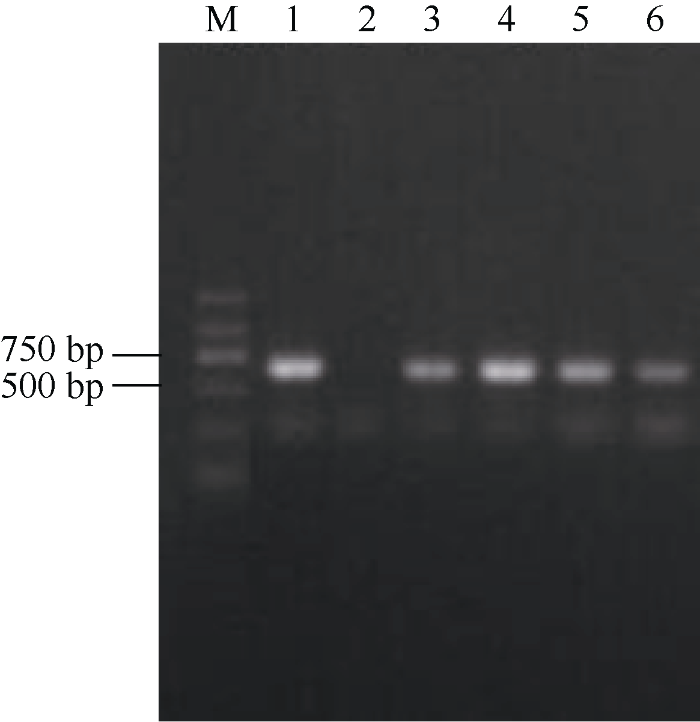 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4722THS自然杂交F1代不育株PCR检测
M: DNA marker; 1: 阳性质粒; 2: 阴性对照; 3~6: 不育株。
Fig. 4PCR detection of 722THS natural hybrid F1 sterile plants
M: DNA marker; 1: positive plasmid; 2: negative control; 3-6: sterile plants.
由于722THS表现为花药不开裂, 不能散粉, 但花药外部形态和大小正常, 四分体大小正常, 圆形, 较为饱满, 但内容物明显不足, 推测722THS的不育性与花粉内淀粉含量不足有关。为证实这一推测, 本研究于2013年3月上旬对4株雄性不育植株进行环割。15 d后发现, 所有环剥株均由不育转变为可育, 且自交结实。为此将其分为2份分别播于南宁和海南陵水, 以检测光温效应。
2013年, 在南宁播种上述环剥可育自交后代发现, 31株中有6株不育和25株可育。NPT II检测表明, 所有不育株均能检测到目的基因; 而18株可育株中, 只有11株能检测到目的条带(图5), 表明, 转基因植株可能为单基因插入并且为隐性性状。2014年, 在海南陵水播种后代发现, 开花初期可育株与不育株的数量明显无规律; 但随着气温升高和日照延长, 部分不育株的育性发生了转变, 统计学分析表明, 可育株与不育株数量比约为3︰1, 符合卡方检验(表2)。由此进一步证实, 雄性不育性为外源基因所致, 低温敏雄性不育性为单基因隐性性状, 且环剥可代替长日高温的效应, 使其恢复育性。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5722THS环割可育自交后代NPT II检测(广西南宁)
M: DNA marker; 1~6为不育株; 7~31为可育株。
Fig. 5NPT II detection of fertile self-progeny after girdling of 722THS in Nanning of Guangxi
M: DNA marker; 1-6: sterile plants; 7-31: fertile plants.
Table 2
表2
表2722THS海南环割可育自交后代育性统计(海南)
Table 2
| 统计时间 Count date | 平均气温 Average temperature (℃) | 杂交组合 Hybrid combination | 可育株数 Number of fertile plants | 不育株数 Number of sterile plants | 期望比例 Expect proportion | χ2 | 显著性测验 Significance test χ2(0.05,1) |
|---|---|---|---|---|---|---|---|
| 开花初期 (3月14-16日) Early flowering (from March 14 to 16) | 23.3 | 722THS-S1环割可育自交 722THS-S1 girdling fertile selfing | 123 | 91 | 3:1 | 35.05 | NS |
| 722THS-S2环割可育自交722THS-S2 girdling fertile selfing | 263 | 193 | 3:1 | 72.99 | NS | ||
| 722THS-S3环割可育自交722THS-S3 girdling fertile selfing | 133 | 101 | 3:1 | 41.17 | NS | ||
| 722THS-S4环割可育自交722THS-S4 girdling fertile selfing | 17 | 44 | 3:1 | 61.55 | NS | ||
| 开花后期 (4月11-13日) Late flowering (from April 11 to 13) | 27.5 | 722THS-S1环割可育自交 722THS-S1 girdling fertile selfing | 158 | 56 | 3:1 | 0.24 | * |
| 722THS-S2环割可育自交722THS-S2 girdling fertile selfing | 324 | 122 | 3:1 | 1.50 | * | ||
| 722THS-S3环割可育自交722THS-S3 girdling fertile selfing | 163 | 71 | 3:1 | 3.56 | * | ||
| 722THS-S4环割可育自交722THS-S4 girdling fertile selfing | 43 | 18 | 3:1 | 0.66 | * |
新窗口打开|下载CSV
为保存THS种质, 利用姊妹交保持, 并采用南宁春播和秋播对育性作进一步鉴定发现, 春播的部分姊妹交后代也表现出育性分离现象, 但根据THS的育性表现特征, 春播红麻因开花时温度较高, 应全部恢复雄性可育, 只有在南宁秋播和海南冬繁条件下才表现雄性不育分离。说明THS的育性表现与其姊妹交父本有关, 受遗传背景的影响, 或者与其他基因发生互作。为此, 本研究选育出南宁秋播和海南冬繁不育的低温敏GMS系722THS, 及南宁春播、秋播和海南冬繁条件下均表现雄性不育的稳定GMS系722HS, 并采用姊妹交保持的方法建立了不育︰可育为1︰1的永久分离系统, 以为进一步的研究
提供材料。观察发现, 722HS与722THS的败育时期和败育特征相同, 但环剥不能诱导722HS恢复育性。
2.2 基于转PH基因GMS种质选育CMS系722HA
2.2.1 质核同源与质核异源CMS系的创制 以上述722HS-S (722HS永久分离系统中的不育)株为母本与系统外的722B不同株系为父本分别进行杂交发现, 部分722B株系的杂交后代表现GMS特征, 而另一部分722B株系的杂交后代全部表现雄性不育, 说明为细胞质遗传。通过饱和回交的方法选育出质核均源于722B的质核同源CMS系722HA。基于这一特性, 又以722HS-S为母本与722B以外的保持系(与转基因供体材料没有亲缘关系的雄性不育保持系)杂交并饱和回交选育出了质核异源CMS系。2.2.2 722HA的花器官形态与败育特征观察 盛花期, 观察722HA及其保持系722HB (与722B为同一材料, 但因此处其所对应的CMS系为722HA, 故如此称之)花的形态特征发现, 722HA的花冠形状、花瓣颜色、雄蕊着生位置、柱头外露程度、花药颜色及花药饱满程度均与722HB相同, 但花药完全不开裂, 没有成熟花粉粒释放出来(图6)。花粉母细胞时期: 722HA和722HB的细胞学特征基本相似, 即初生壁细胞都能够正常分化, 由外至内依次为外皮层、内皮层、中间层和绒毡层; 初生造胞细胞有丝分裂为小孢子母细胞(花粉母细胞), 花粉母细胞位于花粉囊腔中央, 被绒毡层细胞紧密包裹, 其体积较大、细胞核明显、细胞质营养物质丰富(图7-A1, B1)。四分体时期: 722HA和722HB的发育均比较正常, 花粉母细胞经过2次减数分裂形成小孢子四分体, 其周围被透明的胼胝质所包裹; 花粉囊由小孢子四分体、绒毡层、中间层、内皮层及外皮层组成, 绒毡层细胞变大、细胞质丰富, 中间层细胞被压缩(图7-A2, B2)。单核期: 722HA和722HB花药细胞学结构开始出现差异, 两者的花粉囊都逐渐变大; 绒毡层细胞都开始降解, 但722HA的绒毡层细胞降解速度明显比722HB的快; 包裹小孢子四分体的胼胝质被绒毡层细胞降解产生的胼胝质酶所酶解, 并释放出单核小孢子(图7-A3, B3)。双核期: 722HA和722HB花药细胞学结构表现出明显的差异, 722HA和722HB的绒毡层细胞都基本完全降解; 其次, 它们的花粉囊都进一步变大, 722HB花药囊腔壁较薄, 而722HA花药囊腔壁明显较厚; 最后, 722HB的双核期小孢子含有丰富的营养物质, 但722HA的双核期小孢子的营养物质明显较少(图7-A4, B4)。成熟花粉粒时期: 722HA和722HB的花粉粒和花粉囊腔壁同样表现出明显差异, 722HA和722HB的成熟花粉粒大小没有差异, 722HB的成熟花粉粒表面的刺状突起较大, 花粉粒中含有丰富的内容物来为花粉的萌发提供足够的营养物质, 但是722HA的花粉粒表面的刺状突起较小, 花粉粒中出现了质壁分离的现象; 其次, 722HB的花粉囊腔壁较薄, 722HA的花粉囊腔壁明显较厚(图7-A5, B5)。
图6
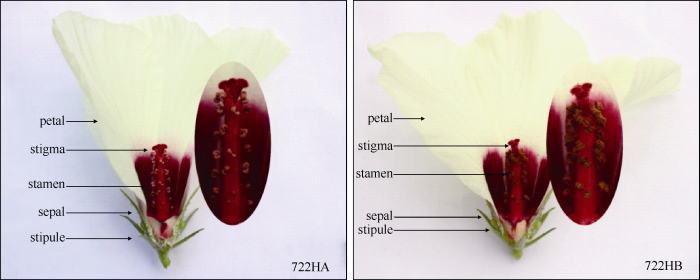 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6红麻722HA、722HB花的形态特征[23]
Fig. 6Morphological characteristics of the flowers from 722HA and 722HB in kenaf [23]
图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7红麻722HA及722HB小孢子发育观察[23]
PMC: 花粉母细胞; Td: 四分体小孢子; Ms: 单核期小孢子; Ds: 双核期小孢子; MP: 成熟花粉粒; Ep: 外皮层; En: 内皮层; ML: 中间层; T: 绒毡层; 比例尺为20 μm。
Fig. 7Microspore development observation of 722HA and 722HB in kenaf [23]
PMC: pollen mother cell; Td: tetrad microspore; Ms: mononuclear microspore; Ds: dinuclear microspore; MP: mature pollen grain; Ep: epidermis; En: endothecium; ML: middle layer; T: tapetum; Bar: 20 μm.
2.2.3 722HA线粒体DNA鉴定 为鉴定722HA的线粒体DNA是否发生重排, 本研究利用本实验室前期开发的2个线粒体基因atp9 (MM556)和atp6 (MM509)的分子标签进行鉴定发现, MM509和MM556的鉴定结果完全一致, 即722B及GMS突变体722THS为可育, 而UG93S细胞质CMS系722A和722THS细胞质CMS系722HA均为不育(图8)。同时对上述条带进行回收测序, 序列比对结果表明722HA与722A序列一致, 722THS与722B序列一致(图9)。由此推测, 722HA与722THS相比发生了线粒体DNA重排。
图8
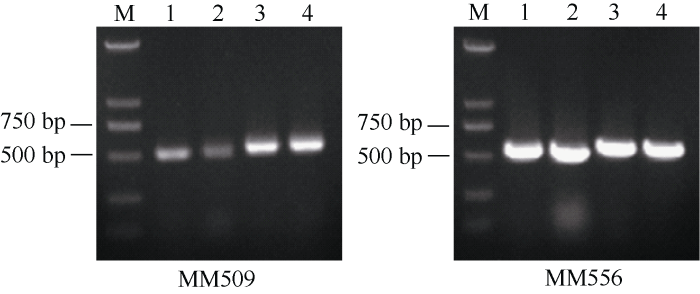 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8分子标签MM509、MM556检测不同材料的胞质类型
M: DNA marker; 1~4分别为722A、722HA、722B和722THS。
Fig. 8Cytoplasmic types detection of different materials using molecular tags MM509 and MM556
M: DNA marker; 1, 2, 3, 4 represent 722A, 722HA, 722B, and 722THS, respectively.
图9
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9分子标签MM509、MM556在不同材料中的序列比对
A: 分子标签MM509序列比对结果; B: 分子标签MM556序列比对结果。
Fig. 9Sequence alignment of molecular tags MM509 and MM556 in different materials
A: sequence alignment with molecular tag MM509; B: sequence alignment with molecular tag MM556.
2.2.4 722HA恢保关系分析 为了解722HA与UG93S细胞质CMS系722A的恢保关系是否一致, 本研究以前期鉴定出的722A恢复系福红992 (引自福建农林大学)和R7 (引自中国农业科学院麻类研究所)为父本分别与722A和722HA杂交发现, 722HA与福红992和R7杂交后代均存在不育株(S)与可育株(F)分离(表3), 说明其不能被722A的恢复系992和R7完全恢复。尽管2个不育胞质分子标签722HA与722A序列一致, 但恢保关系不同, 在一定程度上表明, 二者分属2个不同的CMS系统。
Table 3
表3
表3红麻CMS系722HA、722A与恢复系杂交后代育性统计
Table 3
| 组合 Cross | 可育株数 Number of fertile plants | 不育株数 Number of sterile plants |
|---|---|---|
| 722A/福红992 722A/Fuhong 992 | 56 | 0 |
| 722A/R7 | 91 | 0 |
| 722HA/福红992 722HA/Fuhong 992 | 52 | 14 |
| 722HA/R7 | 44 | 35 |
新窗口打开|下载CSV
3 讨论
3.1 转PH基因创造雄性不育种质的可能机理
由于红麻PH基因缺失酶活性中心, 如将其导入红麻, 必然与内源H基因竞争同一底物。为明确其共同作用底物, 本课题组利用酵母双杂交技术筛选到1个与H和PH基因均发生互作的热激蛋白基因HcHsp40/HcDNA J (结果待发表)。前人研究结果表明, 在真核生物中, Hsp40的DNA J结构域与Hsp70的ATP酶结构域相互作用并激活ATP酶活性[24]。热激蛋白不但可缓解逆境胁迫所致的过量活性氧(reactive oxygen species, ROS)伤害, 而且可保护线粒体DNA (mtDNA)的稳定性[25]。高水平的ROS可导致mtDNA断裂, 破坏其结构和功能[26]; 同时ROS也可以诱发mtDNA的点突变、缺失和插入[27,28], 导致CMS的发生。3.2 转PH基因可创造多种雄性不育种质
基于PH与内源H竞争同一热激蛋白HcHsp40, 故可用PH/H比值对转PH基因创造多种雄性不育种质的多样性作出解释: 由于长期以来对H及其相关蛋白表达量的基因型差异与环境敏感性未作鉴定与选择, 不同品种甚至同一品种不同株系之间必然存在基因型分化。如果PH/H较高且稳定, 有功能HcHsp40较低而直接导致mtDNA重排, 形成CMS; 反之, 如果PH/H较低, 则导入PH无效。对于长日高温敏感材料, 低温下的PH/H不足以导致mtDNA重排而表现GMS, 但长日高温下H上调, 育性恢复, 形成低温敏GMS; 反之, 如果表现钝感, 则稳定表现GMS。如果GMS与低H株系杂交并回交, 将导致PH/H大幅提高而转变为CMS。转PH-GMS与同源细胞核供体杂交既可表现GMS, 也可表现CMS, 与内源H表达有关; 而与异源细胞核供体杂交后代均表现为CMS。为发现进一步的证据, 用花粉管通道法将红麻PH基因导入水稻和棉花均直接创造出了CMS种质[29,30]。说明利用PH基因创造雄性不育种质具有可靠性和广谱性的特点。但其机制仍需进一步研究。3.3 转基因CMS种质创新的育种利用价值
关于GMS转换为CMS的现象, 国内外只查到2篇文献报道。范树国等[31]利用组织培养方法, 获得无花粉型南广占GMS水稻单株, 并与保持系多代回交使其转变为CMS。牛景等[32]在组培过程中利用诱变, 将光敏核不育水稻杂种诱变为CMS种质[32]。但其并非转基因创造, 更未见到相关基础研究的报道。目前, 在生产上利用的CMS种质资源主要是从自然界发现的突变体或远缘杂交后代产生。而自然发生的CMS种质有限, 远缘杂交又难以成功和细胞质的母性遗传特征又限制了杂交种产量的持续提高。由于转基因不受物种限制, 通过转基因方法创造CMS种质是作物杂种优势利用发展到高级阶段的必然选择。但前人通过转基因方法创制的一般是细胞核雄性不育种质, 且创制和利用程序复杂, 技术要求高。因转基因CMS的同源保持系是其非转基因野生型, 由此可选育出质核同源(质核源于同一品种) CMS系, 也可与其他保持系饱和回交选育出质核源于不同品种的质核异源CMS系。因质核同源CMS系与其同源保持系仅存在细胞质不育基因或少数相关基因差异, 因而有利于排除线粒体基因背景的干扰而发掘出雄性不育关键基因; 同时, 因保持系与恢复系杂交组合的优势表现普遍优于CMS系与恢复系杂交组合, 说明同一品种的质核互作是植物长期进化过程中形成的优化质核互作配置, 因此, 利用质核同源CMS系有利于组配出强优势组合; 且因转基因CMS的保持系为非转基因品种/系, 在其高回交世代已不存在外源基因和质粒, 因而不存在转基因作物的生态风险和管理限制, 是雄性不育种质创新方法的重大突破, 具有十分广阔的应用前景。
4 结论
首次采用花粉管通道法将缺失酶活性中心序列的红麻HcPDIL5-2a非全长基因转化红麻保持系722B, 创造出了低温敏雄性不育种质722THS, 通过姊妹交选育出了稳定型核不育系722HS, 与非转基因野生型连续回交, 选育出了细胞质雄性不育系722HA, 为转基因创造作物雄性不育种质找到了一条新途径, 具有重要的科学意义和广阔的应用前景。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLPMID:7940678 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
