 ,1,3,**, 端群
,1,3,**, 端群 ,1,3,**, 史明涛
,1,3,**, 史明涛 ,1,3,**, 吴潞梅1,3, 柳寒2, 林拥军1, 吴高兵3, 范楚川
,1,3,**, 吴潞梅1,3, 柳寒2, 林拥军1, 吴高兵3, 范楚川 ,1,3,*, 周永明
,1,3,*, 周永明 ,1,3,*
,1,3,*Development and identification of transgenic rapeseed with a novel gene for glyphosate resistance
LI Jie-Hua ,1,3,**, DUAN Qun
,1,3,**, DUAN Qun ,1,3,**, SHI Ming-Tao
,1,3,**, SHI Ming-Tao ,1,3,**, WU Lu-Mei1,3, LIU Han2, LIN Yong-Jun1, WU Gao-Bing3, FAN Chu-Chuan
,1,3,**, WU Lu-Mei1,3, LIU Han2, LIN Yong-Jun1, WU Gao-Bing3, FAN Chu-Chuan ,1,3,*, ZHOU Yong-Ming
,1,3,*, ZHOU Yong-Ming ,1,3,*
,1,3,*通讯作者:
收稿日期:2020-07-25接受日期:2020-11-1网络出版日期:2021-05-12
| 基金资助: |
Received:2020-07-25Accepted:2020-11-1Online:2021-05-12
| Fund supported: |
作者简介 About authors
李杰华, E-mail:
端群, E-mail:
史明涛, E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (11274KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李杰华, 端群, 史明涛, 吴潞梅, 柳寒, 林拥军, 吴高兵, 范楚川, 周永明. 新型抗广谱性除草剂草甘膦转基因油菜的创制及其鉴定[J]. 作物学报, 2021, 47(5): 789-798. doi:10.3724/SP.J.1006.2021.04169
LI Jie-Hua, DUAN Qun, SHI Ming-Tao, WU Lu-Mei, LIU Han, LIN Yong-Jun, WU Gao-Bing, FAN Chu-Chuan, ZHOU Yong-Ming.
油菜是我国重要的油料作物, 常年种植面积约700多万公顷, 菜籽油占国产油料作物产油量的55%以上, 是国产食用植物油的第一大来源, 在维护国家食用油供给安全战略中居于核心地位[1]。杂草危害是造成油菜减产的主要因素。杂草与油菜竞争水、肥等生存资源, 影响油菜正常生长发育, 可导致产量平均下降15.8%, 严重时可达50%以上[2]。油菜田间杂草可通过人工除草和施用化学除草剂防治。人工除草耗工耗力, 大幅增加了田间用工成本、制约了油菜的机械化规模化种植, 导致生产效率和农民收益降低; 培育抗除草剂油菜新品种是油菜机械化、规模化种植的必要配套措施, 可解决大田除草的问题, 有效降低生产成本。
草甘膦是一种非选择性除草剂, 其作用靶标为莽草酸路径中的关键酶5-烯醇式丙酮酰莽草酸-3-磷酸合成酶(5-enolpyruvyl-shikimate-3-phosphate synthase, EPSPS); 通过抑制EPSPS的活性, 阻断莽草酸途径, 导致植物芳香族氨基酸(色氨酸、酪氨酸、苯丙氨酸)的生物合成受到抑制和莽草酸在植物体内过量积累, 最终引起植物体内代谢混乱和植物死亡[3]。作为应用最为广泛的广谱性除草剂之一, 草甘膦具有除草效率高、成本低、生态风险小等优势。在2015年全球农药市场调查中, 草甘膦以49.65亿美元的销售额位居除草剂销售额榜首[4]。
目前抗草甘膦作物的培育主要通过常规的诱变育种和转基因育种来实现。诱变育种是在细胞或组织培养基中添加除草剂进行筛选, 以及通过对花粉、小孢子、种子等诱变处理后进行筛选, 获得抗性材料; 利用该方法已在油菜、水稻和大豆等多种作物中获得了具有草甘膦抗性的突变体[5,6,7]。而转基因育种是利用从从微生物或植物体中分离出抗性基因, 通过遗传转化载体导入作物基因组中来实现; 利用该方法已成功培育了大豆、油菜、棉花、玉米等多种抗草甘膦作物[8,9,10,11], 是目前发展迅速、应用最为广泛和有效的抗草甘膦育种方法。在转基因育种中, 利用的抗草甘膦基因主要有3种: (1)突变后的I型EPSPS基因。例如, Comai等[12]从鼠伤寒沙门氏菌中分离得到具有草甘膦抗性的aroA基因, 并将其转入烟草获得了抗草甘膦转基因烟草; (2)天然的抗草甘膦II型EPSPS基因。例如, 孟山都公司从根癌农杆菌CP4菌株中获得的抗草甘膦cp4-epsps基因[13]; (3)草甘膦降解基因。例如, 来源于苍白杆菌的gox基因[14]。目前商业化应用的草甘膦抗性基因主要包含CP4-epsps、mepsps、2mepsps、epsps(Ag)、grg、gat4601、gat4621等, 其中应用最为广泛的是CP4-epsps基因[8,15]。利用这些基因培育的抗草甘膦油菜已在美国、加拿大、澳大利亚等国家实现了广泛的商业化应用。但是这些基因资源的知识产权绝大部分被国外生物技术公司所垄断, 极大限制了我国油菜抗除草剂品种的培育及其产业化的发展。近年来, 随着基因编辑技术的快速发展, 对植物体内EPSPS基因的保守氨基酸进行精准的碱基替换, 也成功获得了抗草甘膦的水稻和木薯[16,17], 为除草剂作物的培育提供了新方法。但是, 该方法在不同作物中的应用还有赖于单碱基编辑技术的建立。
非敏感EPSPS合酶基因I. variabilis EPSPS是华中农业大学从放线菌属变异白蚁菌(Isoptericola variabilis)中克隆到的草甘膦抗性基因[18]。该基因编码的蛋白不具有CP4-EPSPS专利保护的4条保守序列, 但保留了对草甘膦较高的耐受性, 是具有完全自主知识产权的抗除草剂基因资源[19]。利用该基因创制的水稻转化体可以耐受8400 g hm-2高剂量的草甘膦, 显示出良好的应用前景[18]。本研究旨在利用该基因创制新型的抗草甘膦油菜种质资源, 为培育抗除草剂转基因新品种奠定基础, 从而为我国油菜大田生产的杂草治理提供新的解决方案。
1 材料与方法
1.1 试验材料及其种植
用于遗传转化的甘蓝型油菜受体品系为J9707, 是本实验室筛选获得的具有高遗传转化效率的半冬性低芥酸品系。常规品种中双11号由华中农业大学国家油菜工程技术中心提供。转基因T0代材料在昼/夜16 h /8 h、22℃/18℃、光照强度115~144 μmol m-2 s-1的培养室内种植。其后代材料种植于华中农业大学校内油菜转基因试验基地。1.2 植物载体及其遗传转化
本研究所用的草甘膦抗性基因EPSPS是从放线菌属变异白蚁菌中克隆得到, 命名为I. variabilis EPSPS[20]。在该基因的5°端连入来源于拟南芥EPSPS蛋白的叶绿体信号肽序列(chloroplast transit peptide, CTP; GenBank: CAA29828.1), 具有将表达出的EPSPS蛋白运送到芳香族氨基酸的合成场所叶绿体中的功能。然后, 将其替换pCAMBIA1300质粒中的潮霉素基因, 获得具有CaMV 35S启动子和CaMV poly(A)终止子的I. variabilis EPSPS超量表达载体pTGH-1 (图1)。图1
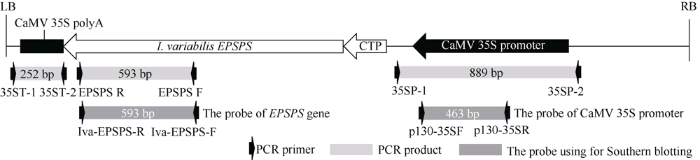 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1pTGH-1质粒的T-DNA示意图
Fig. 1T-DNA region of the binary construct pTGH-1
遗传转化采用农杆菌介导的油菜下胚轴遗传转化法[21]。
1.3 转基因植株的阳性和转化体特异性的PCR检测
设计3对特异性引物EPSPS-F/EPSPS-R、35SP-1/35SP-2和35ST-1/35ST-2分别用于检测pTGH-1载体T-DNA区的目的基因I. variabilis EPSPS、CaMV 35S启动子元件和CaMV 35S终止子元件(图1)。利用分离的T-DNA插入位点侧翼序列信息, 设计油菜转化体的特异性上游引物, 分别与位于T-DNA的LB端的共同下游引物(P5)进行组合, 用于转化体特异性PCR检测。PCR扩增体系含50 ng µL-1的模板DNA 2.0 µL、10×PCR buffer 1.0 µL、2 mmol L-1 dNTPs 0.8 µL、10 µmol L-1引物各0.4 µL、2 U µL-1Taq DNA聚合酶 0.15 µL, 添加ddH2O至10 μL。PCR扩增程序为94℃预变性4 min; 94℃变性30 s, 56℃退火30 s, 72℃延伸30 s, 扩增32个循环; 最后72℃延伸10 min。PCR产物在1.0%琼脂糖凝胶上进行电泳和照相观察。所有引物序列见表1。
Table 1
表1
表1本研究所用引物序列
Table 1
| 引物名称 Primer name | 引物序列 Primer sequence (5°-3°) | 引物名称 Primer name | 引物序列 Primer sequence (5°-3°) |
|---|---|---|---|
| EPSPS-F | ATTAGCGCTAGGGACGTGAG | P1 | CTCTAGCCAATACGCAAACCGCC |
| EPSPS-R | ATACGCTCCCACATCCTGTC | P3 | TGTTGTGTGGAATTGTGAGCGGA |
| 35SP-1 | GAAACCGGTTACAGGCAAATG | SP2 | CAGGTGGAGAACGTCGGTACGACT |
| 35SP-2 | AGAGGCGGTTTGCGTATT | SP3 | GGGTTTCGCTCATGTGTTGAGCA |
| 35ST-1 | ATAACACATTGCGGACGTTT | BnACT-qRTF | CTGGAATTGCTGACCGTATGAG |
| 35ST-2 | AGCCGGTGCTTGATAACT | BnACT-qRTR | ATCTGTTGGAAAGTGCTGAGGG |
| 35SP-2 | AGAGGCGGTTTGCGTATT | EPs-qRTF | CAGGGATGGACTCGTTATCAC |
| p130-35sF | CAAGTGGATTGATGTGATAACATG | EPs-qRTR | GAGGGTCTTCGCAGTCGT |
| p130-35sR | GTAGAGAGAGACTGGTGATTTCAGC | EPSPS6 F | GGCTTCTTAGTGGGCCTTTC |
| Iva-EPSPS-F | ATTAGCGCTAGGGACGTGAG | EPSPS7 F | CATCCGCTTTACGACGAAACT |
| Iva-EPSPS-R | ATACGCTCCCACATCCTGTC | EPSPS2 F | GAACTGAGCATGAATGGCATAAA |
| P5 | ATGTGTGAGTAGTTCCCAGATAAGG |
新窗口打开|下载CSV
1.4 Southern blot检测转基因拷贝数
在目的基因I. variabilis EPSPS和CaMV 35S启动子上分别设计特异性引物对Iva-EPSPS-F/ Iva-EPSPS-R和p130-35sF/p130-35sR, 并对pTGH-1质粒进行扩增, 用于制备EPSPS探针和CaMV 35S promoter探针(图1)。油菜基因组DNA的提取、酶切、电泳和转膜、DNA探针的制备、杂交和检测等具体程序见李杰华[22]的方法。引物序列见表1。1.5 转化单株中的T-DNA插入位点鉴定
利用反向PCR的方法分离转基因的T-DNA插入位点。具体程序见李杰华[22]的方法。第1轮PCR引物为P1/SP2, 第2轮PCR引物为P3/SP3, 引物序列见表1所示。以SP3引物进行PCR产物测序。将克隆得到的序列与甘蓝型油菜参考基因组序列(1.6 基因表达量检测
抽提油菜不同组织的RNA进行RT-PCR (reversed transcript polymerase chain reaction)和qRT- PCR (quantitative real-time PCR)的基因表达量检测。RNA抽提、反转录和RT-PCR等程序详见Fan等[23]的方法。I. variabilis EPSPS和内参基因ACTIN2的表达检测引物对分别为EPs-qRTF/EPs-qRTR和BnACT-qRTF/ BnACT-qRTR, 序列详见表1。qRT-PCR反应体系包含cDNA模板4 μL、2 × SYBR Green Mix 10 μL、2.5 µmol L-1的引物各2 μL, 加ddH2O至总体积20 μL。PCR反应程序为95℃变性3 min; 95℃变性12 s, 60℃退火30 s, 72℃延伸30 s, 45个循环。以ACTIN2作为对照, 目的基因的Ct值减去ACTIN的Ct值得到ΔCt, 计算2(ΔCt)即为相对表达量的值。用Western blot方法对转化体叶片中的I. variabilis EPSPS蛋白表达量进行检测, 以油菜ACTIN2为内参基因, 以转化受体J9707为阴性对照。油菜叶片的蛋白提取、蛋白浓度测定和Western blot检测等具体程序见李杰华[22]的方法。
1.7 除草剂抗性检测
待油菜长出5~6片真叶时, 对各材料进行除草剂草甘膦的喷施处理, 以J9707为阴性对照。除草剂施用剂量设置0倍(喷施等量清水)、生产上推荐剂量的1倍(450 g hm-2农达异丙胺盐制剂)、2倍(900 g hm-2 41%农达异丙胺盐制剂)和4倍(1800 g hm-2农达异丙胺盐制剂)。在喷施处理前、喷施处理后1~4周内观察和调查抗性表现。2 结果与分析
2.1 甘蓝型油菜I. variabilis EPSPS转基因材料创建及其阳性鉴定
将转化载体pTGH-1通过电击法转入农杆菌GV3101中, 然后通过农杆菌介导的油菜下胚轴遗传转化法导入到J9707中。由于pTGH-1中不含筛选标记基因, 因此在油菜转化过程中利用目的基因I. variabilis EPSPS进行筛选, 分别在愈伤诱导和分化阶段添加30 mg L-1的草甘膦, 而在其他阶段中没有施加选择压。最终, 经过侵染、共培养、愈伤诱导、分化、生根和移苗等转化过程, 共获得130个抗性植株。为了确定这些抗性植株的基因组中转化载体的功能元件整合情况, 利用3对特异性引物EPSPS-F/ EPSPS-R、35SP-1/35SP-2和35ST-1/35ST-2分别检测pTGH-1载体T-DNA区的目的基因I. variabilis EPSPS、CaMV 35S启动子元件和CaMV 35S终止子元件(图1)发现, 126株含有完整外源插入序列的目的功能片段, 转基因阳性率为97% (图2)。
图2
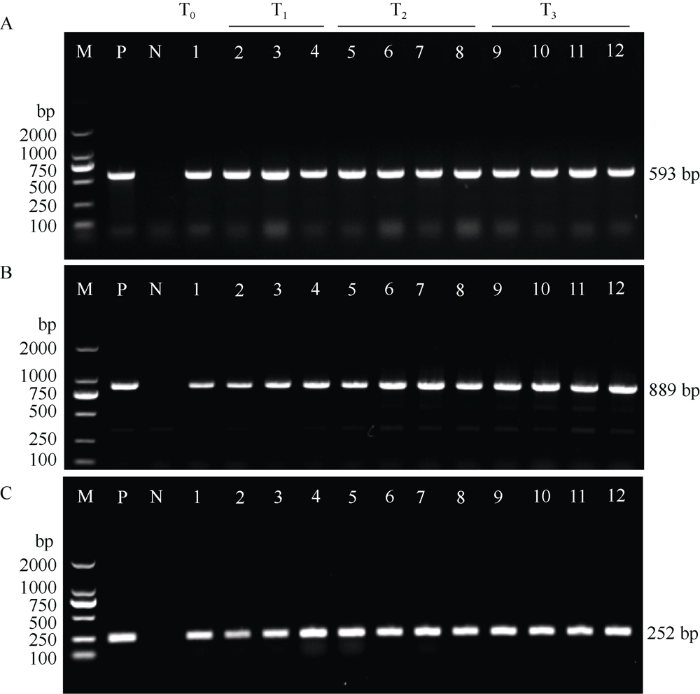 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2转I. variabilis EPSPS基因植株的PCR阳性检测结果
A: 利用引物对EPSPS-F/EPSPS-R检测目的基因I. variabilis EPSPS的PCR结果; B: 利用引物对35SP-1/35SP-2检测CaMV 35S启动子元件的PCR结果; C: 利用引物对35ST-1/35ST-2检测CaMV 35S终止子元件的PCR结果。M为2 kb DNA marker; P为pTGH质粒(阳性对照); N为转化受体J9707 (阴性对照); 1~12为T0代部分转化植株, 编号分别为EPS-1~EPS-12。
Fig. 2PCR identification of positive transgenic plants of the I. variabilis EPSPS gene
A: PCR identification of the target gene I. variabilis EPSPS by primer pair EPSPS-F/EPSPS-R; B: PCR identification of the CaMV 35S promoter by primer pair 35SP-1/35SP-2; C: PCR identification of the CaMV 35S terminator by primer pair 35ST-1/35ST-2. M: 2 kb DNA marker; P: the positive control of pTGH-1plasmid; N: the negative control of J9707; 1-12: the T0 transgenic plants from EPS-1 to EPS-12.
2.2 阳性转化单株的拷贝数检测
针对I. variabilis EPSPS基因设计探针(图1), 采用Southern blot技术对96份T0代阳性转化单株进行了转基因拷贝数检测。如图3所示, 转基因单株中的T-DNA插入存在1~12个拷贝的变异, 其中单拷贝个体占44.8%, 两拷贝和三拷贝个体分别占15.6%和11.5%。表明本研究所采用的农杆菌介导的油菜下胚轴遗传转化法以及采用的草甘膦选择压有利于单拷贝和低拷贝转基因株系的产生。图3
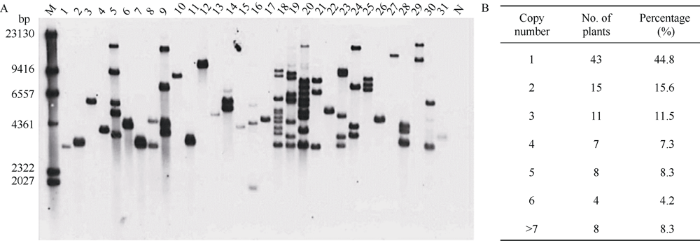 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3转I. variabilis EPSPS基因T0代阳性植株的Southern blot拷贝数检测结果
A: Southern blot检测结果。杂交探针为位于目的基因上的EPSPS探针, 基因组DNA采用Hind III酶切。M: DNA marker; 1~31: 转基因阳性植株; 1: EPS-1; 3: EPS-2; 12: EPS-7; 29: EPS-3; 31: EPS-6; N: J9707 (阴性对照)。B: 不同拷贝数的单株统计。
Fig. 3Determination of the I. variabilis EPSPS transgenic copy number by Southern blotting analysis in the T0-positive transgenic plants
A: detection of Southern blot analysis. The hybrid probe is on the I. variabilis EPSPS gene; the genomic DNA was digested with Hind Ш before electrophoresis. M: DNA marker; 1-31: the positive transgenic plants; 1: EPS-1; 3: EPS-2; 12: EPS-7; 29: EPS-3; 31: EPS-6; N: J9707 (negative control). B: summary of the copy number of transgenic plants.
根据T0代拷贝数检测结果, 同时结合它们后代株系的田间表现, 选择具有1~2个拷贝的优良株系的后代进行了拷贝数验证。分别采用Hind III和EcoR I 2种酶切、EPSPS基因和CaMV 35S启动子2种探针(探针位置见图1所示)对它们的T2和T3代阳性株系进行Southern blot检测, 证实这些家系的拷贝数与T0代检测结果一致(图4)。进一步选择4个具有单拷贝插入的株系进行了T1代除草剂抗性分离的检测, 即苗期使用田间推荐浓度的2倍草甘膦进行处理, 结果可以看出这些家系的存活单株与死亡单株符合3:1的分离比(表2), 从而进一步证实了转基因拷贝数检测结果的准确性。基于上述结果, 从中挑选出3个单拷贝插入株系(EPS-2、EPS-6和EPS-7)和2个双拷贝插入株系(EPS-1和EPS-5)用于后续的试验研究。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4T2和T3代转I. variabilis EPSPS基因植株的Southern blot杂交拷贝数检测
A: EcoR I酶切、CaMV35S promoter探针; B: Hind III酶切、CaMV35S promoter探针; C: EcoR I酶切、EPSPS探针; D: Hind III酶切、EPSPS探针。M: DNA marker; P: pTGH-1质粒(阳性对照); N: J9707 (阴性对照); 1~9: 转基因阳性植株, 依次为EPS-1的T2代植株、EPS-2的T2代植株、EPS-3的T2代植株、EPS-4的T2代植株、EPS-5的T2代植株、EPS-6的T2代植株、EPS-6的T3代植株、EPS-7的T2代植株、EPS-7的T3代植株。
Fig. 4Determination of the I. variabilis EPSPS transgenic copy number by Southern blotting analysis in the T2 and T3 positive transgenic plants
A: detection of Southern blot with the hybrid probe of CaMV35S promoter and EcoR I restriction enzyme; B: detection of Southern blot with the hybrid probe of CaMV35S promoter and Hind Ш restriction enzyme; C: detection of Southern blot with the hybrid probe of EPSPS gene and EcoR I restriction enzyme; D: detection of Southern blot with the hybrid probe of EPSPS gene and Hind Ш restriction enzyme. M: DNA marker; P: pTGH-1 plasmid (positive control); N: J9707 (negative control); 1-9: the positive transgenic plants, which are a T2 plant of EPS-1, a T2 plant of EPS-2, a T2 plant of EPS-3, a T2 plant of EPS-4, a T2 plant of EPS-5, a T2 plant of EPS-6, a T3 plant of EPS-6, a T2 plant of EPS-7, and a T3 plant of EPS-7, respectively.
Table 2
表2
表2单拷贝转基因家系草甘膦抗性分离鉴定
Table 2
| 株系编号 Line ID | 总株数 Total plant number | 存活株数 Number of survived plants | 死亡株数 Number of dead plants | 期望分离比 Expected segregated ratio | χ20.05, 1 |
|---|---|---|---|---|---|
| EPS-1 | 50 | 33 | 17 | 3:1 | 1.71 |
| EPS-2 | 50 | 31 | 19 | 3:1 | 3.84 |
| EPS-4 | 56 | 39 | 17 | 3:1 | 0.59 |
| EPS-5 | 49 | 34 | 15 | 3:1 | 0.55 |
新窗口打开|下载CSV
2.3 单拷贝转化株系中T-DNA插入位点鉴定
利用反向PCR技术分离T-DNA插入位点侧翼序列, 并将分离的序列与甘蓝型油菜参考基因组序列进行比对, 确定了这些转化体中T-DNA整合到染色体中的具体位置(图5)。在EPS-2转基因系分离得到1617 bp的侧翼序列, 可以比对到油菜参考基因组的chrA05:16529633处, 序列同源性达到99%; 该插入位置位于BnaA05g21420D基因的3°末端。EPS-6转基因系分离得到1578 bp的侧翼序列, 可以比对到油菜参考基因组的chrC02:9519946处, 序列同源性达到99%; 该插入位置位于基因BnaC02g14170D和BnaC02g14180D之间的基因间区。EPS-7转基因系分离得到491 bp的侧翼序列, 可以比对到油菜参考基因组的chrC07:19068559处, 序列同源性达到99%; 该插入位置位于基因BnaC07g13430D和BnaC07g13440D之间的基因间区。图5
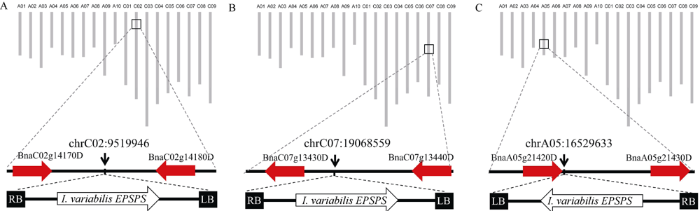 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5EPS-2、EPS-6和EPS-7等油菜转化体中T-DNA插入位置信息
Fig. 5Insertion location information of T-DNA of EPS-2, EPS-6, and EPS-7 in the transgenic lines
2.4 利用特异性PCR验证转化株系中的T-DNA插入位点
利用上述分离的侧翼序列信息, 分别设计了EPS-2、EPS-6和EPS-7等油菜转化体的特异性的上游引物(EPSPS2 F、EPSPS6 F和EPSPS7 F), 分别与载体上的共同下游引物P5进行组合, 用于转化体特异性PCR检测(表1)。利用转化体特异性引物对这些家系的4个不同世代的植株(T0~T3)进行PCR检测(图5)发现, 各转化体从T0~T3世代单株均获得了预期特异性片段, 而阴性对照J9707都没有任何条带。证明EPS-2、EPS-6和EPS-7等油菜转化体基因组中整合的T-DNA在不同世代间的是稳定的。
图6
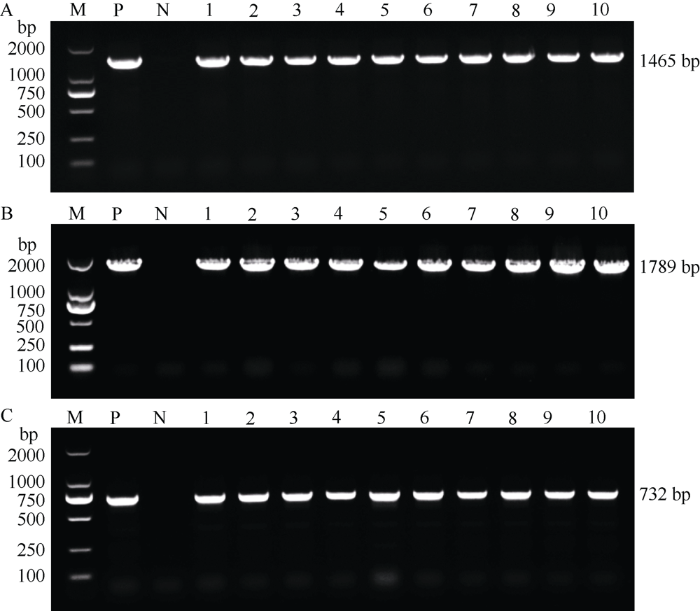 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6EPS-2、EPS-6和EPS-7等转基因家系的转化体特异性PCR检测结果
A: EPS-2转基因家系不同世代材料的转化体特异性PCR检测结果, 检测所用引物为EPSPS-2 F和P5; B: EPS-6转基因家系不同世代材料的转化体特异性PCR检测结果, 检测所用引物为EPSPS6 F和P5; C: EPS-7转基因家系不同世代材料的转化体特异性PCR检测结果, 检测所用引物为EPSPS7F和P5。其中, M为2 kb DNA marker; P为pTGH-1质粒(阳性对照); N为转化受体J9707 (阴性对照); 1为T0代植株; 2~4为T1代抗性植株; 5~7为T2代抗性植株; 8~10为T3代抗性植株。
Fig. 6PCR confirmation of the T-DNA insertion in the transgenic lines of EPS-2, EPS-6, and EPS-7 with specific primers
A: PCR confirmation of the T-DNA insertion in the transgenic line of EPS-2 with specific primer pair EPSPS2 F/P5. B: PCR confirmation of the T-DNA insertion in the transgenic line of EPSPS6 with specific primer pair EPSPS6 F/P5. C: PCR confirmation of the T-DNA insertion in the transgenic line of EPS-7 with specific primer pair EPSPS7 F/P5. M: 2 kb DNA marker; P: pTGH-1 plasmid (positive control); N: J9707 (negative control); 1: T0-transgenic plant; 2-4: T1-transgenic plant; 5-7: T2-transgenic plant; 8-10: T3-transgenic plant.
2.5 转基因植株中I. variabilis EPSPS基因的表达检测
在T0代, 分别用RT-PCR和Western blot检测了几个转化体的叶片组织中目的基因的表达情况。从图7可以看出, 在EPS-1、EPS-2、EPS-5、EPS-6和EPS-7等转化体中可以检测到目的基因超量表达, 而在转化受体J9707中检测不到明显的目的基因表达。图7
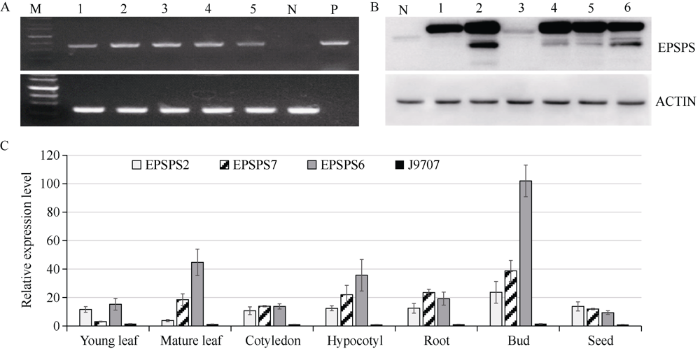 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7转I. variabilis EPSPS阳性株系的表达检测
A: RT-PCR检测目的基因在T0代株系叶片中的RNA表达水平。其中, M为3 kb DNA marker; 1~5依次为EPS-1、EPS-6、EPS-7、EPS-2和EPS-5等转化系; N: J9707 (阴性对照); P: pTGH-1质粒(阳性对照)。B: Western blot检测目的基因在T0代株系叶片中的蛋白表达水平。其中, N: J9707 (阴性对照); 1~6依次为EPS-1、EPS-6、EPS-36、EPS-7、EPS-2和EPS-5转化系。C: qRT-PCR检测目的基因在T3代株系的不同组织中相对表达量。油菜Actin2 (AF111812)为内参基因。
Fig. 7Expression analysis of the transgenic lines of I. variabilis EPSPS
A: the RNA expression levels of the target gene in the leaf of T0-positive transgenic lines detected by RT-PCR. M: 3 kb DNA marker; 1-5: the positive transgenic lines of EPS-1, EPS-6, EPS-7, EPS-2, and EPS-5, respectively; N: J9707 (negative control); P: pTGH-1 (positive control). B: the protein expression level of the target gene in the leaves of the T0-positive transgenic lines detected by Western blot. N: J9707 (negative control); 1-6: the positive transgenic lines of EPS-1, EPS-6, EPS-36, EPS-7, EPS-2, and EPS-5, respectively. C: the relative expression of the target gene in different tissues of the T3-positive transgenic lines detected by qRT-PCR. Actin2 (AF111812) in rape is an internal reference gene.
在T3代, 利用qRT-PCR技术检测了EPS-2、EPS-6和EPS-7等转化体在幼叶、成熟叶、子叶、下胚轴、根、花蕾和种子等不同组织中的基因表达量(图7-C)。相对于转化受体J9707, 3个转化体在各个组织中均能检测到目的基因的上调表达; 在不同转化体中目的基因的表达量有所变异, 其中EPS-6在不同组织中都表现出相对较高的表达水平。
2.6 转基因植株的除草剂抗性鉴定
在T1代, 对EPS-2、EPS-6和EPS-7等转化体的草甘膦抗性进行了初步评价, 以J9707和常规品种中双11号为阴性对照, 苗期使用田间推荐浓度的2倍草甘膦进行了处理。由图8可以看出, 2种阴性对照在处理后药害严重, 20 d左右植株完全死亡; 而各转化体都表现出对草甘膦的抗性。EPS-6在处理后几乎未见明显的药害, 与对照条件下(喷施等量清水)的植株生长相似, 表现出很好的草甘膦抗性; EPS-2和EPS-7等转化体也表现较好的抗性, 但是比对照条件下的植株生长弱小, 表现出一定程度的药害。图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8转I. variabilis EPSPS基因T1代株系喷施草甘膦处理下的抗性表现
Fig. 8Phenotypes of T1 transgenic plants of I. variabilis EPSPS under the treatments of glyphosate
为进一步确定目标除草剂抗性的功能稳定性, 在T3代对EPS-1、EPS-2、EPS-5、EPS-6和EPS-7等株系进行苗期的4种草甘膦浓度的喷施处理(0倍、1倍、2倍和4倍), 以J9707为对照。从图9可以看出, 阴性对照J9707在处理后药害严重, 在4倍浓度喷施处理后第4周完全死亡; 而各转化体在4倍浓度喷施处理后仍未见明显的药害发生, 都表现出很好的草甘膦抗性。
图9
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9转I. variabilis EPSPS基因T3代株系苗期喷施不同浓度草甘膦处理下的抗性表现
Fig. 9Phenotypes of T3 transgenic plants of I. variabilis EPSPS under the treatments with different concentrations of glyphosate at seedling stage
3 讨论
根据国际农业生物技术应用服务组织(International Agricultural Biotechnology Application Service Organization, ISAAA)提供的数据, 截至2020年, 全世界共有70个国家和地区种植或进口了转基因作物, 全球转基因作物种植面积达1.917亿公顷, 涉及32个作物种类、526项转基因作物事件。其中, 除草剂耐受性的转基因事件达341项, 占总转基因作物事件的64.8%, 而抗除草剂转基因油菜转化事件有38项, 占转基因油菜转化事件的90.5%。目前应用的抗除草剂转基因油菜主要有抗草甘膦、抗草铵膦和抗溴苯氰等类型, 其中种植面积最广的是抗草甘膦。油菜中广泛应用的的抗草甘膦基因绝大部分来自于孟山都和杜邦等国外生物技术公司, 其中孟山都公司从根癌农杆菌CP4菌株中获得的抗草甘膦CP4-epsps基因应用最为成功; 该酶对草甘膦不敏感, 对EPSPS催化的底物5-磷酸烯醇式丙酮酸(5-phosphoenolpyruvate, PEP)具有很高的亲和力; 因此, 它可以取代植物的内源EPSPS合成酶体系, 使莽草酸途径正常进行, 从而达到抗草甘膦的效果[15,22]。本研究使用的I. variabilis EPSPS是从细菌I. variabilis中克隆到的一种新型的抗草甘膦基因[11], 与已获得转基因批准的CP4-epsps、玉米EPSPS突变体以及GRG23突变体中的EPSPS基因的氨基酸序列同源性分别只有27.1%、33.5%和31.5%[24]。因此, I. variabilis EPSPS是一种具有完全自主知识产权的新型抗草甘膦基因[19]。本研究成功将该基因转入到甘蓝型油菜中, 获得了一批单拷贝的转基因株系。通过多代的分子特征检测证实该基因稳定整合到油菜基因组中, 在多个世代间可以检测到目的基因的超量表达。在T1代对单拷贝家系EPS-2、EPS-6和EPS-7进行草甘膦喷施处理发现, 转I. variabilis EPSPS的不同家系均表现出草甘膦抗性, 其中EPS-6家系抗性表现最优(图8), 这与该家系中目标基因在叶片等组织中的相对表达量最高一致(图9), 显示提高该目的基因的表达量有利于增强转基因油菜的草甘膦抗性水平。这3个家系中, EPS-6和EPS-7的T-DNA都位于基因间区, 理论上对插入位点附近的基因表达不会产生太大影响, 是比较理想的转化株系; 而EPS-2的T-DNA插入在BnaA05g21420D基因的3°末端, 可能会影响该基因表达, 还需要后续的试验进行验证。在T3代, 进一步对这3个单拷贝家系和2个双拷贝插入的转基因家系(EPS-1和EPS-5)进行了0~4倍田间推荐使用剂量的草甘膦喷施处理, 表明它们都具有很好的抗性。因此, I. variabilis EPSPS基因有望作为一个新型的草甘膦抗性基因应用到油菜抗除草剂品种培育中。
4 结论
将来自放线菌属变异白蚁菌中的新型抗除草剂基因I. variabilis EPSPS通过农杆菌介导的遗传转化法导入甘蓝型油菜中, 获得了126株转基因阳性单株。通过对外源插入片段的拷贝数、整合稳定性、表达稳定性和目标除草剂抗性的稳定性等特性的分析, 筛选出优异的新型抗广谱性除草剂草甘膦转基因株系, 将为我国抗除草剂转基因油菜品种培育提供优异的种质资源。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
