 ,1,**, 潘丽娟1,**, 李昊远2, 王通1, 陈娜1, 陈明娜1, 王冕1, 禹山林1, 侯艳华
,1,**, 潘丽娟1,**, 李昊远2, 王通1, 陈娜1, 陈明娜1, 王冕1, 禹山林1, 侯艳华 ,2,*, 迟晓元
,2,*, 迟晓元 ,1,*
,1,*Expression pattern analysis of genes related to lipid synthesis in peanut
XU Jing ,1,**, PAN Li-Juan1,**, LI Hao-Yuan2, WANG Tong1, CHEN Na1, CHEN Ming-Na1, WANG Mian1, YU Shan-Lin1, HOU Yan-Hua
,1,**, PAN Li-Juan1,**, LI Hao-Yuan2, WANG Tong1, CHEN Na1, CHEN Ming-Na1, WANG Mian1, YU Shan-Lin1, HOU Yan-Hua ,2,*, CHI Xiao-Yuan
,2,*, CHI Xiao-Yuan ,1,*
,1,*通讯作者:
收稿日期:2020-07-10接受日期:2020-11-13网络出版日期:2021-06-12
| 基金资助: |
First author contact:
Received:2020-07-10Accepted:2020-11-13Online:2021-06-12
| Fund supported: |
作者简介 About authors
许静, E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (2203KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
许静, 潘丽娟, 李昊远, 王通, 陈娜, 陈明娜, 王冕, 禹山林, 侯艳华, 迟晓元. 花生油脂合成相关基因的表达谱分析[J]. 作物学报, 2021, 47(6): 1124-1137. doi:10.3724/SP.J.1006.2021.04150
XU Jing, PAN Li-Juan, LI Hao-Yuan, WANG Tong, CHEN Na, CHEN Ming-Na, WANG Mian, YU Shan-Lin, HOU Yan-Hua, CHI Xiao-Yuan.
花生(Arachis hypogaea L.)是世界上重要的油料作物和经济作物, 也是重要的食用油和食用蛋白源, 具有较高的经济价值[1]。我国是世界上最大的花生消费国, 每年花生总产量的46%~48%用于榨油。花生籽仁中脂肪含量占50%左右, 其中80%为不饱和脂肪酸, 能够降低有害胆固醇, 减缓动脉粥样硬化, 有效预防冠心病等心脑血管疾病[2], 是人们理想的健康食用油。因此, 提高花生含油量是国家发展的重大需求, 市场潜力巨大, 发展前景广阔。
植物油脂的合成过程复杂, 涉及多种酶的催化作用。甘油-3-磷酸酰基转移酶(sn-glycerol-3-phosphate acyltransferase, GPAT)、溶血磷脂酸酰基转移酶(lysophosphatidyl acyltransferase, LPAAT)和二酰甘油酰基转移酶(diacylglycerol acyltransferase, DGAT)是参与植物油脂合成的3个关键酶。近年来, 花生油脂合成方面也取得了一定的研究进展。陈玉梅等[3]对花后20、35、50、60 d的花生籽粒进行转录组测序, 共得到135条代谢通路, 其中与油脂合成相关的有脂肪酸生物合成、不饱和脂肪酸生物合成、脂肪酸延长、脂肪酸代谢、花生四烯酸代谢等代谢通路。Chi等[4]在花生中分离得到6个AhGPAT基因, RT-PCR分析发现, 在花生籽仁发育时期AhGPAT9的转录水平逐渐增加, 同时在逆境环境下, AhGPAT基因在叶片或根中的表达显著增加。3个AhDGATs基因从花生中被克隆出来, AhDGAT1-1在籽仁发育的初期表达较低, 但在果针入土50 d时表达增加, AhDGAT1-2在果针入土10 d和50 d高表达, AhDGAT3-3在果针入土20 d和50 d表达量最高[5]。Zheng等[6]将AhDGAT1.1转到烟草中, 与野生型相比, 脂肪酸含量增加14.7%~20.9%。Chi等[7]通过RT-PCR或RACE-PCR在花生中克隆得到4个AhLPAAT基因, AhLPAAT2基因在籽粒中富集表达, 主要集中在籽粒发育初期, 然而AhLPAAT6基因在籽粒发育时期表达量下降, 主要在花中富集表达。Chen等[8]克隆了花生中的AhLPAT4基因, RT-PCR表明AhLPAT4在花后40 d和50 d表达量与种子中油脂的积累速率同步增加。皮广静等[9]分析高油品系农大D666及其亲本不同发育时期籽仁内三类酰基转移酶基因的表达量表明, R5期DGAT1-2和GPAT9、LPAAT基因表达量之间协调性较好, 有利于油脂的合成与积累。
硬脂酰-ACP去饱和酶(Stearoyl-ACP desaturase, FAB2)是实现硬脂酸转化为不饱和脂肪酸的关键酶, 微粒体Δ12去饱和酶(Microsomal Δ12 desaturase, FAD2)是调控花生油酸、亚油酸含量和油亚比(O/L)的关键酶。在酵母中异源表达AhFAD2-2和AhFAD6发现了亚油酸的形成, 证实了两基因的功能[10]。此外, Chi等[11]克隆了一系列的脂肪酸去饱和酶, RT-PCR分析发现AhFAB2-2和AhFAD3-1在籽粒中较其他组织表达量高, 在籽粒发育时期, AhFAB2-2、AhFAD3-1、AhFAD7-1表达量逐渐上升达到最高水平, 然后降低。转录因子WRINKLED(WRI1)是在种子皱缩的拟南芥突变体中发现并命名, 研究发现该基因会导致突变体种子含油量降低80% [12]。随后, WRI1转录因子常被用于油料作物和模式植物油分改良相关的研究。Pouvreau等[13]研究表明, 过表达WRI1基因, 能使转基因玉米种子中含油量增加, 同时还发现WRI1基因具有调节细胞质中三酰甘油主链生成的作用。孙金波等[14]从二倍体花生野生种和四倍体栽培种克隆到20个WRI1转录因子, 转录组分析表明WRI1在种子中的表达高于其他组织, RT-PCR结果进一步表明, WRI1表达随种子成熟水平逐渐增加。为进一步研究花生油脂合成的调控机制, 本研究选用油酸和油脂含量差异显著的2个花生品种(系)。通过基因芯片测序技术, 研究花生种子不同发育阶段的全基因组表达谱, 并分离克隆出与种子发育有关, 特别是与油脂或脂肪酸合成和调控有关的特异表达基因, 以期为花生品质的遗传改良奠定基础。
1 材料与方法
1.1 材料
花生(Arachis hypogaea L.)材料选择山东省花生研究所杂交育种课题组培育的高油酸、中油花生品系F18和低油酸、低油花生品种‘鲁花6号’。1.2 方法
1.2.1 样品采集 分别在10、30、40、60 DAP选取无病害、长势一致的花生荚果, 剥去花生壳后迅速将籽仁放入液氮中速冻, -80℃保存, 作为芯片测序的样品。另取各个时期花生荚果适量, 作为油脂和脂肪酸含量测定的样品。1.2.2 花生籽仁油脂和脂肪酸含量测定 采用索氏提取法[15]提取油脂, 脂肪酸的提取及气相色谱分析方法具体参考迟晓元等[16]的方法。样品采用3 g左右研磨成粉末的花生种子, 每个样品重复3次。
1.2.3 RNA提取和纯化 采用北京天根生化科技有限公司试剂盒(RNeasy Mini Kit)提取样品总RNA。使用NucleoSpin RNA纯化试剂盒(MAC HEREYNAGEL, 德国) 进行RNA样品的纯化。用甲醛琼脂糖凝胶电泳对RNA质检, 然后用Nanovue Plus分光光度计(General Electric Company, USA)对RNA进行定量。所有RNA样品均保存于-80℃冰箱备用。
1.2.4 基因芯片制备 芯片测序工作由厦门博奥生物科技有限公司完成。采用Roche公司的NimbleGen花生表达谱芯片, 芯片包含36,158个探针组。Roche NimbleGen表达谱芯片试验流程按照博奥生物公司的规定流程进行, 具体方法参考Yu等[17]的方法。
1.2.5 数据分析 利用NimbleScan v2.6软件将杂交芯片的图像信号转换为数字信号。采用Genespring v13.0软件分位数法进行数据标准化处理, 以上工作均由博奥生物有限公司完成。根据统计学分析, 差异基因的筛选条件为: 校正后的P-value≤0.05且2个样品的差异倍数|fold change|≥2。
1.2.6 GO功能注释及富集分析 首先利用blast + v2.2.30将基因序列与NCBI中的NR、Swissprot、TrEm1等数据库进行比对。然后将比对结果导入Blast2GO中用于GO注释, 主要包括分子功能、生物过程和细胞组分信息注释。最后利用WEGO对GO功能进行分类统计(http://wego.genomics.org.cn/cgi-bin/wego/index.pl)。
1.2.7 KEGG Pathway分类与富集分析 利用KEGG网站(http://www.kegg.jp/)对获得的序列进行代谢通路分类, 同一个基因序列可能注释到多个代谢通路中。使用R软件中ggplot2软件包进行富集分析。
1.2.8 蛋白互作网络分析 将F18和‘鲁花6号’40 DAP和60 DAP 2个时期的所有差异表达的基因序列比对结果上传至STRING数据库(https://string-db.org/)中, 分析蛋白之间的互作关系。然后导入到cytoscape中进行编辑作图。
1.2.9 差异表达基因的RT-PCR验证 参照陈娜等[18]的方法进行荧光定量PCR的反应。每个样品3次重复, 内参基因选择Actin11, 采用2-ΔΔCt方法分析数据。荧光定量PCR所用引物见表1。
Table 1
表1
表1RT-PCR验证基因所用的引物
Table 1
| 基因编号 Gene ID | 正向引物 Forward primer (5°-3°) | 反向引物 Reverse primer (5°-3°) |
|---|---|---|
| AHTC1032413 | ACGAAGGTTATGGAAGTAG | AGGAAGGTAGTGAAGGAA |
| AHTC1030930 | AGGTGAAGAATCTGTTAGTC | CTTATCTTGTGAATTACTTGTCT |
| AHTC1005724 | GATAAGTGGAGCAGTAGC | CAAGAAGACGATGATATAAGC |
| AHTC1030772 | TCAATCAGATTCGTAACATTC | ACTCAATAACTCTATCCACTAG |
| AHTC1020107 | CTACTACTCATCATTCATTGTC | CTTAACTCACCCACACAT |
| AHTC1012845 | TCCTCTTCTTCATCTTCATC | CCTGGTTACTCCTCTGTA |
| AHTC1014100 | ACTCCTTCTCCTCTTCAT | ATATTAGGCAGCAGATACC |
| AHTC1001812 | AATGGCAGGAGGTTATTG | TTCTTCTTCATCATAATCTTAGC |
| AHTC1001844 | GTGACTTGGCAGAGATTA | AATTGATTGATTGACGGATG |
| AHTC1001749 | TCTTGGAGTTCCTTGTTG | GCTATGCGACTTCTTCAT |
| AHTC1005424 | GAGTGATGTAGTTGAGATAGA | CTCTTCCGATGACTTGAT |
| AHTC1000715 | TGGTTAAGAGGAGCATTG | ATGAGGCATTGTTGAGAA |
| AHTC1002482 | GTTGCTCTGATGACTCTC | TATGGCTAACCGTTGATG |
| AHTC1027178 | TCTCACTCACTCTCATCA | CCACCACCATCTTAGAAG |
| Actin11 | TTGGAATGGGTCAGAAGGATGC | AGTGGTGCCTCAGTAAGAAGC |
新窗口打开|下载CSV
2 结果与分析
2.1 不同发育时期花生籽仁油脂和脂肪酸含量分析
F18和‘鲁花6号’不同发育时期花生籽仁含油量和脂肪酸组分含量如表2, 两品种(系)含油量和油酸含量随着籽仁的发育不断积累。除了30 DAP发育时期, F18在各个发育时期的含油量均高于‘鲁花6号’, 两品种(系)在60 DAP发育时期含油量均最高, 分别为50.81%和45.44%。F18在4个发育时期的油酸含量均高于‘鲁花6号’, 在40 DAP发育时期达76.06%, 而‘鲁花6号’在60 DAP达到最高, 为43.98%。亚油酸含量在两品种(系)中随着籽仁发育呈下降趋势, F18和‘鲁花6号’均在60 DAP发育时期达到最低, 为1.55%和34.28%, 油亚比均最高为45.65和1.28。Table 2
表2
表2不同发育时期两品种(系)油脂和脂肪酸含量
Table 2
| 样品名称 Name | 发育时期 Development stage | 含油量 Oil content (%) | 油酸含量 Oleic content (%) | 亚油酸含量 Linoleic content (%) | 油亚比 O/L |
|---|---|---|---|---|---|
| F18 | 10 DAP | 13.86 | 58.91 | 15.39 | 3.83 |
| 30 DAP | 35.21 | 74.01 | 5.61 | 13.19 | |
| 40 DAP | 46.82 | 76.06 | 2.43 | 31.30 | |
| 60 DAP | 50.81 | 70.75 | 1.55 | 45.65 | |
| 鲁花6号 Luhua 6 | 10 DAP | 19.67 | 31.63 | 37.14 | 0.85 |
| 30 DAP | 36.95 | 34.96 | 41.28 | 0.85 | |
| 40 DAP | 44.44 | 37.67 | 39.39 | 0.96 | |
| 60 DAP | 45.44 | 43.98 | 34.28 | 1.28 |
新窗口打开|下载CSV
2.2 不同发育时期花生籽仁差异表达基因分析
根据芯片杂交结果中不同发育时期籽仁基因表达水平, 筛选出显著差异表达的基因。10 DAP时期两品种(系)基因表达水平差异不显著(图1-A); 30 DAP时期在两品种(系)中差异表达的基因共130个, 与‘鲁花6号’相比, F18上调表达基因20个, 下调表达基因110个(图1-B); 两品种(系)在40 DAP时期差异表达的基因数目最多, 达3556个, 其中上调的差异表达基因有2056个, 下调的有1500个(图1-C); 60 DAP时期两品种(系)差异表达的基因共2783个, 相对于‘鲁花6号’, F18上调表达的基因有1746个, 下调表达的基因有1037个(图1-D)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1不同发育时期两品种(系)间差异表达基因火山图
A: 10 DAP差异表达基因; B: 30 DAP差异表达基因; C: 40 DAP差异表达基因; D: 60 DAP差异表达基因。红色表示F18相对于‘鲁花6号’差异表达的基因。
Fig. 1Volcano plot of differential expression genes at the different developmental stages between F18 and Luhua 6
A: different expression genes of 10 DAP; B: different expression genes of 30 DAP; C: different expression genes of 40 DAP; D: different expression genes of 60 DAP. Red blots represent the different expression genes of F18 compared with ‘Luhua 6’.
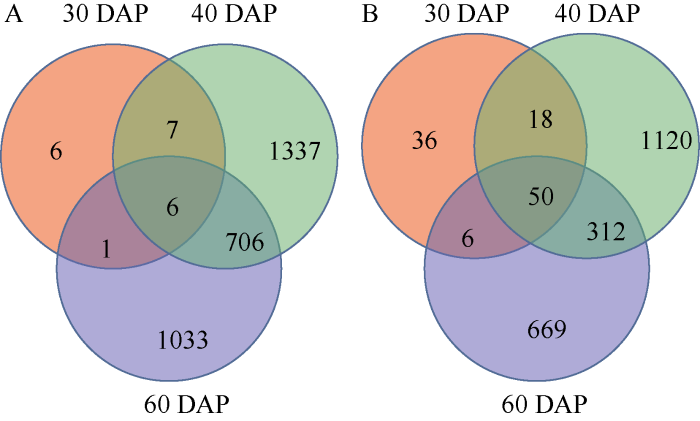
根据筛选的差异表达基因分析发现, 一些基因在花生籽仁发育的不同时期均有表达。由图2可知, 与‘鲁花6号’相比, F18在30、40、60 DAP 3个时期同时表达上调的基因有6个, 下调表达的基因为50个; 在40、60 DAP 2个时期共同差异表达上调的有712个, 差异表达下调的有362个。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同品种(系)间不同发育时期共同表达的差异基因
A: F18相比于‘鲁花6号’上调表达基因; B: F18相比于‘鲁花6号’下调表达基因。
Fig. 2Differentially expressed genes of two variations (lines) at three different developmental stages
A: the up-regulated expression genes of F18 compared with ‘Luhua 6’; B: the down-regulated expression genes of F18 compared with ‘Luhua 6’.
2.3 不同发育时期差异表达基因的GO功能注释分析
对筛选到的差异表达基因进行GO功能注释, 3个不同发育时期分别注释22、1914和1559个差异基因, 主要包括生物过程、细胞组分和分子功能三大类别。如图3-A所示, 40 DAP和60 DAP时期差异表达基因主要参与代谢调控(metabolic process GO: 0008152)和催化进程(catalytic activity GO: 0003824)。有趣的是, 参与光合作用的基因全部上调(53个)而没有下调, 这些参与光合作用的基因大量上调导致F18固定空气中更多的CO2, 并合成为自身碳源, 最终流向脂质合成。此外, 还发现前体代谢物和能量的生成上调的基因有42个, 而下调仅有1个。这些光合作用、糖、蛋白等代谢也对油脂合成和积累有一定影响。进一步对40 DAP和60 DAP 2个时期差异表达的1074个基因进行富集发现, 共有598个基因富集到11个GO类别中(图3-B)。其中代谢进程富集的基因最多, 这表明‘鲁花6号’和F18参与代谢途径的基因的表达有显著差异。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3差异表达基因GO注释及富集分析
Fig. 3GO annotation and enrichment of differentially expressed genes
2.4 不同发育时期差异表达基因的KEGG Pathway富集分析
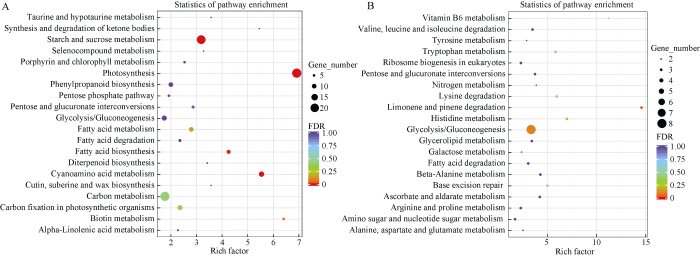
根据KEGG数据库, 本研究对花生籽仁40 DAP和60 DAP 2个发育时期1074个差异表达的基因(上调表达基因712个, 下调表达基因362个)进行KEGG Pathway富集分析。上调表达的基因主要富集在光合、氰氨基酸代谢、脂肪酸合成和淀粉蔗糖代谢4个代谢途径中(图4-A), 注释的基因分别为25、12、21和9个。下调表达的基因只富集在柠檬烯和蒎烯降解途径中, 没有富集到与脂肪酸代谢相关的途径(图4-B)。这表明, 与‘鲁花6号’相比, F18中参与脂肪酸合成的基因在花生籽仁发育的后期表达量普遍较高。另外, 本研究发现, 光合途径差异表达基因编码的都是捕光叶绿素a/b结合蛋白, 这些蛋白复合体能够捕获并传递光能, 调节光能分配, 而光合作用是植物一切物质积累的源头, 这一发现反应了2个品种(系)自身的遗传差异。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4差异表达基因KEGG注释及富集分析
Fig. 4KEGG pathway annotation and enrichment of differentially expressed genes
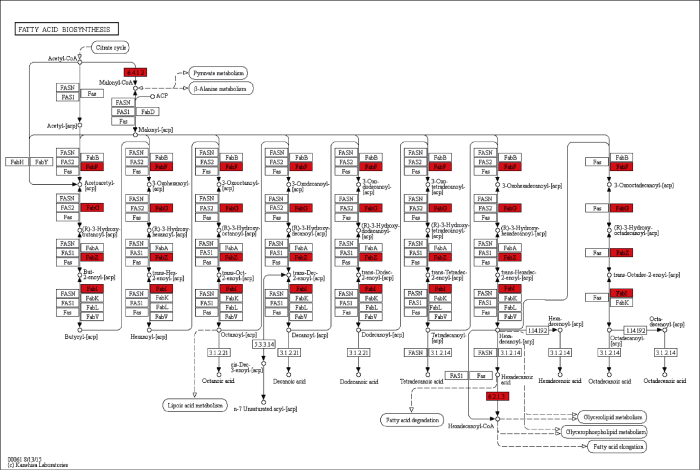
针对我们感兴趣的脂肪酸合成途径, 绘制了代谢通路图(图5)。结果显示, 在F18和‘鲁花6号’后2个发育时期脂肪酸合成途径中没有找到下调的基因, 说明在这一时期中, F18的脂肪酸合成代谢比‘鲁花6号’更旺盛, 产生更多的脂肪酸。在代谢通路的最开始, 第1个上调的是ACCase (EC: 6.4.1.2)基因, 催化脂肪酸生物合成的起始; 而后在脂肪酸合成循环的通路中, β-酮脂酰ACP合酶(FabF)、β-酮脂酰ACP还原酶(FabG)、β-羟酰基ACP脱水酶(FabZ)和烯酰-ACP还原酶(FabI)均上调, 他们共同催化脂肪酸的缩合反应; 在途径的末端, 长链酰基合成酶(EC:6.2.1.3)基因上调表达, 合成长链的脂肪酸。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图540 DAP和60 DAP差异表达基因脂肪酸代谢通路图
红色代表相对于‘鲁花6号’, F18上调表达的基因。
Fig. 5Fatty acid biosynthesis pathway of differential expression genes on 40 DAP and 60 DAP
Red represents the up-regulated expression genes of F18 compared with ‘Luhua 6’.
2.5 油脂代谢相关基因的筛选
根据GO注释的结果, 我们分别在40 DAP和60 DAP籽仁发育时期筛选到64个和62个参与油脂代谢相关的基因, 其中分别鉴定到25个和27个油脂合成的关键基因(表3和表4)。硬脂酰ACP去饱和酶(FAB2)是催化硬脂酸产生油酸的关键酶, ω6脂肪酸去饱和酶(FAD2)是催化油酸C12位去饱和酶形成亚油酸的一类酶。花生籽仁发育的40 DAP时期, F18花生品系中两基因均上调表达(AHTC1008662和AHTC1005915), 比‘鲁花6号’花生品种中的表达量分别高3.48倍和2.06倍。在60 DAP发育时期, FAB2起关键作用, 与‘鲁花6号’相比, F18中FAB2 (AHTC1001749)表达量显著增加, 高达29.89倍。Table 3
表3
表340 DAP发育时期油脂代谢相关基因
Table 3
| 基因编号 Gene ID | 基因注释 Gene annotation | GO富集 GO enrichment | 调控a Regulationa | 差异表达倍数 Fold change | ||||
|---|---|---|---|---|---|---|---|---|
| AHTC1031703 | 移酶1-酰基-sn-甘油-3-磷酸酰基转 | 磷脂生物合成 | 上调 | 4.19 | ||||
| 1-acyl-sn-glycerol-3-phosphate acyltransferase-like | Phospholipid biosynthetic process | Up | ||||||
| 基因编号 Gene ID | 基因注释 Gene annotation | GO富集 GO enrichment | 调控a Regulationa | 差异表达倍数 Fold change | ||||
| AHTC1022314 | 3-酮脂酰-合酶 | 脂肪酸生物合成 | 上调 | 2.88 | ||||
| 3-ketoacyl-synthase | Fatty acid biosynthetic process | Up | ||||||
| AHTC1029564 | 类3-酮脂酰-合酶10 | 脂肪酸生物合成 | 上调 | 2.30 | ||||
| 3-ketoacyl-synthase 10-like | Fatty acid biosynthetic process | Up | ||||||
| AHTC1007527 | 3-酮脂酰-合酶11 | 脂肪酸生物合成 | 下调 | 3.28 | ||||
| 3-ketoacyl-synthase 11 | Fatty acid biosynthetic process | Down | ||||||
| AHTC1008395 | 类3-酮脂酰-合酶11 | 脂肪酸生物合成 | 下调 | 2.55 | ||||
| 3-ketoacyl-synthase 11-like | Fatty acid biosynthetic process | Down | ||||||
| AHTC1016489 | 3-酮脂酰-合酶21 | 脂质生物合成 | 上调 | 5.25 | ||||
| 3-ketoacyl-synthase 21 | Lipid biosynthetic process | Up | ||||||
| AHTC1003640 | 类3-酮脂酰-合酶21 | 脂肪酸生物合成 | 上调 | 3.51 | ||||
| 3-ketoacyl-synthase 21-like | Fatty acid biosynthetic process | Up | ||||||
| AHTC1003641 | 类3-酮脂酰-合酶21 | 脂肪酸生物合成 | 上调 | 6.43 | ||||
| 3-ketoacyl-synthase 21-like | Fatty acid biosynthetic process | Up | ||||||
| AHTC1004544 | 3-酮脂酰-合酶6 | 脂肪酸生物合成 | 上调 | 2.86 | ||||
| 3-ketoacyl-synthase 6 | Fatty acid biosynthetic process | Up | ||||||
| AHTC1019082 | α-乙酰羧化酶亚基 | 脂肪酸生物合成; 丙二酰辅酶A生物合成 | 下调 | 2.07 | ||||
| Alpha-acetyl-carboxylase subunit | Fatty acid biosynthetic process; malonyl-CoA biosynthetic process | Down | ||||||
| AHTC1001812 | β-酮酰基-ACP还原酶 | 脂肪酸生物合成; 氧化还原 | 上调 | 2.05 | ||||
| Beta-ketoacyl-acp reductase 1-2 | Fatty acid biosynthetic process; oxidation-reduction process | Up | ||||||
| AHTC1001844 | β-酮酰基-ACP合酶 | 脂肪酸生物合成 | 上调 | 2.17 | ||||
| Beta-ketoacyl-acp synthase i-2 | Fatty acid biosynthetic process | Up | ||||||
| AHTC1005915 | 叶绿体ω-6 脂肪酸去饱和酶 | 二磷酸生物合成 | 上调 | 2.06 | ||||
| Chloroplast omega-6 fatty acid desaturase | Diphosphate biosynthetic process | Up | ||||||
| AHTC1032453 | 酰基-载体-蛋白合酶 | 脂肪酸生物合成 | 上调 | 2.16 | ||||
| Fatty acid biosynthesis 1 isoform 1 | Fatty acid biosynthetic process | Up | ||||||
| AHTC1032454 | 酰基-载体-蛋白合酶 | 脂肪酸生物合成 | 上调 | 2.57 | ||||
| Fatty acid biosynthesis 1 isoform 1 | Fatty acid biosynthetic process | Up | ||||||
| AHTC1020107 | 鞘脂Δ8 去饱和酶 | 脂质代谢; 氧化还原 | 上调 | 2.04 | ||||
| Fatty acid sphingolipid desaturase | Lipid metabolic process; oxidation- reduction process | Up | ||||||
| AHTC1035094 | 脂质转移蛋白 | 脂质转移 | 上调 | 14.59 | ||||
| Lipid transfer protein gpi-anchored | Lipid transport | Up | ||||||
| AHTC1009675 | 长链酰基合成酶 | 长链脂肪酸代谢 | 上调 | 2.44 | ||||
| Long chain acyl-synthetase 1-like isoform×1 | Long-chain fatty acid metabolic process | Up | ||||||
| AHTC1026013 | 长链酰基合成酶 | 长链脂肪酸代谢 | 上调 | 3.03 | ||||
| Long chain acyl-synthetase 1-like isoform×1 | Long-chain fatty acid metabolic process | up | ||||||
| AHTC1017689 | 长链酰基合酶2 | 长链脂肪酸代谢 | 上调 | 2.65 | ||||
| Long chain acyl-synthetase 2 | Long-chain fatty acid metabolic process | up | ||||||
| AHTC1006429 | 长链酰基合成酶2异构体 | 长链脂肪酸代谢 | 上调 | 3.44 | ||||
| Long chain acyl-synthetase 2-like isoform×2 | Long-chain fatty acid metabolic process | Up | ||||||
| AHTC1034617 | 微粒体ω-3脂肪酸去饱和酶 | 脂质代谢; 氧化还原 | 上调 | 5.40 | ||||
| Microsomal omega-3 fatty acid desaturase | Lipid metabolic process; oxidation- reduction process | Up | ||||||
| 基因编号 Gene ID | 基因注释 Gene annotation | GO富集 GO enrichment | 调控a Regulationa | 差异表达倍数 Fold change | ||||
| AHTC1020991 | 非特异性脂质转移酶蛋白 | 脂质转移 | 上调 | 3.92 | ||||
| Non-specific lipid-transfer protein | Lipid transport | Up | ||||||
| AHTC1017861 | ω-3去饱和酶家族蛋白 | 不饱和脂肪酸生物合成; 氧化还原 | 下调 | 2.55 | ||||
| Omega-3 desaturase family protein | Unsaturated fatty acid biosynthetic process; oxidation-reduction process | Down | ||||||
| AHTC1008662 | 硬脂酰ACP去饱和酶 | 脂肪酸生物合成 | 上调 | 3.48 | ||||
| Stearoyl-acyl-carrier desaturase | Fatty acid biosynthetic process; oxidation-reduction process | Up | ||||||
新窗口打开|下载CSV
Table 4
表4
表460 DAP发育时期油脂代谢相关基因
Table 4
| 基因编号 Gene ID | 基因注释 Gene annotation | GO富集 GO enrichment | 调控a Regulationa | 差异表达倍数 Fold change |
|---|---|---|---|---|
| AHTC1005431 | 类3-酮脂酰-合酶11 | 脂肪酸生物合成 | 上调 | 7.27 |
| 3-ketoacyl-synthase 11-like | Fatty acid biosynthetic process | Up | ||
| AHTC1000075 | 酰基载体蛋白 | 脂肪酸生物合成; 氧化还原 | 上调 | 3.10 |
| Acyl carrier protein 1 | Fatty acid biosynthetic process; oxidation- reduction process | Up | ||
| AHTC1000128 | 酰基载体蛋白 | 脂肪酸生物合成; 氧化还原 | 上调 | 2.72 |
| Acyl carrier protein 1 | Fatty acid biosynthetic process; oxidation- reduction process | Up | ||
| AHTC1028756 | α-羧基转移酶前体 | 脂肪酸生物合成 | 上调 | 4.68 |
| Alpha-carboxyltransferase precursor | Fatty acid biosynthetic process | Up | ||
| AHTC1005278 | α-羧基转移酶 | 脂肪酸生物合成; 泛醌生物合成 | 上调 | 4.26 |
| Alpha-carboxyl transferase 2 | Fatty acid biosynthetic process; coenzyme biosynthetic process | Up | ||
| AHTC1000881 | β-羟烷基-ACP脱氢酶 | 脂肪酸生物合成 | 上调 | 18.60 |
| Beta-hydroxyacyl-acp dehydratase | Fatty acid biosynthetic process | Up | ||
| AHTC1001812 | β-酮酰基-ACP还原酶 | 脂肪酸生物合成; 氧化还原 | 上调 | 7.89 |
| Beta-ketoacyl-acp reductase 1-2 | Fatty acid biosynthetic process; oxidation- reduction process | Up | ||
| AHTC1001844 | β-酮酰基-ACP合酶 | 脂肪酸生物合成 | 上调 | 4.49 |
| Beta-ketoacyl-acp synthase i-2 | Fatty acid biosynthetic process | Up | ||
| AHTC1007010 | β-酮酰基-ACP合酶 | 脂肪酸生物合成 | 上调 | 3.25 |
| Beta-ketoacyl-acp synthase ii-1 | Fatty acid biosynthetic process | Up | ||
| AHTC1002452 | 生物素羧基载体蛋白 | 脂肪酸生物合成 | 上调 | 6.29 |
| Biotin carboxyl carrier protein 2-2 | Fatty acid biosynthetic process | Up | ||
| AHTC1014935 | 生物素羧基载体蛋白 | 脂肪酸生物合成 | 上调 | 2.83 |
| Biotin carboxyl carrier protein 2-2 | Fatty acid biosynthetic process | Up | ||
| AHTC1022457 | 生物素羧基载体蛋白 | 脂肪酸生物合成 | 上调 | 4.01 |
| Biotin carboxyl carrier protein 2-2 | Fatty acid biosynthetic process | Up | ||
| AHTC1032453 | 酰基-载体-蛋白合酶 | 脂肪酸生物合成 | 上调 | 3.90 |
| Fatty acid biosynthesis 1 isoform 1 | Fatty acid biosynthetic process | Up | ||
| AHTC1009675 | 长链酰基合成酶 | 长链脂肪酸代谢 | 上调 | 7.57 |
| Long chain acyl-synthetase 1-like isoform×1 | Long-chain fatty acid metabolic process | Up | ||
| 基因编号 Gene ID | 基因注释 Gene annotation | GO富集 GO enrichment | 调控a Regulationa | 差异表达倍数 Fold change |
| AHTC1026013 | 长链酰基合成酶 | 长链脂肪酸代谢 | 上调 | 9.64 |
| Long chain acyl-synthetase 1-like isoform×1 | Long-chain fatty acid metabolic process | Up | ||
| AHTC1017689 | 长链酰基合酶2 | 长链脂肪酸代谢 | 上调 | 6.75 |
| Long chain acyl-synthetase 2 | Long-chain fatty acid metabolic process | Up | ||
| AHTC1020991 | 非特异性脂质转移酶蛋白 | 脂质转移 | 上调 | 3.89 |
| Non-specific lipid-transfer protein | Lipid transport | Up | ||
| AHTC1002315 | 非特异性脂质转移酶蛋白 | 脂质转移 | 上调 | 3.73 |
| Non-specific lipid-transfer protein at5g64080-like | Lipid transport | Up | ||
| AHTC1015374 | 非特异性脂质转移酶蛋白 | 脂质转移 | 上调 | 3.13 |
| Non-specific lipid-transfer protein at5g64080-like | Lipid transport | Up | ||
| AHTC1019533 | 酰基转移酶 | 甘油酯生物合成 | 下调 | 6.23 |
| O-acyltransferase wsd1-like | Glycerolipid biosynthetic process | Down | ||
| AHTC1005424 | 油酰-酰基载体蛋白硫酯酶 | 脂肪酸生物合成 | 上调 | 2.72 |
| Oleoyl-acyl carrier protein thioesterase chloroplastic-like | Fatty acid biosynthetic process | Up | ||
| AHTC1000715 | ω6 脂肪酸去饱和酶 | 脂质代谢; 氧化还原 | 上调 | 3.82 |
| Omega 6 fatty acid desaturase | Lipid metabolic process; oxidation-reduction process | Up | ||
| AHTC1021791 | 过氧化物酶体脂肪酸-β氧化多功能蛋白 | 脂肪酸生物合成; 氧化还原 | 下调 | 2.62 |
| Peroxisomal fatty acid beta-oxidation multifunctional protein mfp2-like | Fatty acid metabolic process; oxidation- reduction process | Down | ||
| AHTC1001749 | 硬脂酰-ACP去饱和酶 | 脂肪酸生物合成; 氧化还原 | 上调 | 29.89 |
| Searoyl-acp desaturase | Fatty acid biosynthetic process; oxidation- reduction process | Up | ||
| AHTC1003174 | 超长链3-酰基还原酶 | 超长链脂肪酸生物合成 | 上调 | 3.92 |
| Very-long-chain 3-oxoacyl-reductase 1-like | Very long-chain fatty acid biosynthetic process | Up | ||
| AHTC1001068 | 类超长链烯酰还原酶异构体 | 脂质代谢; 氧化还原 | 上调 | 3.97 |
| Very-long-chain enoyl-reductase-like isoformx1 | Lipid metabolic process; oxidation-reduction process | Up | ||
| AHTC1001069 | 类超长链烯酰还原酶异构体 | 脂质代谢; 氧化还原 | 上调 | 3.80 |
| Very-long-chain enoyl-reductase-like isoformx1 | Lipid metabolic process; oxidation-reduction process | Up |
新窗口打开|下载CSV
2.6 WRI1蛋白互作网络分析
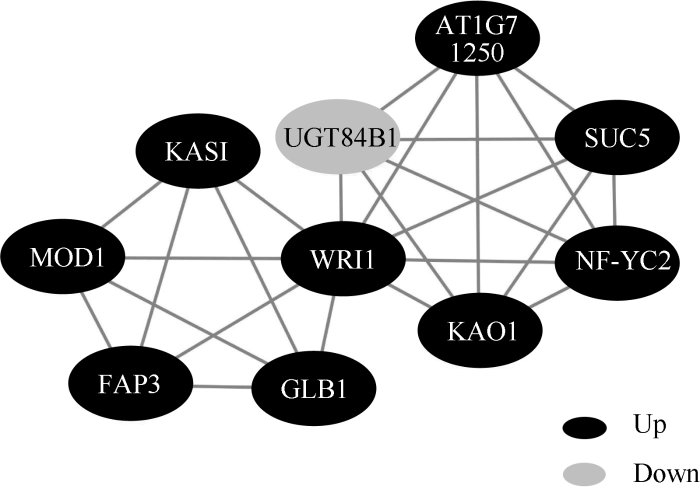
在花生籽仁发育后期的差异表达基因中筛选到WRI1转录因子, 以WRI1为核心进行蛋白互作网络分析, 共发现9个与WRI1互作的蛋白(图6)。其中KASI (3-酮酰基酰基载体蛋白合酶)、MOD1 (烯酰基载体蛋白还原酶)和GLB1 (氮调控蛋白)与脂质代谢有关, SUC5 (蔗糖转运蛋白)和UGT84B1 (葡萄糖基转移酶)参与糖代谢, 进一步使碳源从糖代谢流向脂肪酸合成, 促进脂肪酸合成。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6WRI1蛋白互作网络
黑色和灰色分别代表相对于‘鲁花6号’, F18上调和下调表达的基因。
Fig. 6Protein-protein interaction of WRI1
Black and grey represent the up- and down-regulated expression genes of F18 compared with ‘Luhua 6’.
2.7 不同发育时期差异表达基因的RT-PCR验证
为验证芯片测序结果中基因表达量的准确性, 随机挑选了不同发育时期的16个基因进行RT-PCR验证, 16个差异表达基因及内参基因引物如表1所示。将RT-PCR结果与芯片测序数据比对发现, 16个差异表达基因与芯片数据基本吻合(图7和表5), 表明芯片测序数据的可靠性, 可以用来分析不同发育时期花生籽仁差异表达的基因。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7不同发育时期差异表达基因的RT-PCR验证结果
Fig. 7RT-PCR validation results of the differentially expressed genes at different developmental stages
Table 5
表5
表5差异表达基因的RT-PCR验证结果
Table 5
| 基因编号 Gnen ID | 基因注释 Gene annotation | 发育时期 Development stage | 调控a Regulation a | 芯片数据(倍数) Microarray data (fold change) | RT-PCR验证结果(倍数) RT-PCR result (fold change) |
|---|---|---|---|---|---|
| AHTC1032413 | 黄酮醇合酶 | DAP30 | 上调 | 6.05 | 13.64 |
| Flavonol synthase flavanone 3-hydroxylase-like | Up | ||||
| AHTC1030930 | 锌指蛋白 | DAP30 | 下调 | -3.78 | -4.55 |
| Dof zinc finger protein | Down | ||||
| AHTC1005724 | 非特异性脂质转移酶 | DAP40 | 上调 | 4.04 | 3.25 |
| Non-specific lipid-transfer protein 3-like | Up | ||||
| AHTC1030772 | β-羟酰基-ACP脱水酶 | DAP40 | 上调 | 2.86 | 2.11 |
| Beta-hydroxyacyl-acp dehydrase 1 | Up | ||||
| AHTC1020107 | 鞘脂Δ8 去饱和酶 | DAP40 | 上调 | 2.04 | 3.48 |
| Fatty acid sphingolipid desaturase | Up | ||||
| AHTC1012845 | WRI1 转录因子 | DAP40 | 上调 | 2.15 | 2.31 |
| Ethylene-responsive transcription factor wri1-like | Up | ||||
| AHTC1030930 | 锌指蛋白 | DAP40 | 下调 | -5.30 | -10.24 |
| Dof zinc finger protein | down | ||||
| AHTC1014100 | 肌醇半乳糖醇合酶 | DAP40 | 下调 | -3.09 | -4.07 |
| Galactinol synthase 8 | Down | ||||
| AHTC1001812 | β-酮酰基-ACP还原酶 | DAP60 | 上调 | 7.89 | 5.09 |
| Beta-ketoacyl-acp reductase 1-2 | Up | ||||
| AHTC1001844 | β-酮酰基-ACP合酶 | DAP60 | 上调 | 4.49 | 4.83 |
| Beta-ketoacyl-acp synthase i-2 | Up | ||||
| AHTC1012845 | WRI1 转录因子 | DAP60 | 上调 | 5.83 | 21.21 |
| Ethylene-responsive transcription factor wri1-like | Up | ||||
| AHTC1005424 | 酰基载体蛋白硫酯酶 | DAP60 | 上调 | 2.72 | 3.47 |
| Oleoyl-acyl carrier protein thioesterase chloroplastic-like | Up | ||||
| 基因编号 Gnen ID | 基因注释 Gene annotation | 发育时期 Development stage | 调控a Regulationa | 芯片数据(倍数) Microarray data (fold change) | RT-PCR验证结果(倍数) RT-PCR result (fold change) |
| AHTC1001749 | 硬脂酰-ACP去饱和酶 | DAP60 | 上调 | 29.89 | 16.26 |
| Stearoyl-acp desaturase | Up | ||||
| AHTC1000715 | ω6 脂肪酸去饱和酶 | DAP60 | 上调 | 3.82 | 1.55 |
| Omega 6 fatty acid desaturase | Up | ||||
| AHTC1002482 | 天冬酰胺合成酶 | DAP60 | 下调 | -4.87 | -6.12 |
| Asparagine synthetase 2 | Down | ||||
| AHTC1027178 | Hsf 转录因子 | DAP60 | 下调 | -4.39 | -9.85 |
| Heat stress transcription factor a-2-like | Down |
新窗口打开|下载CSV
3 讨论
油酸是有益脂肪酸, 能够减少心脑血管的发生, 维持身体健康[19]。最近几年已有多家单位开展高油酸花生育种工作: 姜慧芳等[20]发现, 远缘杂交后脂肪酸的变异远超过亲本间的差异, 并且获得了6份油酸含量达64.0%以上且棕榈酸含量在8.5%以下的新种质; 于明洋等[21]将‘花育22’与‘开农1716’杂交并不断回交, 获得了24个油酸含量高于70%的花生新品系。然而, 高油酸代谢的分子机制研究相对较少, 尤其是不同花生品种(系)之间。本研究对‘鲁花6号’和F18不同发育时期的花生籽仁进行芯片测序, 分别在10 DAP、30、40、60发育时期筛选到130、3556、2783个差异表达的基因(10 DAP发育时期无差异表达基因)。本研究发现在发育初期(10 DAP和30 DAP)两品种(系)之间差异表达基因较少, 而在40 DAP发育时期差异表达基因数目最多, 60 DAP发育时期相对减少, 这与植物种子油脂积累呈现慢—快—慢的变化规律相一致[22]。GO注释及富集分析发现, 40 DAP和60 DAP 2个时期共有416个差异表达的基因富集到代谢进程(metabolic process)。其中相比于‘鲁花6号’, F18在脂质代谢进程中上调表达基因居多, 表明F18在花生籽仁发育后期, 脂质代谢相关基因活跃, 油脂合成加快, 这可能是造成两品种(系)间含油量差异的原因。GO富集分析发现, F18中参与光合作用的基因表达量均比‘鲁花6号’高, 这将促使F18固定更多的碳源并流向油脂合成途径。此外, F18中前体代谢和能量生成途径上的基因上调表达。这些光合作用、糖、蛋白等代谢进程的活跃将促进油脂合成和积累, 与前人研究相符[23]。
已有研究证明FAB2和FAD2在改善油料作物脂肪酸组分方面发挥了作用。与野生型相比, 转FAB2基因的烟草植株不饱和脂肪酸(尤其是油酸)含量更高[24]。FAD2是调控花生油酸、亚油酸含量和油亚比(O/L)的关键酶, AhFAD2酶活性的丧失是产生高O/L比值花生的主要原因之一[25]。本研究发现, 60 DAP花生发育时期, F18中两基因均上调表达, 但FAB2的表达量差异倍数(29.89)远高于FAD6 (3.82), 这表明F18品系花生籽仁发育后期, FAB2基因起主要作用, 因此导致F18的油酸含量高于‘鲁花6号’。这与官梅等[26]利用芯片测序的结果一致。
转录因子与基因启动子区相结合调控基因的表达, 有研究发现, 一些转录因子能够参与植物油脂代谢[27]。WRI1 (WRINKLED1)转录因子是AP2/EREBP家族的一员, Maeo等[28]发现, 超表达WRI1基因能够上调脂肪酸合成途径的一系列基因, 包括Pl-PKb1、BCCP2、ACP1、KAS1等。Fukuda等[29]的研究表明, WRI1能够与脂肪酸合成相关基因的上游序列AW-box结合, 调控乙酰辅酶A羧化酶基因的表达, 进而调控油脂代谢。本研究在花生籽仁发育的后期筛选到了WRI1转录因子, 其在F18中的表达量比在‘鲁花6号’高3.99倍, 但是本文中筛选到的与油脂合成相关的差异表达基因是否受到该转录因子的调控有待进一步研究。
以上数据表明, 花生籽仁油脂的合成是一个复杂的过程, 受许多基因和转录因子的共同调控。研究结果可为花生籽仁油脂合成机理研究提供理论基础, 为花生品质育种提供新的基因资源, 但是相关基因复杂的调控网络及功能有待进一步验证。
4 结论
分别在30、40、60 DAP时期检测到130、3556、2783个差异表达的基因。GO注释、KEGG富集和代谢通路图表明, 差异表达的基因主要参与脂肪酸合成和光合等代谢进程, 其中硬脂酰-ACP去饱和酶(FAB2)、微粒体Δ12去饱和酶(FAD2)、WRI1转录因子主要参与油酸的积累。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1186/1471-2229-11-168URL [本文引用: 1]
URLPMID:12136953 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
