 ,1,2, 辛正琦1,2, 何潇1,2, 代欢欢1,2, 吴能表
,1,2, 辛正琦1,2, 何潇1,2, 代欢欢1,2, 吴能表 ,1,2,*
,1,2,*Mechanism exploration on alkaloids accumulation and TAs metabolic pathways regulation in Atropa belladonna L. treated with exogenous methyl jasmonate under UV-B stress
SHAN Yu-Si ,1,2, XIN Zheng-Qi1,2, HE Xiao1,2, DAI Huan-Huan1,2, WU Neng-Biao
,1,2, XIN Zheng-Qi1,2, HE Xiao1,2, DAI Huan-Huan1,2, WU Neng-Biao ,1,2,*
,1,2,*通讯作者:
收稿日期:2020-02-28接受日期:2020-06-2网络出版日期:2020-07-28
| 基金资助: |
Received:2020-02-28Accepted:2020-06-2Online:2020-07-28
| Fund supported: |

摘要
关键词:
Abstract
Keywords:
PDF (482KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
山雨思, 辛正琦, 何潇, 代欢欢, 吴能表. 外源茉莉酸甲酯对UV-B胁迫下颠茄生物碱积累及TAs代谢途径调控的机制探究[J]. 作物学报, 2020, 46(12): 1894-1904. doi:10.3724/SP.J.1006.2020.04050
SHAN Yu-Si, XIN Zheng-Qi, HE Xiao, DAI Huan-Huan, WU Neng-Biao.
颠茄(Atropa belladonna L.)又称“野山茄”、“颠茄草”, 是茄科颠茄属的多年生草本植物, 全草可入药, 因含有莨菪碱和东莨菪碱而成为托品烷类生物碱(tropane alkaloids, TAs)药源植物[1]。莨菪碱和东莨菪碱是一类重要的抗胆碱药物, 在临床上广泛用于麻醉、镇痛、抗晕动病、控制帕金森病的僵直和震颤等[2,3]。但颠茄中的TAs含量极低, 且市场需求量巨大。因此研究如何提高颠茄TAs的含量具有十分重要的医药应用价值。
近年来, 由于氟氯烃等化合物排放的增加, 导致地球臭氧层变薄甚至出现空洞, 过量的UV-B辐射到达地表, 对生物尤其是以光为能源的植物造成很大影响[4]。研究表明, 臭氧量每减少1%, 地球表面的UV-B辐射强度就将增加2%, 因此, 研究UV-B辐射胁迫对植物生长的影响具有极其重要的意义[5]。UV-B作为一种环境胁迫不仅导致植物DNA损伤、细胞死亡及生长受抑制, 同时会影响植物次生代谢产物的合成[6]。卢克欢等[4]研究发现, 中、高强度UV-B辐射显著降低颠茄叶片和茎中莨菪碱和东莨菪碱的含量, 不利于颠茄TAs的积累。
茉莉酸甲酯(MeJA)是一种芳香类的挥发性化合物, 最早发现于茉莉属素馨花中, 作为一种重要的细胞调节剂, 参与植株发育的不同过程, 对植物生长发育具有重要的调节作用[7], 在植物次生代谢产物的生成和基因表达中也发挥着重要的作用[8]。杨怡等[9]研究发现, 适宜浓度的MeJA可通过提高颠茄叶片和根部相关基因的表达量, 促进莨菪碱和东莨菪碱的合成, 提高颠茄TAs的含量。此外, MeJA作为一种信号分子, 广泛参与植物在生物与非生物胁迫中的抗逆反应, 如病虫害、UV-B、干旱、高温等胁迫[10]。植物在逆境胁迫条件下, 内源茉莉酸及茉莉酸甲酯含量增加, 激活自身防御系统, 诱导相关防御基因的表达, 合成防御物质, 增强植物的抗逆性[11]。Fedina等[12]通过对早熟禾的研究发现, 外源施加茉莉酸甲酯能提高早熟禾的抗氧化酶活性, 以缓解UV-B辐射的伤害。郭玉梅[13]研究发现, 外源添加适宜浓度的茉莉酸甲酯能通过提高铁皮石斛苗的光合色素含量、保护酶活性和主要活性成分含量, 缓解UV-B辐射的伤害。目前已有许多关于MeJA在提高植物对逆境适应性以及次生代谢调控方面的研究, 但关于外源MeJA缓解UV-B胁迫对植物伤害的研究仍然屈指可数。
本试验以颠茄实生苗为材料, 分析UV-B胁迫下不同浓度外源MeJA不同处理时间对颠茄TAs含量的变化规律, 探究外源MeJA对UV-B胁迫下颠茄次生代谢上游产物、信号分子以及关键酶基因表达量的影响, 初步探讨外源MeJA对UV-B胁迫下颠茄次生代谢的调控机制, 以期为实际生产中解决颠茄批量栽培中可能遇到的UV-B胁迫问题提供一定的理论依据, 同时对于提高颠茄托品烷类生物碱含量也具有一定的指导意义。
1 材料与方法
1.1 试验设计
颠茄种子购自湖南永州, 经西南大学生命科学学院吴能表教授鉴定为颠茄(Atropa belladonna L.)。挑选颗粒饱满的颠茄种子浸泡于50 mg L-1的赤霉素溶液中, 2 d后取出, 然后用蒸馏水反复漂洗干净, 置于湿润滤纸上于25℃温室内萌发。待萌发后移栽至盛有混匀介质(泥炭土:珍珠岩:蛭石 = 3:1:1)的营养盆(12 cm × 13 cm)中, 每盆3株, 共300盆。幼苗生长条件的室内昼/夜温度为25℃/20℃, 光强为62.5 μmol m-2 s-1, 光照时间为12 h d-1, 相对湿度为60%~70%。每7 d浇灌1次稀释10倍的MS营养液, 2个月后, 挑选200盆长势一致的颠茄幼苗, 开始试验处理。参照苏贝贝[14]的研究并结合预试验结果最终确定UV-B胁迫所用的辐射强度为10 μW cm-2, 设50 (T1)、150 (T2)、250 (T3)和350 (T4) μmol L-1 4个MeJA溶液浓度梯度, 每天采用相同强度的UV-B照射1 h, 同时叶片喷施1次对应浓度的MeJA溶液至欲滴。分别在第4、8、12和16 d时采集颠茄叶片作为待测样品, 存放于-80℃冰箱进行低温保存, 用于各项指标的测定。采集颠茄根、叶组织材料, 一部分冻存于液氮中, 用于基因表达量的测定; 另一部分于60℃烘箱中烘干至恒重, 用于生物碱含量的测定。每处理组设置3次重复。
1.2 测定项目
1.2.1 托品烷类生物碱的提取与含量测定 参照Zárate等[15]方法提取的样品液用0.22 μm滤膜过滤, -4℃保存备用。采用HPLC测定莨菪碱、东莨菪碱含量。色谱仪为日本岛津(Shimadzu) LC-60A高效液相色谱仪(泵: LC-20AD, 控制器: SPD-20A, 柱温箱: CTO-10AS vp); 色谱柱为Xtimate XB-C18液相色谱柱(5 μm, 4.6 mm × 250.0 mm); 流动相为甲醇:醋酸缓冲液(20 mmol L-1醋酸铵, 0.1%甲酸, pH 4.0) = 1:4; 检测波长226 nm; 流速1.0 mL min-1; 柱温40℃; 进样量10 μL。1.2.2 鸟氨酸和精氨酸含量的测定 参照黄爱清等[16]的方法测定鸟氨酸含量, 参照胡桂娟等[17]的方法测定精氨酸含量。
1.2.3 鸟氨酸脱羧酶(ornithine decarboxylase, ODC)和精氨酸脱羧酶(arginine decarboxylase, ADC)活性的测定 参照赵福庚等[18]的方法, 使用紫外分光光度计(日本岛津 UV-2250)测定ODC和ADC的活性。以每克组织在每毫升反应体系中每小时使254 nm下的吸光度变化1为1个酶活力单位(U)。
1.2.4 多胺提取与含量的测定 参照康朵兰[19]的方法提取并甲酰化叶片中的游离多胺, 样品液用200 μL甲醇溶解, 过0.45 μm滤膜待测。采用HPLC测定多胺的含量。色谱仪为日本岛津(Shimadzu) LC-60A高效液相色谱仪(泵: LC-20AD, 控制器: SPD-20A, 柱温箱: CTO-10AS vp); 色谱柱为Xtimate XB-C18液相色谱柱(5 μm, 4.6 mm × 250.0 mm); 流动相为甲醇:水=64:36; 检测波长230 nm; 流速0.7 mL min-1; 柱温30℃; 进样量10 μL。
1.2.5 一氧化氮含量的测定 采用总一氧化氮检测试剂盒(S0023) (碧云天), 通过酶标仪(Infinite F50)测定一氧化氮(NO)含量。
1.2.6 TAs合成途径中关键酶基因表达量的检测
按照Biospin多糖多酚植物总RNA提取试剂盒使用说明提取总RNA。按照PrimeScript RT reagent Kit with gDNA Eraser (Perfect Real-time)说明书反转录颠茄根、叶RNA, 合成用于荧光定量所需的cDNA模板。参照NCBI上公布的序列及强玮等[20,21]的引物序列设计PGK、PMT、TRI和H6H基因引物, 参照Qiu等[22]的引物序列设计PPAR基因引物, 由英潍捷基(上海)贸易有限公司合成引物(表1)。以反转录得到的cDNA为模板, 使用Hieff qPCR SYBR Green Master Mix (High Rox Plus)试剂盒进行荧光定量PCR。以PGK为内参基因, 内参和样本基因分别设3个重复和1个阴性对照, 均以内参基因作为标准进行相对定量, 采用2-ΔΔCt法计算各基因的相对表达量。
Table 1
表1
表1荧光定量PCR所需引物
Table 1
| 基因 Gene | 上游引物 Forward primer (5′-3′) | 下游引物 Reverse primer (5′-3′) |
|---|---|---|
| PGK | TCGCTCTTGGAGAAGGTTGAC | CTTGTCCGCAATCACTACATCAG |
| PMT | CCTACTTACCCTACTGGTGTTATC | GCGAAAGATGGCAAAATAAAAGC |
| TR I | TTCTTTGCTTCCCTGCTGCTTC | CAGGCCAACCTTAGTATCACACAG |
| PPAR | GATTGGAGTTGTTGGATTGG | CCTTGAAGTGTAAGAGATGGA |
| H6H | TTCCACTTGAGCAGAAAGCAAAGC | CCTCATGGTCAACTTCCTCACTTCC |
新窗口打开|下载CSV
1.3 数据处理
采用Microsoft Excel 2010和SPSS 22.0统计与分析数据, 结果均以平均值±标准差($\bar{x}$± s)表示, 采用方差检验进行组间比较, 差异显著性水平为0.05; 采用OriginPro 8.0作图。2 结果与分析
2.1 外源茉莉酸甲酯对UV-B胁迫下颠茄叶片TAs含量的影响
由表2可知, 在UV-B胁迫处理下, CK2组的莨菪碱含量较CK1组在第4天时有一定程度的提高, 而在处理至第8、12、16 d, 其莨菪碱含量随UV-B处理时间的延长而持续降低, 处理至16 d时, 其含量较CK1组降低了39.68%; 而东莨菪碱含量在各个处理时期均显著下降。说明短期(4 d) UV-B胁迫可以促进颠茄莨菪碱的积累, 但中长期(8 d、12 d、16 d) UV-B胁迫显著抑制了颠茄托品烷类生物碱的积累。外施不同浓度MeJA处理后, 在相同处理时间下, 莨菪碱与东莨菪碱的含量变化趋势一致, 较CK2组均有所提高, 且二者含量均随着MeJA浓度的升高呈先上升后下降的趋势, 其中以T3组的处理效果最好, 总生物碱含量显著高于其他处理组, 处理至16 d时, T3组的莨菪碱与东莨菪碱含量较CK2组分别显著提高了30.37%和52.60%。表明外源MeJA对UV-B胁迫下东莨菪碱含量的影响更大, 250 μmol L-1的MeJA可有效促进UV-B胁迫下颠茄莨菪碱向东莨菪碱的转化。总体而言, UV-B胁迫不利于颠茄莨菪碱与东莨菪碱的积累, 而外源施加MeJA可以有效缓解UV-B胁迫对TAs积累的抑制, 以250 μmol L-1的MeJA处理效果最好。Table 2
表2
表2不同浓度外源MeJA对UV-B胁迫下颠茄叶片莨菪碱和东莨菪碱含量的影响
Table 2
| 指标 Indicator | 处理组 Treatment group | 处理时间Treatment time | |||
|---|---|---|---|---|---|
| 4 d | 8 d | 12 d | 16 d | ||
| 莨菪碱 Hyoscyamine | CK1 | 477.988±30.032 d | 464.993±39.364 a | 510.286±29.327 a | 489.386±33.957 a |
| CK2 | 514.323±36.595 c | 403.706±14.900 c | 350.179±35.316 d | 295.220±30.438 d | |
| T1 | 527.659±38.739 bc | 423.530±36.157 bc | 375.603±19.982 c | 312.172±19.933 cd | |
| T2 | 542.565±35.559 bc | 468.808±27.539 a | 392.611±37.487 bc | 361.054±22.242 bc | |
| T3 | 581.520±17.200 a | 447.993±24.571 b | 425.491±47.568 b | 384.890±44.869 b | |
| T4 | 564.200±33.989 ab | 430.305±15.919 bc | 369.667±40.042 c | 332.059±26.077 c | |
| 东莨菪碱 Scopolamine | CK1 | 267.673±24.260 a | 261.248±22.428 a | 294.230±42.998 a | 282.621±28.477 a |
| CK2 | 221.892±20.219 c | 198.795±34.491 c | 174.729±14.562 d | 121.804±15.205 d | |
| T1 | 243.889±28.790 ab | 217.900±17.821 bc | 193.653±21.253 cd | 130.244±24.996 cd | |
| T2 | 237.625±28.217 ab | 236.775±13.461 ab | 221.873±19.211 b | 150.869±26.035 c | |
| T3 | 248.261±20.375 ab | 234.134±26.418 b | 229.996±29.857 b | 185.867±23.527 b | |
| T4 | 225.705±14.739 bc | 220.173±26.487 bc | 208.852±24.722 bc | 164.412±30.129 c | |
新窗口打开|下载CSV
2.2 外源茉莉酸甲酯对UV-B胁迫下颠茄叶片鸟氨酸和精氨酸含量的影响
图1为测定处理16 d时颠茄各处理组中鸟氨酸和精氨酸的含量。UV-B胁迫下, 颠茄叶片鸟氨酸和精氨酸含量均显著下降, 分别较CK1组降低了53.46%和67.55%。经不同浓度的MeJA处理后, 二者含量变化趋势相似, 均随着MeJA浓度的升高呈先升高后降低的趋势。当MeJA浓度为250 μmol L-1时处理效果最好, 与CK2组相比, 二者含量均达到最大值, 分别是CK2组的1.53倍和1.69倍(图1)。表明适宜浓度的MeJA可有效缓解UV-B胁迫对颠茄叶片中鸟氨酸和精氨酸含量的抑制作用。图1
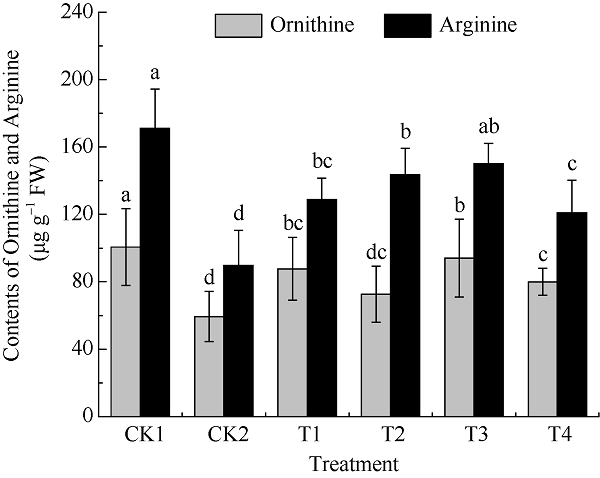 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1不同浓度外源MeJA对UV-B胁迫下颠茄叶片鸟氨酸和精氨酸含量的影响
标以不同小写字母表示不同处理组间差异显著(P < 0.05)。处理同
Fig. 1Effects on the contents of Ornithine and Arginine under exogenous methyl jasmonate with different concentrations in A. belladonna leaves under UV-B stress
Bars superscripted by different lowercase letters show significant differences among different treatment groups at P < 0.05. Treatments are the same as those given in
2.3 外源茉莉酸甲酯对UV-B胁迫下颠茄叶片ODC和ADC酶活性的影响
鸟氨酸脱羧酶(ODC)和精氨酸脱羧酶(ADC)分别催化鸟氨酸和精氨酸生成TAs合成途径中的前体物质腐胺, 这2种酶的活性影响腐胺的积累。为明确UV-B胁迫下茉莉酸甲酯对颠茄TAs前体物腐胺的影响机制, 本研究检测了处理16 d时颠茄叶片ODC和ADC酶活性。由图2可知, UV-B胁迫处理显著降低了ODC与ADC酶活性, 分别为CK1组的34.53%、33.32%。添加外源MeJA处理后, 2种酶活性均有一定程度的提高, 且ODC和ADC 2种酶在同一处理下有相似的活性, 在T3处理组下2种酶活性最高, 分别较CK2组显著提高了43.97%、36.77%。T2处理组下ADC酶活性也维持在较高水平, 且与T3处理组之间无显著性差异, 与CK2组相比显著提高了28.67%。说明适宜浓度的MeJA处理可提高UV-B胁迫下颠茄叶片中ODC和ADC酶活性, 其活性的增强有助于颠茄催化合成更多腐胺, 为TAs的生物合成提供充足的前体物质。图2
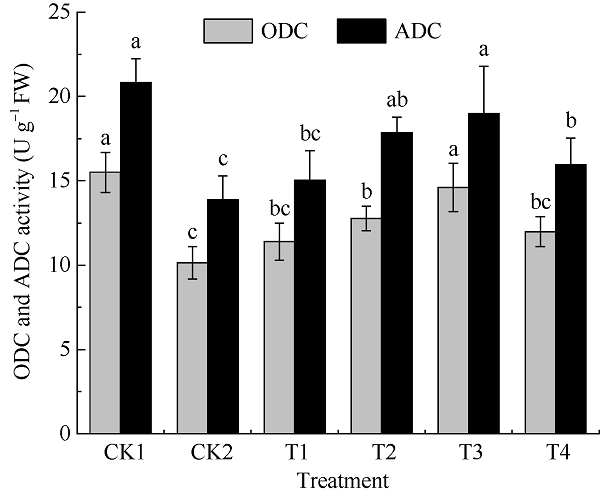 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同浓度外源MeJA对UV-B胁迫下颠茄叶片ODC和ADC酶活性的影响
标以不同小写字母表示不同处理组间差异显著(P < 0.05)。处理同
Fig. 2Effects on ODC and ADC activities under exogenous methyl jasmonate with different concentrations in A. belladonna leaves under UV-B stress
Bars superscripted by different lowercase letters show significant differences among different treatment groups at P < 0.05. Treatments are the same as those given in
2.4 外源茉莉酸甲酯对UV-B胁迫下颠茄叶片多胺合成的影响
多胺(PAs)是一类具有2个或多个氨基的低分子量有机化合物, 在植物体内主要有腐胺(Put)、亚精胺(Spd)和精胺(Spm) 3种类型, 大多数以游离态的形式存在, 且三者之间可进行可逆性的多胺代谢[23], 其中Put是直接进入到颠茄TAs合成的前体物质。图3为检测处理16 d时颠茄叶片中Put、Spd和Spm的含量。UV-B胁迫下, CK2组的Put和Spd含量较CK1组显著降低, 而Spm含量较CK1组无显著性差异。添加不同浓度MeJA处理后, Put含量与Spd含量的变化一致, Put含量较高时, Spd含量也相应地较高, 并且二者含量均随MeJA浓度的升高先升高后降低, 以T2处理下二者含量最高, 分别为CK2组的1.55倍、2.81倍。Spm含量的变化趋势与Put、Spd含量变化不一致, 与CK2组相比, Spm含量在T3处理组下最高, 在其他处理组(T1、T2、T4)下均无显著性变化。总体而言, 外源MeJA处理后, 三者含量在T1组和T4组中均无显著变化, Put和Spd含量在T2组中均达到最大, T3组的Spm含量最高, 同时Put和Spd含量也维持在较高的水平(图3-A)。UV-B胁迫下多胺总量显著降低, 仅为CK1的58.48%, 添加不同浓度的外源MeJA后, 多胺总量均有一定程度的提高, 其中以T2处理组的提高幅度最大, T3处理组次之, 但两组之间多胺总量无显著性差异, 分别为CK2的1.66倍和1.47倍(图3-B)。Put向Spd和Spm转化有利于提高植物的抗逆能力, 因此, (Spm+Spd)/Put比值可作为检测植物耐逆性的一个参考指标[24]。T3组的(Spm+Spd)/Put比值显著升高, 其他处理组均无明显差异, 说明长期UV-B胁迫下, 250 μmol L-1的MeJA处理可显著提高 (Spm+Spd)/Put比值(图3-C)。图3
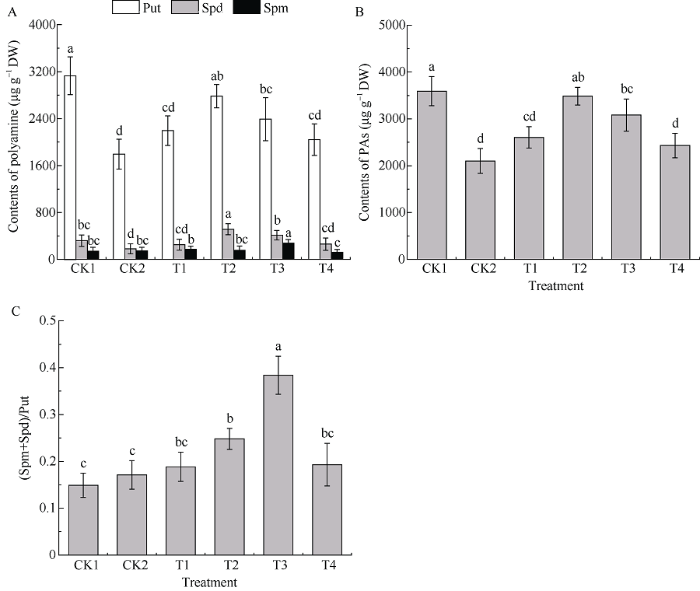 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同浓度外源MeJA对UV-B胁迫下颠茄叶片多胺含量(A), 多胺总量(B)和(Spm+Spd)/Put比值(C)的影响
标以不同小写字母表示不同处理组间差异显著(P < 0.05)。处理同
Fig. 3Effects on Polyamine contents (A), PAs contents (B) and (Spm+Spd)/Put (C) under exogenous methyl jasmonate with different concentrations in A. belladonna leaves under UV-B stress
Bars superscripted by different lowercase letters show significant differences among different treatment groups at P < 0.05. Treatments are the same as those given in
以上结果表明, 长期UV-B胁迫下, 颠茄叶片中多胺的积累被显著抑制, 适宜浓度的MeJA可有效缓解UV-B胁迫对多胺含量的抑制作用, 增强UV-B胁迫下颠茄的抗逆性, 同时为TAs的合成提供充足的物质供应。
2.5 外源茉莉酸甲酯对UV-B胁迫下信号分子NO浓度的影响
一氧化氮(NO)是一种重要的信号分子, 能够直接作用于细胞靶蛋白和基因, 从而调控植物体内各种生理过程, 包括次生代谢产物的合成[25]。为明确茉莉酸甲酯是否通过信号分子NO调控UV-B胁迫下颠茄叶片TAs的合成, 本试验测定了处理16 d时颠茄叶片中NO的浓度, 从信号分子途径探索MeJA对UV-B胁迫下颠茄TAs合成的调控机制。由图4可知, UV-B胁迫显著降低了颠茄叶片中NO的浓度, CK2组的NO浓度相比CK1组降低了39.3%。外源MeJA处理后, 各处理组的NO浓度较CK2组均有一定程度的升高, 其中T3处理组的NO浓度升高幅度最大, 为CK2组的1.57倍, 除T3处理组有较大幅度的升高之外, 其他处理组对NO升高的作用不明显, 各处理组间无显著性差异。表明适宜浓度的外源MeJA处理能缓解UV-B胁迫造成的颠茄叶片NO浓度的降低, 刺激NO的迸发, 其中MeJA浓度为250 μmol L-1时效果最显著。图4
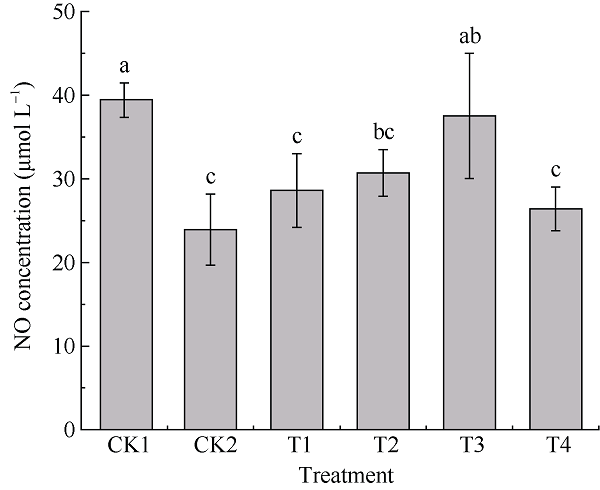 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4不同浓度外源MeJA对UV-B胁迫下颠茄叶片NO浓度的影响
标以不同小写字母表示不同处理组间差异显著(P < 0.05)。处理同
Fig. 4Effects on NO concentration under exogenous methyl jasmonate with different concentrations in A. belladonna leaves under UV-B stress
Bars superscripted by different lowercase letters show significant differences among different treatment groups at P < 0.05. Treatments are the same as those given in
2.6 外源茉莉酸甲酯对UV-B胁迫下颠茄叶片TAs生物合成途径关键酶基因表达量的影响
N-甲基-腐胺转移酶(putrescine n-methyltransferase, PMT)、托品酮还原酶 I (tropinone reductase I, TR I)、苯丙酮酸还原酶(phenylpyruvate reductase, PPAR)和莨菪碱-6-β-羟化酶(hyoscyamine 6β-hydroxylase, H6H)是目前从茄科植物中已鉴定的TAs合成途径中的4个关键酶, 其相应编码基因的表达量直接决定合成途径的中间产物流向以及生物碱的产量[26]。以PGK为内参基因, 采用qRT-PCR分别检测了外源MeJA对UV-B胁迫下处理16 d时颠茄叶片和根部PMT和TR I、PPAR和H6H基因相对表达量。由于PMT、H6H具有组织表达特异性[27], PPAR在须根的中柱鞘和内皮层特异表达[22], 因此颠茄中PMT、PPAR和H6H基因在根中特异性表达, 在叶片中几乎不表达。本试验也未在叶片中检测到这3种基因的表达。UV-B胁迫16 d时, CK2组中TR I的相对表达量较CK1组有所升高, 但没有差异性。在外源MeJA处理后, 除T4处理组有轻微提高外, 其他处理组中TR I的相对表达量较CK2组均显著性升高(图5-A)。相较于叶片, 根部TR I的表达量在UV-B胁迫下较CK1组同样有所增加, 但不显著。在外源MeJA处理后, TR I的表达水平随MeJA浓度的增加先升高后降低, 以T3处理组最高。对于PMT、PPAR和H6H这3个基因, CK2组和CK1组对比发现, UV-B胁迫下, PMT、H6H的表达量均显著降低, PPAR的表达量有轻微下降。用外源MeJA处理后, PPAR、H6H的表达量均有一定程度的提高, 其中在250 μmol L-1处理下这2个基因具有最高表达水平。而添加外源MeJA之后, 对PMT的表达量变化影响不显著(图5-B)。表明UV-B胁迫显著抑制了颠茄根中PMT、H6H基因的表达水平, 而外源添加MeJA处理后, 颠茄叶片和根部TR I、PPAR和H6H基因都有较高的表达水平, 其中以250 μmol L-1时效果最好, 可以有效缓解UV-B胁迫对PPAR、H6H表达的抑制作用, 这也符合该处理下莨菪碱和东莨菪碱含量都较高的情况。
图5
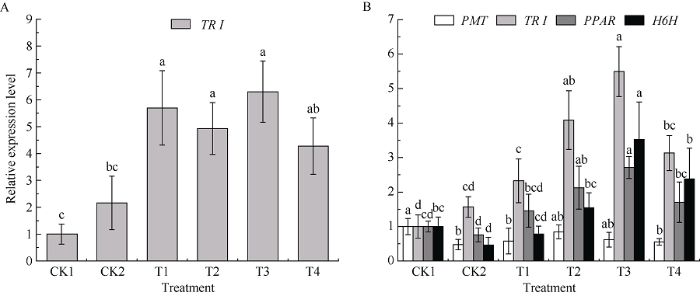 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5不同浓度外源MeJA对UV-B胁迫下颠茄叶片(A)、根(B)中PMT、TR I、PPAR、H6H基因表达量的影响
标以不同小写字母表示不同处理组间差异显著(P < 0.05)。处理同
Fig. 5Effects on relative gene expression level of PMT, TR I, PPAR, H6H under exogenous methyl jasmonate with different concentrations in A. belladonna leaves (A) and roots (B) under UV-B stress
Bars superscripted by different lowercase letters show significant differences among different treatment groups at P < 0.05. Treatments are the same as those given in
3 讨论
增强UV-B辐射能够诱导植物体内紫外吸收物含量的增加[28]。在本试验中, 短期UV-B胁迫刺激颠茄叶片莨菪碱的积累, 但中长期的UV-B胁迫则显著降低莨菪碱和东莨菪碱的含量, 这与卢克欢等[4]的研究结果相似。推测颠茄中的莨菪碱和东莨菪碱不是吸收紫外的物质, UV-B胁迫不利于颠茄TAs的合成。MeJA作为外源诱导子对植物次生代谢途径及其代谢产物的合成具有重要调控作用。段永波等[29]研究发现, 外源诱导子茉莉酸甲酯处理能显著提高半夏悬浮细胞中生物碱含量和生物碱合成相关酶的活性。张翠平[30]研究发现, 适宜浓度的茉莉酸甲酯能提高颠茄托品烷类生物碱含量和TAs合成途径关键酶基因表达, 促进其次生代谢途径。本试验也得到类似的结果, 外源施加适宜浓度MeJA处理后, 颠茄莨菪碱和东莨菪碱含量均有显著提高, 表明外源MeJA可有效缓解UV-B胁迫对颠茄TAs积累的抑制, 推测外源MeJA通过调控UV-B胁迫下颠茄体内TAs代谢途径来提高TAs的合成。腐胺是TAs合成的前体物质, 植物体内主要通过2种途径合成腐胺: (1)鸟氨酸在鸟氨酸脱羧酶的催化作用下直接催化脱羧形成腐胺; (2)精氨酸在精氨酸脱羧酶的催化作用下生成精胺, 然后经过一系列酶促反应生成腐胺[31]。本试验结果显示, UV-B胁迫下, 鸟氨酸和精氨酸含量较CK1组均显著降低, 外施250 μmol L-1 MeJA后, 二者含量均有显著提高, 从而为腐胺的合成提供更多底物, 且较鸟氨酸, 对提高精氨酸含量的作用更大, 推测精氨酸在颠茄腐胺合成中占主导地位, 这与郭双[32]提出的精氨酸含量与颠茄TAs的产量有显著正相关关系的结论一致。非生物胁迫可能抑制颠茄ADC基因的表达, 而促进ODC基因表达, 进而使腐胺含量增加[33]。本试验研究发现, 腐胺合成关键酶ODC和ADC活性在UV-B胁迫下均显著降低, 说明UV-B胁迫抑制了这2种关键酶的活性, 不利于腐胺含量的积累。而外源喷施MeJA后, 其活性均有一定程度的提高。ADC活性水平同样高于ODC活性, 植物体内Put的合成主要依赖于ADC途径[34], 结合本试验结果推测, MeJA主要通过促进ADC途径来提高UV-B胁迫下腐胺的合成, 为TAs合成提供更多的底物。
腐胺合成后可沿2个方向转化, 一是可逆形成亚精胺, 亚精胺又可逆形成精胺; 二是经PMT催化形成N-甲基-腐胺, 进入到合成TAs的方向。UV-B辐射下分解多胺的多胺氧化酶活性增加[35], 本试验结果显示, UV-B胁迫显著降低了多胺含量, 推测UV-B胁迫导致颠茄多胺降低可能是由于UV-B诱导的酶促降解或合成减少。外源MeJA处理后, 可有效缓解UV-B胁迫对颠茄叶片中多胺积累的抑制作用, 150 μmol L-1 MeJA处理下, 颠茄体内的Put含量最高, 而250 μmol L-1 MeJA处理下, Spm含量最高, 同时Spd、Put也都保持在较高的水平, 结合前面各处理组腐胺合成关键酶活性的情况来看, T3处理组下ODC、ADC活性最高, 推测T3组腐胺含量低于T2组可能是由于该处理下TAs含量较高, 生成的腐胺迅速进入次生代谢用于TAs的合成, 因此腐胺的积累较少, 表明适宜浓度的MeJA可促进腐胺更多的向合成TAs的方向进行。Spd和Spm在植物应对胁迫时具有更为有效地保护作用, (Spm+Spd)/Put比值升高是植物提高耐逆性的一个重要机制[23], 本试验中, T3处理组的(Spm+Spd)/Put比值显著性升高, 其他处理组均无显著性变化。说明250 μmol L-1 MeJA能增强UV-B胁迫下颠茄的耐逆性, 抵御UV-B胁迫, 同时促进更多的前体物腐胺流向TAs合成。
NO是一种细胞内信号分子, 在植物体内广泛存在。其在逆境胁迫诱导植物次生代谢产物的过程中扮演着重要角色。在植物体内, NO的来源除了有一氧化氮合酶(NOS)途径外, 硝酸还原酶(NR/NiR)也是主要的途径之一。NR可以在NADPH提供电子的情况下, 催化NO2-生成NO[36], 本研究发现, UV-B胁迫显著抑制了颠茄叶片中NO的浓度。卢克欢等[37]研究发现, UV-B胁迫能够显著降低颠茄NR活性, 因此猜测可能是NR活性影响了细胞内NO浓度, UV-B胁迫导致NR活性显著降低, 使得颠茄叶片NO浓度也降低。外源MeJA处理后, NO浓度有一定的提高, 且以MeJA浓度为250 μmol L-1处理下最高。对应TAs含量的情况发现, 该浓度处理下颠茄TAs含量也达到最高, 说明UV-B胁迫下, 外源MeJA处理刺激了颠茄叶片中NO的迸发, 猜测增加的NO有利于颠茄TAs含量的提升。黑曲霉细胞壁诱导子可以同时诱发金丝桃细胞的NO迸发、JA合成和金丝桃素的积累, 并且诱导子对JA合成的促进作用可以被NO专一性淬灭剂阻断, 而NO对金丝桃素的促进作用也可以被JA合成抑制剂IBU和NDGA阻断, NO作用于JA的上游并对JA 信号途径起调控作用[38,39]。Put和NO有共同的合成前体, 在影响植物次生代谢产物合成的过程中存在着交互作用, NO可以刺激细胞中多胺的合成[40]。结合多胺含量的情况, T3处理组下Put含量也达到较高的水平。因此猜测NO信号分子可能参与颠茄叶片中TAs的合成, NO含量的增加刺激多胺的快速合成, 使更多的Put快速进入TAs合成途径中。NO可能作用于MeJA信号途径的上游, 参与UV-B胁迫下MeJA对颠茄TAs合成的调控, 但关于两者在调控逆境下颠茄次生代谢方面具体的信号转导机制还有待进一步的研究。
本试验中, UV-B胁迫显著抑制了PMT、H6H在根部的表达量, PPAR的表达量仅轻微下降, 添加外源MeJA后, 各处理组PPAR和H6H在根部的表达量都随MeJA浓度的升高而先升高后降低, 其中在MeJA浓度为250 μmol L-1下PPAR和H6H基因表达量均达到最高。同时, 这2个基因的表达量与该浓度处理时间条件下莨菪碱和东莨菪碱含量的变化基本一致, 说明PPAR促进苯丙酮酸还原酶催化苯丙酮酸转化为苯乳酸, 苯乳酸进入TAs生物合成途径中参与莨菪碱的合成[22]; H6H表达量升高, 促进莨菪碱生成东莨菪碱。PMT的表达量虽有上升, 但各处理组之间无显著性差异, 表明UV-B胁迫下MeJA处理对颠茄中PMT在根部的表达量影响不大。对于TR I来说, 它在颠茄叶片和根部都能表达, 且表达情况基本相同。在UV-B胁迫下, TR I在叶片和根部的表达量均有一定程度的提高, 但不显著, 外源MeJA处理后, 各处理组中TR I的表达量有更进一步的提高, 卢克欢等[37]的研究也发现, UV-B胁迫下颠茄TR I在叶片和根部的表达量都有轻微地提高, 而外源Ca2+处理下TR I有更高表达, 本试验与其研究结果相似, 推测可能是UV-B胁迫诱导TAs代谢途径中的上游某一产物或某些产物的增加或积累, 导致TR I表达量增加; 也可能是TR I下游的表达产物对抵御紫外有作用, 是吸收紫外的物质, 所以促进下游产物的合成; MeJA处理使TR I有更高的表达量, TR I表达量的增加能够促进代谢更多的向莨菪碱和东莨菪碱方向进行。表明外源MeJA处理有助于缓解UV-B胁迫对H6H、PPAR表达的抑制作用, 提高TR I的表达量, 因此推测MeJA对UV-B胁迫下颠茄的TAs含量的提升主要依靠TR I、PPAR和H6H基因表达量的提高。
4 结论
UV-B胁迫显著抑制了颠茄TAs的积累, 影响莨菪碱向东莨菪碱的转化, 适宜浓度的MeJA处理有助于缓解UV-B胁迫对颠茄TAs的抑制作用, 提高TAs的含量, 促进莨菪碱向东莨菪碱的转化, 且MeJA浓度为250 μmol L-1时效果最佳。而外源MeJA对UV-B胁迫下颠茄TAs代谢的调控, 则主要是通过提高TAs合成途径的前体物质和刺激关键酶基因TR I、PPAR和H6H的高效表达起作用。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1146/annurev.arplant.52.1.29URLPMID:11337391 [本文引用: 1]

Recent advances in the cell, developmental, and molecular biology of alkaloid biosynthesis have heightened our appreciation for the complexity and importance of plant secondary pathways. Several biosynthetic genes involved in the formation of tropane, benzylisoquinoline, and terpenoid indole alkaloids have now been isolated. The early events of signal perception, the pathways of signal transduction, and the function of gene promoters have been studied in relation to the regulation of alkaloid metabolism. Enzymes involved in alkaloid biosynthesis are associated with diverse subcellular compartments including the cytosol, vacuole, tonoplast membrane, endoplasmic reticulum, chloroplast stroma, thylakoid membranes, and perhaps unique
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s12298-018-0529-0URLPMID:29692543 [本文引用: 1]

The phytohomorne methyl jasmonate (MeJA) is known to trigger extensive reprogramming of gene expression leading to transcriptional activation of many secondary metabolic pathways. However, natural rubber is a commercially important secondary metabolite and little is known about the genetic and genomic basis of jasmonate-elicited rubber biosynthesis in rubber tree (Hevea brasiliensis). RNA sequencing (RNA-seq) of H. brasiliensis bark treated with 1 g lanolin paste containing 0.02% w/w MeJA for 24 h (M2) and 0.04% w/w MeJA for 24 h (M4) was performed. A total of 2950 and 2850 differentially expressed genes in M2 and M4 compared with control (C) were respectively detected. Key genes involved in 2-C-methyl-D-erythritol 4-phosphate, rubber biosynthesis, glycolysis and carbon fixation (Calvin cycle) pathway were found to be up-regulated by MeJA treatment. Particularly, the expression of 3-hydroxy-3-metylglutaryl coenzyme A reductase in MVA pathway was down-regulated by MeJA treatment, but the expression of farnesyl diphosphate synthase (FPS) and cis-prenyltransferase (CPT, or rubber transferase) in rubber biosynthesis pathway were up-regulated by MeJA treatment. Up-regulation of critical genes in JA biosynthesis in response to MeJA treatment exhibited the self-activation of JA biosynthesis. In addition, up-regulated genes of great regulatory importance in cross-talk between JA and other hormone signaling, and of transcriptional regulation were identified. The increased expression levels of FPS and CPT in rubber biosynthesis pathway possibly resulted in an increased latex production in rubber tree treated with MeJA. The present results provide insights into the mechanism by which MeJA activates the rubber biosynthesis and the transcriptome data can also serve as the foundation for future research into the molecular basis for MeJA regulation of other cellular processes.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]

茉莉酸类物质(JAs)是一类新确认的植物内源生长物质。本文从它的合成途径,对植物生长发育、抗旱、抗盐及抗病虫能力的影响等方面对其生理功能进行了简要阐述,同时介绍了JAs与气孔运动、植物代谢及其它激素ABA,SA,乙烯之间的关系。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/jac.2009.195.issue-3URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1023/B:JOEC.0000006489.76006.cbURL [本文引用: 1]
URL [本文引用: 1]

在参照Chinard的L-鸟氨酸测定方法的基础上,确定了一种有效、高灵敏度的L-鸟氨酸快速定量检测方法.用6 mol/L H3PO4-冰乙酸(1/3,V/V)配制浓度为25 mg/mL茚三酮混合酸溶液作为显色液,在100℃水浴锅中60 min反应后,波长510 nm下比色测定L-鸟氨酸浓度.该反应体系稳定,受其他氨基酸的影响程度很小,或者在发酵液等的实际测定体系中存在量极少而可以忽略不计,线性范围为0~0.20 μmol/mL,检测精度为0.01 μmol/mL.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1021/acs.orglett.8b03236URLPMID:30511859 [本文引用: 3]

Solanaceous medicinal plants produce tropane alkaloids (TAs). We discovered a novel gene from Atropa belladonna, AbPPAR, which encodes a phenylpyruvic acid reductase required for TA biosynthesis. AbPPAR was specifically expressed in root pericycles and endodermis. AbPPAR was shown to catalyze reduction of phenylpyruvic acid to phenyllactic acid, a precursor of TAs. Suppression of AbPPAR disrupted TA biosynthesis through reduction of phenyllactic acid levels. In summary, we identified a novel enzyme involved in TA biosynthesis.
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1073/pnas.0401391101URLPMID:15084741 [本文引用: 1]

[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]

2浓度、UV-B辐射、环境污染等非生物环境以及与化学防御、化感作用、菌根共生、微生物病害的关系。研究植物次生代谢与环境的关系,可以从更深的层次发掘植物与环境的内在联系,为全面、深入认识植物与环境的相互关系提供新的研究途径,同时也有利于人类更有效、合理地利用植物的次生代谢产物。]]>
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/s0031-9422(02)00200-5URLPMID:12359518 [本文引用: 1]

The conversion of littorine to hyoscyamine has been investigated by feeding deuterium labelled (RS)-[2-(2)H]-, [3, 3-(2)H(2)]-, [2, 3, 3-(2)H(3)]- phenyllactic acids to transformed root cultures of Datura stramonium. Isolation and GC-MS analyses of the isotope incorporation into the resultant hyoscyamine does not support the involvement of a vicinal interchange process operating during the isomerisation of littorine to hyoscyamine. Additionally a metabolism study with [1'-13C, 3', 3'-(2)H(2)]-hyoscyamine has established that the alkaloid is metabolically stable at C-3' with no evidence for a reversible in vivo oxidation process to the corresponding aldehyde. The data do not support an S-adenosy-L-methionine (SAM 5)/co-enzyme-B(12) mediated process for the isomerisation of littorine to hyoscyamine.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1034/j.1399-3054.2002.1160302.xURL [本文引用: 1]
DOI:10.1023/A:1014459232710URL [本文引用: 1]

Increasing levels of UV-B radiation (UV-B) at the Earth's surfaceare among a suite of anthropomorphic stresses that influence plant growth anddevelopment. Several stress reactions have been shown to occur in response toUV-B, including a stimulation of antioxidant pathways and altered or increasedpigmentation. Polyamines, plant growth regulators that have been shown toincrease during stress, have also been implicated in the UV-B response. Weinvestigated the effects of UV-B radiation on the UV-B sensitive legumePhaseolus vulgaris L. Top Crop over atwo-week period. Total free polyamines showed marked decreases in response toUV-B radiation, primarily due to a decrease in putrescine. The reduction infreepolyamines was correlated with UV-B induced chlorophyll loss.]]>
DOI:10.1016/s0092-8674(03)00350-7URLPMID:12757708 [本文引用: 1]

A growing body of evidence indicates that nitric oxide (NO) plays important signaling roles in plants. However, the enzyme(s) responsible for its synthesis after infection was unknown. Here, we demonstrate that the pathogen-induced, NO-synthesizing enzyme is a variant form of the P protein of glycine decarboxylase (GDC). Inhibitors of the P protein of GDC block its NO synthase (NOS)-like activity, and variant P produced in E. coli or insect cells displays NOS activity. The plant enzyme shares many biochemical and kinetic properties with animal NOSs. However, only a few of the critical motifs associated with NO production in animals can be recognized in the variant P sequence, suggesting that it uses very different chemistry for NO synthesis. Since nitrate reductase is likely responsible for NO production in uninfected or nonelicited plants, our results suggest that plants, like animals, use multiple enzymes for the synthesis of this critical hormone.
[本文引用: 2]
[本文引用: 2]
DOI:10.1104/pp.105.066407URLPMID:16169960 [本文引用: 1]

Fungal elicitor prepared from the cell walls of Aspergillum niger induces multiple responses of Hypericum perforatum cells, including nitric oxide (NO) generation, jasmonic acid (JA) biosynthesis, and hypericin production. To determine the role of NO and JA in elicitor-induced hypericin production, we study the effects of NO scavenger 2- to 4-carboxyphenyl-4,4, 5,5-tetramethylimidazoline-1-oxyl-3-oxide (cPITO), nitric oxide synthase inhibitor S,S'-1,3-phenylene-bis(1,2-ethanediyl)-bis-isothiourea, and inhibitors of the octadecanoid pathway on elicitor-induced NO generation, JA biosynthesis, and hypericin production. Pretreatment of the cells with cPITO and JA biosynthesis inhibitors suppresses not only the elicitor-induced NO generation and JA accumulation but also the elicitor-induced hypericin production, which suggests that both NO and JA are involved in elicitor-induced hypericin biosynthesis. S,S'-1,3-phenylene-bis(1,2-ethanediyl)-bis-isothiourea and cPITO inhibit both elicitor-induced NO generation and JA biosynthesis, while JA biosynthesis inhibitors do not affect the elicitor-induced NO generation, indicating that JA acts downstream of NO generation and that its biosynthesis is regulated by NO. External application of NO via its donor sodium nitroprusside induces hypericin production in the absence of fungal elicitor. Sodium-nitroprusside-induced hypericin production is blocked by JA biosynthesis inhibitors, showing that JA biosynthesis is essential for NO-induced hypericin production. The results demonstrate a causal relationship between elicitor-induced NO generation, JA biosynthesis, and hypericin production in H. perforatum cells and indicate a sequence of signaling events from NO to hypericin production, within which NO mediates the elicitor-induced hypericin biosynthesis at least partially via a JA-dependent signaling pathway.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
