 ,2,*, 严明理
,2,*, 严明理 ,1,3,*
,1,3,*Construction of Hairy Root Induction System and Functional Analysis of TTG1 Gene in Brassica juncea
LI Long1,2, CHENG Cheng1,2, WU Xiao-Fang1,2, ZHANG Da-Wei1,3, LIU Li-Li1,3, ZHOU Jing1, ZHOU Mei-Liang2, ZHANG Kai-Xuan ,2,*, YAN Ming-Li
,2,*, YAN Ming-Li ,1,3,*
,1,3,*通讯作者:
第一联系人:
收稿日期:2018-02-14接受日期:2018-06-12网络出版日期:2018-07-02
| 基金资助: |
Received:2018-02-14Accepted:2018-06-12Online:2018-07-02
| Fund supported: |

摘要
关键词:
Abstract
Keywords:
PDF (3255KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李隆, 程成, 伍小方, 张大为, 刘丽莉, 周静, 周美亮, 张凯旋, 严明理. 芥菜型油菜毛状根诱导体系构建及TTG1基因功能初步研究[J]. 作物学报, 2018, 44(10): 1468-1476. doi:10.3724/SP.J.1006.2018.01468
LI Long, CHENG Cheng, WU Xiao-Fang, ZHANG Da-Wei, LIU Li-Li, ZHOU Jing, ZHOU Mei-Liang, ZHANG Kai-Xuan, YAN Ming-Li.
毛状根用于研究植物次生代谢活性物质在十几年来一直受到了很大关注, 以植物毛状根为反应器, 利用基因工程技术生产生物碱、蒽醌类、类黄酮、皂苷类、萜类等物质成为研究热点[1]。毛状根, 又称发状根、发根, 是发根农杆菌侵染植物后产生的一种病理状态, 具有生长速度快、转化效率高等特点。与毛状根体系相比, 传统的遗传转化体系要经历萌发培养、预培养、共培养、脱分化、生根培养等阶段; 在芥菜型油菜遗传转化体系过程中需要添加2,4-D (2,4-dichlorophenoxyacetic acid)预培养, 6-BA (6-benzylaminopurine)和AgNO3出芽分化, IAA (indole-3-acetic acid)和NAA (1-naphthylacetic acid)等生根培养, 其操作比较繁琐[2,3]。在毛状根中过表达基因或用RNA干扰技术来研究植物次生代谢产物成为一种快速有效的研究方法[4,5]。有研究报道, 转IRTI基因油菜毛状根比野生型毛状根富集Cd的能力强[6]。但是目前对油菜毛状根的研究报道较少, 芥菜型油菜毛状根培养还未有报道。
油菜种皮颜色的差异是由于黄酮生物合成途径中原花色素(proanthocyanidins)在种皮内皮细胞中是否沉积所引起的[7]。芥菜型油菜黄籽种皮中关键酶基因DFR (dihydroflavonol4-reductase)、ANS (anthocyanidin synthase)和BAN (anthocyanidin reductase)不表达造成白花色苷、花色素、表儿茶素无法合成, 原花色素所需要的上游产物被阻断, 使色素无法积累, 导致种皮透明[8,9,10]。在拟南芥中, MYB类型转录因子TT2、bHLH类型转录因子TT8和WD40类型转录因子TTG1形成MBW复合物调控原花色素的生物合成, MBW复合体可以结合在DFR、ANS、BAN等关键酶基因的启动子上, 控制DFR、ANS和BAN酶基因的表达来调控原花色素的生物合成[11,12,13]。甘蓝型油菜中TT2基因可以调控种皮颜色和脂肪酸的含量[14]。芥菜型油菜TT8基因的自然突变, 使MBW复合体不能结合DFR、ANS和BAN启动子而导致原花色素代谢途径不能正常表达, 原花色素无法积累, 种皮透明[15,16]。陈明训等[17]把谷子的TTG1基因转入拟南芥中, TTG1通过调控类黄酮途径相关酶基因的表达来影响色素积累, 改变了拟南芥的种皮颜色和厚度。在拟南芥ttg1突变体中, 类黄酮含量影响了生长素的运输和植物表型, 突变体根的长短、生长方向、花序多少、果角长度、侧根密度等性状都发生了改变[18]。在黄瓜中, TTG1参与调控植物的叶毛形成, 对外来生物侵害起到一定的防御作用, 也影响了黄瓜的表型[19]。目前TTG1基因参与油菜原花色素代谢途径的功能还未验证, 因此通过在毛状根中过表达TTG1基因, 可以分析TTG1基因在油菜原花色素代谢途径中的功能。
本研究对芥菜型油菜毛状根诱导体系做了探索, 构建TTG1过表达载体并转入毛状根中进行功能的初步研究, 为利用和开发油菜种皮颜色基因奠定了基础。
1 材料与方法
1.1 试验材料
以芥菜型油菜四川黄籽(自交系, 种皮为黄色)为材料, 获得油菜组培苗。培养基类型为MS固体培养基; 光照时间为16 h d-1; 光照强度6000 μmol m-2 s-1; 培养温度为(25±2)℃; 发根农杆菌A4菌株由中国农业科学院作物科学研究所荞麦基因资源创新研究组提供; 载体为pCAMBIA3301。1.2 目的基因的克隆
利用TRIzol法提取油菜叶片总RNA, 按全式金生物试剂公司的说明书进行反转录操作, 以cDNA作为PCR模板。反转录反应体系为20 μL, 含2 μL RNase-free Water、10 μL 2×TS Reaction Mix、4 μL总RNA、1 μL gDNA Remover、1 μL Anchored Oligo(dT) Primer (0.5 g μL-1)、1 μL Random Primer (0.1 g μL-1)和1 μL Mixrans Script RT/RI Enzyme Mix。反转录程序为25℃ 5 min, 42℃ 1 h, 75℃灭活5 min, 室温冷却5 min, 反应完成后离心, 作为PCR反应的模板。参考已报道的芥菜型油菜TTG1基因CDS序列[20], 利用Primer5.0 软件引物设计, 上游引物序列为5′-ATGGATAACTCAGCTCCGGA-3′, 下游引物序列为5′-CTCAAACTCTAAGGAGCTGC A-3′。PCR反应总体系20 μL, 含1 μL反转录产物、上下游引物各1 μL (10 mmol L-1)、10 μL REMiX和ddH2O (补足到20 μL), 以上试剂购自北京天根生物公司。PCR反应程序为95℃预变性5 min; 94℃变性30 s, 55℃退火45 s, 72℃延伸1 min, 31个循环; 最后72℃延伸10 min。PCR结束后用1%琼脂糖凝胶电泳检测。将PCR产物用TaKaRa MiniBEST Plasmid Purification Kit Ver 4.0进行切胶回收纯化后, 连接到pMD19-T Vector (TaKaRa)上, 热激转化到大肠杆菌DH5α, 进行氨苄(Ampicillin)抗性筛选。挑取单克隆菌株进行液体培养, 用M13引物进行菌液PCR检测。选取含阳性质粒的菌液送北京奥科鼎盛生物科技有限公司用M13引物进行双向测序, 将测序结果进行拼接, 得到序列与文献上进行比对。应用DNAMAN软件将氨基酸序列进行多序列比对, 结果显示氨基酸序列一致。1.3 载体的构建和转化
根据同源重组的方法在上下游引物前加入15 bp载体同源序列和酶切位点, 上游引物TTG1-F (5′- ACGGGGGACTCTTGACCATGGATGGATAACTCAGCTCCGGA-3′) 和下游引物TTG1-R (5′-GGGAAA TTCGAGCTGGTCACCCTCAAACTCTAAGGAGCTGCA-3′), 酶切位点为Nco I和Eco91 I。以T载体作为模板进行PCR扩增, PCR方法和体系与1.2相同, 切胶回收纯化与1.2相同。对pCAMBIA3301进行Nco I和Eco91 I双酶切。酶切体系为10 μL, 含质粒DNA 6 μL、Nco I和Eco91 I各1 μL、10×buffer Fly 1 μL、ddH2O补至10 μL, 37℃放置2 h。TTG1片段与纯化pCAMBIA3301连接。采用同源重组方式进行载体连接, 体系10 μL, 含PCR纯化产物1 μL、5× Ligation-Free Cloning Master Mix 4 μL、pCAMBIA 3301 2 μL、用ddH2O补至10 μL。反应条件为冰浴30 min。热激转化到大肠杆菌的方法和测序与1.2相同。农杆菌制备以及转化, pCAMBIA3301空载体转入农杆菌A4方法参照文献中报道的方法[21]。通过PCR鉴定转GUS基因和TTG1基因的发根农杆菌A4。反应程序为95℃预变性5 min; 94℃变性30 s, 55℃退火45 s, 72℃延伸1 min, 31个循环, 最后72℃延伸10 min。PCR结束后用1%琼脂糖凝胶电泳检测。1.4 油菜毛状根的诱导
用培养7 d的油菜幼苗的子叶和下胚轴作为外植体与发根农杆菌A4共培养。当农杆菌OD值为0.8时, 离心(5000 r min-1) 15 min, 去上清, 用等体积的MS液体培养基将其重悬。将外植体放入A4侵染液中接种5 min, 在无菌滤纸上吸干, 25℃在黑暗条件下MS固体培养基上共培养2 d后, 将外植体用含有头孢噻肟(100 mg L-1)的MS液体培养基漂洗5次, 并在无菌滤纸上吸干, 然后25℃光照条件下在含有100 mg L-1头孢噻肟MS琼脂培养基上培养。接种2~3周后, 切除单一生长根并接种在含有100 mg L-1头孢噻肟的MS培养固体基上。将毛状根在25℃黑暗中培养, 每5周继代一次, 将约100 mg根(3 cm长度)接种到含有40 mL液体MS培养基的150 mL锥形瓶中, 并在25℃的摇床(100 r min-1)上黑暗培养。转GUS和TTG1基因的诱导方法与1.2相同, 最后在含Basta抗性的MS培养基上进行抗性筛选, 以获得转基因的无菌毛状根。1.5 油菜毛状根诱导条件的优化
为寻找发根农杆菌促进芥菜型油菜毛状根发根的最佳菌液浓度, 分别用OD值为0.4、0.6、0.8、1.0的菌液侵染油菜外植体, 侵染方法与1.2相同。用子叶和下胚轴的发根率来评价外植体对毛状根发根率的影响。使用Microsoft Excel软件统计分析。1.6 转基因毛状根的鉴定
采用CTAB法提取毛状根总DNA, GUS引物设计为5'-AACGGGGAAACTCAGCAAGC-3'和5'-CA AATCGCCGCTTTGGACATA-3', 目的基因285 bp。TTG1引物设计为5'-TGACGCACAATCCCACTAT CCTT-3'和5'-CAGAACTCGCTCGTCTTGCTGTT-3'。目的基因488 bp, 通过PCR对转入GUS基因和TTG1基因的毛状根进行鉴定, 反应程序为95℃预变性5 min; 94℃变性30 s, 55℃退火45 s, 72℃延伸1 min, 31个循环; 最后72℃延伸10 min。PCR反应结束后用1%琼脂糖凝胶电泳检测。1.7 GUS染色鉴定转化效率
(1)用预冷的90%丙酮固定10 min, 4℃保存, 待用。用未添加X-Gluc的染色缓冲液润洗; (2)用预冷的染色缓冲液浸泡, 抽真空10 min, 37℃温育; (3)先后用50%、70%和100%的乙醇漂洗样品, 每次浸泡5 min; (4)加入100%乙醇浸泡直至完全脱色; (5)体视显微镜照相记录。1.8 原花色素合成途径中基因的表达量分析
利用qRT-PCR对转基因的四川黄籽毛状根中的基因进行表达分析。RNA提取和cDNA合成方法同1.2。按照ChamQ SYBR qPCR Master Mix (Low ROX Premixed) (Vazume, Q3301-02)说明书分析表达量, 每个样品3次重复。PCR体系为ChamQ SYBR qPCR Master Mix 10 μL、0.5 μmol上下游引物各1 μL、cDNA 1 μL (50 ng μL-1)、RNase Free ddH2O补足至20 μL。在ABI 7500荧光定量PCR仪上进行反应, 反应程序为95°C预变性60 s; 95°C变性20 s, 55°C退火20 s, 72°C延伸45 s, 40个循环。反应结束后分析荧光值变化曲线和溶解曲线, 采用2-ΔΔCt的方法分析实验结果[22]。qRT-PCR引物相关信息见表1。Table 1
表1
表1qRT-PCR引物表
Table 1
| 基因 Gene | 名称 Name | 引物 Primer (5°-3°) | PCR长度 PCR length (bp) |
|---|---|---|---|
| BAN | Anthocyanidin reductase | F: ATCTTCCATGTCGCAACTCC R: CGAGAGAGATAAACTGCTAG | 200 |
| DFR | Dihydroflavonol4-reductase | F: AGGATTCATTGGTTCATGGCTCG R: TCCGTTTATGGCGTCATCGTAGC | 189 |
| ANS | Anthocyanidin synthase | F: GGACAACTTGAGTGGGAAGATTA R: GCAAACGAAGACACTTAGCGTAC | 132 |
| TTG1 | protein (“WD40” or “WDR”) | F: GGCTGTAAGCATATCTGTTCCG R: GAGAAAGCAATCCCAATCCAATG | 173 |
| 内参 Internal reference | Actin7 | F: GCTGACCGTATGAGCAAAG R: AAGATGGATGGACCCGAC | 182 |
新窗口打开|下载CSV
2 结果与分析
2.1 毛状根诱导过程
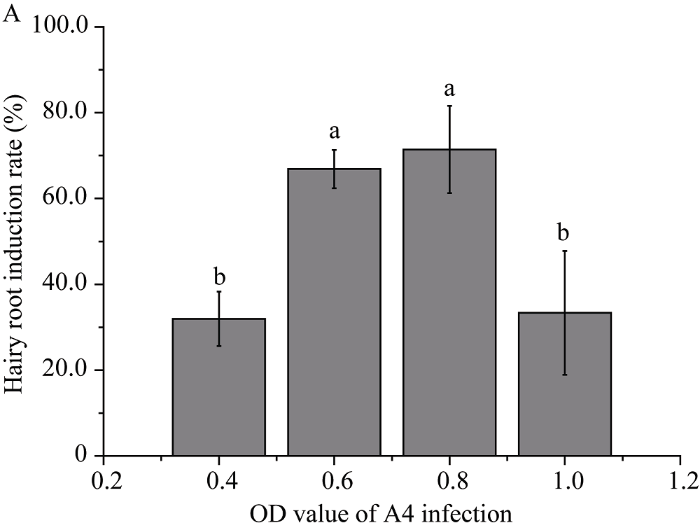
使用不同浓度(OD值分别为0.4、0.6、0.8、1.0) 的野生型农杆菌A4侵染四川黄籽子叶和下胚轴,当菌液OD值为0.8时, 发根率最高, 平均诱导效率为71.5% (图2)。当菌液浓度为0.8时, 使用不同外植体进行侵染时, 其下胚轴发根率明显高于子叶(表2)。未侵染成功的外植体1周以后开始产生褐色, 最终死亡。从诱导毛状根发根到转化培养, 再到生长充满整个培养瓶需要40~60 d。毛状根诱导过程如下, 将四川黄籽种子消毒处理后接种在MS固体培养基, 培养14 d (图1-A); 剪取油菜的无菌苗外植体, 使用A4侵染液侵染, 生长7 d的外植体诱导出的毛状根(图1-B); 继续培养14 d, 外植体上的毛状根长满整个培养基(图1-C); 剪取生长快速的毛状根移入新的培养基, 培养14 d后获得生长旺盛的毛状根(图1-D); 将获得的无菌毛状根接种至MS液体培养基中, 7 d后开始快速生长, 侧枝分支增加(图-E); 培养21 d后, 液体培养基中产生大量毛状根(图1-F)。Table 2
表2
表2不同外植体对油菜毛状根诱导率的影响
Table 2
| 外植体 Explant | 感染外植体数量 Number of infected explants | 外植体发根数量 Number of explants rooted | 诱导率 Induction rate (%) |
|---|---|---|---|
| 下胚轴 Hypocotyl | 30 | 26.2±0.3 a | 87.3±0.01 a |
| 子叶 Cotyledon | 30 | 12.0±0.5 b | 40.0±0.02 b |
新窗口打开|下载CSV
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1毛状根的诱导过程
A: 14 d的四川黄籽油菜幼苗; B: 诱导7 d发根的外植体; C: 14 d以后的毛状根; D: 21 d以后转移到筛选培养基;E: 28 d在液体培养基上; F: 42 d以后的毛状根。
Fig. 1Process of the hairy root induction
A: 14 d SY rape sterile seedling; B: 7 d explants with hairy roots; C: 14 d hairy roots; D: 21 d hairy roots on the screening medium; E: 28 d hairy roots in the liquid medium; F: 21 d hairy roots in the liquid medium.
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同浓度菌液对毛状根的诱导效率
Fig. 2Induction efficiency of different concentrations of A. rhizogenes A4 on hairy roots
2.2 过表达载体的构建和转化的检测
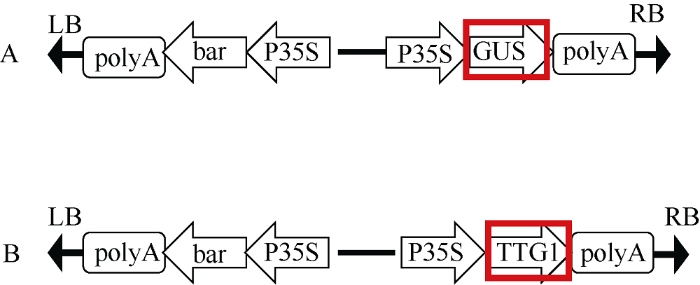
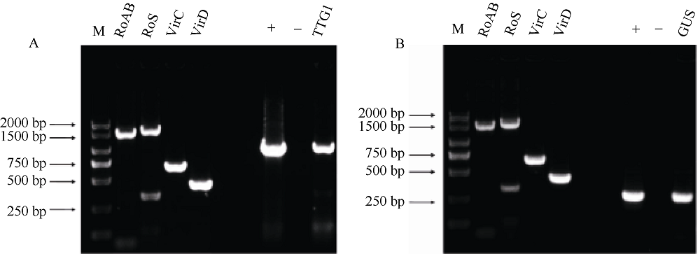
载体构建时选用的是pCAMBIA3301载体, 把原始的GUS基因切掉以后连接上TTG1基因。载体构建如图3所示, 把pCAMBIA3301载体转入发根农杆菌A4感受态中, 利用PCR对pCAMBIA3301- TTG1的菌液进行阳性检测, 同时鉴定含有阳性质粒的毒性区VirC、VirD以及转移区的左右边界RolAB和Ags, 引物序列参考王成龙[23]苦荞毛状根的诱导及高频再生体系的建立。由图4可知, 在转化过的农杆菌A4中检测出TTG1基因和GUS基因, 说明pCAMBIA3301-TTG1和pCAMBIA3301质粒已经成功转入A4感受态中。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3载体构建图
A: pCAMBIA3301载体; B: 改造后的载体。
Fig. 3Vector construction
A: pCAMBIA3301 vector; B: pCAMBIA3301 vector containing TTG1 gene.
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4转化菌液的检测
A: 35S-TTG1阳性检测结果。+: pCAMBIA3301-TTG1, -: H2O; B: GUS 阳性检测结果。+: pCAMBIA3301质粒, -: H2O。
Fig. 4Identification of the transformed A. rhizogenes A4
A: identification of TTG1 gene in A. rhizogenes A4. +: pCAMBIA3301-TTG1, -: H2O; B: identification of GUS gene in A. rhizogenes A4. +: pCAMBIA3301 plasmid, -: H2O.
2.3 转基因毛状根的检测
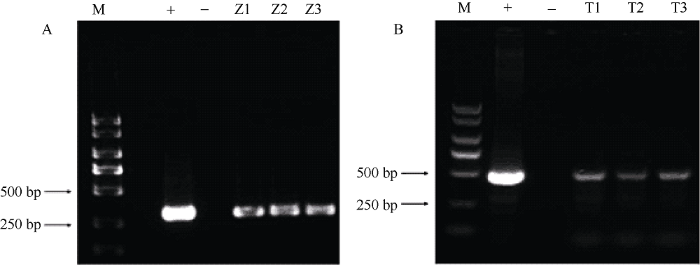
从转化的材料中选择了3个转GUS基因的毛状根分别命名为Z1、Z2、Z3, 3个转TTG1基因的毛状根命名为T1、T2、T3, 检测均呈阳性, 由图5-A可知, 转GUS基因毛状根PCR检测条带为285 bp, 说明基因已经成功转入毛状根中。由图5-B可知, 转基因毛状根的目的基因片段条带为488 bp, 说明基因已经成功转入毛状根中。随后对PCR鉴定为阳性的的转GUS基因的Z1、Z2、Z3进行GUS染色(图6)。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5转基因毛状根的鉴定
A: 转GUS基因的3个根系Z1、Z2、Z3的PCR阳性检测。+: pCAMBIA3301质粒; -: 野生型毛状根; B: 转TTG1基因的3个根系T1、 T2、T3的PCR阳性检测。+: pCAMBIA3301-TTG1; -: 野生型毛状根。
Fig. 5Identification of transgenic hairy roots
A: three lines of hairy roots overexpressing GUS gene tested by PCR. +: pCAMBIA3301 plasmid; -: wild type hairy roots; B: three lines of hairy roots overexpressing TTG1 gene tested by PCR. +: pCAMBIA3301-TTG1; -: wild-type hairy roots.
图6
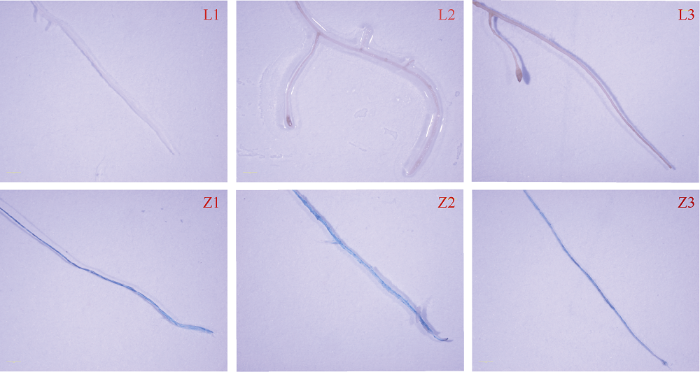 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6野生型和转GUS基因毛状根的染色结果
L1、L2、L3: 野生型的3个根系; Z1、Z2、Z3: 含有GUS基因的3个根系。
Fig. 6Staining of wild type and transgenic hairy roots
L1, L2, L3: three lines of wild-type hairy roots; Z1, Z2, Z3: three lines of hairy roots overexpressing GUS genes.
2.4 转基因毛状根的生长分析
为进一步对转入GUS和TTG1基因对毛状根的形态和生长状况进行分析。分别剪取约0.5 cm野生型四川黄籽油菜(图7-A1)、转GUS基因(图7-B1)和转TTG1基因(图7-C1)的毛状根根尖, 置MS固体培养基上。培养2周左右, 分别获得野生型四川黄籽油菜(图7-A2)、转GUS基因(图7-B2)、转TTG1基因(图7-C2)的毛状根生长状态。从图中可以看出, B2 (转GUS基因)和C2 (转TTG1基因)的毛状根比野生型的A2生长速度快, 出现分枝数多且粗壮。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7野生型和转基因毛状根生长状况
A1: 野生型毛状根根尖转入0 d状态; B1: 转GUS基因毛状根根尖0 d状态; C1: 转TTG1毛状根根尖0 d状态; A2: 野生型毛状根转入14 d状态; B2: 转GUS基因毛状根14 d状态; C2: 转TTG1毛状根14 d状态。
Fig. 7Growth comparison of wild type and transgenic hairy roots
A1: wild-type hairy root tip; B1: GUS-overexpression hairy root tip; C1: TTG1-overexpression hairy root tip; A2: 14 d old wild-type hairy roots; B2: 14 d old GUS-overexpression hairy roots; C2: 14 d old TTG1-overexpression hairy roots.
2.5 基因表达量的检测
由图8可知, 与野生型相比, 转基因材料的TTG1基因表达量提高了1.5倍, 转TTG1基因毛状根中DFR、ANS和BAN的表达受到了抑制, 表达量分别为野生型的0.4、0.6和0.3倍, pCAMBIA3301-TTG1载体转入毛状根中抑制了DFR、ANS和BAN基因的表达。图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8qRT-PCR检测相关基因的表达量
A: TTG1基因; B: DFR基因; C: ANS基因; D: BAN基因。
Fig. 8Related genes expression tested by qRT-PCR
A: TTG1 gene; B: DFR gene; C: ANS gene; D: BAN gene.
3 讨论
3.1 毛状根的诱导条件的优化
建立快速稳定的芥菜型油菜毛状根体系和基因转化体系有助于外源基因的转入, 对转基因功能验证和次生代谢产物合成的研究有着重要的意义。本研究发现, 发根农杆菌A4侵染芥菜型油菜不同的部位, 毛状根诱导率存在很大差别, 下胚轴毛状根生长数明显高于子叶, 推断下胚轴是油菜毛状根产生的合适部位。另外, A4农杆菌OD值在0.8时诱导效率最高, 这个浓度对其他类型的农杆菌诱导油菜发根是不是最佳浓度需要进一步研究。转GUS基因和TTG1基因比野生型毛状根粗大, 生长速度快而且分支数要多, 而转GUS和TTG1基因之间却没有明显差别, 推断外植体被转化后有利于毛状根的形成。传统的油菜遗传转化体系是通过诱导愈伤组织等费时的操作, 得到T1代转基因苗要6个月以上[4], 本研究40 d就可以诱导出稳定的根系, 且毛状根体系不用加植物生长调节剂, 操作简单, 这为建立油菜快速的转基因体系提供了参考。本研究油菜毛状根体系的建立也可用于快速分析植物次生代谢通路中相关基因的表达。3.2 TTG1基因表达与DFR、ANS和BAN基因表达的关系
在拟南芥ttg1突变体材料中, DFR、ANS和BAN基因表达水平会下降, 过表达促进了这3个酶基因的上调[24]。而本研究在黄籽油菜毛状根中, 过表达TTG1基因对DFR、ANS和BAN基因表达没有起到促进作用, 探究其原因, 可能是由于在四川黄籽中形成MBW复合体时, TT8发生突变, MBW不能和DFR、ANS和BAN启动子相结合, 不能加强这3个酶基因的表达[14,15], 即使在毛状根中过表达了TTG1, 也无法促使MBW复合体和这3个酶基因启动子相结合, 促进其下游基因的表达(图9)。正如岳迎春[7]在四川黄籽植株中过表达TT2种皮并未变为黑色, 仍然透明, 而且种子变小败育。而在水稻中直接转入多个原花色素合成途径中的基因, 可以促进水稻胚乳中原花色素的积累, 白色变为紫色[25]。因此推断单独提高TTG1在四川黄籽植株中的表达量, 不能促进DFR、ANS和BAN基因的表达。图9
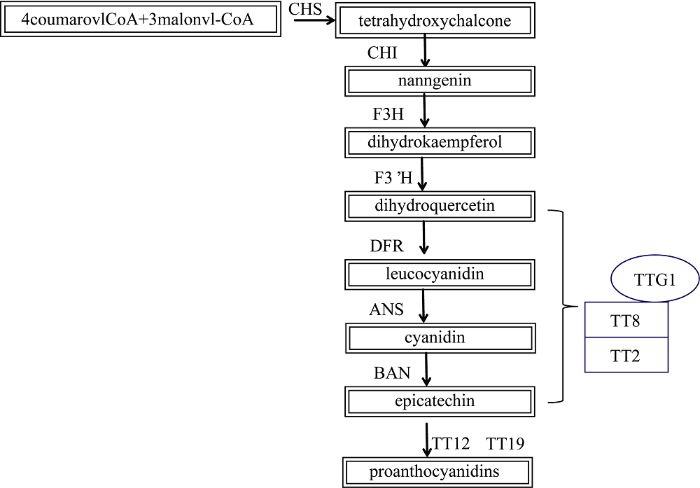 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9拟南芥原花青素代谢途径中TT2、TT8和TTG1形成MBW复合体调控DFR、ANS和BAN的示意图
PA代谢途径的酶基因分别为查尔酮合酶(CHS)、查尔酮异构酶(CHI)、黄烷酮3-羟化酶基因(F3H)、类黄酮3’-羟化酶基因(F3’H)、二氢黄酮醇4-还原酶(DFR)、花青素合成酶(ANS)、花色素还原酶(BAN)、谷胱甘肽S-转移酶(TT12)和MATE次级转运子(TT19)。
Fig. 9MBW complex formed by TT2, TT8, and TTG1 regulates the expression of DFR, ANS, and BAN genes in the proanthocyanidin metabolism pathway of Arabidopsis thaliana
The enzyme genes of the PA metabolic pathway are chalconesynthase (CHS), chalconeisomerase (CHI), flavanone3-hydroxylase (F3H), flavonoid3'-hydroxylase (F3’H), dihydroflavonol4-reductase (DFR), anthocyaninsynthase (ANS), anthocyanidinreductase (BAN), MATE secondary transporter (TT12), and glutathione S-transferase (TT19).
4 结论
在芥菜型油菜四川黄籽中建立了毛状根发根和基因转化体系, 并利用GUS染色进行转化效率的鉴定。在该体系下过表达TTG1基因会导致DFR、ANS和BAN基因下调表达。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1007/s00253-011-3228-0URLPMID:21468707 [本文引用: 1]

Abstract In the past three decades, hairy roots research for the production of valuable biological active substances has received a lot of attention. The addition of knowledge to enhance the yields of desired substances and the development of novel tools for biomass engineering offer new possibilities for large-scale cultivation of the plant hairy root. Hairy roots can also produce recombinant proteins through the transfer of Agrobacterium T-DNA into the plant genome, and thereby hold immense potential for the pharmaceutical industry. This review highlights some of the significant progress made in the past few years and outlines future prospects for exploiting the potential utility of hairy root cultures as "chemical factories" for producing bioactive substances.
[本文引用: 1]
DOI:10.3969/j.issn.1005-7021.2003.05.011URL [本文引用: 1]

综述了发根土壤杆菌诱导植物产生毛状根的方法及毛状根的特点,重点介绍了国内利用毛状根培养技术生产植物次生代谢物的最新研究进展。
DOI:10.3969/j.issn.1005-7021.2003.05.011URL [本文引用: 1]

综述了发根土壤杆菌诱导植物产生毛状根的方法及毛状根的特点,重点介绍了国内利用毛状根培养技术生产植物次生代谢物的最新研究进展。
[本文引用: 2]
[本文引用: 2]
Magsci [本文引用: 1]

为提高根癌农杆菌(Agrobacterium tumefaciens)介导转化甘蓝型油菜外源基因的瞬间表达率和优化遗传转化体系,利用根癌农杆菌共培养法转化甘蓝型油菜(Brassica napus L.)“湘油15”带柄子叶,通过组织化学染色法检测GUS基因瞬间表达情况,研究了预培养基、蔗糖浓度、无机盐浓度和乙酰丁香酮对GUS基因瞬间表达的影响。结果表明, 预培养基为MS+6BA 1.0 mg/L+2,4-D 1.0 mg/L、菌悬液为MS+蔗糖30g/L +乙酰丁香酮100µmol/L或1/2MS+蔗糖60g/L +乙酰丁香酮100µmol/L时GUS基因瞬间表达率较高,达到约40%。 <BR>
Magsci [本文引用: 1]

为提高根癌农杆菌(Agrobacterium tumefaciens)介导转化甘蓝型油菜外源基因的瞬间表达率和优化遗传转化体系,利用根癌农杆菌共培养法转化甘蓝型油菜(Brassica napus L.)“湘油15”带柄子叶,通过组织化学染色法检测GUS基因瞬间表达情况,研究了预培养基、蔗糖浓度、无机盐浓度和乙酰丁香酮对GUS基因瞬间表达的影响。结果表明, 预培养基为MS+6BA 1.0 mg/L+2,4-D 1.0 mg/L、菌悬液为MS+蔗糖30g/L +乙酰丁香酮100µmol/L或1/2MS+蔗糖60g/L +乙酰丁香酮100µmol/L时GUS基因瞬间表达率较高,达到约40%。 <BR>
URL [本文引用: 1]

目的:重金属镉(Cd)因其致癌性强而引起业界广泛关注,Cd可通过工业废水、废渣污染土壤和水源,并通过食物链进入到动物及人体内对生物造成不可逆的损害。随着生物技术的不断发展,利用植物进行Cd污染的修复显示出良好的应用潜力。 自然界中存在可以富集Cd的超富集植物,能够在一定浓度的Cd污染环境中生存,并通过新陈代谢机制摄取和固定Cd。但目前已知的Cd超富集植物存在富集系数低、富集量有限等缺点,影响了实际应用。随着基因工程技术的发展,利用基因工程的手段对Cd超富集植物进行转基因改造,是促进Cd污染环境植物修复技术发展的重要途径。 因此本论文选择分布广泛、易获得的Cd超富集植物油菜(Brassica campestrisL.)进行转基因改造研究,希望通过农杆菌介导的方法建立转基因的油菜毛状根体系,今后可利用转基因毛状根体系作为Cd富集转基因改造研究平台。 方法:利用农杆菌介导的方法对油菜进行转基因毛状根的诱导和基因改造研究。利用油菜种子进行无菌培养获得外植体,同时将发根土壤杆菌ATCC15834进行单克隆培养、活化,将活化好的菌液与外植体子叶外植体进行共培养,后转移至含头孢噻肟钠(Cephalosporins, Cef)的培养基上进行除菌,10d后可获得油菜毛状根。设计引物对油菜毛状根进行PCR检测,检验rol B基因是否已整合进入植物毛状根组织。同时对不同的侵染时间、不同浓度萘乙酸(NAA)对油菜毛状根诱导的影响进行分析研究。 在确定油菜毛状根成功获得的基础上,利用Takara公司的pR1101质粒将与Cd富集相关的IRT1基因整合进ATCC15834菌种中,并利用改造过的ATCC15834浸染油菜子叶外植体,诱导获得转IRT1基因毛状根。同样设计引物利用PCR技术进行IRT1基因、rol B基因的检验,确定IRT1基因、rol B基因已经整合植物毛状根组织的DNA中。 最后对转IRT1基因毛状根进行Cd富集实验研究。将转IRTl基因油菜毛状根与野生菌诱导的油菜毛状根分别置于含不同浓度Cd的培养基上进行暗培养。7d和14d分别取样进行生物量、毛状根富集的Cd含量、培养基残留Cd含量的测定,探讨转入IRT1基因提高油菜毛状根富集Cd的可能性。 结果:设计引物对油菜毛状根进行PCR检测,可以检测到大小为423bp的rolB基因条带,确定发根农杆菌Ri质粒中的rol B基因已整合进入植物毛状根组织DNA中。目前未见有文献报道油菜毛状根的成功诱导。不同的侵染时间对毛状根的诱导有着较明显的影响,在一定范围的侵染时间内,毛状根的诱导率呈正态分布,其中侵染时间为4h时,毛状根的诱导率最高;在培养基中添加不同浓度的NAA也能不同程度地促进油菜毛状根的生长,在0-1.0mg/L的范围内,NAA浓度越高,油菜毛状根诱导率越高。 重组质粒IRT1-pRI101经测序后证明构建成功。经转化重组质粒IRT1-pRI101获得的重组菌ATCC15834侵染油菜子叶外植体获得转IRT1毛状根,设计引物进行IRT1基因、rol B基因的PCR检测,实验结果表明毛状根DNA中存在423bp、471bp大小条带,证明rol B基因、IRT1基因已经整合进入植物毛状根组织。 Cd富集实验结果表明,野生型和转IRT1油菜毛状根都能有效地富集培养基中的Cd。在不同浓度的Cd环境下,转入了IRTl基因的毛状根比野生型毛状根的生长状况更好,对Cd的富集量更高。随着培养基中Cd浓度的增加和培养时间的延长,转IRT1油菜毛状根对Cd的富集量也随之增加。在100μmol/L Cd培养基中培养14d后,转IRT1基因毛状根中富集的Cd含量为33.161±0.026μg/100mg毛状根,Cd富集系数达到7.261%±0.006%,比野生型毛状根的富集系数6.384%±00005%提高了13.73%±0.01%。 论文的研究结果为将来利用转IRTl基因油菜再生植株修复重金属Cd污染提供了应用理论基础,建立的自主生长毛状根体系可作为重金属吸附机理研究的可靠实验体系。
URL [本文引用: 1]

目的:重金属镉(Cd)因其致癌性强而引起业界广泛关注,Cd可通过工业废水、废渣污染土壤和水源,并通过食物链进入到动物及人体内对生物造成不可逆的损害。随着生物技术的不断发展,利用植物进行Cd污染的修复显示出良好的应用潜力。 自然界中存在可以富集Cd的超富集植物,能够在一定浓度的Cd污染环境中生存,并通过新陈代谢机制摄取和固定Cd。但目前已知的Cd超富集植物存在富集系数低、富集量有限等缺点,影响了实际应用。随着基因工程技术的发展,利用基因工程的手段对Cd超富集植物进行转基因改造,是促进Cd污染环境植物修复技术发展的重要途径。 因此本论文选择分布广泛、易获得的Cd超富集植物油菜(Brassica campestrisL.)进行转基因改造研究,希望通过农杆菌介导的方法建立转基因的油菜毛状根体系,今后可利用转基因毛状根体系作为Cd富集转基因改造研究平台。 方法:利用农杆菌介导的方法对油菜进行转基因毛状根的诱导和基因改造研究。利用油菜种子进行无菌培养获得外植体,同时将发根土壤杆菌ATCC15834进行单克隆培养、活化,将活化好的菌液与外植体子叶外植体进行共培养,后转移至含头孢噻肟钠(Cephalosporins, Cef)的培养基上进行除菌,10d后可获得油菜毛状根。设计引物对油菜毛状根进行PCR检测,检验rol B基因是否已整合进入植物毛状根组织。同时对不同的侵染时间、不同浓度萘乙酸(NAA)对油菜毛状根诱导的影响进行分析研究。 在确定油菜毛状根成功获得的基础上,利用Takara公司的pR1101质粒将与Cd富集相关的IRT1基因整合进ATCC15834菌种中,并利用改造过的ATCC15834浸染油菜子叶外植体,诱导获得转IRT1基因毛状根。同样设计引物利用PCR技术进行IRT1基因、rol B基因的检验,确定IRT1基因、rol B基因已经整合植物毛状根组织的DNA中。 最后对转IRT1基因毛状根进行Cd富集实验研究。将转IRTl基因油菜毛状根与野生菌诱导的油菜毛状根分别置于含不同浓度Cd的培养基上进行暗培养。7d和14d分别取样进行生物量、毛状根富集的Cd含量、培养基残留Cd含量的测定,探讨转入IRT1基因提高油菜毛状根富集Cd的可能性。 结果:设计引物对油菜毛状根进行PCR检测,可以检测到大小为423bp的rolB基因条带,确定发根农杆菌Ri质粒中的rol B基因已整合进入植物毛状根组织DNA中。目前未见有文献报道油菜毛状根的成功诱导。不同的侵染时间对毛状根的诱导有着较明显的影响,在一定范围的侵染时间内,毛状根的诱导率呈正态分布,其中侵染时间为4h时,毛状根的诱导率最高;在培养基中添加不同浓度的NAA也能不同程度地促进油菜毛状根的生长,在0-1.0mg/L的范围内,NAA浓度越高,油菜毛状根诱导率越高。 重组质粒IRT1-pRI101经测序后证明构建成功。经转化重组质粒IRT1-pRI101获得的重组菌ATCC15834侵染油菜子叶外植体获得转IRT1毛状根,设计引物进行IRT1基因、rol B基因的PCR检测,实验结果表明毛状根DNA中存在423bp、471bp大小条带,证明rol B基因、IRT1基因已经整合进入植物毛状根组织。 Cd富集实验结果表明,野生型和转IRT1油菜毛状根都能有效地富集培养基中的Cd。在不同浓度的Cd环境下,转入了IRTl基因的毛状根比野生型毛状根的生长状况更好,对Cd的富集量更高。随着培养基中Cd浓度的增加和培养时间的延长,转IRT1油菜毛状根对Cd的富集量也随之增加。在100μmol/L Cd培养基中培养14d后,转IRT1基因毛状根中富集的Cd含量为33.161±0.026μg/100mg毛状根,Cd富集系数达到7.261%±0.006%,比野生型毛状根的富集系数6.384%±00005%提高了13.73%±0.01%。 论文的研究结果为将来利用转IRTl基因油菜再生植株修复重金属Cd污染提供了应用理论基础,建立的自主生长毛状根体系可作为重金属吸附机理研究的可靠实验体系。
URL [本文引用: 2]

种子含油量是油菜品质育种的重要目标。在相同的遗传背景下,黄籽油菜的含油量一般高于黑籽、褐籽,且黄籽油菜具有种皮薄、色素少、杂质少、纤维素含量低、油清澈透明、蛋白质含量高等优点。本研究主要采用芥菜型黄籽油菜的外植体,通过构建转录因子基因TT2表达载体,建立高效遗传转化体系,鉴定其功能。 本研究以芥菜型油菜四川黄籽无菌苗的下胚轴为外植体,研究了无菌苗不同时期的外植体愈伤组织形成、下胚轴上段、中段和下段的愈伤组织形成、预培养基和分化培养基中激素配比等对下胚轴再生的影响。结果表明,3-5d的无菌苗形成愈伤组织最好。下胚轴的上段形成愈伤最快,分化率最高,达41.33%。下段次之,中段形成愈伤组织最慢,同时会产生褐化现象。下胚轴在MS+6-BA 1 mg/L+2,4-D 1.5 mg/L预培养基上培养2d后转接MS+2,4-D 2 mg/L+6-BA 0.5 mg/L的诱导愈伤培养基上诱导愈伤。用含有TT2基因干扰载体的农杆菌转化芥菜型油菜四川黄籽的下胚轴,分化培养基MS+6-BA 2 mg/L诱导分化,转基因植株形态正常,开花、结实,T0代植株种皮颜色为黄色。采用floral-dip方法进行转化,收获T0种子,种皮颜色也为黄色,待下一步检测。 采用正丁醇-盐酸法分析种皮中原花色素含量,四川黄籽经水浴前,溶液为橙色,水浴后仍为橙色。近等基因系NILA和NILB和紫叶芥,水浴前溶液为橙色,水浴后,溶液变为紫红色。这说明紫叶芥和近等基因系种皮中含有矢车菊素(cyanidin)或天竺葵(pelargonidin)色素衍生物,四川黄籽不含有这些物质。研究说明原花色素与油菜种皮颜色密切相关。
URL [本文引用: 2]

种子含油量是油菜品质育种的重要目标。在相同的遗传背景下,黄籽油菜的含油量一般高于黑籽、褐籽,且黄籽油菜具有种皮薄、色素少、杂质少、纤维素含量低、油清澈透明、蛋白质含量高等优点。本研究主要采用芥菜型黄籽油菜的外植体,通过构建转录因子基因TT2表达载体,建立高效遗传转化体系,鉴定其功能。 本研究以芥菜型油菜四川黄籽无菌苗的下胚轴为外植体,研究了无菌苗不同时期的外植体愈伤组织形成、下胚轴上段、中段和下段的愈伤组织形成、预培养基和分化培养基中激素配比等对下胚轴再生的影响。结果表明,3-5d的无菌苗形成愈伤组织最好。下胚轴的上段形成愈伤最快,分化率最高,达41.33%。下段次之,中段形成愈伤组织最慢,同时会产生褐化现象。下胚轴在MS+6-BA 1 mg/L+2,4-D 1.5 mg/L预培养基上培养2d后转接MS+2,4-D 2 mg/L+6-BA 0.5 mg/L的诱导愈伤培养基上诱导愈伤。用含有TT2基因干扰载体的农杆菌转化芥菜型油菜四川黄籽的下胚轴,分化培养基MS+6-BA 2 mg/L诱导分化,转基因植株形态正常,开花、结实,T0代植株种皮颜色为黄色。采用floral-dip方法进行转化,收获T0种子,种皮颜色也为黄色,待下一步检测。 采用正丁醇-盐酸法分析种皮中原花色素含量,四川黄籽经水浴前,溶液为橙色,水浴后仍为橙色。近等基因系NILA和NILB和紫叶芥,水浴前溶液为橙色,水浴后,溶液变为紫红色。这说明紫叶芥和近等基因系种皮中含有矢车菊素(cyanidin)或天竺葵(pelargonidin)色素衍生物,四川黄籽不含有这些物质。研究说明原花色素与油菜种皮颜色密切相关。
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11032-010-9483-4URL [本文引用: 1]

Anthocyanidin synthase (ANS) is a key enzyme of the proanthocyanidin biosynthetic pathway in Arabidopsis . In this study, we report cloning and characterization of an ANS homolog, BjANS, from Brassica juncea . The BjANS cDNA sequence is 1,37702bp long and has a 1,077-bp open reading frame encoding a deduced polypeptide of 358 amino acids with a predicted molecular weight of 40,86202Da and an estimated isoelectric point of 5.18. The putative BjANS protein shows 91–99% amino acid sequence identity with Arabidopsis thaliana , Matthiola incana , B. rapa and B. oleracea ANS proteins. The expression of BjANS was analyzed in yellow- and black-seeded B. juncea accessions to determine its physiological function. RT–PCR analysis showed that BjANS expressed in the seed coats of the black-seeded lines and in embryos of the all lines, but not in the yellow-seeded seed coats. Proanthocyanidins were also detected by histochemical analysis in the seed coat of black-seeded accessions and in embryos of all the lines, but not the yellow-seeded seed coat. Both transcriptional and histochemical analyses confirmed that BjANS was involved in the biosynthesis of proanthocyanidins and in seed coat color formation of B. juncea . Lack of BjANS expression blocked biosynthesis of proanthocyanidins in the yellow seed coat, and therefore seeds appeared yellow because of transparent testa.
[本文引用: 1]
[本文引用: 1]
DOI:10.1046/j.1365-313X.1997.11020289.xURLPMID:9076994 [本文引用: 1]

Abstract A mutant of Arabidopsis that accumulates a high level of red pigments within the seed coat has been isolated from a population of T-DNA-transformed plants. Genetic analysis revealed that the mutation is recessive and affects maternal seed tissues only. Due to the color of the immature seeds, this mutation was named banyuls (ban). Pigments accumulated continuously from early seed development to the desiccation stage in the seed coat of the mutant. The phenotype of the double mutant banyuls/ transparent testa confirmed the flavonoid nature of the pigments and enabled assignment of the regulatory TT (Transparent Testa) genes to two groups according to their epistatic relationship to ban. The flavonoid content of germinated ban and wild-type seedlings was similar. Plants harbouring the ban mutation had a normal formation of trichomes and root hairs and were not affected in their responses to light. The seeds of ban plants exhibited reduced germination compared to wild-type which may be a direct consequence of the high level of pigments. These results suggest that BANYULS functions as a negative regulator of flavonoid biosynthesis that prevents accumulation of pigments in the seed coat during early embryogenesis in Arabidopsis.
DOI:10.1242/dev.00681URLPMID:12917293 [本文引用: 1]

GLABRA3 (GL3) encodes a bHLH protein that interacts with the WD repeat protein, TTG1. GL3 overexpression suppresses the trichome defect of the pleiotropic ttg1 mutations. However, single gl3 mutations only affect the trichome pathway with a modest trichome number reduction. A novel unlinked bHLH-encoding locus is described here, ENHANCER OF GLABRA3 (EGL3). When mutated, egl3 gives totally glabrous plants only in the gl3 mutant background. The double bHLH mutant, gl3 egl3, has a pleiotropic phenotype like ttg1 having defective anthocyanin production, seed coat mucilage production, and position-dependent root hair spacing. Furthermore, the triple bHLH mutant, gl3 egl3 tt8, phenocopies the ttg1 mutation. Yeast two-hybrid and plant overexpression studies show that EGL3, like GL3, interacts with TTG1, the myb proteins GL1, PAP1 and 2, CPC and TRY, and it will form heterodimers with GL3. These results suggest a combinatorial model for TTG1-dependent pathway regulation by this trio of partially functionally redundant bHLH proteins.
[本文引用: 2]
[本文引用: 2]
.
URL [本文引用: 1]

黄籽油菜品种与黑籽油菜品种比,具有种皮薄、含油量高、蛋白含量高和纤维素低等优点,长期以来国内外育种家将黄籽油菜选育作为油菜育种的主要研究方向之一。 我国的栽培油菜主要有白菜型(Brassica rapa)、芥菜型(B. juncea)和甘蓝型(B. napus)三大类型。芥菜型油菜(Brassica juncea CzernCoss,2n=36, AABB)是通过二倍体的白菜(B. rapa,2n=20, AA)和黑芥(B. nigra,2n=16, BB)种间杂交而来。芥菜型油菜同白菜型油菜一样,有丰富的黄籽资源,且黄籽性状由2个基因位点控制。在先前的研究中,我们已将芥菜型油菜A09染色体黄籽基因BjuA.YSC基因定位在0.9cM范围内。本研究进一步利用BC8F2代分离群体精细定位了BjuA.YSC基因,利用其紧密连锁标记筛选BAC文库和BAC测序确定了候选基因,并采用转录组技术解析黄籽及其近等基因系的种皮基因表达差异,主要取得了如下研究结果: 1.利用已公布的白菜基因组序列、韩国白菜BAC序列开发标记和芸薹属植物A09连锁群已定位标记共316个标记进行筛选,发现其中31个标记与A09染色体控制种皮颜色的基因连锁。利用其中19个连锁标记分析1042株BC8F2植株,构建了4.77cM长的黄籽基因区域遗传图谱,将目的基因BjuA.YSC定位在标记Nal0A08与BnGMS351之间0.30cM内,并找到共分离标记S88-Ⅳ-2、H032N11-2和S121-Ⅰ-2。 2.进一步利用白菜基因组序列和测序的芥菜型油菜BAC(末端)序列开发了46对引物,分析发现12个连锁标记,利用更大的BC8F2群体(5434株)进行精细定位,结果表明芥菜型油菜BAC(末端)序列标记68N6和132001R也与BjuA.YSC共分离,侧翼标记S134-16和S102-5相距都为0.04cM。 3.利用BjuA.YSC的侧翼标记采用四维PCR法筛选芥菜型油菜作图群体亲本紫叶芥BAC文库,构建了BjuA.YSC基因区域约1Mb长的BAC重叠群。测序的BAC序列与拟南芥基因组序列进行BLAST分析,发现该区段编码66个基因,其中Gene_24为拟南芥基因At4g09820(TRANSPARENT TESTA8, TT8)的同源基因,该基因是在类黄酮生物合成途径中起调控作用的转录因子基因,因此推测该基因为候选基因。根据BjuA.YSC基因区域序列的特征以及遗传距离和物理距离比的分析,推测该区域可能为近着丝粒区域。 4.从上述作图群体的黑籽亲本紫叶芥和黄籽亲本四川黄籽中克隆TT8基因,发现各有2个拷贝,分别命名为BjuA.TT8和BjuB.TT8。 BjuA.TT8位于A09染色体,BjuB.TT8推测可能位于B组染色体。BjuA.TT8核苷酸序列在黄、黑籽亲本间不仅有SNP位点多态性,而且在黄籽亲本中有一段长为1275bp的序列插入,而BjuB.TT8的基因组序列在黄、黑籽亲本间没有差异。RT-PCR产物限制酶切分析表明四川黄籽BjuA.TT8中由于1275bp插入第7个外显子导致了该基因翻译提前终止。 5.利用芯片技术和RNA-seq技术分析了芥菜型油菜黄籽亲本四川黄籽及其褐籽近等基因系NILA授粉后15天种皮中基因的表达,分别获得25和1304个差异表达基因,其中包括类黄酮合成途径基因。qRT-PCR分析进一步证实CHS、DFR、 LDOX, ANR等类黄酮合成基因在黄籽种皮中不表达或表达显著下调,说明这些基因与种皮颜色的形成密切相关。 综上所述,在芥菜型油菜黄籽材料四川黄籽中由于BjuA.TT8基因第7外显子插入突变导致翻译提前终止,其编码的bHLH转录因子蛋白功能缺失,不能正常参与MBW转录因子复合体的形成,可能导致原花色素合成途径基因不能正常表达,种皮中不能合成原花色素,种皮透明,种子呈现胚的黄颜色,产生黄籽。
URL [本文引用: 1]

黄籽油菜品种与黑籽油菜品种比,具有种皮薄、含油量高、蛋白含量高和纤维素低等优点,长期以来国内外育种家将黄籽油菜选育作为油菜育种的主要研究方向之一。 我国的栽培油菜主要有白菜型(Brassica rapa)、芥菜型(B. juncea)和甘蓝型(B. napus)三大类型。芥菜型油菜(Brassica juncea CzernCoss,2n=36, AABB)是通过二倍体的白菜(B. rapa,2n=20, AA)和黑芥(B. nigra,2n=16, BB)种间杂交而来。芥菜型油菜同白菜型油菜一样,有丰富的黄籽资源,且黄籽性状由2个基因位点控制。在先前的研究中,我们已将芥菜型油菜A09染色体黄籽基因BjuA.YSC基因定位在0.9cM范围内。本研究进一步利用BC8F2代分离群体精细定位了BjuA.YSC基因,利用其紧密连锁标记筛选BAC文库和BAC测序确定了候选基因,并采用转录组技术解析黄籽及其近等基因系的种皮基因表达差异,主要取得了如下研究结果: 1.利用已公布的白菜基因组序列、韩国白菜BAC序列开发标记和芸薹属植物A09连锁群已定位标记共316个标记进行筛选,发现其中31个标记与A09染色体控制种皮颜色的基因连锁。利用其中19个连锁标记分析1042株BC8F2植株,构建了4.77cM长的黄籽基因区域遗传图谱,将目的基因BjuA.YSC定位在标记Nal0A08与BnGMS351之间0.30cM内,并找到共分离标记S88-Ⅳ-2、H032N11-2和S121-Ⅰ-2。 2.进一步利用白菜基因组序列和测序的芥菜型油菜BAC(末端)序列开发了46对引物,分析发现12个连锁标记,利用更大的BC8F2群体(5434株)进行精细定位,结果表明芥菜型油菜BAC(末端)序列标记68N6和132001R也与BjuA.YSC共分离,侧翼标记S134-16和S102-5相距都为0.04cM。 3.利用BjuA.YSC的侧翼标记采用四维PCR法筛选芥菜型油菜作图群体亲本紫叶芥BAC文库,构建了BjuA.YSC基因区域约1Mb长的BAC重叠群。测序的BAC序列与拟南芥基因组序列进行BLAST分析,发现该区段编码66个基因,其中Gene_24为拟南芥基因At4g09820(TRANSPARENT TESTA8, TT8)的同源基因,该基因是在类黄酮生物合成途径中起调控作用的转录因子基因,因此推测该基因为候选基因。根据BjuA.YSC基因区域序列的特征以及遗传距离和物理距离比的分析,推测该区域可能为近着丝粒区域。 4.从上述作图群体的黑籽亲本紫叶芥和黄籽亲本四川黄籽中克隆TT8基因,发现各有2个拷贝,分别命名为BjuA.TT8和BjuB.TT8。 BjuA.TT8位于A09染色体,BjuB.TT8推测可能位于B组染色体。BjuA.TT8核苷酸序列在黄、黑籽亲本间不仅有SNP位点多态性,而且在黄籽亲本中有一段长为1275bp的序列插入,而BjuB.TT8的基因组序列在黄、黑籽亲本间没有差异。RT-PCR产物限制酶切分析表明四川黄籽BjuA.TT8中由于1275bp插入第7个外显子导致了该基因翻译提前终止。 5.利用芯片技术和RNA-seq技术分析了芥菜型油菜黄籽亲本四川黄籽及其褐籽近等基因系NILA授粉后15天种皮中基因的表达,分别获得25和1304个差异表达基因,其中包括类黄酮合成途径基因。qRT-PCR分析进一步证实CHS、DFR、 LDOX, ANR等类黄酮合成基因在黄籽种皮中不表达或表达显著下调,说明这些基因与种皮颜色的形成密切相关。 综上所述,在芥菜型油菜黄籽材料四川黄籽中由于BjuA.TT8基因第7外显子插入突变导致翻译提前终止,其编码的bHLH转录因子蛋白功能缺失,不能正常参与MBW转录因子复合体的形成,可能导致原花色素合成途径基因不能正常表达,种皮中不能合成原花色素,种皮透明,种子呈现胚的黄颜色,产生黄籽。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]

油菜是世界上最主要的油料作物之一,目前各国都在大力发展优质油菜,主要表现在降低种子中的芥酸、硫苷、亚麻酸及纤维素含量,提高油酸和蛋白质含量。在相同的遗传背景下,黄籽油菜的种子含油量普遍高于黑籽;且黄籽油菜具有种皮薄、色素少、纤维素含量低、油清澈透明、蛋白质含量高等优点。目前在生产上种植的油菜普遍是甘蓝型黑籽油菜,而不是甘蓝型黄籽油菜。培育甘蓝型黄籽油菜将有广阔的前景,但在广泛栽培甘蓝型油菜中没有天然的黄籽种质,通过远缘杂交或诱变等育成的甘蓝型黄籽油菜的黄籽性状遗传不稳定且种子是杂黄色。油菜黄籽形成的机理还未研究清楚,因此培育优良的黄籽油菜成为了油菜育种的一个难题。 芥菜型油菜种皮颜色为质量性状,与黑种皮性状相比,黄色种皮为隐性,多数研究结果认为芥菜型油菜种皮颜色是由1-2个基因控制。本试验研究了芥菜型油菜种皮颜色的遗传,找到了种皮颜色基因紧密连锁的标记;分析了芥菜型油菜油菜种皮的化学成分;克隆了芥菜型油菜类黄酮生物合成途径中的相关基因,并用RT-PCR方法对这些基因在种子和种皮中的表达进行了分析,研究结果如下: 无论是黄籽油菜还是黑籽油菜种子的胚都是黄色的,黄籽的种皮是透明的,黑籽的种皮为黑色,黄籽颜色是其胚颜色的体现。 种皮颜色由2对独立的基因控制,只要一个位点为显性,种皮就为黑色。以四川黄籽为轮回亲本,紫叶芥为供体亲本培育的BC_5F_2分离群体为种皮颜色基因的定位群体,找到了2个与棕色种皮基因连锁的SCAR标记SZ1_(-331)和SCAR57_(-383)。连锁分析表明,标记SZ1_(-331)和SCAR57_(-383)标记与种皮颜色基因位点的交换率都为2.35%,遗传距离都为2.5cM,二者位于基因的同一侧,与已发表的标记RA2-A11位于同一连锁群。 测定了种皮中多酚,花色素,纤维素、黑色素和木质素的含量;紫叶芥种皮与四川黄籽种皮的花色素、黑色素和木质素含量之比依次为3.26、3.73、3.02;紫叶芥种皮与四川黄籽种皮中的多酚和纤维素含量之比为分别为1.16、0.99。基于加入位移试剂后特征吸收谱带Ⅰ与Ⅱ的位移方向与大小,推测了黑籽种皮多酚可能含有A环有邻二酚羟基,这种多酚分子结构差异可能是芥菜型油菜种皮色泽差异的主要原因。利用香草醛染色的方法发现了在发育中的黑籽芥菜型油菜种皮中含有黄烷3,4-二羟基醇和黄烷4-羟基醇,而黄籽种皮中没有这些物质。利用能与原花色素特异结合产生蓝色物质的染料对二甲氨基肉桂醛(DMACA)对成熟的芥菜型油菜种皮进行染色,发现黑籽种皮被染上蓝色,而黄籽种皮不能染色,表明在黄籽种皮中不含原花色素,因此认为原花色素是导致芥菜型油菜黄黑籽种皮颜色差异的主要物质。 采用同源克隆的方法,参照拟南芥等植物控制类黄酮合成的基因序列设计引物,克隆了芥菜型油菜类黄酮合成相关基因拷贝。对克隆的拷贝进行测序和BLAST分析,克隆的26基因拷贝属于21个已知功能的基因,其中CHS和PAP有3个拷贝,CHI有2个拷贝,其他基因只获得一个拷贝。在GenBank上,除GST外,其他基因序列在芥菜型油菜未见报道,其中F3H、LAC、TT12、TT1、TT8、TT16、TTGJ、TTG2、AHA10、BAN、PAP和FLS的序列,在芸薹属植物中未见报道。 以克隆的芥菜型油菜类黄酮合成基因序列为基础,利用RT-PCR方法,对这些基因在四川黄籽、紫叶芥及其黑籽近等基因系NILA和NILB种子和种皮中的转录进行了分析。基因PAP和AHA10在种子和种皮中均没有检测到表达;结构基因PAL、C4H、CHS、CHI、F3H、F3'H、LAC、TT12、GST、FLS和调节基因TT1、TT2、TT8、TT16、TTG1、TTG2在黄黑籽种子和种皮中均检测到表达,其中CHS在黄黑籽种皮间表达量有明显的差异,黑籽种皮的表达量明显高于黄籽;DFR、BAN和ANS基因在黄黑籽种子和黑籽种皮中表达,但在黄籽种皮中没有表达。 本研究表明DFR、ANS和BAN基因的在种皮中的不表达将会导致在芥菜型油菜透明种皮的形成,从而产生黄籽。
URL [本文引用: 1]

油菜是世界上最主要的油料作物之一,目前各国都在大力发展优质油菜,主要表现在降低种子中的芥酸、硫苷、亚麻酸及纤维素含量,提高油酸和蛋白质含量。在相同的遗传背景下,黄籽油菜的种子含油量普遍高于黑籽;且黄籽油菜具有种皮薄、色素少、纤维素含量低、油清澈透明、蛋白质含量高等优点。目前在生产上种植的油菜普遍是甘蓝型黑籽油菜,而不是甘蓝型黄籽油菜。培育甘蓝型黄籽油菜将有广阔的前景,但在广泛栽培甘蓝型油菜中没有天然的黄籽种质,通过远缘杂交或诱变等育成的甘蓝型黄籽油菜的黄籽性状遗传不稳定且种子是杂黄色。油菜黄籽形成的机理还未研究清楚,因此培育优良的黄籽油菜成为了油菜育种的一个难题。 芥菜型油菜种皮颜色为质量性状,与黑种皮性状相比,黄色种皮为隐性,多数研究结果认为芥菜型油菜种皮颜色是由1-2个基因控制。本试验研究了芥菜型油菜种皮颜色的遗传,找到了种皮颜色基因紧密连锁的标记;分析了芥菜型油菜油菜种皮的化学成分;克隆了芥菜型油菜类黄酮生物合成途径中的相关基因,并用RT-PCR方法对这些基因在种子和种皮中的表达进行了分析,研究结果如下: 无论是黄籽油菜还是黑籽油菜种子的胚都是黄色的,黄籽的种皮是透明的,黑籽的种皮为黑色,黄籽颜色是其胚颜色的体现。 种皮颜色由2对独立的基因控制,只要一个位点为显性,种皮就为黑色。以四川黄籽为轮回亲本,紫叶芥为供体亲本培育的BC_5F_2分离群体为种皮颜色基因的定位群体,找到了2个与棕色种皮基因连锁的SCAR标记SZ1_(-331)和SCAR57_(-383)。连锁分析表明,标记SZ1_(-331)和SCAR57_(-383)标记与种皮颜色基因位点的交换率都为2.35%,遗传距离都为2.5cM,二者位于基因的同一侧,与已发表的标记RA2-A11位于同一连锁群。 测定了种皮中多酚,花色素,纤维素、黑色素和木质素的含量;紫叶芥种皮与四川黄籽种皮的花色素、黑色素和木质素含量之比依次为3.26、3.73、3.02;紫叶芥种皮与四川黄籽种皮中的多酚和纤维素含量之比为分别为1.16、0.99。基于加入位移试剂后特征吸收谱带Ⅰ与Ⅱ的位移方向与大小,推测了黑籽种皮多酚可能含有A环有邻二酚羟基,这种多酚分子结构差异可能是芥菜型油菜种皮色泽差异的主要原因。利用香草醛染色的方法发现了在发育中的黑籽芥菜型油菜种皮中含有黄烷3,4-二羟基醇和黄烷4-羟基醇,而黄籽种皮中没有这些物质。利用能与原花色素特异结合产生蓝色物质的染料对二甲氨基肉桂醛(DMACA)对成熟的芥菜型油菜种皮进行染色,发现黑籽种皮被染上蓝色,而黄籽种皮不能染色,表明在黄籽种皮中不含原花色素,因此认为原花色素是导致芥菜型油菜黄黑籽种皮颜色差异的主要物质。 采用同源克隆的方法,参照拟南芥等植物控制类黄酮合成的基因序列设计引物,克隆了芥菜型油菜类黄酮合成相关基因拷贝。对克隆的拷贝进行测序和BLAST分析,克隆的26基因拷贝属于21个已知功能的基因,其中CHS和PAP有3个拷贝,CHI有2个拷贝,其他基因只获得一个拷贝。在GenBank上,除GST外,其他基因序列在芥菜型油菜未见报道,其中F3H、LAC、TT12、TT1、TT8、TT16、TTGJ、TTG2、AHA10、BAN、PAP和FLS的序列,在芸薹属植物中未见报道。 以克隆的芥菜型油菜类黄酮合成基因序列为基础,利用RT-PCR方法,对这些基因在四川黄籽、紫叶芥及其黑籽近等基因系NILA和NILB种子和种皮中的转录进行了分析。基因PAP和AHA10在种子和种皮中均没有检测到表达;结构基因PAL、C4H、CHS、CHI、F3H、F3'H、LAC、TT12、GST、FLS和调节基因TT1、TT2、TT8、TT16、TTG1、TTG2在黄黑籽种子和种皮中均检测到表达,其中CHS在黄黑籽种皮间表达量有明显的差异,黑籽种皮的表达量明显高于黄籽;DFR、BAN和ANS基因在黄黑籽种子和黑籽种皮中表达,但在黄籽种皮中没有表达。 本研究表明DFR、ANS和BAN基因的在种皮中的不表达将会导致在芥菜型油菜透明种皮的形成,从而产生黄籽。
URL [本文引用: 1]

二苯乙烯苷被2010年中国药典确定为何首乌质量控制的指标性成分,其含有多个酚羟基,在抗氧化、抗衰老、降血脂以及保护心血管方面都有很好的应用前景,潜在的社会需求大(与之有相同结构母核的白藜芦醇苷已被日本、美国等国家作为日常膳食添加剂,推荐成人用量4mg/d)[1]。而天然药材中次生代谢产物的含量很少,并且野生资源日渐减少以及野生种质退化,使得野生型中药材的供求之间存在矛盾,现代生物技术的快速发展有效的解决这一矛盾。调控何首乌中二苯乙烯苷的生物合成代谢,这就需要清楚二苯乙烯苷生物合成路径以及合成过程中的关键酶基因。而目前对此文献鲜有报道,故对其合成路径以及关键酶基因的研究很有必要。 本论文主要目的是研究以芪类化合物合成酶的保守序列为基础,通过RACE扩增技术在何首乌中得到的芪合酶基因(Fm-STS)的功能,并建立一套完整的研究植物基因功能的方法体系。采用的方法是由含CaMV35S启动子驱动和GFP基因的植物转基因基础表达质粒pBIN-35S-GFP,构建过量表达质粒载体pBIN-35S-STS-GFP(阳性)和双链RNA介导的RNA干扰重组质粒载体pBIN-35S-正向-反向-GFP(阴性),并同空白表达质粒pBIN-35S-GFP(空白)分别导入野生型发根农杆菌ATCC15834中,得到表达菌种阳性、阴性和空白,进而转化何首乌外植体(无菌苗叶片),诱导生成毛状根并对其进行培养,对各组毛状根进行高效液相色谱分析芪类化合物二苯乙烯苷含量差异以及实时荧光定量检测芪合酶基因(Fm-STS)表达水平。 本文的主要研究成果如下: 1)过量表达质粒载体pBIN-35S-STS-GFP(阳性)和双链RNA介导的RNA干扰重组质粒载体pBIN-35S-正向-反向-GFP(阴性)构建成功,经过抗性筛选、PCR扩增、双酶切和测序等验证。 2)目的基因片段均有效的导入何首乌毛状根核基因组中,并在毛状根中顺利表达。由于发根农杆菌Ri质粒上的T-DNA有将目的片段直接导入植物细胞的基因组中的特性,并用ZEISS显微镜在290nm下检测到毛状根中GFP基因得到表达,而由于目的基因片段与GFP基因连接在同一个CaMV35S启动子驱动之后。 3)通过HPLC检测芪合酶基因Fm-STS的过量表达组、RNA干扰组以及空白对照组毛状根中二苯乙烯苷含量,其中RNAi组、空白对照组以及过量表达组二苯乙烯苷的含量依次为0.65±0.07mg/g、2.18±0.12mg/g和4.67±0.11mg/g,可见芪合酶基因Fm-STS与二苯乙烯苷的含量成正相关关系,即可说明芪合酶基因Fm-STS参与到二苯乙烯苷的生物合成中。 4)通过Real-Time PCR技术在以上三组毛状根中mRNA水平上对目的基因FM-STS表达差异进行分析,发现过量表达组最高,其中过量表达组为空白组的2.41倍、RNAi组为空白组的1/433倍,说明在RNA表达水平上三组存在显著差异,结合HPLC中测得的二苯乙烯苷含量可知,基因表达与产物积累成正相关,而且芪合酶基因Fm-STS的表达量对二苯乙烯苷积累影响是显著的。可说明芪合酶基因Fm-STS是二苯乙烯苷的生物合成中的一种关键酶。 5)双链RNA介导的RNA干扰能有效的沉默目的芪合酶基因Fm-STS。可由上述结果中干扰组Fm-STS基因的表达水平仅为空白组的1/433,且RNA干扰组进行普通PCR扩增后电泳检测得在目的基因位置无明显条带;在毛状根生长过程中,RNA干扰组毛状根长得最慢,空白组次之,过量表达组长势最快。均能说明双链RNA介导的RNA干扰能有效的沉默目的芪合酶基因Fm-STS。 6)何首乌中可能存在其他芪合酶基因Fm-STS的家族酶基因。由于干扰组毛状根中依然有二苯乙烯苷存在,且约为空白组的1/4,这与基因在RNA表达水平上的1/433相差较大,我们也可推断何首乌中可能存在其他的芪合酶基因或为Fm-STS基因的家族酶基因。 7)使用HPLC和Real-Time PCR技术检测同一株何首乌根茎叶中二苯乙烯苷含量以及芪合酶基因Fm-STS表达差异。发现二苯乙烯苷在何首乌根块中含量最高,茎中次之,叶片中含量最少(根:14.62±0.09mg/g;茎:1.78±0.12mg/g;叶:0.47±0.07mg/g);而芪合酶基因Fm-STS表达水平分析知该基因在何首乌叶片中表达量最高,根中表达量约为叶片中表达量的1/10;茎中表达量约为叶片中表达量的1/64。可见在何首乌中二苯乙烯苷主要是合成部位是叶片,进而通过转移到根块中富集。
URL [本文引用: 1]

二苯乙烯苷被2010年中国药典确定为何首乌质量控制的指标性成分,其含有多个酚羟基,在抗氧化、抗衰老、降血脂以及保护心血管方面都有很好的应用前景,潜在的社会需求大(与之有相同结构母核的白藜芦醇苷已被日本、美国等国家作为日常膳食添加剂,推荐成人用量4mg/d)[1]。而天然药材中次生代谢产物的含量很少,并且野生资源日渐减少以及野生种质退化,使得野生型中药材的供求之间存在矛盾,现代生物技术的快速发展有效的解决这一矛盾。调控何首乌中二苯乙烯苷的生物合成代谢,这就需要清楚二苯乙烯苷生物合成路径以及合成过程中的关键酶基因。而目前对此文献鲜有报道,故对其合成路径以及关键酶基因的研究很有必要。 本论文主要目的是研究以芪类化合物合成酶的保守序列为基础,通过RACE扩增技术在何首乌中得到的芪合酶基因(Fm-STS)的功能,并建立一套完整的研究植物基因功能的方法体系。采用的方法是由含CaMV35S启动子驱动和GFP基因的植物转基因基础表达质粒pBIN-35S-GFP,构建过量表达质粒载体pBIN-35S-STS-GFP(阳性)和双链RNA介导的RNA干扰重组质粒载体pBIN-35S-正向-反向-GFP(阴性),并同空白表达质粒pBIN-35S-GFP(空白)分别导入野生型发根农杆菌ATCC15834中,得到表达菌种阳性、阴性和空白,进而转化何首乌外植体(无菌苗叶片),诱导生成毛状根并对其进行培养,对各组毛状根进行高效液相色谱分析芪类化合物二苯乙烯苷含量差异以及实时荧光定量检测芪合酶基因(Fm-STS)表达水平。 本文的主要研究成果如下: 1)过量表达质粒载体pBIN-35S-STS-GFP(阳性)和双链RNA介导的RNA干扰重组质粒载体pBIN-35S-正向-反向-GFP(阴性)构建成功,经过抗性筛选、PCR扩增、双酶切和测序等验证。 2)目的基因片段均有效的导入何首乌毛状根核基因组中,并在毛状根中顺利表达。由于发根农杆菌Ri质粒上的T-DNA有将目的片段直接导入植物细胞的基因组中的特性,并用ZEISS显微镜在290nm下检测到毛状根中GFP基因得到表达,而由于目的基因片段与GFP基因连接在同一个CaMV35S启动子驱动之后。 3)通过HPLC检测芪合酶基因Fm-STS的过量表达组、RNA干扰组以及空白对照组毛状根中二苯乙烯苷含量,其中RNAi组、空白对照组以及过量表达组二苯乙烯苷的含量依次为0.65±0.07mg/g、2.18±0.12mg/g和4.67±0.11mg/g,可见芪合酶基因Fm-STS与二苯乙烯苷的含量成正相关关系,即可说明芪合酶基因Fm-STS参与到二苯乙烯苷的生物合成中。 4)通过Real-Time PCR技术在以上三组毛状根中mRNA水平上对目的基因FM-STS表达差异进行分析,发现过量表达组最高,其中过量表达组为空白组的2.41倍、RNAi组为空白组的1/433倍,说明在RNA表达水平上三组存在显著差异,结合HPLC中测得的二苯乙烯苷含量可知,基因表达与产物积累成正相关,而且芪合酶基因Fm-STS的表达量对二苯乙烯苷积累影响是显著的。可说明芪合酶基因Fm-STS是二苯乙烯苷的生物合成中的一种关键酶。 5)双链RNA介导的RNA干扰能有效的沉默目的芪合酶基因Fm-STS。可由上述结果中干扰组Fm-STS基因的表达水平仅为空白组的1/433,且RNA干扰组进行普通PCR扩增后电泳检测得在目的基因位置无明显条带;在毛状根生长过程中,RNA干扰组毛状根长得最慢,空白组次之,过量表达组长势最快。均能说明双链RNA介导的RNA干扰能有效的沉默目的芪合酶基因Fm-STS。 6)何首乌中可能存在其他芪合酶基因Fm-STS的家族酶基因。由于干扰组毛状根中依然有二苯乙烯苷存在,且约为空白组的1/4,这与基因在RNA表达水平上的1/433相差较大,我们也可推断何首乌中可能存在其他的芪合酶基因或为Fm-STS基因的家族酶基因。 7)使用HPLC和Real-Time PCR技术检测同一株何首乌根茎叶中二苯乙烯苷含量以及芪合酶基因Fm-STS表达差异。发现二苯乙烯苷在何首乌根块中含量最高,茎中次之,叶片中含量最少(根:14.62±0.09mg/g;茎:1.78±0.12mg/g;叶:0.47±0.07mg/g);而芪合酶基因Fm-STS表达水平分析知该基因在何首乌叶片中表达量最高,根中表达量约为叶片中表达量的1/10;茎中表达量约为叶片中表达量的1/64。可见在何首乌中二苯乙烯苷主要是合成部位是叶片,进而通过转移到根块中富集。
DOI:10.1006/meth.2001.1262URL [本文引用: 1]
URL [本文引用: 1]

苦荞是一种古老的一年生双子叶草本植物,它广泛分布于世界各地,具有适应性强、耐干旱、耐贫瘠、抗盐碱等特点。苦荞起源于我国,其具有极高的营养保健功能,同时兼具优秀的食疗作用以及卓越的药用价值,是许多绿色食品和重要功能性食品的生产原料。本研究以园子荞、川荞1号和九江苦荞三种不同苦荞品种为试验材料,建立了一个高效的经由发根农杆菌诱导的苦荞毛状根培养体系。同时,深入探讨了影响毛状根诱导的诸多因素。试验发现,发根农杆菌A4对苦荞毛状根的诱导能力最好,园子荞较其他两种苦荞更易诱导苦荞毛状根的产生。经过两天的预培养,利用发根农杆菌A4菌液侵染园子荞下胚轴,其毛状根诱导效果最好,诱导率可达到83.6%。本研究还以园子荞和九江苦荞两种不同苦养品种为试验材料,利用不同外植体,不同培养基进行诱导培养,成功建立了经由体细胞胚胎途径的苦荞高频再生体系。结果表明:苦荞下胚轴的再生能力最好,园子荞的再生能力较强;最佳愈伤组织诱导培养基为MS培养基中添加2.0 mg/L 2,4-D和1.0 mg/L KT,其诱导率可达98.94%;最佳芽分化培养基为MS培养基中添加1.0 mg/L KT和2.0 mg/L 6-BA,其诱导率可达55.53%;最佳生根培养基为1/2MS培养基中添加1.0 mg/L IBA,其生根率高达86%。同时,我们还以苦荞顶端分生组织为外植体,通过直接诱导丛生芽的产生,首次建立了经由组织器官途径的苦荞高频再生体系。其最佳丛生芽诱导培养基为MS培养基中添加2.0 mg/L 6-BA和0.5 mg/L TDZ,最高芽分化率达69.05%,平均外植体出芽数最高可达18个。
URL [本文引用: 1]

苦荞是一种古老的一年生双子叶草本植物,它广泛分布于世界各地,具有适应性强、耐干旱、耐贫瘠、抗盐碱等特点。苦荞起源于我国,其具有极高的营养保健功能,同时兼具优秀的食疗作用以及卓越的药用价值,是许多绿色食品和重要功能性食品的生产原料。本研究以园子荞、川荞1号和九江苦荞三种不同苦荞品种为试验材料,建立了一个高效的经由发根农杆菌诱导的苦荞毛状根培养体系。同时,深入探讨了影响毛状根诱导的诸多因素。试验发现,发根农杆菌A4对苦荞毛状根的诱导能力最好,园子荞较其他两种苦荞更易诱导苦荞毛状根的产生。经过两天的预培养,利用发根农杆菌A4菌液侵染园子荞下胚轴,其毛状根诱导效果最好,诱导率可达到83.6%。本研究还以园子荞和九江苦荞两种不同苦养品种为试验材料,利用不同外植体,不同培养基进行诱导培养,成功建立了经由体细胞胚胎途径的苦荞高频再生体系。结果表明:苦荞下胚轴的再生能力最好,园子荞的再生能力较强;最佳愈伤组织诱导培养基为MS培养基中添加2.0 mg/L 2,4-D和1.0 mg/L KT,其诱导率可达98.94%;最佳芽分化培养基为MS培养基中添加1.0 mg/L KT和2.0 mg/L 6-BA,其诱导率可达55.53%;最佳生根培养基为1/2MS培养基中添加1.0 mg/L IBA,其生根率高达86%。同时,我们还以苦荞顶端分生组织为外植体,通过直接诱导丛生芽的产生,首次建立了经由组织器官途径的苦荞高频再生体系。其最佳丛生芽诱导培养基为MS培养基中添加2.0 mg/L 6-BA和0.5 mg/L TDZ,最高芽分化率达69.05%,平均外植体出芽数最高可达18个。
DOI:10.1093/jxb/erq442URL [本文引用: 1]
DOI:10.1016/j.molp.2017.05.008URL [本文引用: 1]
