 , 贺勇
, 贺勇* 通讯作者(Corresponding author): 周小云, E-mail: xyzhou71@hotmail.com 第一作者联系方式: 王莎, E-mail:
收稿日期:2016-07-20 接受日期:2016-11-02网络出版日期:2016-11-11基金:
摘要
关键词: OsWR2; RNAi; 植物角质层; 干旱胁迫; 非气孔性失水
Influence of OsWR2-RNAi on Rice Cuticle Biosynthesis and Drought Resistance
WANG Sha
 , HE Yong
, HE YongFund:
Abstract
Keyword: OsWR2; RNAi; Plant cuticle; Drought stress; Non-stomatal water loss
Show Figures
Show Figures












植物失水主要通过气孔蒸腾和角质蒸腾, 正常生理条件下, 前者占90%而后者占10%左右[1]。但是持续干旱胁迫时, 植物气孔关闭, 水分的气孔蒸腾(气孔性失水)受阻, 而角质蒸腾(非气孔性失水)仍在继续, 造成植物的持续失水。因而, 角质蒸腾已成为植物在持续干旱胁迫下最主要的失水方式, 并已在拟南芥、苜蓿等植物的研究中得到证实[2, 3, 4]。控制植物的角质蒸腾, 将对持续干旱胁迫下植物生命的维持起着至关重要的作用并成为近年来植物干旱胁迫研究的热点[1, 5]。植物的角质层覆盖在植物表皮细胞外, 是由表皮蜡质和角质组成不溶于水而溶于部分有机溶剂的脂质性保护层[6, 7]。植物的角质层除具有限制植物非气孔性水分散失的作用外, 还能阻挡紫外辐射、防止外源病虫害侵入, 以及降低灰尘、花粉和空气中的污染物在植物表面沉积等, 是植物在长期进化过程中形成的抵御外界不良环境的天然屏障[8, 9, 10]。植物非气孔性失水与植物耐干旱反应密切相关, 干旱胁迫能诱导植物表面角质层蜡质晶体的积累, 导致表皮蜡质和角质的结构、成分及含量改变, 进而引起植物表皮通透性改变, 增加植物对干旱胁迫的耐受能力[11, 12, 13, 14]。OsWR2 (Os06g0604000)是水稻AP2/ERF超家族中ERF亚家族转录因子基因, 本研究团队Zhou等[15]研究发现, 过表达OsWR2既影响水稻表皮蜡质的组分和含量, 也影响角质的结构和生物合成, 是水稻角质层合成代谢途径中的重要调控基因, 同时OsWR2过表达的水稻植株对干旱胁迫耐受性明显增加。为阐明OsWR2调控角质层非气孔性失水的生理机制, 本研究构建了OsWR2-RNAi载体并转入水稻, 获得抑制OsWR2表达的转基因突变植株Ri-OsWR2, 通过对Ri-OsWR2与OE-OsWR2转基因植株以及野生型水稻(WT)日本晴植株在表皮蜡质和角质的组分、含量、结构、表皮通透性、失水率和耐干旱胁迫能力等方面的比较, 解析水稻角质层表皮蜡质和角质与非气孔性失水的关系, 以期进一步验证OsWR2基因参与角质层生物合成和耐干旱胁迫的功能, 并为水稻耐旱性状的改良提供重要基因资源。
1 材料与方法1.1 试验材料过表达植株OE-OsWR2由本团队研究所得[15], 粳稻品种日本晴(Oryza sativa L.)以及载体pCAMBIA1305.1质粒、pCAMBIA1300-Muti质粒、大肠杆菌DH5a、农杆菌EHA105均由湖南省作物基因工程重点实验室保存。
1.2 试验方法1.2.1 OsWR2-RNAi的载体构建和转基因植株的获得 从pCAMBIA1305.1质粒上扩增GUS内含子片段约190 bp (引物: F: 5'-GTAAATTTCTAGTTTTT CTC-3', R: 5'-CTGTAACTATCATCATCATC-3'), 连接到pCAMBIA1300-Muti质粒的35S启动子下游, 构建pCAMBIA1300M-GUS中间载体; 引入不同的酶切位点设计引物OsWR2-RiBamHIF: 5'-ATGGA TCCTTCTCCTACTCTGCCTGCCTCCT-3', OsWR2- RiSmaIR: 5'-ATCCCGGGAGACGCCAATGTGGGA CTTCTC-3'; OsWR2-RiSpeIF: 5'-ATACTAGTTCTCC TACTCTGCCTGCCTCCT-3', OsWR2-RiXbaIR: 5'-AT TCTAGAGACGCCAATGTGGGACTTCTC-3', 从水稻cDNA上分别扩增OsWR2-RNAi的正反向基因片段, 并分别连接到pCAMBIA1300M-GUS质粒的GUS基因片段上下游以构建OsWR2-RNAi载体, 以电激法转入农杆菌EHA105菌株, 农杆菌介导转化水稻粳稻品种日本晴, 获得OsWR2-RNAi转基因植株。
1.2.2 OsWR2-RNAi转基因水稻植株的实时定量PCR分析 从PCR和Southern杂交鉴定阳性的OsWR2-RNAi (Ri-OsWR2)转基因水稻株系中选取3个株系(Ri1, Ri2, Ri3), 采用实时定量PCR法分析OsWR2的表达, 从每个株系取2个单株的幼嫩叶片, 约0.1 g, 液氮速冻后研磨, 采用TRIzol试剂抽提方法提取水稻总RNA, Promega反转录试剂盒将RNA反转录成cDNA, 以OsUBQ1 (F: 5'-ACCCTGGCTG ACTACAACATC-3', R: 5'-AGTTGACAGCCCTAGG GTG-3')为内源性参照标准, SYBR Green I为染料, 用Applied Biosystems7500实时PCR测定仪检测, 设置3个独立的重复性试验, 参照Zhou等[15]的方法分析数据。
1.2.3 扫描电镜样品的制备与观察 取分蘖后期至拔节期的Ri-OsWR2, 过表达(OE-OsWR2)和野生型日本晴水稻(WT)叶片的同一部位, 用扫描电子显微镜观察成熟水稻叶片的蜡质晶体, 戊二醛固定样品, 保存于4℃的冰箱内, 按扫描电子显微镜的要求脱水干燥后, 将样品于JEOL JFC-1600镀膜机上喷金镀膜, 于JSM-6360LV扫描电子显微镜下观察其形态并拍照。
1.2.4 水稻叶片表皮蜡质提取和蜡质总量、组成成分分析 参照周小云等[16]的加热法提取蜡质, 称取Ri-OsWR2、OE-OsWR2和WT水稻成熟叶片1 g浸没于30 mL 60℃氯仿中30 s后取出, 室温冷却后加5 μ g二十四碳烷内标物, 以氮气吹干后, 加入1 mL吡啶使其完全溶解, 取250 μ L提取液, 加入250 μ L BSTFA 70℃加热40 min衍生后, 采用Chen等[8]方法用气相色谱-质谱联用法(GC-MS)分析蜡质组分, 并采用峰面积归一法测定各组分的相对含量。
1.2.5 水稻叶片角质单体组分含量分析 参照Zhou等[15]的方法分析Ri-OsWR2、OE-OsWR2转基因植株和野生型水稻植株叶片角质单体含量。
1.2.6 水稻叶片叶绿素浸提率分析 取分蘖后期至拔节期前的Ri-OsWR2、OE-OsWR2转基因植株和野生型水稻植株的成熟叶片0.1 g, 剪成约2 cm长度, 浸没于40 mL 80%的丙酮溶液中, 黑暗条件下轻轻摇晃, 分别于0、10、20、30、40、50、60、90和120 min等时间点取2 mL浸提液用于测定其在665 nm和649 nm波长下的吸光度值。每次测定后的浸提液倒回相应的瓶中, 参照何旎清等[17]方法计算提取液中每一个时间点各色素的含量与浸提24 h后叶片叶绿素总含量的百分比, 得到每一个时间点的叶绿素浸提率, 试验重复3次。
1.2.7 水稻叶片水分散失率测定 进行非气孔性失水率的测定时, 为减少气孔失水对试验结果的影响, 整个试验在黑暗中操作。失水试验前一晚将处于分蘖后期至拔节期前的试验样品Ri-OsWR2、OE-OsWR2转基因植株和野生型植株的盆钵加满水并套膜使植株处于水分充足、气孔关闭状态来考察水稻植株的非气孔性失水。参照Zhou等[15]方法剪取长势和生长时期基本一致的水稻地上部位于相对湿度为50%, 温度为28℃的暗室里自然干燥, 于0、3、6、9、12、15、18、21和24 h等不同时间段分别检测称重, 通过每个时间段的称重与鲜重的百分比计算失水率, 取不同盆钵的单株重复试验3次。
1.2.8 水稻叶片丙二醛(MDA)含量的测定 分别于干旱胁迫前后称取四叶一心期的Ri-OsWR2、OE-OsWR2转基因植株和野生型水稻植株的叶片1 g, 参照Huvaux等[18]的方法提取其MDA并计算其含量, 每组试验重复3次。
1.2.9 水稻叶片脯氨酸含量的测定 分别于干旱胁迫前后称取四叶一心期的Ri-OsWR2、OE-OsWR2转基因植株和野生型水稻植株的叶片1 g, 参照Bates等[19]的方法提取其脯氨酸并计算其含量, 每组试验重复3次。
1.2.10 材料种植及幼苗干旱处理 将Ri-OsWR2、OE-OsWR2转基因种子和野生型水稻种子去壳消毒后接种于1/2 MS培养基上, 于32℃、光照强度100~150 μ mol m-2 s-1、16 h光照和8 h黑暗的人工气候箱中催芽及培养, 种子萌发1周后选取长势大致相当的水稻幼苗移栽至装有营养土的1.5 mL离心管盒中, 每盒分别种植18株左右转基因和对照幼苗, 生长到四叶一心期, 在正常生长条件下对其断水处理3 d, 复水3 d, 期间观察它的表型变化并照相。
1.2.11 数据统计分析 使用Microsoft Excel 2013录入和整理相关数据, 用SPSS 22.0对数据进行方差分析。
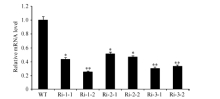
2 结果与分析2.1 OsWR2-RNAi转基因植株中OsWR2基因的表达明显降低qRT-PCR分析Ri-OsWR2转基因植株表明, 和WT相比, 3个Ri-OsWR2代表株系Ri-1、Ri-2和Ri-3中OsWR2基因的表达量都降低, 其中Ri-1-2、Ri-3-1和Ri-3-2中OsWR2 mRNA的相对水平较低, 分别为25%、30%和33% (图1), 说明OsWR2-RNAi转基因植株不同程度地抑制了OsWR2基因的表达, 成功获得抑制OsWR2表达的突变体材料Ri-OsWR2植株。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 Ri-OsWR2转基因水稻植株的qRT-PCR分析误差线表示3次重复的标准误, * 表示P< 0.05显著差异, * * 表示P< 0.01极显著差异。Fig. 1 qRT-PCR analysis of Ri-OsWR2 transgenic rice plantsError bars represent the standard errors of three replicates. * and * * denote significant difference at the 0.05 and 0.01 probability levels, respectively. |
2.2 OsWR2-RNAi减少水稻叶片表皮蜡质晶体的积累分蘖后期至拔节期的电子显微镜扫描观察结果表明, 与WT相比, Ri-OsWR2植株叶片表皮蜡质晶体密度和乳突上的蜡质分布密度明显稀疏(图2); 与过表达OsWR2 (OE-OsWR2)转基因植株中水稻叶表皮蜡质晶体增多和乳突数量显著增加的表型正好相反。进一步验证OsWR2参与了水稻表皮蜡质晶体的积累, 并且OsWR2的表达与水稻表皮蜡质晶体的积累呈正相关。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 Ri-OsWR2转基因水稻叶片表皮蜡质晶体的扫描电镜图Fig. 2 Electron micrograph of wax crystals in Ri-OsWR2 transgenic rice leaves |
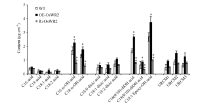
2.3 OsWR2-RNAi水稻叶片蜡质组分及含量变化为进一步分析OsWR2表达抑制后对水稻叶片角质层蜡质含量和组成成分的影响, 用加热氯仿法提取蜡质后, 气相色谱-质谱(GC-MS)联用分析仪分析Ri-OsWR2转基因水稻叶片中表皮蜡质组分和含量, 并比较其与WT和OE-OsWR2植株相同部位叶片的差异。结果表明, Ri-OsWR2转基因叶片中总蜡质含量比野生型降低了14.8% (图3-A), 进一步分析Ri-OsWR2转基因水稻叶片各蜡质组分的含量, 发现其中的C30、C32、C34醛含量和C30醇含量显著降低, 而在OE-OsWR2转基因植株叶片中, 这些组分含量极显著升高; 但脂肪酸类、烷烃类和酯类含量在OE-OsWR2、Ri-OsWR2和WT中都无显著差异(图3-B)。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 Ri-OsWR2水稻叶片中蜡质组分和含量分析A: 水稻叶片中各蜡质组分总含量比较; B: 水稻叶片中表皮蜡质组分各种化合物含量比较。误差线表示3次重复的标准误, * 表示P< 0.05显著差异, * * 表示P< 0.01显著差异。Fig. 3 Analyses of wax contents and constituents in rice leaves of Ri-OsWR2A: quantitative analysis of wax components and contents in rice leaves; B: wax constituents of fatty acids, aldehydes, alcohols, alkanes, and esters in rice leaves. Error bars represent the standard errors of three replicates. * and * * denote significant difference at the 0.05 and 0.01 probability levels, respectively. |
2.4 OsWR2-RNAi水稻叶片角质单体组分和含量的变化GC-MS分析发现, Ri-OsWR2转基因水稻叶片角质单体总量较WT降低了36.2% (Ri-OsWR2、OE-OsWR2转基因水稻和WT水稻叶片中角质单体总量分别为7.98、18.52和12.51 μ g cm-2)。如图4所示, 与WT相比, Ri-OsWR2转基因水稻植株叶片中角质单体的C16:0 ω -OH、C18:1 ω -OH脂肪酸和di-OH脂肪酸等角质组分极显著降低, 而OE-OsWR2转基因水稻叶片中角质单体总量、C16:0 ω -OH、C18:1 ω -OH脂肪酸和di-OH脂肪酸等角质组分显著增加, 表明OsWR2基因参与水稻角质单体生物合成的羟基化反应过程。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 Ri-OsWR2水稻叶片角质单体组分和含量的分析误差线表示3次重复的标准误, * 表示P< 0.05显著差异, * * 表示P< 0.01显著差异。Fig. 4 Cutin monomer composition and loads in rice leaves of Ri-OsWR2Error bars represent the standard errors of three replicates. * and * * denote significant difference at the 0.05 and 0.01 probability levels, respectively. |
2.5 OsWR2-RNAi降低水稻叶片的非气孔性失水率和表皮通透性植物水分散失率是衡量植物抗旱性的一个重要指标, 水分散失速率越低, 叶片的抗旱保水能力就越强, 其抗旱性也越好。对OsWR2过表达研究发现水稻干旱耐受性有所增强。失水率的结果显示, 随着时间的延长, 3种植株的失水率整体都呈上升趋势, 但Ri-OsWR2转基因水稻的失水率与WT相比稍微升高, 处理24 h后, Ri-OsWR2和WT的总失水率已相差不大, 分别为78.18%和75.58%; 而OE-OsWR2失水率明显比WT和Ri-OsWR2低, 处理24 h后的失水率仅为56.13% (图5-A)。为证明失水率与水稻角质层属性的关系, 进行了反映叶片表皮通透性的叶绿素浸提率试验, 其结果显示叶绿素浸提率与时间呈正相关, 浸提120 min后, Ri-OsWR2、WT和OE-OsWR2的叶绿素浸提率分别为58.95%、49.10%和31.28%, 说明与野生型相比, 抑制OsWR2基因表达的水稻植株Ri-OsWR2叶片表皮通透性高, 而过表达植株OE-OsWR2叶片表皮通透性低(图5-B), 结果与预期一致。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 Ri-OsWR2转基因水稻植株叶片非气孔性失水率和叶绿素浸提率的变化A: 非气孔性失水; B: 叶绿素浸提。A: water-loss rate; B: chlorophyll leaking ratio.Fig. 5 Changes of chlorophyll leaking ratio and water loss rate in different rice leaves |
2.6 OsWR2-RNAi转基因水稻植株干旱胁迫下脯氨酸含量变化不大而丙二醛(MDA)含量显著增加植株自由脯氨酸含量在一定程度上反映其体内水分状况, 植物细胞中自由脯氨酸适当的积累, 可以增强植物对逆境胁迫的耐受力[20, 21]。因此体内自由脯氨酸含量可作为抗早品种选育的参考性生理指标。干旱处理前, 转基因和野生型水稻叶片的自由脯氨酸含量差异不显著(Ri-OsWR2 9.09 μ g g-1; WT 10.10 μ g g-1; OE-OsWR2 9.10 μ g g-1), 干旱处理3 d后, 3种水稻叶片的自由脯氨酸含量均明显增加, 其中Ri-OsWR2增加40.58%, WT增加40.46%; 而OE-OsWR2的自由脯氨酸含量极显著增加, 相比处理前增加了2.4倍之多(图6-A)。丙二醛(MDA)是活性氧积累诱发的膜脂过氧化产物, 一旦MDA在植物体内的含量积累到一定程度, 将对膜和细胞造成伤害。通常情况下, 脂质过氧化程度和逆境胁迫造成氧化伤害程度与MDA在体内的含量呈正相关[26]。因此植物体内MDA含量可以作为植物对逆境胁迫耐受力的衡量指标: 体内MDA含量越低的植物, 其受逆境胁迫损伤的程度越低。图6-B显示, 处理前, Ri-OsWR2、OE-OsWR2和WT植株中MDA含量无显著差别, 干旱处理3 d后MDA含量均极显著增加, 分别增加了1.6倍、1.0倍和1.3倍, 处理后Ri-OsWR2转基因水稻叶片中MDA含量明显高于WT, 而OE-OsWR2植株中MDA含量明显降低(图6-B)。逆境特征因子的检测结果表明, Ri-OsWR2转基因植株在干旱胁迫条件下, 其细胞膜损伤程度比野生型和过表达植株OE-OsWR2大, 反向证实OsWR2对植物干旱胁迫的正调控作用。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 Ri-OsWR2转基因水稻植株干旱处理后脯氨酸和MDA含量的变化A: 脯氨酸含量; B: 丙二醛含量。误差线表示3次重复的标准误, * 表示P< 0.05显著差异, * * 表示P< 0.01显著差异。Fig. 6 Changes of proline and MDA contents in Ri-OsWR2 transgenic rice leaves after drought treatmentA: Proline content; B: MDA content. Error bars represent the standard errors of three replicates. * and * * denote significant difference at the 0.05 and 0.01 probability levels, respectively. |
2.7 OsWR2-RNAi转基因水稻幼苗对干旱胁迫不耐受如图7所示, 干旱处理3 d后, 四叶一心期3种幼苗之间出现了较明显的表型差异, WT水稻幼苗和Ri-OsWR2转基因水稻幼苗均出现较明显的萎蔫, 其中Ri-OsWR2转基因幼苗叶片卷曲和萎蔫最为明显, 而过表达OE-OsWR2转基因水稻幼苗只在叶片边缘稍有卷曲的表型特征(图7-b); 复水生长3 d后, 3种幼苗的表型形成鲜明对比: Ri-OsWR2转基因幼苗几乎全部死亡, WT幼苗仅有10%~15%恢复正常, 而OE-OsWR2幼苗全部恢复正常生长状态(图7-c)。这进一步证实了OsWR2对干旱胁迫的正调控作用。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 干旱胁迫对Ri-OsWR2、OE-OsWR2转基因水稻和WT水稻幼苗的影响a: 3周龄幼苗处理前; b: 干旱处理3 d后; c: 复水3 d后。Fig. 7 Influences of water deficiency on OsWR2transgenic and WT seedlingsa: 3-week-old seedlings before dehydration; b: 3 days of water deficit; c: 3 days after dehydration-rewatering. |
3 讨论植物表皮角质层的生物合成不仅受自身遗传因素和外界环境变化的影响, 还受多个代谢途径中多个转录因子的协同调控[22, 23]。拟南芥AP2/EREBP家族转录因子SHN1/WIN1是第一个被鉴定的既影响表皮蜡质又影响角质生物合成的转录因子基因[24, 25]。水稻中与SHN1/WIN1同源性较高的基因有OsWR1和OsWR2, 都属于AP2/ERF超家族中ERF亚家族转录因子基因。OsWR1受盐、ABA、特别是干旱等胁迫的诱导表达, 在水稻中过表达时导致转基因植株角质层透性降低而增强抗干旱胁迫能力, 而OsWR1突变体植株表皮透性和失水率显著升高, 干旱处理后对耐旱性减弱[26]。OsWR2过表达水稻蜡质晶体的密度、蜡质和角质单体组分的含量发生改变, 且能降低植株水分散失率, 增强植株的耐旱性[15]。本研究通过RNAi方法构建抑制OsWR2表达的突变体植株OsWR2-RNAi, 电镜扫描观察水稻叶片表皮蜡质分布情况, 发现与野生型对照相比, OsWR2-RNAi植株叶片表皮蜡质分布密度显著减少, 且乳突数量有所减少; 这与过表达OsWR2植株OE-OsWR2所表现的叶片表皮蜡质分布密度和乳突数量显著增加的表型正好相反。OsWR2-RNAi植株表皮蜡质晶体密度的减小可能是导致Ri-OsWR2植株干旱耐受力降低的根本原因, 因为蜡质晶体的密度和乳突的多少影响水稻表面积及对热辐射的反射作用, 进而影响水稻的干旱耐受力。事实上, 植物表面蜡质晶体的大小和位置对于决定水分扩散途径起非常重要的作用[27]。Mamrutha等[28]用290个桑葚品种研究发现, 不同品种之间叶片持水量变化与叶片蜡质含量、蜡质晶体大小和密度存在明显的相关性。Park等[29]用扫描电镜观察水稻WDL突变体叶表面, 发现蜡质晶体形状不规则, 有断裂和凝结现象, 进一步分析发现该突变体角质蒸腾速率比野生型高2~3倍, 干旱耐受力明显降低。
表皮蜡质对于植物蒸腾起的重要作用不仅仅取决于其厚度, 也与其成分有关。Oliveria等[30]对巴西卡廷加群落植被和热带高草草原植被的抗旱性研究发现, 前者的保水能力强于后者。卡廷加群落植被叶片角质层蜡质的主要成分是极性较低的三萜醇和C27-C33烷烃类物质, 而热带高草草原植被的蜡质含有大量的极性较高的棕榈酮和熊果酸。Seo等[14]研究发现拟南芥活化myb96-1D突变体叶表面蜡质含量显著增加, 其中以醛类和烷烃类物质增加最为明显, 而拟南芥缺失突变体myb96-1蜡质总量明显减少。另发现与对照相比, myb96-1D叶绿素浸提率和角质蒸腾较慢, 而myb96-1叶绿素浸提率和角质蒸腾较快, 表明角质层蜡质中醛类和烷烃类物质的增加提高了拟南芥的抗旱能力。本试验研究发现, 与WT相比, OsWR2-RNAi植株叶片表皮蜡质的总含量明显减少, 且蜡质组分的醛类、醇类和烷烃类都有不同程度的减少, 而过表达OsWR2植株与之相反, 且蜡质组分的脂肪酸和酯类也都有所增加。说明OsWR2主要影响到水稻植株蜡质组分中的醛类、醇类和烷烃类物质含量, 进而影响水稻表皮蜡质的表型、密度和积累, 最终影响角质层的水分散失。
植物叶片失水率是衡量植株维持水分的重要指标, 水分散失率越高, 越容易导致植物枯萎甚至死亡。叶绿素浸提率也是衡量植物抗旱性的一个重要指标, 表面蜡质的减少将导致叶表皮渗透性和水分散失率增加[31, 32]。Weng等[33]发现拟南芥lacs1 lacs2双缺失突变体叶绿素是野生型的4倍, 其失水率也比野生型高, 对于干旱更为敏感。我们发现叶绿素浸提率和水分散失率, 与WT相比, OsWR2-RNAi较高而OE-OsWR2较低。同时, 与WT相比, OsWR2- RNAi干旱处理后其植株中自由脯氨酸含量降低虽然不明显, 但膜脂过氧化的产物MDA含量增加显著; OsWR2-RNAi幼苗植株对干旱胁迫的耐受能力也较弱。这些试验结果表明, OsWR2-RNAi水稻植株细胞膜的稳定性更差, 处于干旱胁迫的条件下, 植物细胞组织所受的创伤更严重, 导致角质层的非气孔性水分散失率增加, 干旱胁迫耐受性降低。OsWR2-RNAi植株所表现的表皮蜡质晶体密度、含量及蜡质、角质单体成分的改变对水稻叶表面细胞膜通透性和水分散失率的影响, 验证了OsWR2对表皮蜡质和角质生物合成和对干旱胁迫的正调控作用。
4 结论RNAi抑制水稻OsWR2基因的表达后, 植株叶片中OsWR2基因表达量显著降低, 叶表面蜡质晶体密度和表皮蜡质的含量显著降低, 且蜡质组分的醛类、醇类和烷烃类都有不同程度的减少, 角质单体的C16:0和C18:1 ω -OH脂肪酸和 di-OH脂肪酸等角质组分显著降低; 同时植株叶片表皮通透性、非气孔性失水率、膜脂过氧化产物MDA显著增加, 耐受干旱胁迫能力降低。OsWR2-RNAi对水稻角质层生物合成和耐旱性的影响说明了OsWR2基因的功能及对角质层生物合成和干旱胁迫的调控作用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] |
