 , 赵德刚
, 赵德刚
*通讯作者(Corresponding authors): 刘洋, E-mail: liuyangbun@163.com; 赵德刚, E-mail: dgzhao@gzu.edu.cn 收稿日期:2016-04-20 接受日期:2016-09-18网络出版日期:2016-09-29基金:
摘要
关键词:烟草; SbSKC1基因; 抗盐性; 抗氧化性
Cloning of SbSKC1Encoding Na+ Transporter Protein from Sorghum and Its Function of Salt-Resistance in Tobacco
YAO Xin-Zhuan
 , ZHAO De-Gang
, ZHAO De-Gang
Abstract
Keyword:Tobacco; SbSKC1 gene; Salt resistance; Oxidation resistance
Show Figures
Show Figures















盐害限制植物细胞从土壤中吸收水分, 引起渗透胁迫, 从而影响农作物生长, 造成农作物减产, 甚至导致作物产量遭受巨大损失。通过遗传改良提高作物的抗盐性是解决这一问题的有效途径之一。目前, 已有一些植物抗盐基因被克隆并用于作物的遗传改良研究[1, 2, 3, 4], 这些基因的表达不同程度地提高了转基因植物的抗盐能力。其中, SKC1是从水稻中克隆出的一个耐盐基因, 编码一个HKT家族的钠离子转运蛋白, 研究发现HKT家族的钠离子转运蛋白专一运输Na+, 不参与运输K+、Li+等[5]其他阳离子。环境的胁迫如盐、干旱和低温可以诱导SKC1基因上调表达, 过量表达SKC1基因可以提高植物的抗逆性[6]。
高粱是世界第五大禾谷作物, 除用作粮食外, 还是饲料、燃料、酿酒及工业淀粉的原料。多年来, 高粱抗盐相关研究主要集中在耐盐性遗传研究和耐盐品种选育方面[7, 8, 9, 10, 11, 12, 13, 14, 15, 16], 韩福光等[17]通过高粱幼叶离体培养, 在盐分胁迫条件下诱导变异筛选耐盐品系, 得到一些较耐盐的品系, 谢登雷等[18]克隆了高粱的SbDREB2基因并分析了该基因的表达特性。目前, 高粱全基因组测序已经完成, 为高粱一些重要基因的克隆及抗逆分子机制的研究提供了很大方便。本研究以高粱为材料克隆了高粱SbSKC1基因, 构建了CaMV35S启动子驱动SbSKC1基因的植物表达载体, 遗传转化烟草, 分析了转基因烟草的抗盐性, 揭示了SbSKC1基因在转基因烟草抗盐胁迫中的调节机制, 为进一步利用SbSKC1基因创制抗盐高粱新种质奠定了基础。
1 材料与方法1.1 试验材料高粱(Sorghum bicolor)红缨子品种、烟草(Nicotiana tabacumcv. Xanthin)种子由本实验室保存, MultiScribe Reverse Transcriptase Kit和Power SYBR Green PCR Master Mix均购于ABI公司; Plant RNA Kit购于OMEGA公司; RT-PCR相关引物均由Invitrogen公司合成; 超氧化物歧化酶(superoxidedismutase, SOD)、脯氨酸(proline, PRO)、丙二醛(malondialdehyde, MDA)、过氧化氢酶(catalase, CAT)和过氧化物酶(peroxidase, POD)检测试剂盒均购于苏科科铭生物技术有限公司。
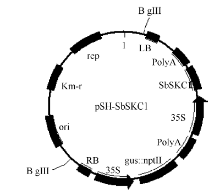
1.2 基因克隆与载体构建利用已报道的水稻SKC1蛋白序列, 在GenBank数据库中进行BlastP搜索, 获得高粱同源基因的氨基酸及cDNA序列并已获得GenBank登录号。根据cDNA序列用Premier 5.0设计并合成引物(F: 5° -ATGAAGTCCATCTCCGTCCCTAGGCCCTC GGCT-3° ; R: 5° -TTAGCCTAGCTTCCATGCCTGAC CCCCATGC-3° )。用高保真酶PrimeSRAR HS DNA Polymerase进行基因扩增, 扩增产物送上海英潍捷基生物技术公司测序。通过用BamH I和EcoR I双酶切, T4 DNA连接酶连接, 获得表达载体pSH-SbSKC1 (图1), 该载体含有SbSKC1基因表达元件, CaMV35S启动子驱动NPT1l::GUS融合基因作为筛选标记基因和报告基因。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 pSH-SbSKC1植物表达载体构建Fig. 1 Construction of the plant expressing vector pSH-SbSKC1 |
1.3 SbSKC1基因编码产物序列分析采用National Center for Biotechnology Information (NCBI)网站(http://www.ncbi.nlm.nih.gov/)的在线工具DNAMAN8.0、MegAlign软件和多序列比对程序ClustalX2进行cDNA序列Blast分析。采用Serial cloner-2.0氨基酸翻译工具。借助ClustalX2和MEGA5.0软件构建系统进化树。
1.4 烟草遗传转化及抗盐性分析采用农杆菌(Agrobacterium tumefaciens)介导的叶盘法将SbSKC1基因遗传转化烟草[19]。将T0代转基因烟草和野生型烟草种子分别装入1.5 mL离心管, 用无菌水洗2~3次后, 用75%的无水乙醇消毒30 s, 再用10% H2O2消毒30 min, 最后用灭菌水冲洗3~5次, 用吸水纸吸干表面的水分, 将野生型烟草和转基因烟草种子分别播于0、50、100、150、200、250和300 mmol L-1 NaCl的MS培养基上进行种子萌发抗盐性试验, 设置6个重复, 每个重复50粒烟草种子, 以胚根完全伸出种皮为种子萌发标准, 在室温25℃ 16 h光照/8 h黑暗光周期、光照强度200~300 μ mol m-2 s-1条件下生长。将培养一周没有处理的幼苗转移到不同浓度的培养基上再培养一周观察转基因和野生型烟草根的生长。将转基因烟草和野生型烟草种子分别播于含有基质花盆中, 6周后选取长势相似的幼苗用300 mmol L-1NaCl处理[20], 处理前和处理后分别采取相同部位的转基因和野生型烟草叶片提RNA作RT-PCR基因表达分析、测定转基因和野生型烟草生理生化指标。
1.5SbSKC1基因的表达 根据SbSKC1基因序列, 设计基因的RT-PCR扩增引物, 以烟草Actin基因作为内参, 定量分析基因的相对表达量。引物设计序列为F: 5° -CTCTT CATGTCCGTCAACTCCAGG-3° ; R: 5° -GGCGGTA GATACATCATGAGCACAT-3° 。分别取转基因和野生型烟草植株相同部位的叶片0.1 g, 总RNA提取试剂盒购自OMEGA Bio-tek Inc., Georgia, USA, 参照ABI公司试剂盒反转录为cDNA。以烟草Actin作为内参基因, 利用SYBR Green实时定量PCR染料法分别对相关基因的表达进行分析。参照ABI公司的仪器使用说明(7500 Real-time PCR System), 按照2-Δ Δ CT法计算和分析基因的表达水平。Real-time PCR体系20 μ L, 含Power SYBR Green PCR Master Mix (2× ) 10 μ L、引物各1.0 μ L、cDNA 4 μ L和ddH2O 4.0 μ L。扩增条件为95℃ 10 min; 95℃ 15 s; 60℃ 1 min, 40个循环。每个样品取样3次, 每次设置3个重复。
1.6 烟草中Na+和K+的含量测定 取长势一致的烟草叶片, 用去离子水冲洗后擦干, 105℃杀青15 min。70℃烘箱中烘至恒重。精确称取0.5 g干材料, 置马弗炉500℃灰化至材料呈白色粉末状态后取出。冷却至室温后用硝酸溶解, ddH2O定容于100 mL容量瓶中, 摇匀, 用火焰光度计6400 (Flame Photometer 6400, 上海仪电科学仪器股份有限公司)测定Na+和K+的含量[20], 并计算K+/Na+比, 每个处理3个重复。
1.7 烟草生理指标的测定使用酶标仪测定保护性酶活。样品处理前按照组织质量(g):生理盐水或0.05 mol L-1磷酸钾缓冲溶液(pH 7.8)体积比例(mL)为1:5~10 (称取0.1 g组织, 加入1 mL生理盐水或磷酸钾缓冲溶液), 以液氮研磨成匀浆。8000× g 4℃离心10 min, 取上清液, 置冰上用苏科科铭生物技术有限公司试剂盒说明书按步骤测定氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性和脯氨酸(PRO)、丙二醛(MDA)、过氧化氢(H2O2)含量[21]。
1.8 统计分析采用Microsoft Excel 2003和SPSS22.0软件数据分析, 并绘制图表。
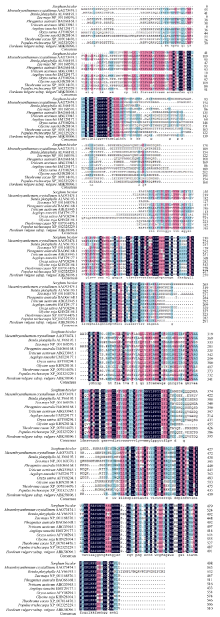
2 结果与分析2.1 SbSKC1基因序列同源比对及进化树分析比对结果表明, 克隆得到的SbSKC1序列与数据库中的CDS (GI: 242057180)比对完全一致。序列分析表明, SbSKC1基因的ORF (open reading frame)全长1497个核苷酸, 编码498个氨基酸残基。将测序后的SbSKC1 cDNA序列进行BlastX分析显示, 显示其与玉米(Zea mays)的LOC100382359 (NP_ 001162576.1)相似性最高, 为79%, 与芦苇(Phragmites australis)的HKT1.5 (BA066168.1)、小麦(Triticum aestivum)的HKT8 (ABG33945.1)、大麦(Hordeum vulgare)的HKT1.5 (ABK58096.1)相似性均为67% (图2), 进一步证明SbSKC1基因为编码cDNA全长。选取其中最具代表性的11种物种氨基酸序列运用MEGA 5.0进行系统进化树分析显示, 高粱SbSKC1在进化过程中与玉米亲缘性较近(图3)。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 SbSKC1与其他物种的氨基酸序列同源比对结果 参与同源比对的分别为冰叶花、白桦、玉米、芦苇、小麦、节节麦、水稻、大豆、可可树、毛果杨、大麦; 黑色表示相同残基, 红色表示保守替换, 绿色表示半保守替换。Fig. 2 Homologous analysis of amino acid sequences among different plants Amino acid sequence homology comparison were analysed in Mesembryanthemum crystallinum, Betula platyphylla, Zea mays, Phmites australis, Triticum aestivum, Aegilops tauschii, Oryza sativa, Glycine soja, Theobroma cacao, Populus trichocarpa, Hordeum vulgaresubsp. vulgare, respectively. The same residue is shown in black, conservative alternative is shown in red, and semi conservative alternative is shown in green. |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 推定SbSKC1基因与其他物种氨基酸系统进化树 各节点处数值表示BootStrap值(迭代1000次)。比对物种冰叶花、白桦、玉米、芦苇、小麦、节节麦、水稻、大豆、可可树、毛果杨、大麦。Fig. 3 Phylogenetic tree of putative SbSKC1protein and other species Each node is represented by a bootstrap value (iteration 1000). Amino acid sequence homology comparison were analysed in Mesembryanthemum crystallinum, Betula platyphylla, Zea mays, Phmites australis, Triticum aestivum, Aegilops tauschii, Oryza sativa, Glycine soja, Theobroma cacao, Populus trichocarpa, Hordeum vulgaresubsp.vulgare, respectively. |
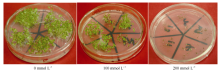
2.2 转基因植株的获得及抗盐性分析以烟草叶片为外植体, 通过农杆菌介导转化法共获得抗性植株40株。在植株长至2~3片叶时选取抗性植株和野生植株的叶片进行GUS组织化学染色和PCR鉴定, 获得转基因植株30株, 说明SbSKC1基因整合到植株中。将其移栽到花盆中, 收获种子。不同株系的转基因种子经消毒后分别播于0、100和200 mmol L-1NaCl的MS培养基上培养15 d, 观察种子发芽和幼苗生长情况, 结果表明在不含NaCl培养基上转基因株系与野生株系并无明显差异, 而随着NaCl的浓度增加转基因株系和野生型发芽率都受到抑制, 在200 mmol L-1 NaCl的MS培养基上, 转基因烟草株系种子的发芽率都在55%以上, 而野生型烟草种子的发芽率不到20%。说明在含有NaCl的MS培养基上野生型烟草比转基因烟草种子发芽率受到的抑制更为明显(图4和图5)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 不同浓度NaCl处理的烟草种子Fig. 4 Tobacco seeds treated with different concentrations of NaCl |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 不同浓度NaCL处理下烟草种子的发芽率Fig. 5 Germination rate of tobacco seeds treated with different concentrations of NaCl |
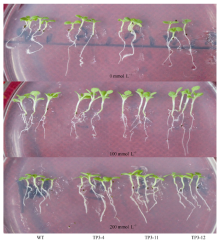
在MS培养基上生长15 d的野生型和转基因烟草幼苗, 转接到含有0、100和200 mmol L-1 NaCl的培养基上生长7 d (图6), 野生型烟草根系生长较转基因株系缓慢, 随着NaCl浓度的增加, 野生型烟草根系生长受到的抑制更加明显, 表明转基因株系较野生型烟草耐受盐胁迫。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 不同浓度NaCl胁迫下烟草根的变化Fig. 6 Changes of tobacco roots under different concentrations of NaCl stress |
生长8周龄转基因和野生型烟草植株用300 mmol L-1NaCl胁迫10 d后(图7)野生型烟草叶片开始枯萎, 而转基因株系叶片正常。以上结果表明, 过度表达SbSKC1提高转基因烟草植株抗盐胁迫能力, 同时对种子萌发和根系伸长都有影响。
图 7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图 7 盐胁迫下(用300 mmol L-1 NaCl灌溉10 d)烟草生长状态 A: 盐胁迫前; B: 盐胁迫10 d。Fig. 7 Tobacco growth state under salt stress ( 300 mmol L-1 NaCl irrigation for ten days) A: before stress; B: stress. |
2.3 盐胁迫下转基因烟草SbSKC1表达和烟草中Na+、K+含量分析 如图8所示, SbSKC1基因表达分析表明, 在盐胁迫前野生型烟草和转基因烟草SbSKC1基因的表达无显著性差异, 盐胁迫10 d后, 野生型烟草和转基因烟草SbSKC1基因的表达差异显著, 其中TP3-11株系的SbSKC1表达达到了野生型烟草的5倍。在盐胁迫下, 转基因烟草和野生型烟草Na+和K+以及K+/Na+比存在显著差异。在无盐胁迫下, K+和Na+含量在转基因株系和野生型之间无显著差异(图8-B, C)。然而, 在盐胁迫下转基因植物中Na+和K+含量及钾钠比例升高(图8-D)。这表明高表达SbSKC1起到调节阳离子含量的作用。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 盐胁迫下SbSKC1基因表达及对Na+、K+含量的影响 A: 基因相对表达; B: Na+含量; C: K+含量; D: K+/Na+。Fig. 8 SbSKC1 gene expression and the influence on Na+, K+contents under salt stress A: relative expression level; B: Na+ content; C: K+ content; D: K+/Na+. |
2.4 盐胁迫对转SbSKC1基因烟草和野生型烟草MDA和H2O2含量的影响 转基因烟草与野生型烟草经300 mmol L-1NaCl胁迫10 d后, MDA和H2O2的含量变化明显。从图9可以看出, 在正常条件下, 转基因烟草与野生型MDA、H2O2含量差异不显著, 用300 mmol L-1 NaCl处理后, 转基因烟草株系MDA的平均含量分别比野生型烟草降低了1.99倍; 转基因烟草株系H2O2的平均含量比野生型烟草降低了2.20倍。说明在NaCl胁迫下, 转基因烟草膜脂过氧化程度低于野生型烟草, 有利于维持膜的功能。
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 盐胁迫对转基因烟草中H2O2和MDA含量的影响 A: H2O2含量; B: MDA含量。Fig. 9 Salt stress Influence of salt stress on H2O2 and MDA contents in transgenic tobacco A: H2O2 content; B: MDA content. |
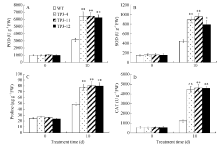
2.5 盐胁迫对转SbSKC1基因烟草抗氧化酶活性的影响 正常条件下转基因烟草和野生型烟草中POD、SOD、CAT活性和脯氨酸含量无显著差异, 而在300 mmol L-1 NaCl胁迫下, 转基因烟草的POD、SOD和CAT活性分别是野生型的2.02、1.96和3.64倍(图10-A, B, D), 脯氨酸含量比野生型提高了62.9% (图10-C)。
图10
Fig. 10
| Figure OptionViewDownloadNew Window | |
 | 图10 盐胁迫对转基因烟草中POD、SOD、CAT活性及脯氨酸含量的影响 A: POD活性; B: SOD活性; C: 脯氨酸含量; D: CAT活性。Fig. 10 Effects of salt stress on activities of POD, SOD, and CAT and proline content in transgenic tobacco A: POD activity; B: SOD activity; C: proline content; D: CAT activity. |
3 讨论本试验克隆得到了SbSKC1基因cDNA全长序列, 该基因的氨基酸序列与其他植物氨基酸序列具有高度同源性, 与玉米(Zea mays) LOC100382359 (NP_001162576.1)相似性最高, 为79%, 与芦苇、小麦、大麦氨基酸相似性均为67%。超量表达SbSKC1基因提高了转基因烟草的抗盐性, 在300 mmol L-1 NaCl处理下, 转基因烟草株系的发芽率显著高于野生型烟草, 其根的生长好于野生型烟草, 同时转基因烟草保持了较高的K+/Na+比。细胞质内过量的Na+对植物造成有害影响, 然而K+是植物生长所必需的并且必须以相对较高的浓度存在, 因此保持胞质内高的K+/Na+比对植物在盐分胁迫下的生长具有重要意义。由于大部分植物对于Na+与K+之吸收具有拮抗效应, 当植物体内的Na+含量增加时, 就会导致K+含量的降低[22]。与耐盐性有关的SKC1基因编码的转运体蛋白质的主要生理作用正是负责调节Na+的远距离运输以及维持植物体内的K+稳态, 进而提高对盐胁迫的耐性[17], 通常认为, K+/Na+是评估植物是否耐盐的一个重要生理指标。本研究表明, 盐胁迫下转基因烟草和野生型烟草Na+含量均增加, 而后者高于前者。由此可见, 转SbSKC1基因烟草维持Na+较低的水平, 减轻了离子毒害, 从而维持了植物正常的生长状态。盐胁迫下, K+含量在转基因烟草和野生型烟草中均增加, 但转基因增加明显高于野生型烟草。转基因植物维持了较低的Na+水平和较高的K+水平使其耐盐性增强, 这与Ren等[5]的结果一致。
盐肋迫对植物造成的影响是多方面的, 但膜系统是其伤害的初始以及主要部位[23, 24]。膜脂和膜蛋白是构建植物细胞膜系统的主要成分, 其中膜脂分磷脂和糖脂。通常盐胁迫下生物膜的不饱和脂肪酸降解, 丙二醛含量急剧增加, 由于丙二醛能够和生物膜上的蛋白质或者酶等结合, 致使蛋白质分子内与分子间发生交联效应, 使酶失活[25], 损伤了生物膜的结构与功能。所以丙二醛的含量往往被人们用作判断植物膜脂过氧化程度的指标, 本研究表明, 在盐胁迫下, 转SbSKC1基因烟草比野生型烟草MDA含量增加的幅度要低, 说明转SbSKC1基因烟草的膜脂过氧化程度较低, 因此细胞膜受到的损伤程度也较小。在正常生长情况下, 植物细胞内的自由基产生及消除总是处于动态平衡中, 即植物体内自由基水平很低, 不会伤及细胞。植物在胁迫条件下, 此平衡被打破, 导致植物体内自由基含量过高, 细胞受到伤害。植物会通过多条途径产生如O2-、H2O2等自由基, 此类自由基的氧化性能很强, 能够对许多生物功能分子产生破坏作用[26], 同时植物细胞内存在着清除这些自由基的系统。超氧化物歧化酶(SOD)主要负责清除O2-、SOD催化清除O2-的反应生成H2O2, 减少脂质氧化, 降低膜系统遭受伤害的程度。H2O2不仅自身的积累对细胞会造成直接伤害, 甚至会通过一系列的反应导致更具破坏性的OH-生成[27]。过氧化氢酶(CAT)与过氧化物酶(POD)在植物组织中普遍分布, 主要负责清除H2O2[28], 只有SOD和POD以及CAT三者协调作用, 才能保证自由基维持在低水平, 减少膜的损伤, 提高植株的抗逆性。本研究中, 用300 mmol L-1 NaCl处理烟草后, 转基因烟草株系H2O2的平均含量比野生型烟草降低了2.2倍。而转基因烟草POD、SOD和CAT活性分别是野生型的2.02、1.96和3.64倍, SOD和POD以及CAT三者协调作用, 是转基因植物体内H2O2的含量低于野生型烟草的主要原因。通过RT-PCR分析SbSKC1基因表达, 在盐胁迫前SbSKC1基因在烟草中表达无显著差异, 盐胁迫10 d后, 野生型烟草和转基因烟草SbSKC1基因的表达差异显著, 其中TP3-11株系的SbSKC1表达量是野生型烟草的5倍, 说明转SbSKC1基因烟草提高了烟草的抗盐性。
4 结论克隆了高粱抗盐性基因SbSKC1的cDNA全长序列, 其ORF (open reading frame)全长1497 bp, 编码498个氨基酸残基。该基因过量表达能够显著提高转基因烟草抗盐性, 在盐胁迫下显著提高叶片中SOD、POD、PRO和CAT活性, 降低MDA和H2O2含量。初步推断SbSKC1具有抗盐功能。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] |
