 , 刘峰
, 刘峰 , 鲍依群
, 鲍依群* 通讯作者(Corresponding authors): 鲍依群, E-mail: baoyiqun@njau.edu.cn, Tel: 025-84396795; 张云辉, E-mail: zyhrice@163.com, Tel: 025-84390321 第一作者联系方式: 刘钰龙, E-mail: 2013116120@njau.edu.cn; 刘峰, E-mail: liufeng@njau.edu.cn
收稿日期:2016-03-21 接受日期:2016-07-11网络出版日期:2016-08-24基金:
摘要
关键词:水稻( Oryza sativa.L); 温敏型; 白化; 突变体; 叶绿体发育
Phenotypic Characterization and Gene Mapping of a Thermo-sensitive Albino Leaf Mutant tsa1 in Rice
LIU Yu-Long
 , LIU Feng
, LIU Feng , BAO Yi-Qun
, BAO Yi-QunFund:
Abstract
Keyword:Rice ( Oryza sativaL.); Thermo-sensitive; Albino; Mutant; Chloroplast development
Show Figures
Show Figures









叶片是植物最主要的光合器官, 叶绿体是光合作用的主要场所, 可将太阳能转化、贮存为能被生物体利用的化学能。叶绿体起源于原始光合细菌, 拥有自己的基因组, 能够编码上百种蛋白质, 但超过95%的叶绿体必需蛋白都是由核基因组编码的[1]。叶绿体属于植物细胞中众多质体的一种, 植物光合器官中的叶绿体是由种子中的原质体(proplast)经黄化体(etioplast)发育而成, 受到核基因与质体基因共同调控[2]。叶绿体的光合能力依赖于其中包含的大量光合色素, 其中叶绿素主要负责光能的捕获、传递和转化, 而类胡萝卜素能够维持光系统稳定性, 防止光伤害。光合色素的生物合成是一个非常复杂的酶促反应过程, 仅叶绿素的合成就有至少15种酶的参与[3]。光合色素含量、叶绿体数量的改变可引起植物叶色的显著变化, 因此叶色变异突变体是解析光合色素代谢途径以及叶绿体发育过程的理想材料[4, 5]。
水稻(Oryza sativaL.)是世界最主要的粮食作物之一, 通过对其叶色突变的研究, 可深入解析C3禾本科作物光合作用的分子机制, 有助于通过基因工程手段提高叶片光合效率, 进而提高粮食产量, 具有重要的意义。叶色变异是水稻中一个较为常见的突变类型, 通过图位克隆的方法, 已经从中分离到至少86个叶色相关基因(http://www.ricedata.cn/), 绝大多数突变体在苗期叶色表型最为明显, 随着生育时期的推进, 部分突变体表型可减弱或消失, 其表型的变化有时还受到光照、温度等条件的影响。目前已经报道的水稻叶色突变体种类众多, 表型各异, 根据其叶色表型可以分为白化(albino)、黄化(chlorine)、淡绿(virescent)、条纹(stripe)、斑马(zebra)等不同类型[6]。
温敏型叶片白化突变体是叶色突变中较为常见的一种, 只在某些特定温度下出现不同程度的白化。已研究报道的水稻温敏型叶片白化突变体v1[7]、v2[8]、v13(t)[9]、W1[10]、W17[11]、W25[11]、fan5[12]、osv4[13]、ctd9[14]、wlp1[15]等均在低温条件下呈现白化。水稻突变体W1在30℃条件下表型正常, 叶绿素和类胡萝卜素含量与野生型无显著差异; 但是在低温(15~20℃)条件下表现为白化, 叶绿素和类胡萝卜素含量显著降低[10]。W25在不同温度下叶色差异显著, 在较低温度(≤ 25℃)条件下, 幼叶为完全白化, 而在较高温度(≥ 30℃)条件下, 其第1~2叶却表现为浅绿色或正常绿色[11]。深入研究发现, 大部分白化叶片突变体的表型都是由于叶绿体发育的缺陷造成的。例如, v13(t)突变体在24℃下, 白化叶片中叶绿体发育不正常, 只能看到一些空的囊泡状结构, 观察不到类囊体基粒片层结构存在[9]。W25突变体在低于25℃的条件下, 白化叶片的叶绿体轮廓完好, 但是内部结构简单, 仅有少量的片状结构, 尚未分化出基粒和基粒片层, 叶绿体发育滞后[11]。fan5在低于临界温度26.1℃的条件下, 叶片呈现白化, 其叶绿体无类囊体垛叠结构, 只有与前质体类似的泡状结构[12]。李育红等[16]和李超等[17]发现的白化叶片突变体, 其白化部位细胞有嗜锇体存在, 但没有正常的类囊体和基粒片层结构。王荣平等[18]对gra75突变体的叶绿体观察发现, 白化叶片的叶绿体数量显著减少, 叶绿体结构异常, 没有类囊体片层。因此, 温敏型叶片白化突变体是研究温度影响叶绿体发育的良好材料。
本试验利用甲磺酸乙酯(EMS)诱变宁粳36得到的一个温敏型叶片白化突变体tsa1 (thermo-sensitive albino), 对tsa1进行了不同温度处理、叶绿素测定及叶绿体观察等相关试验, 并完成了突变基因的初定位, 可为该基因的图位克隆及深入功能研究奠定基础。
1 材料与方法1.1 试验材料水稻温敏型叶片白化突变体tsa1, 经多代自交已经稳定遗传。2014年夏将tsa1突变体与籼稻“ 南京11” 杂交, 同年在海南种植F1植株, 2015年在江苏省农业科学院种植亲本和F2群体。在田间随机选取成熟期的野生型与tsa1突变体各10株, 考察其株高、有效穗数、剑叶长宽, 并收获其稻穗, 用于统计结实率与千粒重等农艺性状, 利用t测验分析统计结果的差异显著性。
1.2 遗传分析与基因定位2014年于海南考察F1植株的表型, 2015年于江苏南京统计F2群体中正常型和突变型的个体数, 用卡方测验法分析统计结果。
采用隐性极端个体法进行连锁分析与基因定位。选用均匀分布于水稻12条染色体上在“ 宁粳36” 和“ 南京11” 之间存在多态性的SSR标记, 利用F2群体中10株极端单株进行初步连锁分析。根据初步定位结果, 在定位区间内利用Primer Premier 5.0软件开发新的InDel标记, 逐步缩小目标区段。
1.3 突变体苗期叶色表型鉴定及光合色素含量测定。在光照培养箱中(8 h黑暗/16 h光照), 不同的温度条件下(20℃、24℃、28℃、32℃)播下野生型与突变体种子, 直至成苗。采用丙酮浸提的方法提取色素, 选用各温度下培养的发芽20 d后的幼苗, 剪取最后一片完全展开叶的中间部位(取样株数≥ 5, 总质量为30~200 mg), 于2 mL 80%丙酮中, 室温避光浸提24 h, 中间混匀多次。将浸提液5000转 min-1离心10 min, 取上清液用紫外可见分光光度计分别测定663、645和470 nm处的吸光值。参照Lichtenthaler[19]的方法, 测定和计算叶片单位质量叶绿素a(Chl a)、叶绿素b (Chl b)和类胡萝卜素(Car)的含量。Chl a = 12.21A663 - 2.81A645; Chl b = 20.13A645 - 5.03A663, Car = (1000A470 - 2.05 Chl a- 114 Chl b)/245, A代表吸光值(absorbance), 用t测验分析差异显著性。
1.4 原生质体叶绿体观察取20℃条件下培养14 d的野生型与突变体幼苗, 切成1~2 mm的小段, 放入含有纤维素酶、果胶酶的酶解液中, 抽真空1 h, 在室温下40转 min-1震荡酶解5 h, 过滤除去残渣, 将滤液100转 min-1离心10 min收集原生质体, 显微镜下观察, 照相记录。
1.5 苗期叶鞘荧光观察撕取在20℃条件下培养20 d的野生型与突变体幼苗的叶鞘, 在激光共聚焦显微镜明场及488 nm通道下观察细胞形态及叶绿体自发荧光, 照相记录。
1.6 苗期叶绿体超微结构观察分别取各温度处理的野生型与突变体的叶片, 用含有2.5%戊二醛的磷酸缓冲液固定24 h后, 用50%、70%、80%、95%、100%的丙酮脱水, 之后用Epon812树脂包埋样品, 切片并染色, 再用透射电镜观察。
1.7 质体发育与叶绿素合成相关基因转录水平分析选取在20℃条件下培养20 d的野生型与突变体相同部位的叶片, 提取其总RNA。取2 μ g RNA作为模板, 反转录合成第1链cDNA。利用Real-time PCR测定野生型与突变体中质体发育与叶绿素合成相关基因的转录水平, 其中包括PsaA1/A2 (光系统I叶绿素脱辅基蛋白)、PsbD1/D2 (光系统II醌结合蛋白)、RbcL (Rubisco酶大亚基)、Rpoα /β /β ° /β ° ° (质体RNA聚合酶亚基)、RCA(二磷酸核酮糖羧化酶活化酶)、NADH2 (NADH氧化还原酶2)、NADH4 (NADH氧化还原酶4)、ATPCF2(ATP合酶亚基)等。
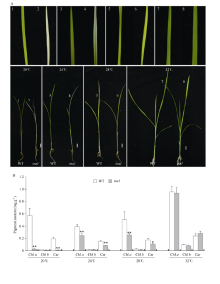
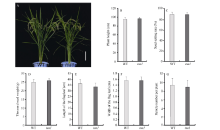
2 结果与分析2.1 tsa1是温敏型白化突变体在24℃光照培养箱中, 相比野生型, tsa1突变体植株幼苗明显白化, 白化表型在萌发后5 d最为明显, 而后逐渐恢复, 萌发后20 d突变体植株表现白色条纹叶(图1)。在大田中种植tsa1突变体时发现, 分期播种的tsa1突变体表型有较大差异, 早期播种(江苏南京, 5月上旬)的较晚期播种(江苏南京, 5月下旬)的白化表型更明显。因此, 我们在光照培养箱中用不同的温度处理野生型和突变体植株, 发现tsa1突变体突变表型受低温诱导: 20℃时, 突变体叶片完全白化; 24℃时, 突变体叶片表现白条纹; 28℃时, 突变体叶片表现淡黄绿色; 32℃时, 突变体与野生型无明显差异(图2-A)。色素含量测定结果显示, 20℃、24℃、28℃条件下培养的突变体叶片中叶绿素a和类胡萝卜素含量显著低于野生型, 而32℃条件下培养的突变体叶片中光合色素含量与野生型无显著差异(图2-B), 该结果与观察到的植株表型相一致。此外, 在成熟期tsa1突变体的株高、剑叶长宽、每株穗数、结实率和千粒重等农艺性状与野生型相比没有显著差异(图3)。以上结果表明, tsa1突变体是一个温敏型叶片白化突变体, 低温可诱导突变表型的出现。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 野生型(WT)和tsa1突变体苗期表型24℃萌发后5 d (A)、14 d (B)和20 d (C)的野生型和tsa1突变体幼苗表型。比例尺为1 cm。Fig. 1 Phenotype of wild type and tsa1 mutant at seedling stagePhenotype of 5 DAG (days after germination) (A), 14 DAG (B), and 20 DAG (C) seedlings of wild type (WT) and tsa1 mutant. Bars = 1 cm. |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 不同温度下野生型(WT)和tsa1突变体幼苗表型及光合色素含量A: 野生型和tsa1突变体在不同温度(20、24、28和32℃)下发芽20 d后的幼苗表型。比例尺为1 cm; B: 野生型和tsa1突变体在不同温度下发芽20 d后的光合色素的含量。* 表示根据t测验差异显著, P < 0.05, * * 表示根据t测验差异极显著, P < 0.01。Fig. 2 Phenotype and photosynthetic pigment content of wild type, tsa1 mutant seedlings at different temperaturesA: phenotype of 20 DAG seedlings of wild type and tsa1 mutant at different temperatures (20, 24, 28, and 32℃). Bars = 1 cm; B: photosynthetic pigment content of 20 DAG seedlings of wild type and tsa1 mutant at different temperatures (20, 24, 28, and 32℃). * indicates significant difference at P < 0.05 as determined by t-test; * * indicates extremely significant difference at P< 0.01 as determined by t-test. |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 成熟期野生型和tsa1突变体表型及农艺性状统计A: 成熟期野生型(WT)和tsa1突变体植株表型。比例尺为15 cm; B~G: 成熟期野生型(WT)和tsa1突变体株高(B)、结实率(C)、千粒重(D)、剑叶长(E)、剑叶宽(F)及每株穗数等(G)主要农艺性状分析。B~G各数据在0.05水平无显著差异(t测验)。Fig. 3 Phenotype and agronomic traits of wild type and tsa1 mutant at mature stageA: phenotype of the wild type (WT) and the tsa1 mutant plants at mature stage. Bar = 15 cm; B-G: major agronomic traits of the wild type and tsa1 mutant at mature stage, including plant height (B), seed-setting rate (C), thousand seed weight (D), length of flag leaf (E), width of flag leaf (F) and panicle number per plant (G). Data in B-G are no significant difference at the 0.05 level by t-test. |
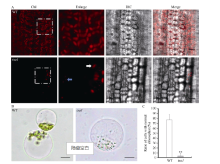
2.2 tsa1白化组织中正常叶绿体数量减少选取20℃条件下培养15 d的野生型及tsa1突变体植株, 在激光共聚焦显微镜下通过叶绿素的自发荧光观察其中叶绿体形态。如图4-A显示, 野生型叶鞘组织细胞中叶绿体饱满、呈梭形, 而tsa1突变体中正常叶绿体(白色箭头指示)数量极为稀少, 经统计, 野生型中正常叶绿体密度约为9530个 mm-2, 而突变体中为460个 mm-2; 此外, 在tsa1突变体中还观察到大量直径小于1 μ m的具有叶绿素自发荧光的异常叶绿体(蓝色箭头指示)。通过酶解水稻幼苗, 我们分离了20℃条件下培养15 d的野生型和tsa1突变体植株的原生质体(图4-B), 统计发现野生型中有77.4%的细胞含有正常的叶绿体, 而在tsa1突变体中含有外观正常的叶绿体的细胞仅占3.9% (图4-C)。以上结果表明, 低温下tsa1突变体植株细胞中正常叶绿体数量显著降低, 进而导致其白化的表型。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 野生型(WT)和tsa1突变体的叶绿体观察A: 野生型(WT)和tsa1突变体叶鞘细胞叶绿体自发荧光。白色箭头指示正常叶绿体, 蓝色箭头指示异常叶绿体。比例尺为10 μ m; B: 野生型(WT)和tsa1突变体叶肉细胞原生质体。比例尺为5 μ m; C: 野生型(WT)和tsa1突变体中含有正常叶绿体的叶肉细胞所占百分比。* * 表示根据t测验差异极显著, P < 0.01。Fig. 4 Observation of chloroplasts in wild type (WT) and tsa1 mutantA: autofluorescence of chloroplast in leaf sheath cell of the wild type and tsa1 mutant. Normal chloroplasts are indicated by white arrow, while abnormal chloroplast by blue arrow. Bar = 10 μ m; B: protoplast of the wild type and tsa1 mutant mesophyll cells. Bar = 5 μ m; C: percentage of mesophyll cells with normal chloroplasts in the wild type (WT) and tsa1 mutant. * * indicates extremely significantly difference at P< 0.01 as determined by t-test. |
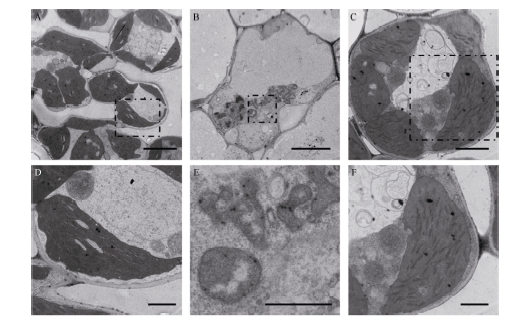
2.3 tsa1突变体中叶绿体发育存在缺陷通过透射电镜观察发现, 野生型叶肉细胞中叶绿体含量丰富(图5-A), 叶绿体中的类囊体片层排列紧密整齐(图5-D), 而tsa1突变体白化叶片的叶肉细胞中没有观察到正常的叶绿体(图5-B), 取而代之的是大量直径小于1 μ m的异常叶绿体, 该结构中含有嗜锇颗粒, 但不含有成型的类囊体片层(图5-E)。此外, 我们将20℃条件下培养的完全白化植株移栽到32℃培养7 d后切片观察, 发现突变体中出现大量大小正常的叶绿体, 其中含有一定数量的类囊体垛叠(图5-A~F)。这些结果暗示, 在低温下tsa1突变体中叶绿体不能正常发育成熟, 停滞在中间阶段, 形成了异常的小型叶绿体结构。后用Real-time PCR的方法对叶绿素合成和质体发育的相关基因进行了表达分析表明, 突变体中光合作用相关基因PsaA1/A2、PsbD1/D2、RbcL及电子传递相关基因RCA、NADH2/4、ATPCF2表达显著下调, 而编码质体RNA聚合酶的亚基的Rpoα /β /β ° /β ° ° 基因表达上调(图5-G)。以上结果说明TSA1突变阻碍了低温下水稻幼叶中的叶绿体发育进程, 并影响了光合作用调控网络, 最终导致白化表型。
(图5)
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 野生型(WT)和tsa1突变体叶肉细胞的超微结构及相关基因的转录水平A~F: 野生型和tsa1突变体在不同温度下叶肉细胞的电镜图片; D、E、F分别是A、B、C中虚线区域的放大图。A、B标尺为5 μ m, C标尺为2 μ m, D、E、F中标尺为1 μ m; G: 光合作用与叶绿体发育相关基因的转录水平。野生型基因转录水平设定为“ 1” 。* * 表示根据t测验差异极显著, P < 0.01。Fig. 5 Ultrastructure of mesophyll cells of WT and tsa1 mutant and expression level of related genesA-F: TEM picture of mesophyll cell of wild type (WT) and tsa1 mutant at different temperatures; D, E and F are the enlarged picture of the dashed areas in A, B, and C, respectively. Bars in A and B = 5 μ m, Bars in C = 2 μ m, Bars in D, E, and F = 1 μ m; G: expression of photosynthesis and chloroplast development related genes. The gene expression level of the wild type is set to “ 1” . * * indicates extremely significant difference at P< 0.01 as determined by t-test. |
2.4 Tsa1基因的精细定位用tsa1突变体与籼稻“ 南京11” 杂交, 所得F1代植株表型正常, F2代群体中出现明显的分离, 其中正常单株1186株, 突变型单株368株, 符合3∶ 1的分离比例(χ 2= 1.5027 < χ 20.05, 1), 说明该突变性状受单个隐性核基因控制。选取在两亲本间有多态性的463个均匀分布于水稻12条染色体上的SSR和InDel标记, 采用极端隐性个体定位的方法, 利用F2群体中10株极端单株进行初步连锁分析。结果显示突变基因与位于第5染色体长臂的SSR标记RM19159和RM5907存在连锁关系。而后在该区间内设计了8对InDel标记(表1), 利用筛选到的368株极端个体, 将突变基因定位到InDel标记Indel-12和Indel-16之间, 物理距离为163 kb (图6)。
表1
Table 1
表1(Table 1)
| 表1 水稻第5染色体上的连锁标记 Table 1 Linkage markers used in the fine mapping on the rice chromosome 5 |
3 讨论叶绿体的分化是在细胞质、细胞核遗传物质的协同调控下完成的, 一般可分为3个步骤[20, 21], 第1阶段, 当叶片原基分化为分生组织时, 激活了质体的复制及质体DNA的合成; 第2阶段, 分生组织细胞不断扩增, 由核编码的质体RNA聚合酶开始优先转录质体转录和翻译元件相关基因, 质体中翻译和转录活性大大增加, 叶绿体遗传系统元件建立; 最后, 叶肉细胞成熟, 质体编码的RNA聚合酶开始转录光合作用相关元件, 至此叶绿体发育形成[22]。很多研究表明, 叶绿体的发育受环境温度显著影响。例如, OsV1基因编码了定位于叶绿体的NUS1蛋白, 免疫沉淀显示其能够与质体中的RNA相结合, 该基因的突变影响了低温下叶绿体核糖体RNA的正常积累, 导致质体蛋白合成及叶绿体发育的异常[7]。水稻中的OsV2编码一个定位在质体和线粒体上的鸟苷酸激酶(guanylate kinase), 该酶是鸟嘌呤代谢通路中的关键酶, 催化GMP磷酸化形成GDP, 该基因的突变导致了叶绿体在低温条件下蛋白翻译机制的缺陷, 从而使叶绿体的分化受到抑制[8]。OsV4编码一个在水稻幼叶中高表达的PPR蛋白, osv4突变体幼苗在低温下叶片光合色素的含量下降、叶绿体异常, 分析显示其中核糖体组分(叶绿体16S和23S rRNA)和质体编码聚合酶(PEP)依赖型转录本的表达水平显著降低, 进而导致其早期叶绿体发育障碍[13]。TCD9基因编码Cpn60蛋白α 亚基(Cpn60α ), 在低温胁迫下水稻TCD9基因的突变阻碍了FtsZ的转录/翻译, 影响了质体分裂, 导致叶片早期叶绿体结构的异常[14]。在wlp1突变体中, 编码叶绿体50s核糖体蛋白L13 (RPL13)的WLP1 基因发生突变, 导致突变体低温条件下rpoA和rpoB基因的错误翻译进而破坏了质体编码聚合酶(PEP)的合成, 引起叶片和穗子的白化[15]。由此可见, 绝大多数温敏型白化突变体中, 某些叶绿体发育相关基因的转录和翻译受到了影响, 而低温胁迫能够进一步抑制叶绿体相关蛋白、光合色素的合成, 显著影响叶绿体发育, 进而出现明显的白化表型。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 Tsa1基因的精细定位Fig. 6 Fine mapping of Tsa1 gene |
本研究中, tsa1突变体只在低温下出现突变表型, 在20~24℃条件下叶片及叶鞘明显白化, 而在较高温度下突变体植株趋于正常。深入观察tsa1突变体白化植株发现, 其中正常叶绿体数量稀少, 取而代之的是大量小型的异常叶绿体, 该结构具有自发荧光, 说明其中含有光合色素。电镜观察发现异常叶绿体具有较高的电子密度, 说明其中含有较为丰富的蛋白质内容物, 但是没有观察到典型的类囊体垛叠结构。表达分析结果显示, tsa1突变体中光合作用相关基因下调, 叶绿体发育第2阶段相关基因表达显著上调。这些结果暗示该突变基因可能影响了叶绿体的后期发育, 使叶绿体滞留在发育中间阶段。而之前报道的水稻白化突变体中, 叶绿体的形态几乎丧失, 取而代之的是只含有嗜锇体的空泡状结构[9, 12, 16, 17], 这与本研究中报道的tsa1突变体有所不同, 因此对该突变体的深入研究很有可能拓展我们对叶绿体发育的认识。目前, 我们已经将TSA1基因锁定在第5染色体长臂163 kb的区间内, 包含编号为OSJBa0009C07、OJ1007H05和OJ1115D04的3个BAC克隆。已经克隆的水稻叶色相关基因中, 仅有4个基因分布于第5染色体, 且均与TSA1处于不同位置。其中, YGL1基因编码叶绿素合成酶, 位于编号为AC136221的BAC克隆上[23]; BGL基因编码一个鸟嘌呤核苷酸交换因子OsRopGEF10, 定位于编号为OJ1126D01的BAC克隆上[24]; OsHAP3B和OsHAP3C编码产物为CAAAT-box 结合复合体HAP的亚基, 分别定位于编号为OJ1280A04和OJ1735C10的BAC克隆上[25]。根据预测, Tsa1定位区间内包含28个ORF, 其中Os05g0586300编码产物具有DNA结合/转录激活活性, Os05g0587300编码产物属于HSP40分子伴侣家族, Os05g0588100编码一个定位于叶绿体的酰基蛋白硫酯酶, Os05g0586500编码一个氨基酸转运子, 此外还含有众多功能未知的蛋白质。目前, tsa1突变体中目的基因的鉴定工作正在进行, 该基因的图位克隆及深入研究有助于我们深入了解叶绿体发育途径, 对于提高水稻光合效率, 进而提高产量, 具有积极的意义。
4 结论tsa1是一个温敏型的白化突变体, 低温(20~24℃)下突变体植株明显白化, 叶绿素a和类胡萝卜素的含量显著降低, 而高温(28~32℃)下突变体外观及光合色素含量趋于正常。成熟期, 突变体tsa1的主要农艺性状与野生型没有显著差异。低温下tsa1突变体白化组织中叶绿体发育停滞, 出现了大量小型异常叶绿体结构, 该结构中含有光合色素及嗜锇体, 但无类囊体片层结构。经过精细定位, Tsa1基因被锁定在第5染色体长臂物理距离为163 kb的区域内。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] |
