
*通讯作者(Corresponding author): 陈明, E-mail: chenming02@caas.cn, Tel: 13683360891 **同等贡献(Contributed equally to this work) 第一作者联系方式: E-mail: hnndhs@126.com, Tel: 17701300735
收稿日期:2016-03-06 接受日期:2016-06-20网络出版日期:2016-07-04基金:
摘要
关键词:谷子; NF-Y类转录因子; 高盐胁迫; ABA非依赖途径
Transcription Factor SiNF-YA5 from Foxtail Millet ( Setaria italica) Conferred Tolerance to High-salt Stress through ABA-independent Pathway in Transgenic Arabidopsis
HUANG Suo

Abstract
Keyword:Foxtail millet ( Setaria italic); NF-Y like transcription factor; High salt stress; ABA independent signaling pathway
Show Figures
Show Figures
















干旱、盐碱、低温等非生物胁迫严重影响作物的生长发育及产量[1]。植物在长期的进化过程中逐渐形成一套复杂的逆境应答机制, 以抵御不良环境对植物的损害[2, 3]。大量研究证明, 植物细胞在染色体水平、转录水平以及转录后水平精确调控一系列胁迫应答基因的表达, 其中, 一些功能蛋白包括胚胎发育后期丰富蛋白(LEA蛋白)、渗透调节蛋白、离子区域化和水通道蛋白、脯氨酸及果聚糖合成酶及甜菜碱合成酶等直接发挥功能增强植物细胞抗逆性[4]。另外, 一些调控蛋白包括感应和传导胁迫信号的蛋白激酶(例如CDPK, cadium dependent phospholylation kinase; MAPK, mitogen-activated protein kinases)以及参与调控基因表达的转录因子(包括Bzip, basic leucine zipper类; NAC, nascent polypeptide-associated complex类; DREB, dehydration responsive element binding protein类; NF-Y, nuclear transcription factor Y类等)在植物胁迫应答过程中也发挥重要的基因表达调控作用[5]。近年来, 研究证明NF-Y类、NAC类、DREB类等转录因子参与多种逆境信号转导途径[6]。ABA (abscisic acid)是调控植物非生物胁迫响应的主要激素[7]。植物调控非生物胁迫响应的信号途径主要被分为ABA依赖性和ABA非依赖性信号途径[2, 3]。DREB1A转录因子主要参与ABA非依赖的逆境信号途径, 过表达DREB1A提高植物对低温的抗性[8]; 而MYBR/C (MYB/C recognition site)和ABRE (ABA responsive element)作为ABA依赖性信号途径中的一类重要的顺式作用元件, 能够调节干旱响应基因的表达[9], 过表达MYC类转录因子AtMYC2和MYB类转录因子AtMYB2基因可以提高植物对ABA的敏感性和对脱水逆境的耐受性[10]。
植物NF-Y类转录因子是一类重要的逆境调节因子, 由NF-YA、NF-YB和NF-YC亚基组成。在行使功能时, NF-YB亚基和NF-YC亚基先在细胞质中形成异源二聚体, 然后迁移到细胞核中和NF-YA亚基结合形成有活性的异源三聚体[11, 12, 13]。NF-Y异源三聚体具有保守的CCAAT-box位点结合特性, 而CCAAT-box顺式调控元件存在于真核生物约25%基因的启动子区域, 说明NF-Y转录因子在调控真核生物细胞内基因表达方面具有重要作用[14, 15, 16]。NF-Y转录因子普遍存在于拟南芥[17]、水稻[18]、玉米[19]、大豆[20]、小麦[21, 22]等作物中, 参与细胞增殖[23]、叶绿体形成[24]、胚胎发育、种子成熟[25]、光合作用[26, 27]、固氮成分的合成[28, 29]、花发育[30]等生长发育过程。除此之外, 一些NF-YA类转录因子在ABA信号途径中发挥重要作用。基因芯片分析结果显示, 诱导启动NF-YA2、NFYA3、NF-YA7和NF-YA10基因的表达可以下调PYR1/PYL/RCAR、PP2C和SnRK2等ABA信号途径相关基因的转录[31]。除此之外, 一些NF-YA类基因的拟南芥突变体和过表达植株在萌发期或者干旱条件下也表现与ABA有关的表型。拟南芥AtNF-YA5基因通过依赖ABA信号途径调控干旱胁迫[32], 并且在萌发期, NF-YA5突变体也表现出对ABA高度敏感[33]。定量分析显示, 过表达NF-YA1、NF-YA2、NF-YA3、NF-YA7、NF-YA9和NF-YA10均可导致拟南芥对ABA高度敏感[25]。这些研究结果都说明NF-Y转录因子调控植物抗逆反应依赖ABA信号途径, 关于NF-Y转录因子通过ABA非依赖途径调控植物抗逆反应未见报道。
谷子具有抗旱、耐贫瘠等特点, 是研究作物抗逆的理想材料[34]。本研究通过克隆并分析高盐胁迫响应NF-Y类转录因子SiNF-YA5基因的特性和生物学功能, 旨在为NF-Y类转录因子调控植物抗逆性的信号途径提供证据, 同时也为作物耐盐遗传改良提供新的遗传资源。
1 材料与方法1.1 试验材料1.1.1 植物材料 拟南芥野生型(Columbia生态型, WT)由本实验室保存, 谷子品种龙谷25由中国农业科学院作物科学研究所刁现民课题组提供。
1.1.2 载体和菌株 大肠杆菌、农杆菌GV3101、pBI121载体、GFP载体都由本实验室保存, pZeroBack载体购于北京天根公司。
1.1.3 试剂 限制性内切酶、T4 DNA连接酶购于Promega公司; in-Fusion克隆试剂盒购于TaRaKa公司; RT-PCR试剂盒购于全式金生物技术有限公司: 质粒提取试剂盒、RNA提取试剂盒、DNA凝胶回收试剂盒、qRT-PCR试剂盒购于天根公司; 引物合成和测序由奥科生物技术科技有限公司完成; 其他化学药品为国产分析纯试剂。
1.2 谷子SiNF-YA5基因的生物信息学分析 谷子数据来源于Phytozome数据库(http://www. phytozome.net/search.php), 利用SMART数据库(http://smart.embl-heidelberg.de/)在线工具分析谷子SiNF-YA5蛋白的保守结构域。
1.3 SiNF-YA5基因的克隆及载体构建根据谷子基因SiNF-YA5的CDS序列设计基因引物A5-F1和A5-R1 (表1), 用RNA提取试剂盒(TIANGEN, 北京)提取龙谷25植株总RNA, 用TransScript II一步法反转录试剂盒(TransGen, 北京)反转录成cDNA, 以cDNA为模板扩增SiNF-YA5, 并将其回收纯化, 采用in-Fusion试剂盒(TaKaRa)将其连接到pZeroBack载体上。以pZeroBack-SiNF-YA5质粒为模板, 引物为A5-F2和A5-R2 (表1)扩增SiNF-YA5, BamH I酶切GFP表达载体, 利用in-Fusion技术构建载体16318hGFP-SiNF-YA5。同样以pZeroBack-SiNF-YA5质粒为模板, 引物为A5-F3和A5-R3 (表1)扩增SiNF-YA5, Sma I酶切pBI121表达载体, 利用in-Fusion技术构建载体pBI121-SiNF-YA5。
1.4 SiNF-YA5的亚细胞定位参考Yoo等[35]的方法制备谷子原生质体, 将融合表达的重组质粒p16318hGFP-SiNF-YA5和GFP空载体质粒作为对照分别转化原生质体, 黑暗培养16 h以上, 并在激光共聚焦显微镜(Zeiss LSM700)下观察定位情况。
1.5 拟南芥转化参考Clough等[36]方法进行SiNF-YA5基因的遗传转化, 将收获的T0代种子种于含卡那霉素(50 mg L-1)的MS0培养基上, 筛选、扩繁获得T3代的纯合转基因株系OE1、OE2和OE3, 进一步分析其功能。
1.6 RNA提取及SiNF-YA5的表达谱分析 将谷子幼苗在营养土中正常生长(温度22℃、相对湿度65%、光照周期16 h光照/8 h黑暗) 3周后分别移至干旱(6% PEG-6000)、ABA (100 μ mol L-1)、NaCl (100 mmol L-1)、低氮(0.2 mmol L-1)的水培营养液中胁迫处理, 于处理后0、1、6和24 h分别取样, 用RNA提取试剂盒(TIANGEN)提取谷子植株总RNA。另外取NaCl (MS0+125 mmol L-1)处理的拟南芥转基因和WT植株, 提取总RNA, -80℃保存备用。分别用4种胁迫下的谷子总RNA和NaCl处理下的拟南芥转基因和WT植株RNA反转录产物作为模板, 以TransScriptII一步法反转录试剂盒(TransGen, 北京)反转录成cDNA, 以SYBR Green染料法, 在ABI Prism 7500上进行实时荧光定量PCR。RT-PCR反应体系含: 2× SuperReal PreMix Plus (含荧光染料)(TIANGEN) 12.5 μ L、10 μ mol L-1正向引物和反向引物各0.5 μ L、50× ROX Reference Dye∆ 0.5 μ L、RNase-free ddH2O 9.5 μ L。反应条件为95℃预变性10 min; 95℃变性15 s, 60℃退火20 s, 72℃延伸30 s, 并收集荧光信号, 35个循环, 用2-∆ ∆ Ct法计算该基因表达量。谷子SiNF-YA5基因qRT-PCR引物为A5-F4和A5-R4, 内参基因(Si001873m.g)引物为SiActin-F和SiActin-R (表1); 拟南芥下游基因qRT-PCR引物为NHX1-F和NHX1-R、LEA7-F和LEA7-R, 内参基因(AT3G15260)引物为AtActin-F和AtActin-R (表1)。
表1
Table 1
表1(Table 1)
| 表1 SiNF-YA5基因克隆和Real-time PCR分析所用引物 Table 1 Primers used for gene cloning and real-time PCR analysis |
1.7 转SiNF-YA5基因拟南芥的抗盐性分析 将WT和转SiNF-YA5基因株系OE1、OE2、OE3的种子经70%酒精处理3 min, 无菌水清洗3次, 每次1 min左右; 用0.5%~0.8%的次氯酸钠处理15 min, 无菌水清洗3次, 每次1 min; 4℃春化3 d, 再将种子分别点播至MS0、MS0+75 mmol L-1 NaCl、MS0+100 mmol L-1 NaCl和MS0+125 mmol L-1 NaCl的培养基上, 每种材料64粒种子, 重复3次。在22℃、相对湿度65%、光照周期16 h光照/8 h黑暗条件下萌发种子, 统计萌发率, 从第1天开始统计, 连续统计4 d; 同时, 将MS0培养基上正常生长7 d的拟南芥幼苗转移至MS0、MS0+100 mmol L-1 NaCl、MS0+125 mmol L-1 NaCl和MS0+150 mmol L-1 NaCl培养基上, 垂直培养7 d, 统计不同浓度处理下SiNF-YA5过表达株系和WT植株鲜重, 使用根系扫描仪(WINRHIZO proLA2400)分析根长, 试验重复3次, 运用方差分析软件分析转基因株系与野生型之间的差异。
1.8 转SiNF-YA5基因拟南芥对ABA敏感性分析 方法同1.7。萌发试验的ABA处理浓度为0.5 μ mol L-1和1 μ mol L-1, 苗期敏感性试验的ABA处理浓度为30 μ mol L-1和40 μ mol L-1。
2 结果与分析2.1 SiNF-YA5基因的特性分析前期工作对谷子干旱胁迫转录组分析发现1个在干旱处理下表达上调的NF-YA类转录因子基因SiNF-YA5。在谷子基因组数据库(http://www. phytozome.net/)搜索SiNF-YA5全长序列, 发现SiNF-YA5基因编码序列为924 bp, 有6个外显子, 5个内含子, 编码307个氨基酸, 分子量为33.76 kD。SiNF-YA5在149~210位氨基酸之间含有CBF保守域, 属于CCAAT结合蛋白家族。
2.2 SiNF-YA5基因的表达模式分析利用qRT-PCR分别检测结果(图1), 在NaCl处理下, SiNF-YA5的表达量逐渐上升并在24 h达到最大, 表达量是处理前的13.0倍; 在PEG处理下, SiNF-YA5的表达量逐渐上升, 在24 h达最高值, 表达量提高了4.0倍; 在低氮处理下, SiNF-YA5的表达量也呈上升趋势, 在12 h达最高值, 表达量提升了6.0倍左右。在ABA处理下, SiNF-YA5的表达量在1 h有所上升, 但相比处理前仅提高1.5倍。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 SiNF-YA5在不同处理下的表达模式Fig. 1 Expression patterns of the SiNF-YA5gene under various treatments |
2.3 SiNF-YA5蛋白亚细胞定位分析将融合表达的重组质粒p16318hGFP-SiNF-YA5和GFP空载体质粒作为对照分别转化制备的原生质体, 激光共聚焦显微镜下观察结果显示, 对照GFP蛋白在细胞核、细胞质、细胞膜中均有表达; 而转入16318hGFP-SiNF-YA5融合载体的原生质体在细胞核和细胞膜上都能观察到绿色荧光信号, 表明SiNF-YA5定位在细胞膜和细胞核中(图2)。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 16318hGFP-SiNF-YA5蛋白的亚细胞定位分析结果Fig. 2 Subcellular localization of 16318hGFPSiNF-YA5 protein |
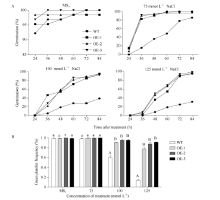
2.4 高盐条件下SiNF-YA5转基因拟南芥种子萌发率分析 从第1天观察WT和SiNF-YA5转基因拟南芥株系OE-1、OE-2和OE-3, 连续4 d统计萌发率。结果显示, 在MS0培养基中的SiNF-YA5转基因拟南芥和WT种子萌发率基本保持一致, 在24 h以后萌发率维持在95%左右(图3和图4-A); 在75 mmol L-1NaCl的培养基中, 在24 h WT不萌发, SiNF-YA5转基因拟南芥少量萌发, 在48 h, 两者的萌发率相差最大, WT为26.3%, SiNF-YA5转基因拟南芥为84.5%, 72 h以后SiNF-YA5转基因拟南芥萌发率接近100%, 两者差异逐渐减小(图3和图4-A); 在100 mmol L-1 NaCl和125 mmol L-1 NaCl的培养基中, 分别在36 h和48 h, SiNF-YA5转基因拟南芥和WT的萌发率才开始出现差异, SiNF-YA5转基因拟南芥的萌发率始终显著高于WT (图3和图4-A)。以上结果表明, 高盐处理条件下, SiNF-YA5转基因拟南芥的萌发率明显高于WT, 随着NaCl浓度的增加, WT和SiNF-YA5
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 高盐处理下SiNF-YA5转基因拟南芥和WT种子萌发情况Fig. 3 Seed germination situation ofSiNF-YA5transgenic Arabidopsis and WT under high salt stress condition |
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 高盐处理下SiNF-YA5转基因拟南芥和WT种子的萌发率和绿苗率A: 高盐处理下的种子萌发率; B: 高盐处理下的绿苗率; 采用单因素方差分析法对数据进行统计分析, 柱上不同的小写字母代表柱值在0.05水平上差异显著, 不同大写字母代表柱值在0.01水平上差异显著。Fig. 4 Seed germination rates and green plantlet rates ofSiNF-YA5transgenic Arabidopsis and WT under high salt stressA: seed germination rate under high salt treatment; B: green plantlet frequency under high salt treatment; Data statically analysis was made by the means of one-way ANOVA. The values marked with different lowercase letters on the columns are significantly different at the 0.05 level; the values marked with different capital letters on the columns are significantly different at the 0.01 level. |
转基因拟南芥的萌发速率都减慢, 但SiNF-YA5转基因拟南芥的萌发率始终显著高于WT。另外, 在萌发第5天统计, 在100 mmol L-1和125 mmol L-1 NaCl处理条件下, SiNF-YA5转基因拟南芥绿苗数高于WT, 并达到极显著水平(图4-B)。说明在拟南芥中过表达SiNF-YA5基因提高了拟南芥萌发期对高盐胁迫的耐受性, SiNF-YA5正向调节植物对高盐胁迫的耐性。
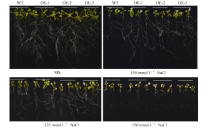
2.5 SiNF-YA5转基因拟南芥苗期耐盐性鉴定垂直培养7 d后显示, 在正常MS0培养基上, SiNF-YA5转基因拟南芥根表面积和植株鲜重与WT比较没有明显差别(图5和图6-A), 而在100 mmol L-1和125 mmol L-1 NaCl胁迫处理下, 与WT相比, SiNF-YA5转基因拟南芥的根表面积及植株鲜重增加, 在125 mmol L-1NaCl处理下的根表面积差异达到极显著水平(图6-A), 转基因株系的鲜重与WT相比差异达到显著水平(图6-B)。以上结果表明在植物中过表达SiNF-YA5基因可以显著提高转基因拟南芥苗期耐盐性。在150 mmol L-1 NaCl处理条件下, 转基因拟南芥及WT都趋向于死亡, 差异不显著(图5)。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 高盐处理下SiNF-YA5转基因拟南芥和WT苗期表型Fig. 5 Phenotype ofSiNF-YA5transgenic Arabidopsis and WT seedlings under high salt stress |
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 高盐处理下SiNF-YA5转基因拟南芥和WT苗期根表面积和鲜重A: 高盐处理下的根表面积; B: 高盐处理下植株鲜重。采用单因素方差分析法对数据进行统计分析, 柱上不同的小写字母代表柱值在0.05水平上差异显著, 不同大写字母代表柱值在0.01水平上差异显著。Fig. 6 Root surfaces and fresh weights ofSiNF-YA5transgenic Arabidopsis and WT seedlings under high salt stressA: root surface under high salt treatment; B: fresh weight under high salt treatment. Data statically analyzed by using method of one-way ANOVA. The values marked with different lowercase letters on the columns are significantly different at the 0.05 level; the values marked with different capital letters on the columns are significantly different at the 0.01 level. |
2.6 高盐胁迫响应相关基因的表达分析图7显示, 在盐胁迫下, 盐胁迫响应相关基因Na+/H+转运蛋白基因(NHX1)和种子胚胎发育后期富集的脱水保护蛋白基因(LEA7)在SiNF-YA5转基因拟南芥中的表达明显高于WT, 说明SiNF-YA5可能通过控制拟南芥中盐胁迫相关基因NHX1和LEA7的表达来提高植物耐盐性。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 NaCl处理下SiNF-YA5转基因拟南芥中盐胁迫相关基因表达水平Fig. 7 Expression levels of two stress-tolerant genes in SiNF-YA5transgenic Arabidopsis under NaCl treatment |
2.7 SiNF-YA5转基因植株对ABA敏感性分析在ABA处理下, WT和SiNF-YA5转基因株系萌发率无差异(图8-A和图9)。取上述MS0培养基上正常生长7 d的WT和SiNF-YA5转基因拟南芥幼苗, 分别转接到正常MS0和含有30 μ mol L-1和40 μ mol L-1 ABA的MS0培养基上照光, 垂直培养7 d, 结果显示, WT和转基因拟南芥在地上部分和地下部分无显著差异(图8-B)。说明无论在萌发期还是苗期, SiNF-YA5转基因拟南芥与WT相比对ABA敏感性没有差异, 证明SiNF-YA5不参与ABA信号途径, 它通过ABA非依赖途径调控植物的耐盐性。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 SiNF-YA5转基因拟南芥和WT对ABA敏感性A: SiNF-YA5转基因拟南芥和WT种子在含有0.5 μ mol L-1和1.0 μ mol L-1ABA的培养基上萌发情况; B: SiNF-YA5转基因拟南芥幼苗和WT幼苗在含有30 μ mol L-1和40 μ mol L-1ABA的培养基上对ABA敏感性。Fig. 8 Sensitivity analysis ofSiNF-YA5transgenic Arabidopsis and WT under ABA treatmentA: seed germination situation ofSiNF-YA5transgenic Arabidopsis and WT under 0.5 μ mol L-1 and 1.0 μ mol L-1ABA treatment; B: sensitivity analysis of SiNF-YA5 transgenic Arabidopsis seedlings under 30 μ mol L-1 and 40 μ mol L-1ABA treatment. |
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 ABA处理下SiNF-YA5转基因拟南芥和WT种子的萌发率Fig. 9 Seed germination rates ofSiNF-YA5transgenic Arabidopsis and WT under ABA treatment |
3 讨论NF-Y转录因子是一类重要的逆境调控因子, 它由3类亚基构成, NF-YA亚基可进一步被分为7个亚族。本研究从谷子中克隆1个NF-YA类基因SiNF-YA5, 根据已经发表的谷子NF-YA类转录因子进化树分析结果显示SiNF-YA5属于第III亚族[37], 与水稻NF-YA蛋白(OsHAP2E)进化关系最近, 而与拟南芥NF-YA蛋白进化关系较远。目前, 已经报道许多NF-Y类转录因子依赖ABA信号途径参与干旱、耐盐胁迫反应。大豆GmNF-YA3受ABA和NaCl胁迫诱导表达, 在拟南芥中过表达GmNF-YA3能够提高植物的抗旱性。在正常条件下, 在GmNF-YA3过表达拟南芥中, ABA合成及信号传导相关基因和胁迫相关基因转录水平提高[20]。拟南芥AtNF-YA1基因依赖ABA信号途径负向调控植物盐胁迫耐性, 抑制幼苗的生长。在苗期, 过表达AtNF-YA1基因的转基因拟南芥提高了植物对盐和ABA的敏感性, 当ABA抑制剂存在时, 过表达AtNF-YA1拟南芥对盐敏感的表型恢复[38]。谷子SiNF-YA1 (Si037045m)和SiNF-YB8(Si032469m)基因通过ABA信号途径激活胁迫相关基因表达, 改善植物生理特性从而正向调节植物耐盐性和耐旱性[37]。同时发现SiNF-YA5与拟南芥AtNF-YA1、谷子SiNF-YA1和SiNF-YB8均不在同一亚族, 推测SiNF-YA5可能通过与上述基因不同的其他途径调控耐盐和抗旱性。本文研究结果表明, 在高盐处理条件下, SiNF-YA5转基因拟南芥在萌发期的萌发率显著高于WT (图4); 在苗期, SiNF-YA5转基因拟南芥的根系比WT发达, 鲜重显著大于WT (图6)。然而, 与SiNF-YA1和SiNF-YB8基因不同, SiNF-YA5转基因拟南芥在萌发期和苗期对ABA均不敏感(图8), 所以推测SiNF-YA5通过ABA非依赖途径提高植物对NaCl胁迫的耐性。Chamindika创建拟南芥NF-YA类转录因子的10个过表达材料, 观察ABA调节的种子萌发和植物生长发育的情况, 结果发现所有的材料生长发育受到抑制, 但萌发期对ABA敏感性存在差异。在ABA不敏感的过表达材料中进行基因表达检测发现ABA信号途径相关基因下调[39]。同样, NF-YC类转录因子在种子萌发期对ABA的反应也不完全相同, 种子萌发期NF-YC4突变体对ABA敏感, 而NF-YC3和NF-YC9突变体则不敏感[40]。这些研究结果都表明NF-Y类转录因子调控耐盐的途径存在差异, 同时存在着ABA依赖型和ABA非依赖型的耐盐信号调控途径。
在SiNF-YA5转基因株系中, 我们检测到参与盐胁迫响应基因NHX1和LEA7的表达量较WT都显著提高(图7)。同时, 分别分析NHX1和LEA7基因的启动子区域, 发现两者均有4个CAATT-box结构域(NF-Y类转录因子结合元件), 因此推测SiNF-YA5可能主要通过ABA非依赖途径直接激活下游基因NHX1和LEA7基因表达完成植物的耐盐调控。NHX1是第1个在拟南芥中发现的Na+/H+转运蛋白, 能够促进钠离子在液泡中的积累[41]。盐胁迫环境下构建及分析 SOS 转录调控网络时发现拟南芥bZIP类转录因子At5g65210首先通过ABA非依赖途径接收细胞膜上感受器传递的外界Na+信号, 然后调控液泡膜上的Na+/H+转运基因 NHX1[42]。NHX1主要利用液泡膜的H+-ATPase和液泡膜H+-PPase产生的跨膜质子梯度将胞质中的Na+逆浓度梯度运入液泡中降低Na+对植物细胞的毒害作用[43]。LEA蛋白是一类参与细胞抗逆保护的蛋白质, 广泛存在于植物的种子中, 能够在干旱胁迫时保护膜系统以及生物大分子免受脱水伤害。植物遭受干旱、盐渍及低温等胁迫时, 体内LEA基因的表达会增加。已有研究报道LEA基因可以增加转基因水稻耐盐和抗旱性[44]。关于SiNF-YA5提高转基因植物对高盐胁迫耐性的信号途径还需要进一步分析, 本研究初步阐明了谷子SiNF-YA5在调节高盐胁迫响应中的ABA非依赖型信号途径, 为进一步了解谷子抗逆机制提供了新的依据。
4 结论从谷子中分离出NF-Y类转录因子基因SiNF-YA5。SiNF-YA5被定位于细胞核及细胞膜。SiNF-YA5受低氮、干旱、高盐等胁迫的诱导表达。在植物中过表达SiNF-YA5可以显著提高植物在萌发期及苗期的耐盐性。SiNF-YA5转基因植物对ABA的敏感性与WT差异不显著, 证明SiNF-YA5通过ABA非依赖途径调控植物的耐盐性。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] | |
| [36] | |
| [37] | |
| [38] | |
| [39] | |
| [40] | |
| [41] | |
| [42] | |
| [43] | |
| [44] |
