 , 苗利娟, 齐飞艳, 张忠信, 高伟, 孙子淇, 黄冰艳, 董文召, 汤丰收, 张新友
, 苗利娟, 齐飞艳, 张忠信, 高伟, 孙子淇, 黄冰艳, 董文召, 汤丰收, 张新友
*通讯作者(Corresponding author) : 张新友, E-mail: haasz@126.com, Tel: 0371-65729560 第一作者联系方式: E-mail: leis100@163.com
收稿日期:2016-02-29 接受日期:2016-07-11网络出版日期:2016-08-11基金:
摘要
关键词:花生; Δ9-硬脂酰-ACP脱氢酶基因( SAD); 启动子; 基因组步移; GUS报告基因
Cloning and Functional Analysis of Peanut Δ9-Stearoyl-Acyl Carrier Protein Desaturase Promoter
SHI Lei
 , MIAO Li-Juan, QI Fei-Yan, ZHANG Zhong-Xin, GAO Wei, SUN Zi-Qi, HUANG Bing-Yan, DONG Wen-Zhao, TANG Feng-Shou, ZHANG Xin-You
, MIAO Li-Juan, QI Fei-Yan, ZHANG Zhong-Xin, GAO Wei, SUN Zi-Qi, HUANG Bing-Yan, DONG Wen-Zhao, TANG Feng-Shou, ZHANG Xin-You
Fund:
Abstract
Keyword:Peanut ( Arachis hypogaea L.); Δ9-stearoyl-ACP desaturase ( SAD); Promoter; Genomic walking; GUS reporter gene
Show Figures
Show Figures













花生是国产植物油的重要来源。花生脂肪含量约占籽仁干重的50%, 其中不饱和脂肪酸油酸(C18:1)和亚油酸(C18:2)约占脂肪酸含量的80%。油酸是人们日常摄入最多的单不饱和脂肪酸, 约占单不饱和脂肪酸总摄入量的90%[1], 油酸可以选择性地抑制低密度脂蛋白升高, 而不影响高密度脂蛋白, 低密度脂蛋白使人体内胆固醇增加, 高密度脂蛋白降低身体组织内的胆固醇, 降低冠心病及动脉粥样硬化风险, 高油酸花生还可以改善血脂和血糖, 并且具有更低的致敏性, 油酸还具有抗炎特性并且可以激活多种免疫细胞[2, 3, 4], 因此食用高油酸花生油更有益于健康[5]。油酸比亚油酸少一个双键, 根据不同的检测方法其氧化稳定性比亚油酸高3.4~14.5倍, 这导致高油酸花生及其制品不易氧化和腐败, 货架期更长, 并且具有更好的风味[5, 6, 7, 8]。油酸的这些优点决定了油脂的营养价值及氧化稳定性, 因此油酸含量或油酸与亚油酸的比值(油亚比, O/L)成为评价不同花生品种(油)商品性的重要生化指标。培育高油酸花生品种已成为世界花生遗传改良的重要目标, 阐明花生高油酸形成的分子机制具有重要意义。
Δ 9-硬脂酰-ACP脱氢酶(SAD)是一种存在于质体基质中的可溶性脂肪酸脱氢酶, 通过在脂肪酸链的C9和C10之间引入一个双键催化硬脂酰-ACP脱饱和生成油酰-ACP, 决定了植物油脂中饱和脂肪酸与不饱和脂肪酸的比例[9]。目前, 在拟南芥[10]、花生[11]、大豆[12]、油菜[13]、小桐子[14]、冬性小麦[15]、水黄皮[16]、油樟[17]、银杏[18]、椰子[19]、亚麻籽[20]、亚麻[21, 22]等多种植物中克隆到了SAD基因。SAD属于一个小的基因家族[10, 13, 14, 15, 16, 17, 23], 不同成员之间的表达模式及功能也有差异[10, 17, 23, 24, 25], SAD在多种植物发育的种子中表达量高于其他组织, 并随着种子发育其表达量呈钟型变化[16, 19, 20, 22, 26, 27]。利用RNAi沉默棉花SAD, 硬脂酸含量从正常的2%~3%上升到40%, 同时伴随棕榈酸、油酸、亚油酸含量的降低[28]。拟南芥SAD突变也会导致硬脂酸含量从野生型的0.8%增加到14.3%, 同时伴随棕榈酸及油酸含量的减少[29], 而过表达SAD6会导致拟南芥硬脂酸含量降低和油酸含量升高, 而重新干扰SAD6后, 表型又恢复至野生型[25]。将马铃薯SAD转入烟草, 同样提高了叶片和种子中不饱和脂肪酸含量[30]。
很多高等植物通过基因复制、多倍体化等机制使维持生长、发育等基本生物学过程的关键基因以多拷贝形式存在, 不同拷贝之间的功能或表达模式逐渐发生变化[31], 启动子功能分析可以精确定位基因的表达部位、发育阶段和调控机制, 预测基因的功能, 另外内源启动子也是植物基因工程中表达载体的重要元件, 根据不同目的需要各种不同类型的启动子驱动目的基因在转基因植物中定时、定位表达。因此启动子序列的功能研究对于阐明基因功能及植物基因工程都具有非常重要的意义。
虽然有****在花生中克隆了SAD并进行了表达模式分析[11, 24], 但还未见有关AhSAD启动子的克隆与功能分析的报道。本研究通过基因组步移技术克隆了AhSAD上游720 bp的核苷酸序列, 并分析了AhSAD启动子序列特点及顺式作用元件, 构建了该启动子驱动GUS报告基因的植物表达载体pBI121-PAhSAD。通过转基因拟南芥及花生不同组织的瞬时表达, 初步研究了AhSAD启动子的功能, 以期为阐明AhSAD的功能特征及进一步明确花生高油酸形成的分子机制提供理论参考, 同时也为花生品质改良基因工程提供新的调控元件。
1 材料与方法1.1 试验材料1.1.1 植物材料 花生(Arachis hypogaea L.)品种豫花9326由本课题组选育, 正常季节种植于河南省农业科学院试验基地, 转基因受体为拟南芥Columbia生态型, 由本实验室保存。
1.1.2 菌株及质粒 农杆菌菌株GV3101、植物表达载体pBI121由本实验室保存。大肠杆菌JM109感受态、pMD18-T克隆载体购自TaKaRa公司。
1.1.3 试剂 GenomeWalker Universal Kit、SMARTer RACE cDNA amplification Kit购自Clontech公司; 植物DNA提取试剂盒、质粒提取试剂盒、DNA纯化试剂盒、琼脂糖凝胶回收试剂盒购自北京天根生化科技有限公司; 各种限制性内切酶、连接酶、LA Taq、PfuTaq等购自TaKaRa公司; RNA提取试剂盒购自Omega公司, Prime-Script RT Reagent Kit购自TaKaRa公司, SYBR PCR Master Mix Kit购自罗氏(Roche, Swiss), PCR引物合成及DNA测序由北京六合华大基因科技有限公司完成; 其他试剂均为进口或国产分析纯。
1.2 AhSAD基因表达的实时荧光定量PCR分析按照RNA提取试剂盒说明提取花生根、茎、叶、果针、种衣及花后30、40、50、60、70和80 d种子的总RNA, 按照试剂盒说明进行反转录, 以获得的cDNA第1链为qRT-PCR模板, 花生ADH3作为内参基因[32], 测定AhSAD的相对表达量。基于AhSAD序列(AF172728.1)设计qRT-PCR引物AhSAD-RT-F (5° -CCTAACCCTTCACAGAAGCT-3° )和AhSAD-RT-R (5° -TCAGCCCAACCCTCTAACGA -3° )。ADH3 qRT-PCR引物为ADH3-RT-F (5° -GACG CTTGGCGAGATCAACA-3° )和ADH3-RT-R (5° -AAC CGGACAACCACCACATG-3° )[32]。扩增体系10 μ L, 含1 μ L cDNA、5 μ L 2 × LightCycler 480 SYBR Green I Master (Roche, Swiss)、10 μ mol L-1正向引物和反向引物各0.5 μ L、3 μ L ddH2O。用罗氏LightCycler 480 II Real-time PCR System (Roche, Swiss)进行qRT-PCR, 反应条件为95℃ 10 min; 95℃ 10 s, 60℃ 30 s, 40个循环。每个样品3个重复孔(技术重复), 3个生物学重复。采用2-Δ Δ Ct法分析相对表达量, 并计算3次生物学重复的标准误。
1.3 AhSAD启动子的克隆按照植物DNA提取试剂盒操作说明提取花生叶片基因组DNA。按照基因组步移试剂盒操作说明(增加了Sma I内切酶)进行2轮PCR扩增克隆AhSAD启动子。详细步骤如下: 经分光光度计、Dra I内切酶酶切和凝胶电泳检测, 将DNA稀释至0.1 μ g μ L-1, 分别取25 μ L DNA经Dra I、EcoR V、PvuII、StuI、Sma I内切酶酶切, 回收纯化后溶于20 μ L TE缓冲液(pH 7.5)中。分别取4 μ L纯化后的TE缓冲液, 连接接头(5° -GTAATACGACTCACTATAGGGCACGC GTGGTCGACGGCCCGGGCTGGT-3° ), 构建5个不同的DNA库(LD、LE、LP、LSt、LSm), 用作基因组步移第1轮PCR模板。基于AhSAD序列(AF172728.1)信息, 在该序列的5° 端设计2个3° 端特异性巢式PCR引物GSP1 (5° -CCATGCGGAACCTT GGAGATCTGAGG-3° )和GSP2 (5° -GAAGGGTTAG GGTTCAGCCTCAGAGCCAT-3° )。分别以5个DNA库为模板, 以GSP1和AP1 (5° -GTAATACGACTCAC TATAGGGC-3° )为引物进行第1轮扩增, 扩增体系10 μ L, 含模板DNA 0.2 μ L、10× LA-PCR缓冲液II (Mg2+ plus) 1 μ L、2.5 mmol L-1dNTPs混合物1.6 μ L、10 μ mol L-1 GSP1 0.5 μ L、AP1 (10 μ mol L-1) 0.5 μ L、LATaq (5 U μ L-1) 0.1 μ L。ddH2O补齐至10 μ L。反应条件为94℃预变性1 min; 98℃变性10 s, 72℃退火6 min, 7个循环; 98℃ 变性10 s, 67℃退火6 min, 33个循环; 72℃延伸10 min。将第1轮PCR产物稀释50倍, 取0.2 μ L作为第2轮PCR模板, 以GSP2和AP2 (5° -ACTATAGGGCACGCGTGGT-3° )为引物进行第2轮PCR, 扩增体系及条件同第1轮。1%琼脂糖电泳检测第2轮PCR扩增产物, 切胶回收, 并克隆到pMD18-T载体上测序。
1.4 RNA提取及5° 非翻译区序列(5° UTR)的克隆用RNA提取试剂盒提取叶片、花后30、40和60 d种子的总RNA, 经琼脂糖电泳检测RNA质量和分光光度计定量后, 等量混合。用SMARTer RACE cDNA amplification kit提供的试剂和方法进行5° RACE第1链cDNA的合成, 反应体系含0.5 μ g RNA和1.0 μ L 5° -CDS Primer A, ddH2O补齐至3.75 μ L, 72℃温浴3 min, 42℃温浴2 min。加入1 μ L SMARTer IIA oligo、2.0 μ L 5× First-Strand缓冲液、1.0 μ L DTT (20 mmol L-1)、1.0 μ L dNTPs混合物(10 mmol L-1)、0.25 μ L核糖核酸酶抑制剂(40 U μ L-1)、1.0 μ L SMARTscribe逆转录酶(100 U), 42℃温浴90 min, 70℃温浴10 min终止反应, 加入20 μ L Tricine- EDTA缓冲液, 混匀, 完成构建5° -RACE-Ready cDNA。以5° -RACE-Ready cDNA为模板, GSP1和UPM (5° -CTAATACGACTCACTATAGGGCAAGC AGTGGTATCAACGCAGAGT-3° )为引物, 进行第1轮PCR扩增, 除退火时间改为1 min外, 扩增体系及条件同AhSAD启动子步移PCR。将第1轮PCR产物稀释50倍, 取0.2 μ L作为第2轮PCR模板, 以GSP2和NUP (5° -AAGCAGTGGTATCAACGCAGA GT-3° )为引物进行第2轮扩增, 扩增体系和条件同第1轮。以1%琼脂糖电泳检测第2轮PCR扩增产物, 切胶回收, 并克隆到pMD18-T载体上测序。
1.5 AhSAD启动子序列分析利用植物启动子在线分析网站PLACE (http://www.dna.affrc.go.jp/PLACE/signalscan.html)和plantCARE (http://bioinformatics.psb.ugent.be/ webtools/plantcare/html/)分析可能的顺式作用元件。
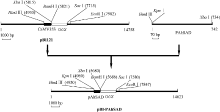
1.6 AhSAD启动子表达载体构建根据基因组步移获得的DNA序列, 设计带有保护碱基和酶切位点的引物AhSAD-P-S (5° -CAGAAG CTT(Hind III)GGTACC(Kpn I) AAATTTTGAGTAT CATTTTAGTAATAG-3° )和AhSAD-P-A (5° -GACAT CTAGA(XbaI)TTTTCGTGTTGCGTCTTC-3° ), 以花生基因组DNA为模板, 用PfuTaq进行AhSAD启动子的PCR扩增, 回收纯化产物, 经Hind III和Xba I双酶切后, 用T4 DNA连接酶连接到经Hind III和Xba I双酶切的pBI121质粒上, 替换CaMV35S构建重组植物表达载体pBI-PAhSAD, 过程如图1所示。转化大肠杆菌感受态, 通过PCR扩增、酶切及测序(pBI121-S: 5° -GGAATTGTGAGCGGATAAC-3° ; pBI121-A: 5° -GCCCGGCTTTCTTGTAAC-3° )鉴定阳性克隆。提取质粒, 以冻融法转化pBI-PAhSAD和pBI121至农杆菌中, 鉴定阳性克隆, 保存于-80℃备用。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 植物表达载体构建过程Fig. 1 Flow chart for construction of the plant expression vector |
1.7 根癌农杆菌介导法转化拟南芥及花生各组织利用农杆菌花序浸染法转化拟南芥。转化前1 d浇足水分, 剪去果荚; 农杆菌离心后用5%的蔗糖溶液重新悬浮, 加入终浓度为0.02% Silwet-77, 花序于蔗糖悬浮的农杆菌菌液中浸泡50 s, 用保鲜膜包裹植株, 22℃避光培养24 h, 取下保鲜膜, 1周后进行第2次侵染。种子成熟后, 室温干燥, 于4℃冰箱保存。T1代种子经75%的乙醇消毒3 min, 0.01%的升汞消毒3 min, 无菌水漂洗5~7次, 播种于含50 mg L-1卡那霉素的MS固体培养基上。4℃暗培养3 d, 转入22℃ 16 h光照/20℃ 8 h黑暗的植物生长培养箱, 筛选抗性植株。以CTAB法提取抗性苗幼嫩叶片基因组DNA, 用引物AhSAD-P-S和AhSAD-P-A进行PCR扩增鉴定阳性植株, 分别以野生型拟南芥DNA和pBI-PAhSAD载体为阴性对照和阳性对照。用农杆菌介导法转化花生根、茎、叶、果针、种子、子叶等组织, 进行瞬时表达。农杆菌菌液的处理方法同转化拟南芥的处理方法, 取花生各组织浸泡其中10 min, 无菌水冲洗2次, 于MS培养基上, 28℃避光培养2 d。
1.8 AhSAD启动子功能分析用GUS组织化学染色分析方法验证AhSAD启动子的功能。取拟南芥阳性苗和农杆菌侵染后的花生不同组织, 放入GUS染色液中(X-gluc 0.5 g L-1, 50 mmol L-1 pH 7.0磷酸缓冲液, 10 mmol L-1EDTA, 0.5 mmol L-1铁氰化钾, 0.5 mmol L-1亚铁氰化钾, 0.01% Triton X-100, 20%甲醇), 抽真空10 min, 37℃温育过夜。用乙醇乙酸混合液(体积比为1:1)将绿色组织脱色至无色, 分别用75%、50%、25%的乙醇洗涤3次, 用蒸馏水洗涤数次, 显微镜或相机照相、保存。
2 结果与分析2.1 AhSAD基因组织表达分析实时荧光定量PCR结果表明, AhSAD基因在上述组织中均有表达, 且表达量存在组织差异性, AhSAD在不同发育时期种子中的表达量最高, 果针中的表达量最低(图2)。AhSAD相对表达量在不同发育时期的种子中存在明显差异, 随着种子发育呈钟型变化, 在花后70 d的种子中表达量达到最高值, 是花后30 d种子中的4.35倍, 随着种子的成熟, 表达量下降, 这暗示AhSAD可能在种子发育过程中起重要作用。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 AhSAD基因在不同花生组织和发育时期种子中的相对表达量Fig. 2 Expression of AhSAD in various peanut tissues and various development stage seeds DAF: days after flowering. |
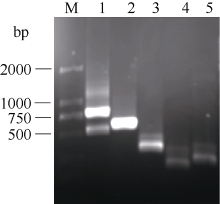
2.2 AhSAD启动子的克隆利用基因组步移法, 以AhSAD特异性引物为起点经2轮PCR扩增, 在豫花9326基因组DNA构建的LD和LE库中获得了明显的特异性条带(图3), 切胶回收较大的LD库的PCR产物, 并连接到T载体pMD18-T中测序。结果表明PCR产物碱基数目785 bp, 在序列的5° 端查找到了接头的部分序列和Dra I (识别序列TTT|AAA)酶切后的AAA残基序列, 在3° 端查找到了GSP2引物序列和AhSAD 5° UTR的部分序列(图5)。去除接头的部分序列, 获得了起始密码子ATG上游720 bp的碱基序列。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 基因组步移扩增AhSAD基因启动子电泳图 M: DL 2000 DNA marker; 1: LD PCR产物; 2: LE PCR产物; 3: LP PCR产物; 4: LSt PCR产物; 5: LSm PCR产物。Fig. 3 PCR products of AhSAD promoter by the genomic walking method M: DL 2000 DNA marker; 1: fragment from LD; 2: fragment from LE; 3: fragment from LP; 4: fragment from LSt; 5: fragment from LSm. |
2.3 AhSAD 5° UTR的克隆利用构建的花生幼叶、花后30、40和60 d种子的混合全长cDNA文库进行5° RACE, 克隆到了AhSAD的特异性扩增片段(图4)。连接到pMD18-T载体测序, 证明该序列为AhSAD的5° UTR序列。去除序列中5° RACE接头碱基, 从GSP2引物到可能的转录起始位点长度为167 bp, 转录起始位点位于起始密码子ATG上游-138 bp处(图5)。通过和基因组步移获得的AhSAD启动子序列比对, 该序列完全位于AhSAD启动子的3° 端, 证明获得的启动子序列并不是AhSAD位于ATG上游的内含子区域, 确定是AhSAD启动子序列。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 AhSAD基因5´ RACE琼脂糖电泳图 M: DL 2000 DNA marker; 1: 5° RACE PCR产物。Fig. 4 Agarose electrophoresis image of AhSAD 5° RACE M: DL2000 DNA marker; 1: fragment obtained by 5° RACE PCR. |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 AhSAD基因启动子序列的生物信息学分析 “ ↓ ” 表示转录起始位点。Fig. 5 Bioinformatics analysis of DNA sequence of AhSAD promoter “ ↓ ” shows the transcription initiation site. |
2.4 AhSAD启动子生物信息学分析应用在线软件PLACE和plantCARE对花生AhSAD启动子进行生物信息学分析表明, 在AhSAD启动子区有4个可能的真核生物RNA聚合酶II结合位点TATA-box, 5个增强转录的CAAT-box (图5)。并发现了多个生物胁迫和非生物胁迫响应的顺式作用元件, 其中有1个响应病原菌及盐诱导的作用元件GT1GMSCAM4 (GAAAAA), 5个光响应相关元件, 分别是-10PEHVPSBD、GATABOX、GT1CONSENSUS、GT1CORE和GT1CONSENSUS, 1个水杨酸诱导的WRKY结合位点WBOXATNPR1, 1个MYB结合位点CCA1ATLHCB1, 1个激素应答相关位点ARFAT。该序列还有1个叶肉组织表达特异性元件CACTFTPPCA1 (YACT), 1个增强种子特异性表达元件EBOXBNNAPA (CANNTG), 1个增强基因表达的顺式元件CT-rich motif (TCTCTCTCT)。这些作用元件对AhSAD启动子的功能可能起重要作用。
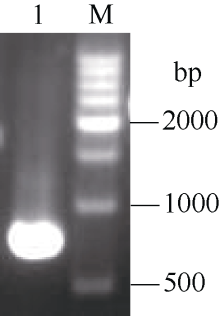
2.5 转基因植株的获得及组织化学染色以基因组DNA为模板, PCR扩增获得AhSAD启动子序列(图6), 构建了植物表达载体pBI-PAhSAD, 经Hind III和Xba I双酶切及测序鉴定正确后, 以冻融法转化农杆菌GV3101。采用花序浸染法转化野生型拟南芥Col-0, 获得T1代种子。用50 mg L-1Kan筛选T1代种子, 获得近百株抗性苗, 通过PCR检测和GUS染色显示, 抗性苗绝大多数为阳性苗。选取9株进行T2代种子的Kan筛选追踪, 发现6个T2代转基因株系绿苗和黄化苗的比例接近3︰1, 初步认为这6个株系是以单拷贝的形式整合到拟南芥基因组中的。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 AhSAD基因启动子的PCR扩增 M: 500 bp ladder DNA marker; 1: PCR产物。Fig. 6 PCR amplification result of AhSAD promoter M: 500 bp ladder DNA marker; 1: fragment obtained by PCR. |
取上述6个株系的T3代转基因植株幼苗及不同组织进行GUS染色, 确定启动子的表达特性, 染色结果如图7所示。在子叶期转基因植株幼苗的子叶为蓝色, 根部不能被染色; 幼苗期子叶、莲座叶和根部都被染成蓝色, 随着苗龄的增加, 颜色有所变浅, 主要集中在主根及叶脉处, 幼嫩的根部不能被染色; 进入生殖生长期后, 拟南芥的茎被染成蓝色, 在茎生叶中只有主叶脉被染成蓝色; 进入生殖生长期后, 拟南芥种子中的胚被染成蓝色。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 转基因拟南芥的GUS组织化学染色 A: 2日龄幼苗; B: 6日龄幼苗; C: 15日龄幼苗; D: 茎; E: 茎生叶; F: 种子。Fig. 7 Histochemical GUS assay of transgenic Arabidopsis A: two day-old seedling; B: six day-old seedling; C: 15 day-old seedling; D: stem; E: cauline leaf; F: seed. |
对农杆菌侵染后的花生根、茎、叶、果针、种子和子叶进行GUS染色, 如图8所示, 阴性对照花生的各个组织没有被染色。转化阳性对照pBI121载体的花生各个组织都被染成了蓝色, 说明花生根、茎、叶、果针、种子和子叶中的GUS基因都可以被CaMV35S组成型启动子激活表达。转化载体pBI-PAhSAD花生的根、茎、叶、果针、种子和子叶都被染成蓝色, 除叶片的颜色比CaMV35S驱动的叶片颜色更蓝外, 其他组织与CaMV35S驱动的GUS基因的表达接近, 说明载体pBI-PAhSAD能够驱动GUS报告基因在花生的根、茎、叶、果针、种子和子叶中表达。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 花生不同组织的GUS组织化学染色 A: 未转化的花生组织; B: GUS基因由CaMV35S启动子驱动; C: GUS基因由AhSAD基因启动子驱动。Fig. 8 Histochemical GUS assay of different tissues of peanut A: non-transformed peanut tissues; B: GUS gene driven by CAMV35S; C: GUS gene driven by AhSAD promoter. |
3 讨论基因在植物中的富集表达部位与其功能密切相关, 为了研究花生Δ 9-硬脂酰-ACP脱饱和酶基因的功能, 首先通过荧光定量PCR分析该基因的表达模式, 其在种子中的表达量较高, 表达量随着种子的发育呈钟型分布, 在根、茎、叶、果针和种衣中也均有表达, 与目前克隆到的其他物种SAD基因表达模式相似[16, 19, 20, 22, 23, 26, 27], 说明该基因表达模式具有一定的保守性, 推测其功能也具有保守性。利用基因组步移技术和PCR方法克隆得到AhSAD基因5′ 侧翼序列, 虽然在其他物种未发现该基因存在位于起始密码子ATG上游非编码区中的内含子, 鉴于花生脂肪酸合成途径中的一些基因存在该类内含子且片段较长, 如AhFAD2-1[33]、AhFAD2-2和AhFAE(未发表数据), 为验证获得的序列是否为内含子序列, 本研究通过5′ RACE技术获得了该基因的5′ 非编码区序列, 通过与基因组步移获得序列比对, 证明获得的序列为启动子序列。启动子序列中调控元件的种类、数量以及彼此的顺序和距离都可能影响下游基因的转录。序列分析表明, 除了TATA-box和CAAT-box基本顺式作用元件外, 还含有生物胁迫和非生物胁迫的作用元件, 以及增强种子特异性表达的元件。通过GUS组织化学染色, 表明该启动子在转基因拟南芥和瞬时表达的花生组织中都能启动GUS的正确表达, 两者的表达模式基本一致, 并且在种子中的染色较深, 说明该启动子在种子中表达量较大, 这与花生AhSAD的表达模式基本一致, 证明克隆到的启动子具备执行功能的基本元件, 推测该基因对花生种子中的油酰-ACP的合成与积累起重要作用。SAD通过催化硬脂酰-ACP的氧化与多种植物生命活动密切相关, 如增强低温耐受性[34]、增加抗病能力及调控植物生长[17], 这与该启动子区域发现的多个生物胁迫、非生物胁迫、病原菌及盐诱导的作用元件相一致, 对这些顺式作用元件的深入研究有助于了解该启动子的具体作用, 具有实际意义。
鉴于花生遗传转化周期比较长, 转化效率较低, 研究中经常选择模式植物拟南芥和烟草来分析启动子的表达模式, 如通过转录组分析获得的根特异性表达基因Asy, 其启动子在拟南芥和烟草中呈现根特异性表达[35]; 在花生胚中特异性表达的油体蛋白AhOleo17.8基因[36], 其启动子在拟南芥中驱动GUS在胚和胚根中都有表达, 这可能是花生荧光定量过程中对根的取样没有包含胚根的结果, 也可能是该启动子在花生和拟南芥中的功能存在差异引起的。相同启动子在不同受体中的表达模式也有差异, 如烟草绒毡层特异性启动子pTA29在烟草中特异性地在绒毡层中表达, 而在棉花的叶片表皮毛和花粉中也检测到了GUS活性[37]; 拟南芥PABP5启动子在拟南芥的绒毡层、花粉、胚珠中表达[38], 与拟南芥不同, 在烟草受体的柱头中也检测到了GUS活性[39]。因此尽管本研究中花生硬脂酰-ACP脱饱和酶基因启动子在转基因拟南芥和花生的瞬时表达模式与荧光定量结果一致, 要明确该启动子的功能及作用元件如何调控启动子仍需在转基因花生中进一步研究。
4 结论通过基因组步移技术克隆了花生AhSAD基因5′ 侧翼序列, 该序列长度为720 bp, 含有TATA-box和CAAT-box等顺式作用元件。AhSAD启动子在根、茎、叶片和种子中启动GUS的优势表达。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] | |
| [36] | |
| [37] | |
| [38] | |
| [39] |
