 , 郭建春
, 郭建春*通讯作者(Corresponding author): 杨成龙, E-mail: yangchenglong208@163.com, Tel: 0859-3911295 第一作者联系方式: E-mail: yushizhou2008@163.com
收稿日期:2016-02-19 接受日期:2016-07-11网络出版日期:2016-07-28基金:
摘要
关键词:海马齿; 甜菜碱醛脱氢酶; 原核表达; 酶活测定
Cloning, Expression, and Enzymatic Characteristics of Betaine Aldehyde Dehydrogenase Gene in Sesuvium portulacastrum L.
YU Shi-Zhou
 , GUO Jian-Chun
, GUO Jian-ChunFund:
Abstract
Keyword: Sesuvium portulacastrumL.; Betaine aldehyde dehydrogenase; Prokaryotic expression; Enzyme activity assay
Show Figures
Show Figures



低温、高温、高盐和干旱等环境胁迫是限制植物生长和分布的主要因素之一。植物在应答环境胁迫时, 甜菜碱是无毒害快速增加的渗透调节物质。同时在细菌、真细菌和动植物中, 甜菜碱是许多组织生理缺水时的重要渗透调节物质[1, 2, 3]。在植物体内, 甜菜碱以胆碱为底物, 经两步催化合成, 即乙酰胆碱→ 甘氨酸甜菜碱醛→ 甘氨酸甜菜碱, 其中甜菜碱醛在甜菜碱醛脱氢酶(betaine aldehyde dehydrogenase, BADHase) 的作用下氧化生成甜菜碱。甘氨酸甜菜碱(GB)作为季胺碱, 是植物的一种重要的渗透保护剂, 不仅在植物受到环境胁迫时积累于细胞内以降低渗透势, 还能对有氧呼吸、能量代谢过程和光呼吸生理功能具有良好保护和促进作用[4, 5, 6]。
海马齿(Sesuvium portulacastrumL.)是一种真盐生红树林植物, 该属共有8个种, 中国只有1个种, 多生长于热带和亚热带海岸。海马齿具有很强的生命力, 逆境生活能力非常强; 具有耐盐, 耐旱和抗重金属等作用, 且在淡水和海水浇灌下均能完成其生活史[7, 8]。本文系统研究了甜菜碱脱氢酶基因的表达特性、酶的生物学特性, 以期了解SpBADH基因的功能以及在海马齿抗盐过程中作用机理, 为培育理想的耐盐植物新品系提供参考。
1 材料与方法1.1 试验材料海马齿采自海南省海口市白沙门滨海, pMD18-T Vector (货号为D101A)购自宝生物公司; 表达载体pET-28a(+)、大肠杆菌DH5α 菌株及大肠杆菌BL21(DE3) plys由本实验室保存。
1.2 工具酶及主要试剂DNA Marker和蛋白质Marker、小量质粒提取试剂盒、T4 DNA连接酶、BamH I和Sal I限制性内切酶购自上海生工生物工程有限公司; DNA回收试剂盒购自申能博彩有限公司; IPTG、丙烯酰胺(Acr)及甲叉双丙烯酰胺(Bis)和Ni-NTA-Sefinose Colum蛋白纯化试剂盒购自BioBasic公司。四甲基乙二胺(TEMED)购自Sigma公司; 其余试剂均为国产分析纯。
1.3 重组载体pET-SpBADH的构建与鉴定根据海马齿甜菜碱醛脱氢酶全长基因SpBADH的cDNA序列(GenBank登录号为JN192464), 设计扩增SpBADH开放阅读框引物。上游引物为5° -ATC GGATCCATGGCGTTCCCTATACCT-3° , 引入BamH I酶切位点(下画线部分), 下游引物为5° -ATCGTCGAC TCAAGGAGACTTGTAC-3° , 引入Sal I酶切位点(下画线部分)。引物由上海生工生物工程有限公司合成。以海马齿cDNA为模板进行PCR扩增, PCR体系(50 μ L)含: 5× Prime STAR缓冲液(Mg2+plus) 10 μ L、2.5 mmol L-1 dNTPs 3 μ L、引物各2 μ L、模板2 μ L、2.5 U mL-1 PrimeSTAR HS DNA聚合酶1 μ L、ddH2O 30 μ L。PCR程序为94℃预变性4 min; 94℃变性45 s, 60℃退火45 s, 72℃延伸l.5 min, 35个循环: 72℃延伸10 min。PCR产物经1%的琼脂糖凝胶电泳分析, 其大小与预期一致。将目的片段切胶回收, 加尾连接pMD18-T Vector, 送上海生工生物工程有限公司测序, 阳性克隆提取质粒, 将pMD18- SpBADH和pET-28a(+)质粒分别用BamH I和SalI双酶切, 目的片段切胶回收, 回收产物以摩尔比3︰1混合, 然后加入T4 DNA连接酶, 16℃下连接过夜, 转化大肠杆菌DH5α 感受态细胞, 在含有Amp抗性的平板上培养, 挑取阳性克隆进行PCR及BamH I和Sal I双酶切初步鉴定, 鉴定正确后送上海生工生物工程有限公司测序。
1.4 重组SpBADH基因工程菌的构建及目的基因的表达 将已经鉴定的重组表达载体pET-SpBADH转化大肠杆菌BL21(DE3)plys, 筛选阳性克隆。将阳性克隆活化过夜后, 以1∶ 100浓度加到液体LB培养基中37℃振荡培养, 使OD600为0.6左右, 加入IPTG诱导培养, 取菌液进行SDS-PAGE分析。
1.5 重组SpBADH基因工程菌诱导条件的优化 1.5.1 菌株最佳诱导起始生长量的确定 工程菌分别培养至OD值为0.1、0.2、0.5、0.6、0.8、1.0和1.2时向培养液中添加最佳浓度的IPTG, 37℃下诱导6 h, 取菌液作SDS-PAGE分析。
1.5.2 最适IPTG浓度的确定 在重组菌株生长至OD为0.6时, 分别向6个摇瓶中加入不同量的IPTG, 使其终浓度分别为0.1、0.2、0.5、0.6、0.8和1.0 mmol L-1, 37℃下诱导6 h, 取菌液作SDS-PAGE分析。
1.5.3 最佳诱导温度的确定 向处于最佳诱导起始生长量的摇瓶中添加最适浓度的IPTG, 分别在28℃、30℃、33℃和37℃下诱导6 h, 取菌液作SDS-PAGE分析。
1.5.4 最佳诱导时间的确定 培养菌液至OD=0.6时, 向菌液中添加最适浓度的IPTG, 于诱导1、2、3、4、5、6、7和8 h后取菌液作SDS-PAGE分析。
1.6 重组SpBADH的纯化将大规模诱导的菌液于4℃, 6000 × g离心10 min收集菌体, 用细胞破碎缓冲液(50 mmol L-1 NaH2PO4、300 mmol L-1 NaCl、10 mmol L-1咪唑, pH 8.0, 不含EDTA)洗2次, 加入破碎缓冲液重悬菌体后置冰上预冷, 以超声波破碎菌体。待菌体完全破碎后以17 000 × g离心30 min, 上清液中的蛋白溶液含有可溶表达的重组SpBADH。再按照Ni-NTA-Sefinose Colum蛋白纯化试剂盒说明书纯化重组SpBADH, 将纯化的重组SpBADH进行SDS-PAGE, 并测定重组SpBADH蛋白质的浓度, 余下的缓冲液于4℃保存。
1.7 甜菜碱醛脱氢酶酶活的测定和酶活力的计算参照罗笛等[9]所述略有修改, l mL反应体系中, 取0.9 mL反应缓冲液(50 mmol L-1HEPES, 0.5 mmol L-1 NAD+, 5 mmol L-1 DTT, pH 9.5), 加入0.05 mL纯化蛋白溶液于紫外分光光度计比色杯中。反应从加入0.05 mL甜菜碱醛(betaine aldehyde, BA) (0.5 mmol L-1)起, 以未加入甘氨酸甜菜碱醛的反应液作对照, 25℃下反应15 min, 测定OD340。试验重复3次, 取平均值。
参照崔喜艳等[10]方法, 酶活力单位定义为25℃下每分钟转化生成1 nmol NADH所需甜菜碱醛脱氢酶的量为一个活性单位(U), 比活力为每毫克蛋白的活力数。比活力(nmol min-1 mg-1) = Δ OD× 10-3/ (ε max× C)× 10-9。式中Δ OD为吸光值每分钟增加的平均值; ε max为NADH OD340摩尔消光系数(6220); C为测定时加入的蛋白酶量, 单位为mg; 10-3为1 mL反应体系转化为升的系数; 10-9为摩尔转化为纳摩尔的系数。可溶性蛋白含量以BSA为标准品, 按照Bradford法定量。
1.8 甜菜碱醛脱氢酶的酶学性质研究1.8.1 最适pH值及pH值的稳定性 配制pH 4.0~12.0的反应缓冲液, 37℃下将酶液分别与不同pH值的缓冲液反应, 测SpBADH在不同缓冲液中反应时的酶活性, 确定酶反应的最适pH值。
将反应体系中的一定酶液加入不同pH值的缓冲液中(不含有底物和辅酶), 在37℃温浴1 h, 测剩余的酶活力, 观察SpBADH在不同pH值下的稳定性。
1.8.2 最适温度和热稳定性 采用pH值为7.2的反应体系, 分别在16~80℃下反应10 min, 测定其酶活力, 观察不同温度下对酶促反应的影响。将一定量的酶液置于以上不同温度下1 h, 测定其剩余酶活力, 观察SpBADH在不同温度下的稳定性。
1.8.3 不同醇类对酶活力的影响和热稳定性 选择酶的最适温度和pH值条件下, 在反应体系中分别加入终浓度为2%的乙二醇、丙二醇、丙三醇、甘露醇、山梨醇和聚乙二醇, 测定SpBADH的活性, 以不加醇类的初始酶液的酶活力为对照, 测定不同醇类对酶促反应的影响。
将酶液分别置于以上6种醇类中于42℃保温1 h, 测定保温后的剩余酶活力。观察不同酶类对SpBADH稳定性的影响。以初始酶液的活力为100%, 以不加保护剂的酶液经同样热处理为对照。
2 结果与分析2.1SpBADH的克隆与重组表达载体的构建
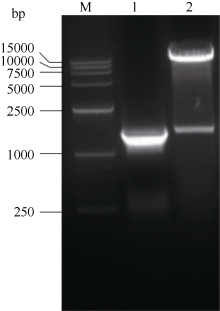
根据NCBI登录的海马齿甜菜碱醛脱氢酶基因(SpBADH)序列克隆出全长cDNA, 将克隆到的序列测序, 测序结果与NCBI登录序列相似性100%。将连有SpBADH基因片段的pMD18-SpBADH的质粒和pET-28a(+)分别用BamH I和SalI双酶切, 将2片段割胶回收并连接。将连接产物转化DH5α , 得到重组pET-SpBADH质粒, 经PCR和双酶切鉴定表达载体正确(图1)。并将鉴定正确的克隆测序, 测序结果与NCBI比对结果一致, 说明pET-SpBADH表达载体构建成功。
2.2 重组SpBADH大肠杆菌表达工程菌的诱导表达分析 对重组大肠杆菌表达工程菌BL21(DE3)/pET- SpBADH进行IPTG诱导表达。取诱导后的工程菌进行菌体蛋白制样, 以相同的量上样进行SDS-PAGE凝胶电泳分析, 以未诱导重组BL21(DE3)/pET-SpBADH工程菌为对照, SDS-PAGE结束后以考马斯亮蓝染色。
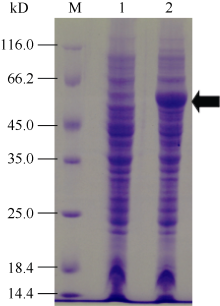
图2表明, 重组大肠杆菌表达工程菌BL21(DE3) /pET-SpBADH经诱导后在55 kD处比对照多一条蛋白条带, 这与试验预测大小一致。这说明重组大肠杆菌表达工程菌BL21(DE3)/pET-SpBADH可以按照试验设计正确表达目的蛋白。
2.3 重组SpBADH大肠杆菌表达工程菌的诱导条件的优化2.3.1 最佳IPTG浓度 取工程菌8个浓度梯度诱导的菌体制样, 并经SDS-PAGE及考马斯亮蓝染色和脱色, 表明重组大肠杆菌表达工程菌BL21(DE3)/pET-SpBADH的表达量与IPTG浓度关系相关性不紧密, 工程菌在不同IPTG浓度的表达量差异不显著, 考虑到IPTG对菌体有毒害作用, 所以选择最佳IPTG浓度为0.2 mmol L-1。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 pET-SpBADH的PCR和酶切鉴定M: DL l5000 marker; 1: pET-SpBADH的PCR鉴定; 2: pET-SpBADH的酶切鉴定。Fig. 1 Identifications of pET-SpBADH by PCR and double digestionM: DL15000 marker; l: PCR analysis of pET-SpBADH; 2: double digestion of pET-SpBADH. |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 重组SpBADH在大肠杆菌工程菌中的诱导表达M: protein marker; 1: 未诱导的工程菌BL21(DE3)/pET-SpBADH的菌体蛋白; 2: 诱导后的工程菌BL21(DE3)/pET-SpBADH的菌体蛋白。Fig. 2 Induction expression of the recombination SpBADH proteins in E. coliM: protein marker; 1: total cell proteins of BL21(DE3)/ pET-SpBADH without induction; 2: total cell proteins of BL21(DE3)/pET-SpBADH with induction. |
2.3.2 诱导时间的优化 取7个诱导时间1、2、3、4、5、6和7 h的工程菌全蛋白制样, 取相同量的样品经SDS-PAGE及考马斯亮蓝染色和脱色, 表明重组大肠杆菌表达工程菌BL21(DE3)/pET- SpBADH诱导4 h时表达量最高, 随着时间的增加工程菌的蛋白表达量不变。所以对重组大肠杆菌表达工程菌BL21(DE3)/pET-SpBADH最佳诱导时间为4 h。
2.3.3 最佳起始浓度优化 取9个起始OD6000.1、0.2、0.4、0.5、0.6、0.8、1.0、1.2和1.5诱导的工程菌全蛋白制样, 取相同量的样品SDS-PAGE凝胶电泳, 通过考马斯亮蓝染色和脱色, 表明重组大肠杆菌表达工程菌BL21(DE3)/pET-SpBADH诱导起始OD600为0.6时表达量最高, 随着OD600的增加工程菌的表达量差异也不明显。所以对重组大肠杆菌表达工程菌BL21(DE3)/pET-Sp BADH最佳诱导起始OD600为0.6。
2.3.4 最佳诱导温度 对重组SpBADH大肠杆菌表达工程菌进行诱导温度优化表明, 重组大肠杆菌表达工程菌BL21(DE3)/pET-SpBADH在其他温度时均也可诱导表达, 但在37℃下诱导蛋白表达量最高。所以重组大肠杆菌表达工程菌BL21(DE3)/pET-SpBADH的诱导表达的最佳温度为37℃。
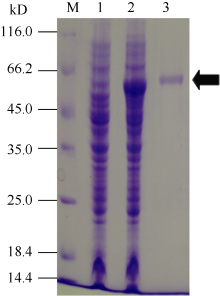
2.4 重组SpBADH的分离纯化分别取咪唑浓度洗脱液制样, 经SDS-PAGE和考马斯亮蓝染色, 最后根据OD值测定重组SpBADH相对含量。图3表明, 通过Ni-NTA-Sefinose Column分离纯化重组SpBADH的含量为301 μ g mL-1。
2.5 重组SpBADH的酶学特性2.5.1 最适pH值和pH值稳定性 将重组纯化的SpBADH加入pH为4.0~10.0的反应体系中, 测定不同pH值下的酶活力表明, 重组SpBADH在pH为7.2时酶活力最大, 达到84.6 U mg-1。在pH为7.0左右时, SpBADH的酶活力较快上升并基本维持一个上升趋势, 在超过最适pH值后其变化趋势较为缓慢, 相对酶活力维持在50%左右。表明该酶在pH值相对偏碱性的环境较稳定。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 重组SpBADH的分离纯化M: protein marker; 1: BL21(DE3)/pET-SpBADH未诱导对照菌体总蛋白; 2: 诱导后工程菌菌体蛋白; 3: 纯化的蛋白SpBADH。Fig. 3 Purification of the recombinant SpBADH proteinM: protein marker; 1: total cell proteins of BL21(DE3)/pET-SpBADH without induction; 2: total cell proteins with induction; 3: purified recombinant protein SpBADH. |
2.5.2 最适温度及热稳定性 SpBADH在37℃范围内的酶活力最高, 最大比酶活力100 U mg-1。由此可知, 37℃范围是该酶反应的最适温度。该酶对温度变化敏感, 尤其对高温表现最为显著, 超过最适温度以后的相对酶活力迅速下降到一半, 55℃以后的相对酶活力不足最高酶活力的20%。说明SpBADH对高温很敏感, 在高温条件下对酶活力影响最大。
2.5.3 不同醇类对酶活力的影响 在37℃下测定SpBADH的活性, 以不加入醇类的初始酶活力为100%, 观察各种醇类对酶活力的影响。从表1可以看出, 各种醇类对SpBADH的比酶活力影响不大。说明醇类在SpBADH的催化过程中起到缓冲液的作用。
2.5.4 不同醇类对酶热稳定性的影响 由以上试验可知SpBADH表现出热不稳定性, 醇类小分子有机物对酶的稳定性有一定的作用。从表2可以看出醇类小分子有机物对SpBADH具有热稳定性, 特别在反应体系中加入丙三醇后SpBADH的酶活力最高。
3 讨论盐胁迫是影响植物分布和农作物产量及品质的重要因素之一, 植物通常以许多保护机制来维护自身正常的生理代谢。植物在受到胁迫时, 迅速合成并积累大量的渗透调节物质来维持植物细胞内正常生理功能, 免受胁迫伤害[11, 12, 13]。甜菜碱是最理想的有机小分子渗透调节物质。本研究将海马齿甜菜碱醛脱氢酶基因克隆到表达载体pET-28a中, 转化大肠杆菌BL21(DE3) plys, 得到能够表达SpBADH基因的重组菌株, 经IPTG诱导, 重组SpBADH的蛋白的大肠杆菌重组工程菌能够高效表达目的蛋白。它们的最优表达条件为菌体培养温度37℃, 蛋白质诱导表达菌体起始OD600为0.6, 诱导剂IPTG最佳浓度为0.2 mmol L-1, 诱导时间为6 h, 重组菌株SpBADH表达量达301 µ g mL-1。通过Ni-NTA-Sefinose Column将重组SpBADH的可溶性蛋白分离纯化, 以酶学特性分析表明SpBADH酶活性的最适pH值、最适温度及热稳定性、醇类对酶活力和热稳定的影响。BADH蛋白的辅酶是NAD+, 可以催化甜菜碱醛、4-三甲基氨基丁醛和4-氨基正丁醛[14]等醛类物质生成甜菜碱。本研究用甘氨酸甜菜碱醛作为底物与大肠杆菌中表达的SpBADH基因的分离纯化物反应表明, SpBADH全长基因表达的蛋白质其酶活性可以达到87 U mg-1, 说明我们从海马齿植物中分离的SpBADH基因具有催化甘氨酸甜菜碱醛的功能, 所以该基因为甜菜碱醛脱氢酶基因。SpBADH酶活力的最适pH值为7.2; 最适反应温度为37℃; SpBADH对高温十分敏感, 温度超过55℃时酶活性只有20%。李秋莉等[15]在研究辽宁碱蓬SlBADH纯化蛋白性质时发现, SlBADH纯化蛋白在超过40℃后, 其活性迅速下降。本研究建立了重组SpBADH蛋白在大肠杆菌表达系统中的完全可溶性表达及纯化体系, 获得了纯度较高的重组SpBADH蛋白, 并分析了甜菜碱醛脱氢酶的基本生物特性。本研究为重组SpBADH蛋白在其他微生物表达系统中的表达提供了参考依据, 为研究其在抗逆过程中的作用提供了技术支撑。海马齿作为海滨盐生植物具有很强的抗盐能力, 因此研究海马齿中的甜菜碱合成途径, 及相关基因的分子特性等, 对揭示甜菜碱抗盐机理具有重要意义。
表1
Table 1
表1(Table 1)
| 表1 不同醇类对酶活力的影响 Table 1 Effect of alcohols on the activity of SpBADH |
表2
Table 2
表2(Table 2)
| 表2 不同醇类对酶热稳定性的影响 Table 2 Effect of alcohols on the thermal stability of SpBADH |
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] |
