
*通讯作者(Corresponding author): 万平, E-mail: pingwan3@163.com, Tel: 010-80799134 第一作者联系方式: E-mail: 574088090@qq.com
收稿日期:2016-01-27 接受日期:2016-05-04网络出版日期:2016-05-09基金:
摘要
关键词:miRNA; 栽培小豆( Vigna angularis); 野生小豆( Vigna angularis var. nipponensis)
Global Identification and Comparison of MicroRNA in Wild and Cultivated Adzuki Bean
MA Yan-Ming

Fund:
Abstract
Keyword:miRNA; Wild adzuki bean ( Vigna angularis); Cultivated adzuki bean ( Vigna angularis var. nipponensis)
Show Figures
Show Figures










MicroRNA (miRNA)是一类长度为20~25 nt的内源单链非编码调控小分子RNA。1993年, miRNA首次在秀丽线虫(Caenorhadits elegans)中被克隆, 发现其在胚胎后期发育中起到重要的阶段性调控作用[1]。随后研究表明, 几乎所有真核生物中都存在miRNA, 可以通过与靶mRNA互补配对而在转录水平上对基因的表达进行负调控, 导致mRNA的翻译抑制或降解[2, 3]。因此, miRNA在真核生物的基因转录和转录后调控中发挥重要作用。迄今研究结果表明, miRNAs可以影响生物体的各个方面, 其功能可以分为以下几个方面: (1)调节生物的生长发育, 如细胞生长、器官的形成与分化、新陈代谢、育性转换以及激素的信号传导等; (2)参与胁迫反应, 包括生物胁迫和非生物胁迫, 如养分胁迫、低温胁迫、干旱胁迫、病虫害害胁迫和辐射胁迫等; (3)调节小RNAs的合成, miRNA不仅可以调节其他小RNA (如siRNAs)的合成, 同时也反馈调节自身合成; (4)沉默基因组中的重复序列, 如转座子和逆转座子等[4, 5]。
鉴于miRNA在生物体中的重要作用, 其鉴定和功能分析得到了越来越多的重视。研究结果表明, 一方面, 不同物种中存在一定量的保守miRNA, 目前在不同的动物之间发现一些保守的miRNA, 在不同的植物之间也发现一些保守的miRNA, 然而在动物和植物之间保守的miRNA非常少; 另一方面, 在保守miRNA存在的同时, 也存在大量的物种特异性miRNA[6, 7]。例如, 在拟南芥的约100个miRNA基因家族中, 只有21个是和水稻共有的[8]。甚至即使是亲缘关系非常近的拟南芥的2个种(A. thaliana和A. lyrata)之间, 也存在较多的物种特异miRNA[9]。一般而言, 大多数古老的miRNA在物种间是高度保守的, 这暗示了其功能的重要性; 而年轻的miRNA通常是弱表达, 加工不严密, 分化程度较高, 趋向于缺少靶标, 但是它们可能对物种特有新功能的产生具有重要意义[10, 11]。这些结果一方面暗示miRNA的进化速率是非常快的, 另一方面也提示不同物种特异miRNA的鉴定对于该物种功能基因组的研究具有重要意义[12]。
小豆(Vigna angularis)起源于中国, 早在1.2万年前已被驯化, 俗名红小豆、赤豆等, 是中国传统小杂粮[13]。不同于大豆等其他豆科作物, 小豆脂肪含量非常低, 平均仅为0.59%, 而总淀粉含量较高, 平均为57.06%。另外, 其所含人体必需的8种氨基酸是禾谷类作物的2’ 3倍, 并富含维生素B、铁、钙等矿物质和萜类、异黄酮、皂苷等生物活性物质[14, 15]。现代医学研究发现, 小豆具有降血糖、降血脂、减肥、抗癌等作用[16, 17]。因此, 小豆是重要的高蛋白、低脂肪、补血的经济粮食作物。迄今, 小豆的功能基因组研究非常薄弱, 主要原因之一是长期以来缺乏完整的参考基因组。最近, 对京农6号的全基因组测序, 完成了小豆高质量基因组框架图的组装, 结果显示小豆有3.4万多个基因, 进一步研究表明小豆和大豆在淀粉和油含量上的差异主要来源于淀粉和油脂合成代谢相关基因的转录水平差异, 而非基因拷贝数的差异。通过对49份野生小豆、半野生小豆、栽培小豆的重测序, 证实半野生小豆与栽培小豆的关系近于野生小豆, 说明半野生小豆可能是小豆驯化过程中的初始农家品种[18]。
在此基础上, 本文对参考基因组的测序品种京农6号和另外一个野生小豆CWA108进行了小RNA测序, 并对栽培小豆和野生小豆之间的miRNA进行了系统鉴定和比较, 除了共有的miRNA外, 还找到一些特有miRNA, 并分析了它们之间靶基因的异同。这些结果为小豆功能基因组的研究奠定了重要基础。
1 材料与方法1.1 试验材料北京农学院育成的京农6号(JN6)和来自中国的野生小豆CWA108, 2013年夏于北京农学院试验农场种植。在生长季取茎、叶、花、幼荚、幼嫩籽粒等组织, 每份材料至少取自5棵植株, 混合后迅速放入液氮中冷冻, 贮存于-80度冰箱备用。
1.2 RNA的提取将液氮冷冻的样品置研钵中快速磨碎, 粉末转移至预冷的2 mL离心管; 加入1 mL TRIzol试剂, 振荡混匀; 4℃条件下12 000 × g离心10 min; 取上清液移入新离心管, 加入200 μ L氯仿, 轻摇混匀; 4℃条件下12 000 × g离心10 min; 取上清液移入新离心管, 加入250 μ L异丙醇和1.2 mol L-2氯化钠250 μ L, 室温放置3 min; 4℃条件下12 000 × g离心10 min, 去除上清液; 沉淀经75%乙醇洗涤两次, 4℃条件下7500 × g离心2 min, 去除上清液; 将沉淀于室温干燥5~10 min, 加入适量(50 μ L左右) DEPC水, 置于冰上充分溶解。向提取的RNA加入DNase I (New England BioLabs), 于37℃消化30 min, 除去残留的DNA。
1.3 miRNA文库构建及测序委托深圳华大基因有限公司进行小RNA文库构建及测序。该公司用Agilent2100进行样品检测, 在RNA达到其建库要求后构建文库。构建好的文库用Illumina HiSeq2000测序仪进行测序, 得到49 nt的读段序列。
1.4 miRNA鉴定对测序得到的原始数据, 经过一系列的数据处理, 去除测序质量较低、有5° 接头污染、没有3° 接头序列、没有插入片段和包含polyA的reads, 去除小于18 nt的小片段。之后, 通过与各类已知的数据库进行比对、寻找样品与数据库之间在基因组位置上的覆盖等方法, 对各类小RNA注释分类, 同时选取没有被注释上的小RNA, 使用华大自主开发的软件Mireap预测新的miRNA。
1.5 miRNA靶基因的预测首先分别用psRobot [19]和TargetFinder [6, 20]预测miRNA靶基因, 然后取并集作为预测结果[21, 22]。
1.6 表达差异分析将栽培和野生小豆中miRNA的表达量均一化到同一个量级(TPM[23])。均一化的表达量 = miRNA表达量/样品总表达量× 均一量级。使用标准化后的结果统计fold_change和P-value[24]及绘图。Fold_ change公式为: Fold_change = log2 (野生/栽培)
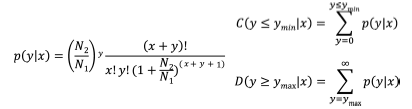
1.7 miRNA靶基因KEGG代谢通路分析在生物体内, 不同基因相互协调行使其生物学功能, 基于pathway的分析有助于更进一步了解基因的生物学功能。KEGG是有关通路的主要公共数据库, 通路显著性富集分析以KEGG中的通路为单位, 应用超几何检验, 找出与整个参考基因相比较在候选靶基因中显著性富集的通路, 参照已报道的研究方法[25]。FDR≤ 0.05的通路被认为在候选靶基因中显著富集。通过通路显著性富集分析能确定候选靶基因参与的最主要生化代谢途径和信号转导途径。
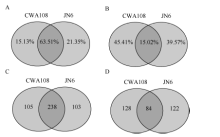
2 结果与分析2.1 小RNA测序数据的概括分析为了系统鉴定小豆的miRNA, 并对野生和栽培种中miRNA进行比较, 选取了小豆栽培品种京农6号(JN6)和野生小豆CWA108作为研究材料, 在生长期采取茎、叶、花、幼荚、籽粒等不同组织样品, 提取RNA, 等量RNA混样, 测序小RNA (sRNA)。测序结果表明, 栽培品种京农6号获得22.4百万(million, M) sRNA读段, 去掉冗余后, 单一特异sRNA读段为7.0 M; 在野生小豆CWA108获得24.3 M sRNA读段, 去掉冗余后, 单一特异sRNA读段为6.3 M (表1)。在总的sRNA读段中, 野生和栽培小豆共有的占了两者之和的63.51%, JN6和CWA108特异sRNA在中分别占据了15.13%和21.35%。而在单一特异的读段总和中, 野生和栽培小豆共有的占了两者之和的15.02%, JN6和CWA108特异sRNA在中分别占据了45.41%和39.57% (图1)。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 野生和栽培小豆小RNA测序数据 A: 总sRNA读段分析; B: 单一特异sRNA读段分析; C: 栽培和野生小豆中已知miRNA比较; D: 栽培和野生小豆中未知miRNA比较。Fig. 1 miRNA data of wild and cultivated adzuki bean A: reads analysis of total miRNA; B: reads analysis of single specific miRNA; C: comparison of conserved miRNA between cultivated and wild adzuki beans; D: comparison of new miRNA between cultivated and wild adzuki beans. |
进而sRNA与基因组序列进行比对, 发现这些sRNA分别比对到了基因组上外显子的正义链、外显子的反义链、内含子正义链、内含子反义链、核糖体RNA、小核RNA、小核仁RNA、转运RNA、重复序列和一些未知的RNA区域(表1)。可以看出, 虽然在特异的sRNA中, JN6和CWA108的miRNA分别为0.93%和0.90%, 非常接近; 然而, 在总的sRNA中, JN6和CWA108的miRNA分别为17.42%和9.57%(表1), 暗示野生种和栽培品种小豆的miRNA在表达量上存在一定的差异。
表1
Table 1
表1(Table 1)
| 表1 栽培小豆和野生小豆小RNA测序结果统计 Table 1 Overview of small RNA-seq data from cultivated and wild adzuki bean |
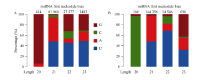
2.2 miRNA基因鉴定利用华大基因自主开发软件Mireap对miRNA进行了预测, 在栽培小豆JN6中发现547个miRNA, 其中341个为已知miRNA, 206个为新的miRNA; 在野生小豆CWA108中发现555个miRNA, 其中343个为已知miRNA, 212个为新的miRNA。在已知的miRNA中, 有238个是两者共有的, 有103个为JN6特有, 105个为CWA108特有(图1-C)。在新的miRNA中, 有84个是两者共有的, 有122个为JN6特有, 128个为CWA108特有(图1-D)。进一步对新鉴定miRNA的第一位碱基序列频率进行分析, 发现21 nt和23 nt的miRNA在野生和栽培小豆中没有明显区别。而20nt的miRNA两者有明显区别, 在JN6中以G为主(图1-A), 而在CWA108中以C为主(图1-B); 22nt的miRNA中, JN6以G的比例明显高于CWA108, 而C的比例明显低于CWA108 (图2)。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 栽培和野生小豆新miRNA首位序列比较 A: 栽培小豆新miRNA首位序列频率分布; B: 野生小豆新miRNA首位序列频率分布。Fig. 2 Comparison on first sequence of new miRNAs between cultivated and wild adzuki beans A: frequency distribution of first sequence of new miRNAs in cultivated adzuki bean; B: frequency distribution of first sequence of new miRNAs in wild adzuki bean. |
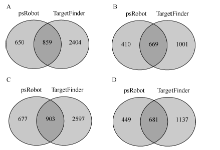
2.3 野生和栽培小豆中miRNA靶基因预测miRNA的作用一般是通过调控其靶基因实现的, 为了深入地了解小豆中miRNA的功能, 分别对JN6和CWA108的miRNA的靶基因进行了预测。在JN6的已知miRNA中, 预测到294个miRNA具有靶基因, 其靶基因数目总和为3913个, 其中paRobot预测到1509个, TargetFinder预测到3263个, 两者共同预测到的靶基因有859个(图3-A); 在未知miRNA中, 预测到188个miRNA具有靶基因, 靶基因数目总和为2080个, 其中paRobot预测到1079个, Target Finder预测到1570个, 两者共同预测到的靶基因有669个(图3-B)。在野生小豆CWA108的miRNA的靶基因预测中, 发现303个已知miRNA具有靶基因, 其靶基因数目总和为4177个, 其中paRobot预测到1580个, TargetFinder预测到3500个, 两者共同预测到的靶基因有903个(图3-C); 在未知miRNA中, 预测到198个miRNA具有靶基因, 其靶基因数目总和为2267个, 其中paRobot预测到1130个, TargetFinder预测到1818个, 两者共同预测到的靶基因有681个(图3-D)。野生小豆miRNA靶基因数高于栽培小豆。
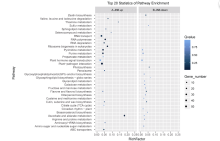
接下来, 比较了JN6和CWA108中特有miRNA (图1-C和1-D) 的靶基因的功能。发现JN6特有的103个已知miRNA的靶基因多富集于RNA转运(RNA-transport)通路(图4-A); 而CWA108特有的105个已知miRNA的靶基因多富集于与抗病抗逆相关的植物-病原菌互作(Plant-pathogen interaction)通路(图4-B)。对于新的miRNA, JN6特有的122个已知miRNA的靶基因多富集于代谢途径(Metabolic Pathway)等通路(图4-C), 而CWA108特有的128个已知miRNA的靶基因同样多富集于抗病相关的Plant-pathogen interaction等通路(图4-D)。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 栽培和野生小豆小RNA靶基因预测 A: JN6已知miRNA靶基因预测; B: JN6新miRNA靶基因预测; C: CW108已知miRNA靶基因预测; D: CW108新miRNA靶基因预测。Fig. 3 Prediction of miRNA targets in cultivated and wild adzuki beans A: prediction of conserved miRNA targets in cultivar Jingnong 6; B: prediction of new miRNA targets in cultivar Jingnong 6; C: prediction of conserved miRNA targets in wild adzuki bean CWA108; D: prediction of new miRNA targets in wild adzuki bean CWA108. |
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 栽培和野生小豆特有miRNA靶基因的功能富集分析 A: 栽培小豆JN6已知miRNA靶基因KEGG功能富集分析; B: 野生小豆CWA108已知miRNA靶基因KEGG功能富集分析; C: 栽培小豆JN6新的miRNA靶基因KEGG功能富集分析; D: 野生小豆CWA108新的miRNA靶基因KEGG功能富集分析。Fig. 4 KEGG enrichment analysis of specific miRNAs in cultivated and wild adzuki beans A: KEGG enrichment analysis of conserved miRNA targets in cultivar Jingnong 6; B: KEGG enrichment analysis of conserved miRNA targets in wild adzuki bean CWA108; C: KEGG enrichment analysis of new miRNA targets in cultivar Jingnong 6; D: KEGG enrichment analysis of new miRNA targets in wild adzuki bean CWA108. |
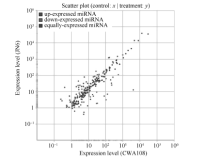
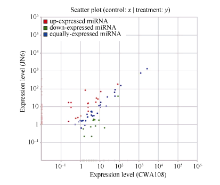
2.4 野生和栽培小豆中差异表达的已知miRNA分析为了进一步揭示野生和栽培小豆中miRNA可能的功能差异, 对它们共有miRNA在表达上的差异进行了分析, 找出了差异表达的miRNA。JN6和CWA108相比, 在已知的miRNA中, 有69个显著上调, 25个显著下调(图5)。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 栽培和野生小豆已知miRNAs差异表达分析Fig. 5 Differential expression analysis of conserved miRNAs in cultivated and wild adzuki beans |
进一步对这些表达差异miRNA的靶基因分析发现69个显著上调的已知miRNA的靶基因多富集于植物-病原菌互作(plant-pathogen interaction)和嘧啶代谢(pyrimidine metabolism)等通路(图6-A), 而 25个显著下调的已知miRNA的靶基因多富集于植物激素信号转导(plant hormone signal transduction)等通路(图6-B)。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 栽培小豆已知miRNAs靶基因KEGG功能富集分析 A: 栽培小豆上调已知miRNAs靶基因KEGG功能富集分析; B: 栽培小豆下调已知miRNA靶基因KEGG功能富集分析。Fig. 6 KEGG enrichment analysis of conserved miRNAs analysis of conserved miRNAs in cultivated and wild adzuki beans A: KEGG enrichment analysis of conserved miRNAs up-regulated targets in cultivated adzuki beans; B: KEGG enrichment analysis of conserved miRNAs down-regulated targets in cultivated adzuki beans. |
2.5 野生和栽培小豆中差异表达的新miRNA分析对野生和栽培小豆中共有的新miRNA在表达上的差异分析发现JN6和CWA108相比, 在新的miRNA中, 有29个显著上调, 21个显著下调(图7)。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 栽培和野生小豆新miRNAs差异表达分析Fig. 7 Differential expression analysis of new miRNAs in cultivated and wild adzuki beans |
对这些表达差异新miRNA的靶基因分析发现29个显著上调的新miRNA的靶基因多富集于RNA运输(RNA transport)和抗病相关Plant-pathogen inter- action)等通路(图8-A); 而21个显著下调的新miRNA的靶基因也多富集于RNA transport, Plant-pathogen interaction等通路(图8-B)。有意思的是它们不属于相同miRNA调控。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 栽培小豆新miRNAs靶基因KEGG功能富集分析 A: 栽培小豆上调新miRNAs靶基因KEGG功能富集分析; B: 栽培小豆下调新miRNA靶基因KEGG功能富集分析。Fig. 8 KEGG enrichment analysis of new miRNAs in cultivated adzuki beans A: KEGG enrichment analysis of new miRNAs up-regulated targets in cultivated adzuki beans; B: KEGG enrichment analysis of new miRNAs down-regulated targets in cultivated adzuki beans. |
3 讨论miRNA对于基因功能的调控具有重要作用, 其种类和数量的系统鉴定是功能分析的基础。迄今仍未见小豆miRNA的分析报道, 本研究利用小RNA测序技术, 系统鉴定了栽培小豆和野生小豆中miRNA的种类、数量和表达量, 发现两物种存在一定量的保守miRNA, 同时新的特异性miRNA存在很大的比例; 其他物种的研究结果表明各物种除了保守miRNA, 也有自身特异的miRNA[6, 7, 8, 9], 进一步说明miRNA的进化速率是非常快的[12, 26]。
很多物种在驯化过程中, 野生种和栽培种会发生很多基因组的演化, 其中重要的一个现象是从野生种到栽培种会伴随大量抗病基因的丢失和一些其他基因的获得[27, 28]。通过栽培和野生小豆特异miRNA靶基因的比较发现, 野生小豆特有的miRNA的靶基因多富集于与抗病、抗逆相关的通路, 可见野生小豆中保有大量抗病和抗逆基因, 在小豆从野生种到栽培种的演化进程中, 由于人工选择使得许多抗病和抗逆相关基因丢失, 与之相关的miRNA同样也会在驯化中丢失。但人为选择和品种改良也可以导致一些新基因产生, 本研究发现栽培小豆京农6号可能演化出一些新的miRNA, 其更多地参与调控有关RNA-transport通路。不仅如此, 研究还发现即使是野生小豆和栽培小豆共有的miRNA, 也会通过上调和下调基因的表达来完成功能的演化。在野生和栽培小豆共有miRNA差异表达的分析中, 发现了一些上调和下调基因, 有意思的是它们的靶基因功能都富集于Plant-pathogen interaction通路, 说明这些共有miRNA通过上调和下调的演化模式, 实现对抗病基因的不同调控, 增加栽培小豆和野生小豆对环境的适应性。本研究为野生小豆的抗病、抗逆基因发掘、相关等位基因及其功能鉴定和育种应用, 小豆功能基因组学研究, 奠定了重要基础。
4 结论鉴定出了野生小豆343个已知miRNA, 栽培小豆340个已知miRNA, 其中包括238个共有的已知miRNA; 野生小豆和栽培小豆特有的miRNA分别为212个和206个, 共有的特异miRNA有84个。找出了它们之间差异表达的miRNA, 发现2个物种之间miRNA无论在种类和表达量上的分化都与抗病和抗逆通路相关。
致谢: 本文在中国科学院遗传与发育生物学研究所田志喜研究员悉心指导下完成, 在此表示由衷的感谢。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] |
