
*通讯作者(Corresponding author): 郭旺珍, E-mail: moelab@njau.edu.cn, Tel: 025-84396523 收稿日期:2016-02-29 接受日期:2016-07-11网络出版日期:2016-08-11基金:
摘要
关键词:棉花; ACBP基因家族; 结构; 表达; 干旱胁迫; 盐胁迫
Genome-wide Identification of Acyl-CoA-Binding Protein (ACBP) Gene Family and Their Functional Analysis in Abiotic Stress Tolerance in Cotton
QIN Peng-Fei, SHANG Xiao-Guang, SONG Jian, GUO Wang-Zhen

Abstract
Keyword:Cotton; ACBP gene family; Structure; Expression; Drought stress; Salt stress
Show Figures
Show Figures




















植物在生长发育过程中需要稳定的能量供应与合适的生长环境, 脂类物质在该过程中发挥重要作用。脂类物质不仅为植物生长提供能量, 同时也是植物体内生理和病理反应的重要参与者, 尤其在稳定细胞膜、识别并响应生物非生物胁迫方面具有重要作用[1]。ACBP家族蛋白是一类酰基载体蛋白, 在脂类合成和转运过程中具有重要功能。在原核和真核生物体内均发现ACBP基因家族, 并在哺乳动物体内首次发现该蛋白[2, 3]。目前已在拟南芥、蓖麻、地黄、龙舌兰、陆地棉、水稻等植物中系统鉴定该家族基因[4, 5, 6, 7, 8, 9, 10]。ACBP家族主要具有一个高度保守的ACBP结构域[11, 12], 部分成员还具有锚蛋白重复序列(ankyrin repeats)、kelch motif、coiled-coil、信号肽、跨膜域等结构域[13], 根据以上结构域的有无将所有成员分为4类(I~IV)[14]。
ACBP蛋白通过调节饱和脂肪酸代谢[15]、酰基辅酶A库[16]、脂肪酸β 氧化、囊泡运输[17]等多种细胞内复杂的生理过程[11, 18]参与植物生长发育、生物非生物胁迫响应、膜修复等生理过程[13, 14, 19]。研究表明, 拟南芥中AtACBP1和AtACBP2能够结合卵磷脂和酰基辅酶酯类[20], 同时参与长链饱和脂肪酸的合成。AtACBP1和AtACBP2基因的双突变会导致拟南芥种子胚胎发育前期所需的长链脂肪酸不足, 进而引起拟南芥种子胚胎发育异常甚至死亡[21, 22]。其他ACBP蛋白也会参与种毛和成熟叶片表皮毛发育过程[9]。大量研究表明, ACBP家族蛋白影响植物对重金属氧化、干旱、低温和病菌侵染等生物、非生物胁迫的响应[12]。AtACBP1和AtACBP2能够被Pb(II)、Cd(II)、Cu(II)等离子胁迫诱导表达, 他们通过结合转运亚油酰(18:2)辅酶A、亚麻酰(18:3)辅酶A来促进细胞膜修复[23], 过表达AtACBP2能够增强拟南芥抗旱性[24]。AtACBP3通过水杨酸信号途径参与拟南芥的抗病性, 在AtACBP3过表达的拟南芥植株中, 提升了拟南芥对假单胞菌(Pseudomonas syringae)侵染的抵抗能力。同时, ACBP基因家族参与低温胁迫响应过程, AtACBP1和AtACBP6均参与拟南芥抗冻反应, 但二者功能截然相反。沉默AtACBP6后, 发现拟南芥对冻害更加敏感, 而敲除AtACBP1, 拟南芥抗冻性却得到增强[25, 26]。水稻(Oryza sativa)中研究也表明, OsACBP4、OsACBP5和OsACBP6显著受盐及干旱胁迫诱导[27]。以上研究表明, ACBP基因家族在植物生长发育和响应胁迫方面具有重要作用。
棉花是我国及世界上重要的经济作物。随着气候变化及耕地面积的减少, 为满足水稻、小麦、玉米等粮食作物的种植需求, 更多的棉花种植向较为干旱、滩涂盐碱、贫瘠的土地转移。高盐、干旱胁迫对棉花生长及最终产量具有重要影响[28]。提高棉花抗逆性、培育抗逆新品种是确保棉花产业安全的有效途径。ACBP作为一类重要的调节植物生长发育及响应胁迫的基因家族, 对其在棉花生长及抗逆过程中的功能研究相对较少。本研究结合最近公布的陆地棉基因组序列信息[29]分析棉花ACBP基因家族结构、分布、表达特征, 通过qRT-PCR、VIGS等方法[30]验证GhACBP3和GhACBP6在陆地棉高盐、干旱胁迫中的功能, 为利用ACBP基因提高棉花抗逆性提供了重要的理论基础。
1 材料与方法1.1 试验材料利用耐旱、耐盐陆地棉品种晋棉19 (Gossypium hirsutumcv. Jinmian 19)进行目标基因表达分析和VIGS试验。将其种植于南京农业大学植物生长室, 16 h (28℃)/8 h (25℃)(白天/晚上)生长条件。VIGS侵染菌株为根癌农杆菌GV3101 (Agrobacterium tumefaciensGV3101), 转化载体为烟草脆裂病毒(Tobacco rattle virus)载体TRV1和TRV2。
1.2 陆地棉ACBP家族序列获取利用释放的陆地棉遗传标准系TM-1 (Gossypium hirsutumacc. TM-1)基因组序列信息[29], 参考拟南芥中ACBP基因序列, 从棉花基因组中获取全部含有ACBP结构域的序列, 并根据不同组织器官转录组数据分析各成员表达水平。
1.3 陆地棉ACBP家族生物信息学分析将所获取的棉花ACBP序列和拟南芥ACBP序列进行系统进化分析。使用ClustalX软件比对氨基酸序列[31], 用MEGA5.0软件通过邻接算法构建系统进化树[32], 用BootStrap检验, 并重复1000次。通过NCBI-Blast (http://blast.ncbi.nlm.nih.gov/Blast. cgi)、SignalP (http://www.cbs.dtu.dk/services/SignalP/)网站分析功能结构域、跨膜结构域和信号肽。使用Premier 5.0软件(http://www.premierbiosoft.com/)设计定量引物、用于构建VIGS载体的引物及基因沉默后目标基因表达检测引物(表1)。
表1
Table 1
表1(Table 1)
| 表1 ACBP家族基因表达分析及载体构建所用引物 Table 1 Primers for expression analysis and vector construction ofACBP family genes |
1.4 诱导表达分析及qRT-PCR检测在二叶一心期, 分别对晋棉19进行干旱(PEG- 6000, 20%)、盐(NaCl, 200 mmol L-1)、低温(4℃)、高温(40℃)及过氧化氢(H2O2, 10 mmol L-1)、水杨酸(SA, 10 mmol L-1)、茉莉酸(JA, 10 mmol L-1)、脱落酸(ABA, 100 μ mol L-1)和乙烯(ET, 10 mmol L-1)处理。对每一处理分别在处理后0、0.5、1、2、4、6、8、10、12和24 h取叶片样品, 取3株作为生物学重复, 液氮保存备用。采用RNA提取试剂盒(BioFlux)提取样品RNA, -70℃保存备用。使用反转录试剂盒(HiScriptIIQRT SuperMix for qPCR)反转录合成cDNA第1链, -20℃保存cDNA产物备用。VIGS候选基因沉默的检测样品处理同上。
按照SYBR Green说明书叙述的定量反应体系, 以棉花持家基因His3 (AF024716)为内参基因, 在7500型实时荧光定量PCR仪(ABI, USA)上完成定量PCR扩增, 每个生物学重复单株中设置3次技术重复。扩增程序为95℃预变性10 min; 94℃变性15 s, 60℃退火15 s, 72℃延伸30 s, 40个循环; 72℃延伸10 min, 以熔解曲线绘制程序结束。反应结束后, 采用2-Δ Δ Ct分析数据。
1.5 GhACBP3和GhACBP6基因沉默植株的抗旱或耐盐性鉴定在GhACBP3和GhACBP6中分别选取401 bp和273 bp的基因专化序列作为候选片段, 采用同源重组法构建融合该片段的TRV2基因沉默载体(表1)。经金斯瑞生物科技有限公司(南京)测序证明载体无误。以TRV1和含有候选基因片段的TRV2分别转化农杆菌工程菌, 于28℃培养72 h, 挑单克隆检测, 确认携带载体的阳性农杆菌株。经过培养后, 将TRV1重悬液和TRV2::GhACBP3、TRV2::GhACBP6、TRV2::GhCLA1、TRV2::00分别以1:1 (体积比)比例混匀后, 采用针筒浸润法, 从叶片背部注射菌液, 进行棉花VIGS沉默。随后于培养箱中培养(白天16 h/23℃; 晚上8 h/21℃), 约两周后目的基因沉默, 其中注射TRV2::GhCLA1 (编码1-脱氧-D-木酮糖-5-磷酸还原异构酶, 沉默后引起植株叶片白化表型)的棉花叶片白化, 作为基因沉默的标识表型。
待幼苗生长至3~4片真叶期, 分别用15% PEG、250 mmol L-1 NaCl直接从培养钵顶部浇灌, 观察表型。PEG处理约10 d及NaCl处理约20 d后对表型拍照并取样用于测生理指标。选用子叶节以上部分测量株高; 采用倒3叶离体测定干旱导致的叶片失水率, 每小时测量1次; 取根及地上幼苗部分于105℃杀青5 min, 95℃过夜烘干, 测定其重量, 取三个单株作为生物学重复, 并计算平均值; 使用南京建成生物工程研究所提供的试剂盒测定生理指标(超氧化物歧化酶SOD、过氧化物酶POD和丙二醛MDA)[30], 每个生理指标测定采用3个生物学重复, 每个生物学重复设置3次技术重复。
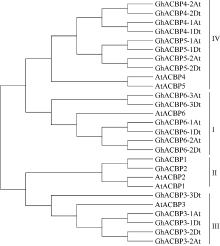
2 结果与分析2.1 陆地棉ACBP家族基因生物信息学分析 基于高度保守的ACBP (PF00887)结构域, 在异源四倍体陆地棉TM-1 (AADD)基因组数据库中筛选出21条序列, 其中A亚组含有10个ACBP成员, 分布于5个A亚组染色体, D亚组含有10个ACBP成员, 分布于4个D亚组染色体, 另外1条尚未确定具体染色体归属(表2)。该家族成员的开放阅读框(ORF)核苷酸序列长度从267 bp到2109 bp, 预测对应编码氨基酸序列长度88 aa到702 aa不等。参照拟南芥分类方法和系统进化分析结果, 将陆地棉21条氨基酸序列分成I~IV类(图1)。6个陆地棉ACBP基因和拟南芥AtACBP6分属一支, 归为第I类; 2个和AtACBP1、AtACBP2分属一支, 属于第II类; 5个和AtACBP3聚为一支, 为第III类; 8个和AtACBP4、AtACBP5聚为一支, 为第IV类。根据该分类结果, 分别将这21条ACBP家族基因命名为GhACBP1~ GhACBP6亚类(图1), 除了GhACBP1和GhACBP2中分别只包含一个亚组成员外, 其余每个基因都具有A亚组和D亚组2个成员。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 拟南芥和陆地棉中ACBP基因家族的系统进化树Fig. 1 Phylogenetic tree ofACBP genes in Arabidopsis thalianaand Gossypium hirsutum |
表2
Table 2
表2(Table 2)
| 表2 棉花ACBP家族基因信息 Table 2 Information on ACBP family genes in cotton |
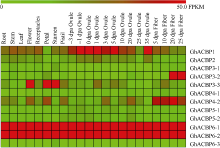
2.2 陆地棉ACBP家族基因表达分析 2.2.1 陆地棉TM-1转录组数据分析 该家族不同亚类基因在不同组织、器官和不同发育时期的胚珠、纤维中其表达量差异较大(图2)。GhACBP6-1和GhACBP6-2在所有成员中表达量最高, 呈组成型表达模式, 其他ACBP基因在不同组织中表达水平存在较大差异。GhACBP1在胚珠发育过程中优势表达; GhACBP3-2在纤维次生壁发育期优势表达, 而GhACBP3-3在花、花瓣及雄蕊中优势表达; GhACBP4-2在纤维发育过程中均优势表达。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 陆地棉ACBP家族基因表达谱Fig. 2 Expressional patterns of ACBP genes in multiple tissues in Gossypium hirsutum |
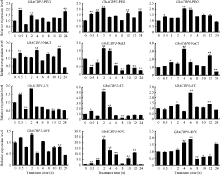
2.2.2 不同逆境胁迫诱导表达分析 未检测到GhACBP2在叶片中表达, GhACBP4和GhACBP5对这4种逆境胁迫的响应不明显, 而GhACBP1、GhACBP3和GhACBP6均受到不同逆境处理的诱导表达(图3)。特别是GhACBP3在干旱、低温和高温胁迫下表达量显著上升, 是处理前表达量的2~20倍, 同时在盐处理2 h和4 h后, 表达水平也显著提高; GhACBP6在干旱、盐、低温和高温胁迫下, 表达水平极显著升高, 推测在棉花受逆境胁迫中发挥重要作用。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 棉花ACBP基因在干旱、盐、低温及高温胁迫下的表达水平 * 和* * 分别表示相对表达水平在0.05和0.01概率水平达到显著差异(t-检验)。数据为3个生物学重复平均值± 标准误, 设置0 h的表达量为1。Fig. 3 Expression level of cotton ACBPgenes under drought, salt, low temperature and high temperature stresses * and * * indicate significance in relative expression at the 0.05 and 0.01 probability levels (t-test). Values are the mean ± standard error of three biological replicates. The expression level at 0 hour is assigned as value of 1. |
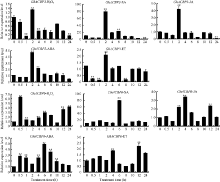
GhACBP3和GhACBP6亚类基因均受过氧化氢(H2O2)、水杨酸(SA)、茉莉酸(JA)、脱落酸(ABA)、乙烯(ET) 5种植物信号物质的显著诱导(图4)。表明GhACBP3和GhACBP6能够响应陆地棉体内多种信号途径, 可能参与多种防御功能。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 GhACBP3和GhACBP6在过氧化氢(H2O2)、水杨酸(SA)、茉莉酸(JA)、脱落酸(ABA)和乙烯(ET)处理后的表达水平 * * 表示与处理前相比, 相对表达水平在0.01概率水平达到显著差异(t-检验)。数据为3个生物学重复平均值± 标准误。Fig. 4 Expression levels of GhACBP3 and GhACBP6 after hydrogen peroxide (H2O2), salicylic acid (SA), jasmonic acid (JA), abscisic acid (ABA), and ethylene (ET) treatment * * indicates significant change in relative expression at the 0.01 probability level (t-test). Values are the mean ± standard error of three biological replicates. |
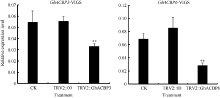
2.3 GhACBP3和GhACBP6抗旱、耐盐功能鉴定2.3.1 GhACBP3和GhACBP6沉默水平检测 不同组合的VIGS载体分别注射子叶完全展开的棉株, 10天后, 作为沉默标识表型的TRV2::GhCAL1组幼苗真叶出现白化表型, 而其他组并无显著白化表型(图5)。对不注射对照组(CK)、注射TRV2::00组以及注射TRV2::GhACBP3、TRV2::GhACBP6组检测GhACBP3与GhACBP6基因的表达水平, 发现TRV2::GhACBP3、TRV2::GhACBP6组的目标基因均被显著沉默(图6)。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 沉默GhACBP3和GhACBP6的植株表型 A: TRV2::GhCLA1 VIGS植株; B: TRV::00 VIGS植株; C: TRV::GhACBP3 VIGS植株; D: TRV::GhACBP6 VIGS植株。Fig. 5 Phenotype of VIGS cotton plants with silencing of GhACBP3 and GhACBP6 A: TRV2::GhCLA1 VIGS plant; B: TRV::00 VIGS plants; C: TRV::GhACBP3 VIGS plants; D: TRV::GhACBP6 VIGS plants. |
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 GhACBP3和GhACBP6在VIGS植株中的基因沉默水平 A: GhACBP3在VIGS植株中的表达量; B: GhACBP6在VIGS植株中的表达量。* * 表示与对照相比, 相对表达水平在0.01概率水平达到显著差异(t-检验)。数据为3个生物学重复平均值± 标准误。Fig. 6 Silencing level of GhACBP3 and GhACBP6 in VIGS cotton plants A: Expression of GhACBP3 in VIGS plants; B: Expression of GhACBP6 in VIGS plants. * * indicates significance in relative expression at the 0.01 probability level (t-test). Values are the mean ± standard error of three biological replicates. |
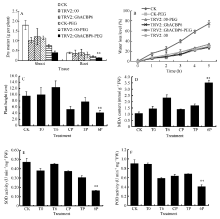
2.3.2 GhACBP3和GhACBP6抗旱鉴定 胁迫处理10 d后, PEG处理组植株出现叶片失水、萎蔫等典型的植株受干旱胁迫表型, 同期浇水对照组并无以上显著表型(图7和图8)。与野生型CK及TRV2::00植株相比, TRV2::GhACBP3基因沉默植株表现出对干旱的高度敏感, 叶片褐化死亡, 茎秆明显弯曲(图7-D, E, F)。与CK及TRV2::00植株相比, TRV2::GhACBP3基因沉默植株在干旱处理后, 根及幼苗的干物质重量显著降低, 失水率显著加快, 植株也显著变矮(图9-A, B, C)。TRV2::GhACBP3基因沉默植株中超氧化物歧化酶(SOD)含量、过氧化物酶(POD)含量显著降低, 而丙二醛(MDA)含量显著升高(图9-D, E, F)。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 GhACBP3沉默植株在干旱胁迫下的表型 A: 正常浇水野生型CK植株; B: 正常浇水TRV::00 VIGS植株; C: 正常浇水TRV::GhACBP3 VIGS植株; D: 干旱处理野生型CK植株; E: 干旱处理TRV::00 VIGS植株; F: 干旱处理TRV::GhACBP3 VIGS植株。Fig. 7 Phenotype of GhACBP3-silencing plants under drought stress A: wild type plants (CK) under water condition; B: TRV::00 VIGS plants under water condition; C: TRV::GhACBP3 VIGS plants under water condition; D: wild type plants (CK) under drought stress condition; E: TRV::00 VIGS plants under drought stress condition; F: TRV::GhACBP3 VIGS plants under drought stress condition. |
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 GhACBP6沉默植株在干旱胁迫下的表型 A: 正常浇水野生型CK植株; B: 正常浇水TRV::00 VIGS植株; C: 正常浇水TRV::GhACBP6 VIGS植株; D: 干旱处理野生型CK植株; E: 干旱处理TRV::00 VIGS植株; F: 干旱处理TRV::GhACBP6 VIGS 植株。白色箭头指示VIGS植株受干旱处理后叶片出现失水萎蔫部位。Fig. 8 Phenotype of GhACBP6-silencing plants under drought stress A: wild type plants (CK) under water condition; B: TRV::00 VIGS plants under water condition; C: TRV::GhACBP6 VIGS plants under water condition; D: wild type plants (CK) under drought stress condition; E: TRV::00 VIGS plants under drought stress condition; F: TRV::GhACBP6 VIGS plants under drought stress condition. White arrows indicate the dehydration and wilting sites of the GhACBP6-VIGS plants after drought treatment. |
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 GhACBP3沉默植株在干旱胁迫下的生长参数(A、C)及生理指标(B、D~F) A: 干物质量; B: 失水率; C: 植株高度; D: 丙二醛含量; E: 超氧化物歧化酶活性; F: 过氧化物酶活性。* * 表示在相同处理条件下, 基因沉默植株与对照相比在0.01概率水平达到显著差异(t-检验)。数据为3个生物学重复平均值± 标准误。B、C、D和E图中: CK: 正常浇水野生型CK植株; T0: 正常浇水TRV::00 VIGS 植株; T3: 正常浇水TRV::GhACBP3 VIGS 植株; CP: 干旱胁迫处理野生型CK植株; TP:干旱胁迫处理TRV::00 VIGS 植株; 3P: 干旱胁迫处理TRV::GhACBP3 VIGS植株。Fig. 9 Growth parameters (A and C) and physiological index (B and D-F) of GhACBP3-silencing plants under drought stress A: dry matter; B: water loss level; C: plant height; D: malondialdehyde (MDA) content; E: superoxide dismutase (SOD) activity; F: peroxidase (POD) activity. * * indicates significant difference between VIGS plants and control plants under same growing condition at the 0.01 probability level, respectively (t-test). Values are the mean ± standard error of three biological replicates. On picture B, C, D, and E: CK: wild type plants (CK) under water condition; T0: TRV::00 VIGS plants under water condition; T3: TRV::GhACBP3 VIGS plants under water condition; CP: wild type plants (CK) under drought stress condition; TP: TRV::00 VIGS plants under drought stress condition; 3P: TRV::GhACBP3 VIGS plants under drought stress condition. |
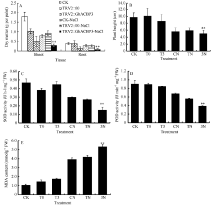
与野生型CK及TRV2::00植株相比, TRV2::GhACBP6基因沉默植株对干旱表现敏感, 虽然没有GhACBP3基因沉默植株反应强烈, 但显示明显的叶片黄斑及失水表型, 而在CK及TRV2::00植株中很少出现此表型(图8-D, E, F)。TRV2::GhACBP6基因沉默植株在干旱处理后, 植株根及幼苗的干物质重量显著降低, 失水率显著增加, 植株也显著变矮(图10-A, B, C)。同时, 其超氧化物歧化酶(SOD)含量、过氧化物酶(POD)含量显著降低, 而丙二醛(MDA)含量显著升高(图10-D, E, F)。综上所述, GhACBP3和GhACBP6抑制表达均显著降低棉花对干旱的抵抗能力。
图10
Fig. 10
| Figure OptionViewDownloadNew Window | |
 | 图10 GhACBP6沉默植株在干旱胁迫下的生长参数(A、C)及生理指标(B、D~F) A: 干物质量; B: 失水率; C: 植株高度; D: 丙二醛含量; E: 超氧化物歧化酶活性; F: 过氧化物酶活性。白色箭头指示VIGS植株受干旱处理后叶片出现失水萎蔫部位。* * 表示在相同处理条件下, 基因沉默植株与对照相比在0.01概率水平达到显著差异(t-检验)。数据为三个生物学重复平均值± 标准误。B、C、D和E图中CK: 正常浇水野生型CK植株; T0: 正常浇水TRV::00 VIGS植株; T6: 正常浇水TRV::GhACBP6 VIGS植株; CP: 干旱胁迫处理野生型CK植株; TP: 干旱胁迫处理TRV::00 VIGS 植株; 6P: 干旱胁迫处理TRV::GhACBP6 VIGS植株。Fig. 10 Growth parameters (A and C) and physiological index (B and D-F) of GhACBP6-silencing plants under drought stress A: dry matter; B: water loss level; C: plant heights; D: malondialdehyde (MDA) content; E: superoxide dismutase (SOD) activity; F: peroxidase (POD) activity. White arrows indicate the dehydration and wilting sites of the GhACBP6-VIGS plants after drought treatment. * * indicates significant difference between VIGS plants and control plants under same growing condition at the 0.01 probability level, respectively (t-test). Values are the mean ± standard error of three biological replicates. On picture B, C, D, and E: CK: wild type plants (CK) under water condition; T0: TRV::00 VIGS plants under water condition; T6: TRV::GhACBP6 VIGS plants under water condition; CP: wild type plants (CK) under drought stress condition; TP: TRV::00 VIGS plants under drought stress condition; 6P: TRV::GhACBP6 VIGS plants under drought stress condition. |
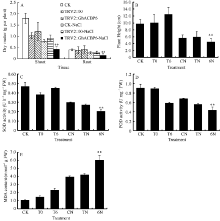
2.3.3GhACBP3和GhACBP6耐盐鉴定 与CK及TRV2::00植株相比, TRV2::GhACBP3基因沉默植株在盐处理第10天叶片出现黄斑, 同时叶片颜色变深, 是植物受到盐胁迫的典型性状, 第15天出现倒一叶生长停滞, 第25天倒一叶出现皱缩, 部分植株已经皱缩死亡(图11-D, E, F, G)。与正常浇水对照组相比, 盐处理组的植株生长受到抑制, 植株高度显著降低; 同时, 在受到盐胁迫后, TRV2::GhACBP3基因沉默植株的株高和干物质量与CK及TRV2::00植株相比显著降低(图12-A, B)。与对照相比, TRV2::GhACBP3植株中SOD和POD活性显著降低, 而MDA含量显著升高(图12-C, D, E)。
图11
Fig. 11
| Figure OptionViewDownloadNew Window | |
 | 图11 GhACBP3沉默植株在盐胁迫下的表型 A: 正常浇水野生型CK植株; B: 正常浇水TRV::00 VIGS 植株; C: 正常浇水TRV::GhACBP3 VIGS 植株; D: 盐胁迫处理野生型CK植株; E: 盐胁迫处理TRV::00 VIGS植株; F: 盐胁迫处理TRV::GhACBP3 VIGS植株; G: 倒一叶皱缩表型。Fig. 11 Phenotype analysis of GhACBP3-silencing plants under salt stress A: wild type plants (CK) under water condition; B: TRV::00 VIGS plants under water condition; C: TRV::GhACBP3 VIGS plants under water condition; D: wild type CK plants (CK) under salt stress condition; E: TRV::00 VIGS plants under salt stress condition; F: TRV::GhACBP3 VIGS plants under salt stress condition; G: shrinkage phenotype of last leaf. |
图12
Fig. 12
| Figure OptionViewDownloadNew Window | |
 | 图12 GhACBP3沉默植株在盐胁迫下的生长参数(A、B)及生理指标(C、D和E)检测 A: 干物质量; B: 植株高度; C: 超氧化物歧化酶活性; D: 过氧化物酶活性; E: 丙二醛含量。* * 表示在同一处理条件下, 基因沉默植株与对照相比在0.01概率水平达到显著差异(t-检验)。数据为3个生物学重复平均值± 标准误。B、C、D和E图中: CK: 正常浇水野生型CK植株; T0: 正常浇水TRV::00 VIGS植株; T3: 正常浇水TRV::GhACBP3 VIGS植株; CN: 盐胁迫处理野生型CK植株; TN: 盐胁迫处理TRV::00 VIGS植株; 3N: 盐胁迫处理TRV::GhACBP3 VIGS植株。Fig. 12 Growth parameters (A and B) and physiological index (C, D, and E) of GhACBP3-silencing plants under salt stress A: dry matter; B: plant height; C: superoxide dismutase (SOD) activity; D: peroxidase (POD) activity; E: malondialdehyde (MDA) content. * * indicates significant difference between VIGS plants and control plants under same growing condition at the 0.01 probability level, respectively (t-test). Values are the mean ± standard error of three biological replicates. On picture B, C, D, and E: CK: wild type plants (CK) under water condition; T0: TRV::00 VIGS plants under water condition; T3: TRV::GhACBP3 VIGS plants under water condition; CN: wild type plants (CK) under salt stress condition; TN: TRV::00 VIGS plants under salt stress condition; 3N: TRV::GhACBP3 VIGS plants under salt stress condition. |
TRV2::GhACBP6基因沉默植株在受到盐胁迫后其表型与GhACBP3沉默植株略有不同。GhACBP6沉默植株在盐胁迫20 d后出现严重的倒一叶生长停滞, 且叶片皱缩, 出现黄斑较少, 叶片颜色变深(图13-D, E, F, G)。与CK及TRV2::0植株相比, GhACBP6沉默植株的干物质量及株高显著降低, 表明其正常生长受到严重抑制(图14-A, B)。SOD和POD活性在GhACBP6沉默植株中显著降低, MDA含量显著升高(图8-C, D, E)。
图13
Fig. 13
| Figure OptionViewDownloadNew Window | |
 | 图13 GhACBP6沉默植株在盐胁迫下的表型 A: 正常浇水野生型CK植株; B: 正常浇水TRV::00 VIGS 植株; C: 正常浇水TRV::GhACBP6 VIGS 植株; D: 盐胁迫处理野生型CK植株; E: 盐胁迫处理TRV::00 VIGS 植株; F: 盐胁迫处理TRV::GhACBP6 VIGS 植株; G: 倒一叶皱缩表型。Fig. 13 Phenotype of GhACBP6-silencing plants under salt stress A: wild type plants (CK) under water condition; B: TRV::00 VIGS plants under water condition; C: TRV::GhACBP6 VIGS plants under water condition; D: wild type plants (CK) under salt stress condition; E: TRV::00 VIGS plants under salt stress condition; F: TRV::GhACBP6 VIGS plants under salt stress condition; G: shrinkage phenotype of last leaf. |
图14
Fig. 14
| Figure OptionViewDownloadNew Window | |
 | 图14 GhACBP6沉默植株在盐胁迫下的生长参数(A、B)及生理指标(C、D和E) A: 干物质量; B: 植株高度; C: 超氧化物歧化酶活性; D: 过氧化物酶活性; E: 丙二醛含量。* * 表示在同一处理条件下, 基因沉默植株与对照相比在0.01概率水平达到显著差异(t-检验)。数据为3个生物学重复平均值± 标准误。B、C、D和E图中CK: 正常浇水野生型CK植株; T0: 正常浇水TRV::00 VIGS植株; T6: 正常浇水TRV::GhACBP6 VIGS 植株; CN: 盐胁迫处理野生型CK植株; TN: 盐胁迫处理TRV::00 VIGS植株; 6N: 盐胁迫处理TRV::GhACBP6 VIGS植株。Fig. 14 Growth parameters (A and B) and physiological index (C, D, and E) detection of GhACBP6-silencing plants under salt stress A: dry matter; B: plant height; C: superoxide dismutase (SOD) activity; D: peroxidase (POD) activity; E: malondialdehyde (MDA) content. * * indicates significant difference between VIGS plants and control plants under same growing condition at the 0.01 probability level (t-test). Values are the mean ± standard error of three biological replicates. On picture B, C, D, and E: CK: wild type plants (CK) under water condition; T0: TRV::00 VIGS plants under water condition; T6: TRV::GhACBP6 VIGS plants under water condition; CN: wild type plants (CK) under salt stress condition; TN: TRV::00 VIGS plants under salt stress condition; 6N: TRV::GhACBP6 VIGS plants under salt stress condition. |
总之, GhACBP3和GhACBP6沉默后, 盐胁迫下会导致棉花幼苗生长严重滞缓, 叶片幼小, 整株孱弱, 对盐胁迫的抵抗力下降, 对棉花的生长发育造成不可逆的伤害。说明GhACBP3和GhACBP6亚类基因在棉花幼苗抵抗盐胁迫过程中具有重要作用。
3 讨论ACBP家族基因在应对植物生物及非生物胁迫及多种生长发育过程中具有重要作用[1, 13, 19, 33]。本研究将21个ACBP基因分为I~IV四大类。每一类包含1~2个拟南芥ACBP成员及多个陆地棉成员, 说明ACBP家族基因在陆地棉基因组中进行了多次基因复制与扩张。
ACBP家族基因能够在拟南芥多种组织中表达, 如种子、叶片及根中, 且一些家族成员具有组织表达特异性[9, 21, 23]; 在水稻中, 不同ACBP家族基因的表达也表现出器官和组织特异性[27]。本研究利用转录组数据及qRT-PCR分析表明, 陆地棉ACBP家族基因的表达具有明显的时空特异性, 暗示ACBP不同家族成员间具生物学功能的多样性。进一步研究表明, ACBP家族基因响应多种逆境, 特别是GhACBP1、GhACBP3和GhACBP6亚类基因受到多种逆境处理均诱导表达。同时, GhACBP3和GhACBP6亚类基因也受包括过氧化氢(H2O2)、水杨酸(SA)、茉莉酸(JA)、脱落酸(ABA)、乙烯(ET) 5种植物激素显著诱导。说明GhACBP3和GhACBP6基因可能是调控陆地棉逆境下生长发育的关键ACBP成员。
在拟南芥中, AtACBP3能够通过调控细胞膜磷脂代谢及胞吞作用相关蛋白ATG8的稳定性而影响叶片衰老过程。过量表达AtACBP3基因能够增加或减少植株中磷脂酰乙醇胺(PE)、半乳糖脂和磷脂的含量, 而抑制表达则获得相反结果[34]。本研究通过VIGS试验沉默GhACBP3基因后, 在高盐、干旱胁迫下, 植株叶片损伤严重, 膜质过氧化有害衍生物含量升高, 生长发育滞缓, 显著降低了陆地棉抗旱、耐盐能力。说明GhACBP3基因能够参与棉花的多种逆境胁迫反应, 在陆地棉抗旱、耐盐中具有重要生物学作用。与GhACBP3基因在陆地棉抗旱、耐盐中的作用类似, GhACBP6基因沉默后也会显著降低陆地棉的抗旱、耐盐能力。拟南芥研究表明, AtACBP6能够结合亚麻酰辅酶A酯、油酰辅酶A酯等辅酶酯类和卵磷脂(PC), 过表达AtACBP6能够上调磷脂酶Dδ (PLDδ )的表达, 从而促进甘油磷酸酯(PA)的合成, 并能够在细胞内转运卵磷脂参与脂类代谢, 而促进细胞膜的修复[26]。推测GhACBP6基因在棉花抗逆过程中的作用也是通过参与细胞膜的修复来完成。本研究发现, GhACBP3和GhACBP6基因沉默植株在受到干旱及盐胁迫后其表型有所差异。在受到干旱胁迫后, GhACBP3沉默植株叶片萎焉死亡严重, 而GhACBP6沉默植株的这种表型较轻; 受到盐胁迫后, GhACBP3沉默植株叶片出现黄斑较多, 倒一叶停止生长也较早, 而GhACBP6沉默植株叶片出现黄斑较少, 倒一叶停止生长也晚。这与AtACBP3和AtACBP6基因调控拟南芥发育过程存在差异相一致[26, 34], 说明GhACBP3和GhACBP6基因在陆地棉抗旱、耐盐中的作用可能有所差异, 或者两者的非生物胁迫抗性机制存在不同, 其作用机制需要进一步研究。
盐、旱害主要通过植物体内渗透胁迫、离子毒害和营养供应失衡而引起, 植物通过启动自身众多防御基因, 从信号响应到信号传递, 最后到功能基因作用的发挥, 包括提高脯氨酸、脂类等有机物质含量, 修复受损机体等。目前在棉花中已经鉴定出许多和抗旱、耐盐相关的基因, 包含转录因子[35]、激酶基因[36]、胚胎发生晚期富集蛋白、离子通道蛋白等。而ACBP家族基因涉及到植物体内酰基辅酶A库的稳定, 细胞膜修复所需磷脂类物质的合成及转运, 生长发育所需脂类及传递抗逆信号的磷脂类含量变化的识别, ACBP家族基因和脂类代谢对植物抵抗高盐、干旱等逆境具有不可忽视的作用。植物在盐渍化土壤中会遭受水分亏缺和Na+毒害的双重作用, 本研究鉴定完成的GhACBP3和GhACBP6基因同时参与陆地棉的抗旱、耐盐进程, 有望在棉花抗逆育种方面发挥重要作用。
4 结论基于陆地棉遗传标准系TM-1序列信息, 获得21个棉花ACBP家族成员信息, 并完成系统进化和分类分析。ACBP家族不同亚类基因在不同组织、不同发育时期表达差异大, 其中GhACBP1、GhACBP3和GhACBP6显著受高盐、干旱、低温、高温等逆境胁迫诱导。沉默GhACBP3和GhACBP6导致陆地棉抗旱、耐盐能力显著下降, 表明GhACBP3和GhACBP6在棉花抗逆进程中发挥重要作用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] | |
| [36] |
