 , 梁雅珺
, 梁雅珺
* 通讯作者(Corresponding author): 张林生, E-mail: linszhang@nwsuaf.edu.cn, Tel: 029-87092379
第一作者联系方式: E-mail:qiangsir0934@qq.com
收稿日期:2016-01-23 接受日期:2016-05-09网络出版日期:2016-06-02基金:
摘要
关键词:小麦; 脱水素; 荧光实时定量PCR; 原核表达
Cloning and Functional Analysis of wzy2-1Gene in Wheat
QIANG Zhi-Quan
 , LIANG Ya-Jun
, LIANG Ya-Jun
Fund:
Abstract
Keyword:Wheat; Dehydrins; Real-time PCR; Procaryotic expression
Show Figures
Show Figures














植物赖以生存的环境并不总是适合植物生长。干旱、盐渍、低温、高温等都会影响植物生长发育, 严重时会导致植物死亡。为了适应各种逆境胁迫, 植物在进化过程中, 已经形成了多种生理生化机制, 以抵御不利环境因素, 通常在逆境胁迫下, 植物会积累一系列逆境相关蛋白, 如胚胎发育后期丰富蛋白(late embryogenesis abundant protein, LEA)、分子伴侣、解毒酶等[1]。其中, LEA蛋白对提高植物的逆境胁迫耐受性具有非常重要的作用。
LEA蛋白是胚胎发生后期大量积累的一类蛋白, 最早发现于胚胎发育后期的棉花子叶中[2]。LEA蛋白的共同特点是含有大量极性氨基酸, 其中赖氨酸和甘氨酸含量最高, 具有较强的亲水性和热稳定性[3]。LEA蛋白是一大类逆境响应蛋白, 根据LEA蛋白氨基酸序列的同源性分为6个家族, 即LEA-D19 (1族)、LEA-D11 (2族, 又称脱水素)、LEA-D7 (3族)、LEA-D113 (4族)、LEA-D29 (5族)和LEA-D95 (6族), 后两族为附加族[4]。
脱水素属于LEA2家族, 是目前研究较为深入的一类LEA蛋白[5], 根据脱水素保守序列, 可以分为YnSKm、Kn、KnS、SKn和YnKm共5个亚类。该类蛋白的特点是含有3个保守的区域, 分别是K、Y和S片段。其中, K片段富含赖氨酸, 是所有脱水素共有的, 一般由15个氨基酸残基组成(EKKGIMDKIKEKLPG)[6]; K片段可以形成两亲性的α -螺旋, 在植物失水情况下, 两亲性的α -螺旋可以保持细胞膜和细胞内蛋白的稳定性[7]。S片段是一段富含丝氨酸的保守序列(SSSSSS), 可被磷酸化, 并可能与脱水素的入核有关[8, 9]。Y片段的保守序列为(VT)DEYGNP, 但目前尚不清楚其功能。除了这3个保守的序列外, 脱水素还有另外一些保守区域, 这些区域富含极性氨基酸, 称作Φ 片段, 通常分布于K片段之间, 可能与参与细胞质组分的相互作用有关[10]。
近些年对于脱水素的研究有了许多重要发现。将小麦DHN5 (YSK2)转入大肠杆菌中, 发现DHN5可以提高大肠杆菌的耐逆性, 这可能与DHN5可以防止大肠杆菌体内的蛋白聚集有关, 并且发现DHN5能够保护LDH酶和葡萄糖苷酶的活性[11, 12]。通过对小麦WZY2和DHN5 K片段的缺失, 发现K片段在提高大肠杆菌耐逆性和LDH等酶活保护中起着最主要的作用[13]。当植物遭受低温、干旱、盐渍等逆境时, 体内会大量积累脱水素蛋白, 例如, 小麦WCOR410[14]、拟南芥COR15[15]、马铃薯CI7[16]均可响应低温胁迫; 大麦DHN5可以响应干旱、低温和盐渍胁迫[17]; 对辣椒的CaDHN1研究表明, CaDHN1可以响应低温、盐和水杨酸胁迫, 但不响应ABA诱导[18]。本研究通过同源克隆, 从郑引1号小麦中成功克隆了小麦Kn型脱水素基因wzy2-1, 对其进行生物信息学分析, 并且研究了不同胁迫下的wzy2-1表达模式以及WZY2-1蛋白对大肠杆菌的保护作用。
1 材料与方法1.1 植物材料和胁迫处理小麦品种郑引1号, 由西北农林科技大学生命科学学院中心实验室提供。将小麦种子经75%酒精消毒2 min, 蒸馏水浸泡6 h, 置培养皿中培养。培养条件为光/暗16 h/ 8 h, 昼/夜温度25℃/19℃。当小麦长到二叶一心期时, 分别进行干旱(10%的PEG-6000)、低温(4℃培养箱)、盐(500 mmol L-1NaCl溶液)和外源ABA (100 μ mol L-1ABA溶液)处理。在处理0、12、24、36、48和60 h取样, 液氮速冻后保存于-80℃。
1.2 小麦RNA的提取及反转录合成cDNA取干旱处理2 d小麦叶片, 在液氮中研磨, 按照TRIzol试剂(Invitrogen)的操作说明, 提取小麦幼苗总RNA。以提取的RNA为模板, 按照反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser (TaKaRa)的操作说明反转录成cDNA。
1.3 目的基因全长cDNA克隆根据大麦DNH5 (GenBank登录号为AF181455)的cDNA序列设计引物(F1: 5′ -ATGCACGACGCCGAC-3′ ; R1: 5′ -TTAGTTCAGTCCAGGC-3′ ), 以小麦cDNA为模板进行PCR扩增。反应体系20 μ L, 包含2× Taq PCR Supermix (全式金公司) 8 μ L, cDNA模板1 μ L, 上、下游引物各1 μ L, ddH2O 9 μ L。PCR反应参数为94℃预变性5 min; 94℃ 30 s, 63℃ 30 s, 72℃ 1 min, 35个循环; 72℃ 10 min。将扩增产物回收(天根公司), 连接到pMD18-T载体上, 转化TOP10感受态细胞, 涂板, 挑单克隆, 菌液PCR检测, 送3个阳性菌落到上海生工生物工程有限公司测序。
1.4 目的基因的生物信息学分析利用DNAMAN分析wzy2-1基因序列及蛋白序列; 通过Blast, 利用MEGA5.0对wzy2-1进行同源性分析。利用ExPAsy软件(http://web.expasy.org/protscale/)对WZY2- 1蛋白进行疏水性预测; 利用Metaprediction软件(http:// iimcb.genesilico.pl/metadisorder/metadisorder.html)对WZY2-1蛋白无序化程度进行分析[13, 19]。
1.5 目的基因的原核表达及Western blot验证设计含有Xho I和BamH I酶切位点的引物(F: 5′ -CGCGGATCCATGCACGACGCCGAC-3′ ; R: 5′ -CCGCT CGAGTTAGTTCAGTCCAGGC-3′ ), 以pMD18-T-wzy2-1质粒为模板进行PCR扩增, 回收产物, 然后对产物和pET28a质粒酶切。酶切体系20 μ L, 含PCR产物或pET28a质粒10 μ L, Xho I 1 μ L, BamH I 1 μ L, 10× K buffer 2 μ L, ddH2O 6 μ L。将酶切产物进行胶回收, 再将回收的PCR产物和pET28a质粒进行16℃连接, 转化TOP10感受态细胞, 涂板, 挑单克隆, 双酶切检测, 选3个阳性菌落送生工生物工程(上海)股份有限公司测序。
将构建好的原核表达载体pET28a-wzy2-1转入大肠杆菌BL21 (DE3), 经0.2 mmol L-1IPTG诱导0、2、4、6、8 h, 收集3 mL菌体, 10 000× g离心2 min, 加入1 mol L-1Tris-HCl 100 μ L和 2× 蛋白loading buffer 100 μ L, 在沸水浴中煮10 min, 冰上冷却, 10 000× g离心10 min, 取上清液10 μ L进行SDS-PAGE检测, 并且用K片段抗体进一步验证[20, 21]。
1.6 WZY2-1蛋白对大肠杆菌的耐逆性实验将转pET28a-wzy2-1和pET28a空载体的大肠杆菌BL21 (DE3)接种到50 mL液体LB中, 于37℃摇床培养至OD值为0.6, 再加入0.2 mmol L-1IPTG诱导2 h。取该诱导菌液1 mL, 加入含10% PEG-6000、500 mmol L-1NaCl或500 mmol L-1KCl的50 mL液体LB中, 测定波长600 nm下每小时的菌液OD值, 以无处理的菌液作对照。
采用涂板技术法进行目的基因表达蛋白对大肠杆菌的温度耐逆性分析。对IPTG诱导2 h的重组菌和空菌进行45℃ 30 min或者-20℃ 2 h的处理, 然后稀释1000倍, 于37℃过夜, 统计菌落数, 以无胁迫处理作对照, 计算菌存活率[11, 22]。
1.7 不同胁迫处理的实时定量PCR分析提取不同处理的小麦样品RNA, 以小麦β -actin (KC775780.1)为内参基因进行定量RT-PCR分析。引物序列为wzy2-1-F: 5′ -CGGAGTGACCGATAAGG-3′ , wzy2-1- R: 5′ -TGCCAGTTGTTTCGTTGT-3′ ; actin-F: 5′ -TCCAATC TAGGGATACACGC-3′ , actin-R: 5′ -TCTTCATTAGATTAT CCGTGAGGTC-3′ 。反应体系25 μ L, 包括2× SYBR Premix 12.5 μ L, 模板2 μ L, 上、下游引物各1 μ L。反应程序为95℃预变性30 s, 然后95℃ 5 s, 55℃, 20 s, 39个循环。
2 结果与分析2.1 目的基因的克隆以干旱处理24 h的小麦RNA为模板, 反转录得到cDNA, 利用合成的特异引物F1/R1扩增得到1740 bp的产物。回收该产物, 并连接到pMD18-T载体上, 转入大肠杆菌TOP10中。通过对阳性菌落测序, 得到完整开放阅读框序列, 定名为wzy2-1基因, 提交到GenBank, 登录号为KU230444。
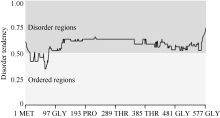
2.2 wzy2-1基因的生物信息学分析利用DNAMAN软件分析表明, wzy2-1编码产物由579个氨基酸组成, 其分子量约为60.3 kD, 等电点为5.8; 该蛋白含有9个保守的K片段基序, 属于典型的Kn型脱水素(图1)。利用MEGA5.0构建了wzy2-1基因的系统进化树, 发现wzy2-1和大麦的脱水素基因Dhn5具有较高的同源性(图2)。利用ExPAsy软件(http://web.expasy.org/ protscale/)分析表明, WZY2-1蛋白平均疏水系数为-1.307 (图3), 具有较强的亲水性。用Metprediction (http://iimcb. genesiico.pl/metadisorder/metadisorder.html)软件分析表明, WZY2-1蛋白是无序状蛋白(图4)。以上结果显示, WZY2-1蛋白在生理条件下是一种高度亲水性的无序蛋白, WZY2-1蛋白属于IDPs家族。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 wzy2-1基因编码的氨基酸序列 下画线表示保守的K片段。Fig. 1 Amino acid sequence of wzy2-1gene Conserved sequences of K fragment are underlined. |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 小麦wzy2-1基因编码区与多种植物脱水素基因的遗传进化树 DHN5: 大麦; DHN4: 伞穗山羊草; DHN: 高粱; WCS66: 小麦; ESI18-2: 长穗偃麦草; WSC120: 小麦; DHN3: 伞穗山羊草; WZY2-1: 小麦; Rab 16B-Like: 短花药野生稻; DHN1: 雀稗COR39: 小麦; SPV462: 高粱。Fig. 2 Phylogenetic tree ofwzy2-1 and other dehydrin genes from different plant species DHN5: Hordeum vulgare; DHN4: Aegilops umbellulata; DHN: Sorghum bicolor; WCS66: Triticum aestivum; ESI18-2:Lophopyrum elongatum; WCS120: Triticum aestivum; DHN3: Aegilops umbellulata; WZY2-1: Triticum aestivum; Rab 16B-Like: Oryza brachyantha; DHN1: Paspalum quadrifarium; COR39: Triticum aestivum; SPV462: Sorghum bicolor. |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 WZY2-1蛋白的疏水性预测Fig. 3 Hydrophobicity prediction of WZY2-1 protein |
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 WZY2-1蛋白无序化程度预测Fig. 4 Disorder prediction of WZY2-1 protein |
2.3 wzy2-1基因的原核表达以及Western blot验证构建了pET28a-wzy2-1原核表达载体, 并用0.2 mmol L-1IPTG诱导重组菌BL21 (DE3), 通过对热溶性蛋白SDS-PAGE电泳检测, 发现在100 kD附近有一条带, 比预测的结果偏大, 这可能是K片段与蛋白胶的特殊作用导致电泳条带略滞后移。Western blot验证结果显示, 该条带是WZY2-1重组蛋白(图5)。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 用K片段抗体进行Western blot验证Fig. 5 Western blot with K-fragment antibody |
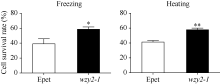
2.4 WZY2-1蛋白对大肠杆菌的耐逆性在正常条件下, 重组菌和对照菌生长情况基本一致, 但在10% PEG-6000、500 mmol L-1NaCl和500 mmol L-1KCl处理后, 重组菌表现出较好的生长趋势(图6), 说明WZY2-1蛋白能够提高大肠杆菌对逆境胁迫的耐受性。分别将对照菌和重组菌进行45℃ 30 min和-20℃ 2 h处理, 结果表明, 重组菌的存活率显著高于对照菌(图7), 说明重组菌对温度胁迫有较高的耐受性。
图6
Fig.6
| Figure OptionViewDownloadNew Window | |
 | 图6 不同处理条件下重组菌(wzy2-1)和对照菌(Epet)的生长曲线Fig.6 Growth of recombinant (wzy2-1) and control E. coli(Epet) under different treatments |
2.5 不同胁迫处理下wzy2-1表达的定量RT-PCR分析 在冷胁迫处理下, wzy2-1基因表达量在12 h达到最高, 为对照的30倍; 在盐胁迫处理下, wzy2-1基因的表达量在36 h达到最高, 是对照的30倍; 然而在干旱胁迫下, 直到48 h wzy2-1的表达量才达到峰值, 是对照的8倍(图8)。同时还发现, 在ABA处理条件下, wzy2-1基因表达量在60 h内没有明显上调的趋势(图8)。推测wzy2-1基因属于非ABA依赖型的冷、渗透、干旱响应的脱水素基因。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 重组菌(wzy2-1)和对照菌(Epet)在经45℃ 30 min和-20℃ 2 h处理后的存活率 柱状图上星号表示重组菌(wzy2-1)和对照菌(Epet)存活率的差异显著性(* , P< 0.05; * * , P< 0.01)。Fig. 7 Survival rate of recombinants (wzy2-1) and controlE. coli (Epet) under 45 ° C for 30 min and -20° C for 2 h conditions Different asterisk on top of bars indicate the significant differences of the survival rate between recombinants (wzy2-1) and control E. coli(Epet) (* , P< 0.05; * * , P< 0.01). |
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 不同胁迫处理下小麦叶片wzy2-1基因的表达模式Fig. 8 Transcript accumulation ofwzy2-1 in wheat leaves in response to different abiotic stresses as determined by qRT-PCR |
3 讨论植物在生长过程中会产生一系列应对非生物胁迫的机制, 像上调某些基因的表达以适应外界多变的环境。LEA蛋白就是其中之一, 它能够提高植物对干旱、盐渍、低温等逆境胁迫的耐受性。脱水素具有的K片段能形成A2型双亲性α -螺旋, 能与囊泡膜、酸性磷脂、磷脂双分子层结合, 提高细胞膜的稳定性, 提高植物对不利环境的耐受性[24, 25, 26]。小麦wzy2-1基因含有9个保守的K片段, 分子量为60.3 kD, 等电点为5.8, 属于Kn型酸性脱水素。具有较强的亲水性和高度的无序化, 这种高度亲水性的无序蛋白在细胞失水情况下表达, 对于细胞水分子有较强的束缚能力, 以利保护细胞免于逆境下过度失水而发生膜的损伤[27]。
研究表明, 脱水素可能具有分子伴侣、防冻剂、离子缓冲剂、膜的稳定剂、抗氧化剂等功能[21]。本实验结果表明, WZY2-1蛋白能够提高大肠杆菌对低温、高温、高盐以及高渗胁迫的耐受性(图6和图7), 脱水素能够提高大肠杆菌对逆境胁迫的耐受性, 这为后续转基因相关研究奠定了基础。
植物响应非生物胁迫依赖于一系列的信号途径, 包括ABA依赖型和非ABA依赖型[23, 28, 29]。在本研究中, 低温、干旱、盐渍胁迫处理诱导wzy2-1基因上调表达, 但是基因对各胁迫处理的敏感程度不尽相同。低温胁迫12 h wzy2-1基因表达至峰值, 而盐胁迫36 h基因表达才到峰值; 干旱胁迫48 h, 基因表达量比对照上调8倍, 与低温和盐胁迫上调wzy2-1表达量30倍有较大差距。可见, wzy2-1对各种胁迫的敏感程度为低温> 盐渍> 干旱。这与以前报道结果相似, 即Kn型脱水素主要响应低温胁迫[17, 30]。ABA处理60 h未引起wzy2-1基因表达量明显变化(图8), 因此我们认为, wzy2-1可能属于非ABA依赖型脱水素基因。
The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] |
