
* 通讯作者(Corresponding author): 刘国振, E-mail:gzhliu@genomics.org.cn, Tel: 0312-7528250 收稿日期:2014-01-12 基金:
摘要
关键词:水稻; 几丁质酶; 聚类分析; 白叶枯病菌; 转录; 免疫印迹
Transcriptional and Translational Characterization of Rice Chitinase Genes
FAN Wei

Fund:
Abstract
Keyword:Rice; Chitinase; Clustering analysis; Xanthomonas oryzae pv. oryzae (Xoo); Transcription; Western blot
Show Figures
Show Figures











引言几丁质(chitin)又称壳多糖, 其在甲壳类动物的外壳、昆虫的甲壳和真菌的细胞壁以及绿藻中广泛存在。几丁质是由1000~3000个N-乙酰葡萄糖胺残基通过β-1,4糖苷键相互连接而成的聚合物, 其分子量往往在1000 kD以上。它在生物体中主要是作为身体骨架且具自身保护作用。在植物与病原物的互作过程中, 几丁质的降解产物N-乙酰葡萄糖胺可以发挥病原物相关的分子模式(microbe/pathogen associated molecular pattern, MAMP)的作用激发植物的防卫反应[ 1]。拟南芥受体激酶AtCERK1 (chitin elicitor receptor kinase 1 of Arabidopsis)的胞外区有3个赖氨酸基序(lysine motif, LysM), 它们可以与几丁质寡糖结合从而激活植物免疫反应。几丁质诱发的AtCERK1的二聚化可进一步激发AtCERK1介导的信号途径[ 2]。在水稻中, 第一个报道的几丁质酶寡糖受体是CEBiP (chitin elicitor binding protein), 它带有2个LysM的糖蛋白, 与几丁质寡糖具有很高的亲和力, CEBiP和激酶OsCERK1共同作用, 可使植物对来自几丁质寡糖的信号做出反应[ 3, 4]。最近又有报道表明, LYP4 (lysine motif-containing protein 4)和LYP6与CEBiP具有同源性, 它们对水稻识别几丁质信号也发挥着作用[ 2]。将CEBiP与水稻白叶枯病抗性基因 XA21或稻瘟病抗性基因 PI-D2重组形成嵌合基因, 可以增强水稻对稻瘟病菌的抗性[ 5, 6]。
几丁质酶(EC 3.2.1.14)的作用是将几丁质分解为N-乙酰葡萄糖胺, 在自然界中, 几丁质酶在细菌、真菌、植物甚至动物中都存在。根据作用于几丁质的方式不同, 几丁质酶可分为内切和外切几丁质酶二大类[ 7], 根据氨基酸序列的相似性和几丁质结合结构域的有无可把几丁质酶分为Class I~Class VII[ 8, 9]。
有大量报道表明, 几丁质酶在植物中的表达受生物或非生物胁迫的诱导。在拟南芥中, 非亲和病原物的侵染使Class IV几丁质酶基因的转录更快地积累[ 10], 而用亲和病原物侵染可使Class III几丁质酶的转录升高[ 11]。在甜菜中也观察到亲和病原物的侵染可使Class IV几丁质酶转录增强的现象[ 12]。从稻瘟病菌侵染后的叶片cDNA中克隆出一个属于Class III几丁质酶编码基因, 命名为 Oschib1, 该基因的转录在稻瘟病菌和白叶枯病菌侵染后均大幅提高, 且在接种非亲和稻瘟病菌的组织中 Oschib1反应更快速, 另外, 该基因的转录提升受水杨酸(salicylic acid, SA)、乙烯、甲基茉莉酸、H2O2和CuSO4的诱导[ 13]。
也有多例报道表明, 几丁质酶在正常生长的植物组织中也有表达。如在烟草的花形成阶段[ 14]、在葡萄的果实成熟期[ 15]以及水稻的叶片、叶鞘、根和分生组织中都有高表达的几丁质酶[ 9]。胡萝卜的EP3几丁质酶在体细胞胚胎发生过程中发挥作用, 拟南芥的 ep3同源基因为 Atep3/ Atchit IV, 该基因在胚胎细胞的周围看护细胞中表达, 但不在胚胎细胞中表达, 在拟南芥植株中, 该基因在成熟的花粉和生长中的花粉管中表达, 但没有检测到在胚乳和珠被中的转录, 在胚胎形成后期, 其转录还发生在托叶、根表皮和根毛中[ 16]。拟南芥类几丁质酶基因 Atctl1的突变引起了木质素的异位沉积和细胞的非正常形态突变, Atctl1基因在大部分正常生长的组织中表达, 但不受创伤、SA或乙烯处理的诱导[ 17]。水稻脆秆突变体 bc15的控制基因编码几丁质酶类蛋白BC15/ OsCTL1, 该基因的突变引起厚壁细胞壁变薄和纤维素含量下降, 导致水稻茎秆机械强度降低, 表达模式检测发现BC15/OsCTL1在水稻的各个组织器官中均广泛表达[ 18]。这些事实说明几丁质酶不但在逆境胁迫反应中有作用, 在植物正常生长发育过程中也发挥着作用。
转基因实验也提供了几丁质酶作用的证据。在水稻中组成型表达 Cht2(Os05g33130)或 Cht3(Os06g51050)基因提高了对稻瘟病的抗性, 且几丁质酶的高水平表达和稻瘟病抗性在后代中能稳定遗传[ 19, 20]。在水稻中组成型表达几丁质酶基因 RC7, 使水稻增强了抗纹枯病的能力[ 19, 20]。干扰编号为Os02g39330或Os04g41620的水稻几丁质酶基因的表达, 会使水稻提高对稻瘟病菌及白叶枯病菌的敏感性[ 21]。把水稻的几丁质酶基因转入香蕉或小麦[ 22, 23]可提高受体植物的抗病性。
白叶枯病是危害水稻最为严重的细菌性病害, 在水稻育种和植病学家的努力下, 先后鉴定了30多个水稻白叶枯病抗性基因, 其中7个已被克隆[ 24]。最早克隆的 Xa21编码受体激酶, 且对白叶枯病菌具有广谱抗性, 过去十几年中, 通过酵母双杂交和Pull-down技术已经鉴定了 XB3、 XB15、 XB24、 Bip3[ 25, 26, 27, 28]等多个在 Xa21介导的抗病途径中的关键元件, 利用水稻全基因组基因芯片体系, 我们筛选出了441个在 Xa21介导的抗病反应中的差异转录基因。采用基于抗体的蛋白质组学策略, 利用免疫印迹技术(western blot, WB), 我们也检测到PR、WRKY转录因子等抗病相关蛋白质的表达变化[ 24, 29, 30, 31, 32]。
综上所述, 几丁质酶在植物正常生长发育和抗病过程中都可能发挥作用。水稻中的几丁质酶属于PR3家族, 有19个成员[ 33], 本研究以水稻PR3家族的几丁质酶为对象, 分析了几丁质酶基因的转录和蛋白质表达特征, 试图为水稻几丁质酶的功能研究提供线索。
1 材料与方法1.1 试验材料水稻品种93-11是超级杂交稻两优培九的父本, 4021是将白叶枯病抗性基因 Xa21转入水稻品TP309后获得的纯合转基因株系, 对白叶枯病菌PXO99野生型(由中国科学院遗传与发育生物学研究所朱立煌研究员提供)表现不亲和反应, 对白叶枯病菌突变株PXO99ΔraxST (由美国加州大学戴维斯分校Pamela Ronald教授提供)表现亲和反应。
1.2 试验方法1.2.1 水稻接种与取材 在PSA培养基中(0.5% bacto peptone, 2% sucrose, 0.05% L-glutamic acid) 30℃培养白叶枯病菌48~72 h后, 用水稀释至109个细胞 mL-1, 用灭菌剪刀蘸取菌液剪切叶片以接种, 以灭菌蒸馏水作为对照(Mock)。分别于接种后0 h、2 h、8 h、1 d、2 d、3 d、5 d、7 d和10 d采集接种部位叶片(约1 cm), 液氮速冻后于-70℃冰箱保存。
1.2.2 多克隆抗体制备 目标几丁质酶蛋白质序列来自水稻基因组数据库(http://rice.plantbiology. msu.edu), 利用BEPITOPE软件预测抗原决定簇, 选择峰值较高的片段, 用BLASTP软件对水稻蛋白质库进行唯一性检测后, 确定目标多肽片段。以合成多肽作为免疫原, 多克隆抗体的制备由北京华大蛋白质研发中心有限公司完成。
1.2.3 水稻蛋白质提取 将-70℃冻存的水稻叶片在液氮中充分研磨, 加入蛋白质提取液(62.5 mmol L-1 Tris-HCl, pH 7.4; 10%甘油; 0.1% SDS; 2 mmol L-1 EDTA; 1 mmol L-1 PMSF; 5% β-巯基乙醇), 混匀, 冰上放置10 min, 12 000转 min-1 4℃离心20 min, 取上清液即为总蛋白质, 具体方法可参考本课题组以前的报道[ 29]。
1.2.4 WB分析和信号采集 WB分析实验至少重复3次, 使用HSP (heat shock protein)蛋白质的检测信号作为等量加样的内参[ 34]。用ImageJ软件扫描X光片上的条带信号, 计算平均值及标准差, 比较其信号的相对强度。
1.2.5 生物信息学分析 从水稻基因组数据库中, 根据几丁质酶蛋白质的Locus号, 获得几丁质酶基因编码的蛋白质序列, 使用ClustalW进行多序列比对, 参数使用默认值, 使用Mega4.0进行系统树分析, 应用临近法, boot strap次数为2000。用SMART软件(http://smart.embl-heidelberg.de/)进行结构域分析。从水稻基因组注释项目(rice genome annotation project)数据库(http://rice.plantbiology.msu.edu/)找到目标几丁质酶基因后下载RNA-Seq 产生的FPKM (reads per kilobase of exon model per million mapped reads)数据, 其高通量测序产生的转录原始数据可从NCBI的SRA (Sequence Read Archive)数据库(http://www.ncbi.nlm.nih.gov/sra)根据文库的编号下载。
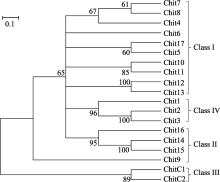
2 结果与分析2.1 水稻PR3家族的几丁质酶基因水稻PR3家族中有19个几丁质酶成员[ 33], 表1列出了这些几丁质酶编码基因的LOC号、注释和分子量, 水稻PR3家族几丁质酶蛋白质的分子量大都在30 kD左右, 最高为36.7 kD, 最低的为CHIT9, 只有15.3 kD (154个氨基酸)。用SMART软件预测几丁质酶的结构域(图1), 可以看出几丁质酶的主要结构域有N端的信号肽、几丁质结合域和催化域, 其中, CHITC1和CHITC2的催化域属于糖苷酶18家族, 而其余几丁质酶的催化域都属于糖苷酶19家族。需要指出的是, CHIT9中没有明显的几丁质结合域和催化域。Nakazaki等[ 9]曾将当时鉴定的12个水稻PR3几丁质酶划分了类别(Class), 在此基础上, 我们补充了新鉴定的7个几丁质酶, 将19个水稻PR3几丁质酶进行了分类(图2), 类别编号列于聚类图的右侧, 其中最初鉴定的12个水稻PR3几丁质酶的分类结果与原报道相同。从图2可见, 大部分编号相近的几丁质酶的相似度较高, 如CHIT7和CHIT8, CHIT10和CHIT11, CHIT12和CHIT13, CHIT2和CHIT3以及CHITC1和CHITC2等。其中CHITC1和CHITC2与其他几丁质酶的亲缘关系较远, 但整个PR3家族几丁质酶的相似度较高。属于Class I的几丁质酶有11个成员, 缺失几丁质结合域的Class II成员有CHIT14、CHIT15和CHIT16, 拥有糖苷酶18家族的催化域的Class III成员有CHITC1和CHITC2, 而CHIT1、CHIT2和CHIT3的催化域中有4段缺失, 它们组成了Class VI亚类。
2.2 几丁质酶基因的转录分析经由RNA-Seq分析获得了多个水稻组织(幼苗期地上部或叶片、穗部、花药及雌蕊、授粉后未成熟胚和胚乳等)的转录的FPKM数据(表2), 比较不同几丁质酶基因在参试组织中的转录强度可见,
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 水稻PR3家族几丁质酶的结构域Fig. 1 Predicted domains of rice PR3 family chitinases |
表1
Table 1
表1(Table 1)
| 表1 水稻PR3家族几丁质酶编码基因的相关信息 Table 1 Information of rice PR3 family chitinase genes |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 基于氨基酸序列同源性的水稻几丁质酶蛋白质聚类分析用Mega4.0进行系统树分析, 应用临近法构建, 并做2000次检验。分支上的数字为贝叶斯后验概率, 分支长度表示每个核苷酸的替代率, 对应每个位点0.1个估计的替换的标尺列于图的左上方。Fig. 2 Cluster analysis of rice chitinase proteins based on amino acid sequencesTree: Mega4.0, Neighbor-Joining, bootstrap=2000; Bayesian posterior probabilities are showed by number of branch; the length of branch represents the substitution rate of each nucleotide, estimated replacement corresponding scale shown in the upper left graph. |
Chit6的FPKM值最高, 表明其转录强度高, 其转录主要发生在穗部, 尤其是在雌蕊中, 而在其他组织中的转录强度较低, 该基因的转录呈现明显的组织特异性。 Chit12、 Chit13、 ChitC2和 Chit5在大部分
参试组织中都有一定的转录信号, 呈现组成型转录的特点。 Chit9在所有参试材料中都没有被检测到转录信号, 结合CHIT9的结构特征可以推测该基因具有某种特殊性。整体来看, 除 Chit6在穗部表达量较高外, 大部分 Chit基因在水稻苗期叶片和授粉后的种子或胚乳中表达量均较低。根据RNA-Seq提供的转录信息对几丁质酶也进行了聚类分析, 结果见图3。比较图2和图3结果可见, 2种方法聚类的结果有相似之处, 说明序列相似、进化关系较近的基因可能有相似的转录谱, 表达谱的相似性支持其功能上的互补性。
2.3 几丁质酶蛋白质在水稻叶片生长过程中的表达分析为了解水稻PR3家族几丁质酶蛋白质的表达特征, 我们制备了几丁质酶蛋白质特异的抗体, 采用免疫印迹技术分析了不同时期的水稻叶片, 检测到部分几丁质酶蛋白质在正常生长的水稻叶片中有表达(图4)。从图4可见, CHIT5在幼苗期的表达强度较高, 在15 cm幼苗及后续时期样品中均检测不到信号。CHIT6和CHIT11表现为随叶片生长表达强度逐步提高, 在开花期达到最高峰, 成熟期有所下降, CHIT14的表达上调在苗期即达到最高峰, 在以后的时期保持恒定, CHITC2的表达呈现逐步上升的特点, 到成熟期达到最高峰。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 基于转录谱的水稻PR3家族几丁质酶的聚类分析Shoot: 苗期地上部; 4-leaf: 四叶期; 20 d: 20 d叶片; Pre-E: 花序出现前; Post-E: 花序出现后; Anther: 花药; Pistil: 雌蕊; DAP: 授粉后天数; Em: 胚; En: 胚乳。Fig. 3 Cluster analysis of rice chitinase genes in PR3 family based on transcription dataPre-E: pre-emergence inflorescence; Post-E: pre-emergence inflorescence; DAP: days after pollination; Em: embryo; En: endosperm. |
表2
Table 2
表2(Table 2)
| 表2 水稻几丁质酶基因在不同组织中的FPKM数据 Table 2 FPKM value of rice chitinases genes at different tissue/organs | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
FPKM: 每百万被测到的外元中每一千碱基所含目标片段数; Pre-E: 花序出现前; Post-E: 花序出现后; DAP: 授粉后天数; Em: 胚; En: 胚乳。表中数据来源的文库编号: 苗期地上部叶片: SRR042529; 四叶期: SRX016110; 20 d叶片: OSN_AA; 花序出现前: OSN_AC; Post-E: 花序出现后: OSN_AB; 花药: OSN_AD; 雌蕊: OSN_AE; 授粉后5 d: OSN_AF; 授粉后10 d: OSN_AK; 胚: OSN_AG; 胚乳: OSN_AH。
FPKM: fragments per kilobase of exon per million fragments mapped; Pre-E: pre-emergence inflorescence; Post-E: post-emergence inflorescence; DAP: Days after pollination; Em: embryo; En: endosperm. Data derived from Libraries: Shoots: SRR042529;4-leaf: SRX016110;20 d: OSN_AA; Pre-E: OSN_AC; Post-E: OSN_AB; Anther: OSN_AD;Pistil:OSN_AE; 5DAP: OSN_AF; 10DAP: OSN_AK; Em: OSN_AG; En: OSN_AH.
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 水稻PR3家族几丁质酶蛋白质在叶片中的表达谱上部图片为相应CHIT特异抗体检测水稻叶片蛋白质的WB结果; 中部为用HSP抗体检测的WB结果(示样品的等量加样); 下部为采集3次WB数据, 计算平均值和方差绘制的折线图, 纵坐标为相对信号强度, 横坐标与泳道对应。泳道1~9分别代表水稻的苗期1 cm、2 cm、5 cm、10 cm和15 cm地上部, 分蘖期叶片、孕穗期叶片、开花期叶片和成熟期叶片的总蛋白质样品。Fig. 4 Expression patterns of rice PR3 family chitinase proteins in normal growth leavesUpper panels: WB detection of the expression of CHIT at different time points in rice leaves; Middle panels: WB detection of HSP expression in rice leaves to demonstrate equal loading; Lower panels: Lanes 1-9: Protein samples isolated from normal rice leaves at seedling stage (1 cm, 2 cm, 5 cm, 10 cm, and 15 cm), tillering stage, booting stage, flowering stage and mature stage, respectively. |
2.4 几丁质酶蛋白质在水稻抗白叶枯病过程中的表达白叶枯病是危害水稻生产最为严重的细菌性病害, 为了检测CHIT蛋白质在水稻抗病过程中的表达, 我们将白叶枯病菌接种到带有白叶枯病抗性基因 Xa21的转基因水稻4021叶片上。为了确证4021对白叶枯病菌的抗性反应, 我们在叶片接种后15 d, 量取叶片病斑长度, 发现4021的病斑长度在1 cm以下, 呈现典型的抗病反应, 而接种TP309后的病斑长度在18 cm以上, 呈现典型的感病特征, 同时接种蒸馏水的Mock对照没有明显的病斑, 水稻接种白叶枯病菌后的表型变化与我们以前的报道一致[ 24]。同时, 在接种后不同时间点取样, 提取总蛋白质进行WB分析(图5)。由图5可见, 随接种后时间的延长, CHIT1、CHIT2、CHIT5、CHIT6、CHIT10、CHIT15和CHIT16蛋白质都上调或诱导表达, 而CHIT14、CHITC1和CHITC2均下调表达。由图5还可看出, 可检测的蛋白质表达变化大都在接种后3 d或以上。二个属于Class III的几丁质酶蛋白质(CHITC1和CHITC2)都下调表达, 而其他Class的几丁质酶蛋白质大都上调表达。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 水稻PR3几丁质酶蛋白质在抗白叶枯病反应中的表达谱上部图片为相应CHIT特异抗体检测接种白叶枯病菌后不同时间点的水稻叶片蛋白质的WB结果; 中部为用HSP抗体检测的WB结果(示样品的等量加样); 下部为采集3次WB数据, 计算平均值和方差绘制的折线图, 纵坐标为相对信号强度, 横坐标与泳道对应。泳道1~9分别为接种后0 h、2 h、8 h和1 d、2 d、3 d、5 d、7 d、10 d的蛋白质样品。Fig. 5 Expression patterns of rice PR3 family chitinase proteins in the incompatible reactions between rice and XooUpper panels: WB detection of the expression of CHIT at different time points in the incompatible interaction between rice and Xoo; Middle panels: WB detection of HSP expression in rice leaves to demonstrate equal loading; Lower panels: plot of average and standard deviation among three repeats of WB analysis. Lanes 1-9: protein samples isolated from rice leaves at 0 h, 2 h, 8 h, 1 d, 2 d, 3 d, 5 d, 7 d, and 10 d after inoculation with Xoo, respectively. |
2.5 几丁质酶蛋白质在不同水稻- Xoo互作反应中的表达比较 比较几丁质酶蛋白质在3个时间点(0 h、3 d和5 d)在抗病(R: 4021-PXO99)、感病(S: 4021-PXO99 ΔraxST)和对照(M: 4021-H2O)反应中的表达表明(图6), 在抗病和感病反应中, 各几丁质酶蛋白质的表达具有相近的模式, 与Mock反应都有明显的区别, 且一般在感病反应中的变化程度高于抗病反应。有意思的是, CHIT6在Mock反应中的表达量表现上升, 说明其表达可能受创伤的诱导, 其他几丁质酶蛋白质表达量在Mock反应中表现一致, 说明这些蛋白质的表达不受创伤的诱导。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 PR3家族几丁质酶蛋白质在不同水稻- Xoo互作反应中的表达比较0 h、3 d和5 d为水稻接种白叶枯病菌后的时间点; R: 抗病反应; S: 感病反应; M: Mock对照。上部图片为用相应CHIT特异性抗体检测的WB结果; 中部为用HSP抗体检测的WB结果(示样品的等量加样); 下部为采集3次WB数据, 计算平均值和方差绘制的框图, 纵坐标为相对信号强度, 横坐标与泳道对应(实心柱、空心柱和线条柱分别表示R、S和M的数据)。Fig. 6 Expression comparison of rice PR3 family chitinases proteins among different rice- Xoo interactions0 h, 3 d, and 5 d were the time points post inoculation with Xoo; R: incompatible interaction; S: compatible interaction; M: mock control. Upper panels: WB detection of the expression of CHIT; Middle panels: WB detection of HSP expression in rice leaves to demonstrate equal loading; Lower panels: plot of average and standard deviation among three repeats of WB analysis (black bars, white bars and lined bars designate the data of R, S, and M, respectively). |
3 讨论有大量报道表明, 植物几丁质酶在抵抗生物或非生物逆境胁迫及生长发育过程中发挥作用。近年来, 经由几丁质与受体激酶的结合启动抗病信号传导途径的发现进一步激发了人们对几丁质酶研究的兴趣。水稻基因组序列的解析为在全基因组水平系统开展几丁质酶家族的研究提供了可能。
在完成水稻全基因组序列解析和基因预测及注释的基础上, 人们可以对不同基因家族的整体情况有更为全面的了解。通过系统的分析发现, 水稻的病程相关基因(PR)有900多个, 占全基因组编码基因的2%左右, 其中PR3为几丁质酶, 在水稻中注释为几丁质酶的基因共有19个[ 33]。根据基因组注释提供的几丁质酶氨基酸序列, 我们对几丁质酶进行了聚类分析, 进而对其蛋白质结构域进行了预测, 并将其划分为4个亚类。随着高通量测序技术的进步, 基于深度测序技术获得的转录谱数据更为灵敏、准确, 为转录谱的分析提供了重要的资源。本试验发现, 在正常生长的水稻组织中, 几丁质酶基因的转录是相当普遍的, 其转录也佐证了这些基因在正常发育过程中可能发挥功能。 Chit6在雌蕊中有很高的转录丰度, 是典型的组织特异性转录基因, 还发现了多个组成型转录的几丁质酶基因, 也注意到在所有参试材料中未检测到 Chit9表达。
基于氨基酸序列相似性和基于表达谱相似性的二种聚类分析表明, 二者间有一定的相似性, 前者可能来自进化过程中的关联, 后者可能支持其功能的互补性, 暗示亲缘关系相近的基因更可能有功能的互补性。随着转录谱数据的积累, 可能在更大范围上分析基因转录的关联, 从而获得其功能以及功能互补相关的线索。我们对PR3家族几丁质酶基因的分析可以说是进行了一个尝试。
检测水稻PR3家族几丁质酶蛋白质在正常生长及与白叶枯病菌互作的叶片中的蛋白质表达, 仅发现5个几丁质酶蛋白质在正常叶片中有表达, 而在水稻与 Xoo不亲和反应中, 有10个几丁质酶蛋白质的表达发生了变化, 其中CHIT1、CHIT2、CHIT5、CHIT10、CHIT15和CHIT16的表达都是受诱导后发生的, 多个几丁质酶的表达受白叶枯病菌接种的诱导, 提示它们在抗病反应中可能发挥作用。有3个几丁质酶蛋白质的表达在接种白叶枯病菌后下调, 它们是CHIT14、CHITC1和CHITC2, 提示它们可能发挥负调控的作用, 另外, CHITC1和CHITC2都属于ClassIII, 提示其表达下调可能是该类别几丁质酶的特征。有意思的是, CHIT6在对照(Mock)反应中表达上调, 可能是受创伤诱导的基因, 暗示其启动子与创伤的关联性。
我们试图分析转录和蛋白质表达数据的相关性, 但并没有发现二者的明显关联, 实际上, 转录和翻译是二个层面的调控机制, 有大量的数据揭示了二者的独立性。从转录和蛋白质表达特征都可以看出, 水稻几丁质酶在正常生长发育中可能发挥作用, 在水稻- Xoo互作过程中可能发挥作用。但值得指出的是, 在水稻中并没有发现几丁质, 几丁质也不是白叶枯病菌这类细菌的组成成分, 那么在水稻正常生长中几丁质酶的底物是什么?其功能又是通过什么方式发挥的呢?已经鉴定的水稻 bc15基因编码几丁质酶(Os09g32080, 本文中 Chit13), 该基因也呈组成型表达, 但体外表达的蛋白质没有检测到几丁质酶活性[ 18], 深入开展酶学分析将有助于了解其功能的生化机理。
本文制备了水稻PR3家族几丁质酶蛋白质的抗体, 并用免疫印迹揭示了其在不同条件下的蛋白质表达谱。这种基于抗体的策略[ 35]可以对特定目标蛋白质开展研究, 其灵敏度较高。此外, 这些抗体也将是几丁质酶蛋白质定位、免疫沉淀等研究的重要资源。
本研究对水稻PR3家族的19个成员的聚类分析、结构域分析和亚类划分, 并根据深度测序获得的转录数据鉴定了组成型和组织特异型转录的基因, 在此基础上调查了正常生长和收白叶枯病菌侵染后的水稻叶片中的蛋白质表达特征, 发现随水稻的生长发育CHIT6、CHIT14、CHITC1、CHITC2为上调表达, CHIT5为下调表达; 在水稻与 Xoo互作中CHIT1、CHIT2、CHIT5、CHIT6、CHIT10、CHIT15和CHIT16蛋白质为上调表达, CHIT14、CHITC1和CHITC2为下调表达, 另外, CHIT6的表达可能受创伤诱导。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] |
