
*通讯作者(Corresponding author): 郭秀林, E-mail:myhf2002@163.com 收稿日期:2013-12-13 基金:
摘要
关键词:玉米; 热激转录因子ZmHSF-Like; 逆境胁迫; H2O2信号; Ca2+信号
Signal Transduction Pathway of
LI Hui-Cong, LI Guo-Liang, GUO Xiu-Lin

Fund:
Abstract
Keyword:Maize; ZmHSF-Like; Stresses; H2O2signal; Ca2+ signal transduction
Show Figures
Show Figures







热激转录因子(HSF)能够通过结合热激蛋白基因启动子区的热激元件(HSE)来调控热激蛋白基因的表达, 在传递逆境信号尤其是热胁迫以及在提高植物抗逆性方面起重要调控作用[ 1, 2, 3, 4, 5, 6]。热激转录因子在植物中普遍存在, 首个植物HSF基因来自番茄[ 7], 随后在拟南芥、大豆、玉米、豌豆、向日葵、水稻和小麦等植物中都发现有 HSF基因成员的存在[ 8, 9, 10, 11, 12, 13, 14, 15]。与其他生物体相比, 植物中的 HSF是一个多基因家族, 在模式植物中研究较为深入。Lin等[ 16]报道玉米中至少有25个HSF基因, 电子表达谱结果显示这些基因在玉米不同组织器官中呈现不同的表达模式, 暗示出该家族成员功能的复杂性和多样性, 但对它们的具体功能没有进一步报道。在玉米花粉发育的不同时期至少有3个HSF基因表达, 其中1个是组成型表达, 另外2个受热胁迫诱导表达[ 17]。
在前人报道的基础上, 本实验室前期通过同源克隆的方法, 从玉米叶片中获得一个新的热激转录因子基因 ZmHSF-Like[ 18], 该基因开放阅读框共包含1404 bp核苷酸序列, 编码467个氨基酸残基, 该序列包含典型的HSF家族DNA结合结构域。通过基因枪法在洋葱内表皮瞬时表达融合蛋白发现, 该基因定位在细胞核, 具有一段包含氨基酸KKRR的核定位信号(NLS)。实时荧光定量PCR结果进一步表明, 正常生长条件下 ZmHSF-Like基因在玉米叶片、茎部和根系均有表达, 其中在根系表达量最高, 叶片次之, 而茎部表达量较低。42℃热胁迫、PEG-6000和外源ABA处理均能上调该基因的表达, 热胁迫和ABA处理效果更显著。初步表明, ZmHSF-Like可能介导多种逆境胁迫的响应反应。
研究表明, 植物体内存在多种应答逆境胁迫的信号转导途径, 钙-钙调素途径是目前研究最为清楚的一条热激信号转导途径, 不仅如此, 钙信号还参与对诸如干旱、ABA、冷害等多种逆境胁迫的响应[ 19, 20]。近年来越来越多的研究发现, H2O2作为信号分子, 也参与多种逆境胁迫的响应过程, 甚至认为热胁迫与氧胁迫之间存在交叉反应[ 21, 22, 23, 24]。本研究在前期工作的基础上, 进一步探讨基因 ZmHSF-Like对不同逆境胁迫响应的可能信号途径, 并明确其结合的下游热激蛋白, 以期为全面深入揭示其生物学功能奠定理论基础。
1 材料与方法1.1 幼苗培养选取玉米自交系H21种子(由河北省农林科学院遗传生理研究所玉米育种室提供), 表面消毒后用自来水反复冲洗, 浸泡12 h后将其播至Hoagland营养液中, 于28℃培养箱中暗培养。待玉米长到二叶一心期时, 进行胁迫处理。以28℃条件下正常生长的植株为对照。
1.2 幼苗处理选取生长一致的二叶一心期玉米幼苗: (1)置含10 mmol L-1 H2O2的Hoagland营养液中[ 25]; (2)置含 5 mmol L-1 Ca2+的Hoagland营养液中[ 26]; (3)在含 150 µmol L-1的H2O2抑制剂DPI + 20 mmol L-1 H2O2清除剂DMTU的Hoagland营养液中预处理2 h[ 25]; (4)在含120 µmol L-1钙通道阻断剂Vp + 3 mmol L-1钙离子螯合剂EGTA的Hoagland营养液中预处理2 h[ 26]。
(3)和(4)完成后, 再对幼苗分别进行如下处理: (1)置42℃培养箱中进行热胁迫; (2)移至含20% PEG-6000的Hoagland营养液中进行干旱胁迫; (3)移至含200 μmol L-1 ABA的Hoagland营养液中[ 27]。分别在处理后不同时间点剪取第2片展开叶, 液氮中速冻, 提取总RNA。每个样本取3个重复。
1.3 总RNA提取与cDNA合成采用华舜生物工程公司生产的RNArose Reagent Systems, 按照该公司提供的步骤提取叶片总RNA, 用DNase I (TaKaRa)处理总RNA以除去残留的基因组DNA。取1 μg纯化的总RNA合成cDNA第一链(Invitrogen, Carlsbad, CA, USA)。通过NanoDrop ND-2000分光光度计测定RNA含量(Thermo Scientific, Waltham, MA, USA)。
1.4 实时荧光定量PCR根据 ZmHSF-Like基因序列设计特异性引物(正向引物: 5′-ACATGTCGTCTAACCAAGTGCCCA-3′; 反向引物: 5′-ACCAAGTCTGCCAGAGCTGAGAAT-3′), 根据玉米 β-actin设计内参特异性引物(正向引物: 5′-TGTCCATCACTTGTGAAGCCTCCT-3′; 反向引物: 5′-ACGACCTTAGCCAATATCGCACCA-3′)。按照SYBR Green RT-PCR试剂盒说明书配制PCR反应液, 其总体积20 µL, 含SYBR Premix Ex Taq II 10 µL、10 µmol L-1 forward primer 0.8 µL、10 µmol L-1 reverse primer 0.8 µL、1st strand cDNA 1 µL和ddH2O 7.4 µL。在7500 Real-time PCR System (Applied Biosystems, Carlsbad, CA, USA)上设定反应程序进行反应, 反应程序为预变性95℃, 10 min; 变性95℃, 15 s, 退火/延伸60℃, 1 min, 45个循环。设3个定量分析重复, 用Microsoft Excel分析数据, 计算标准误差。
1.5 热激蛋白基因引物合成及定量分析选取4种玉米热激蛋白, 即HSP701、HSP702、HSP704和HSPeu701 (均由本实验室前期克隆获得), 其引物序列见表1。
表1
Table 1
表1(Table 1)
| 表1 选取的热激蛋白及其定量PCR引物 Table 1 HSPs used in experiment and their primer pairs for real-time PCR |
采用实时荧光定量PCR测定。反应总体积20 µL, 含SYBR Premix Ex Taq II 10 µL、10 µmol L-1 forward primer 0.8 µL、10 µmol L-1 reverse primer 0.8 µL、1st strand cDNA 1 µL和ddH2O 7.4 µL。同样在7500 Real-time PCR System (Applied Biosystems, Carlsbad, CA, USA)上设定反应程序进行反应, 反应程序为预变性95℃ 10 min, 变性95℃ 15 s, 退火/延伸60℃ 1 min, 45个循环。
2 结果与分析2.1 单独H2O2诱导对 ZmHSF-Like基因表达的影响 将玉米幼苗置含10 mmol L-1 H2O2的Hoagland营养液中处理, 发现(图1)叶片 ZmHSF-Like基因表达呈先升后降的趋势, 90 min时最大, 之后逐渐降低。表明H2O2处理能上调 ZmHSF-Like基因的表达水平。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 10 mmol L-1 H2O2处理对玉米幼苗 ZmHSF-Like基因表达的影响Fig. 1 Effect of 10 mmol L-1 H2O2 treatment on gene ZmHSF-Like expression of maize seedlings |
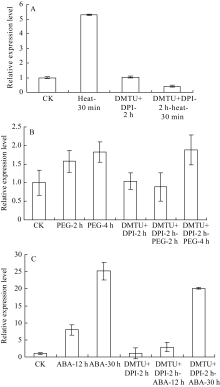
2.2 H2O2抑制剂和清除剂处理对 ZmHSF-Like基因表达的影响 由图2-A可见, 单独42℃热激30 min能显著上调 ZmHSF-Like基因的表达, 抑制剂和清除剂预处理2 h后, ZmHSF-Like基因表达与正常对照差异不明显, 此时再热激30 min并不能诱导 ZmHSF-Like基因表达量升高, 而是显著低于单独42℃热胁迫, 甚至低于正常表达水平。表明清除H2O2后, 42℃热激处理不能上调 ZmHSF-Like基因的表达。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 H2O2抑制剂DPI和清除剂DMTU预处理玉米幼苗后不同逆境胁迫对 ZmHSF-Like基因表达的影响A: DPI和DMTU预处理2 h后再进行42℃热胁迫; B: DPI和DMTU预处理2 h后再进行20% PEG-6000渗透胁迫; C: DPI和DMTU预处理2 h后再用200 μmol L-1 ABA处理。Fig. 2 Effect of abiotic stresses on gene ZmHSF-Likeexpression after pretreated with both 150 µmol L-1 DPI and 20 mmol L-1 DMTU in maize seedlingsA: Treated under 42℃ heat shock after pretreated with DPI and DMTU for 2 h; B: Treated with 20% PEG-6000 after pretreated with DPI and DMTU for 2 h; C: Treated with 200 μmol L-1 ABA after pretreated with DPI and DMTU for 2 h. |
图2-B显示, 类似于单独PEG-6000处理, 幼苗经H2O2抑制剂和清除剂共同预处理2 h, 再用PEG-6000处理2 h和4 h均能诱导叶片 ZmHSF-Like基因表达量升高, 4 h的表达量接近单独PEG-6000胁迫处理, 清除H2O2并不影响PEG-6000上调 ZmHSF-Like基因的表达。
幼苗经H2O2抑制剂和清除剂共同预处理2 h, 再用ABA处理, 结果发现(图2-C): ZmHSF-Like基因的表达量也随ABA处理时间延长而升高, 但在ABA诱导12 h和30 h时基因的表达量均显著低于单独ABA处理, 清除H2O2部分抑制ABA上调 ZmHSF-Like基因的表达水平。
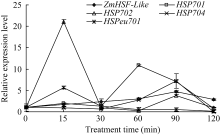
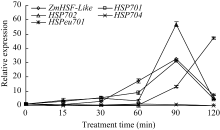
2.3 H2O2诱导对下游热激蛋白基因表达的影响 从选取的4个玉米热激蛋白基因定量表达结果发现(图3), H2O2处理120 min内, 热激蛋白基因 HSP702和 HSPeu701在处理15 min时出现表达高峰, 其他时间点基因表达量接近或低于正常水平; 基因 HSP701和 HSP704表达量呈现出随处理时间的延长逐步升高的趋势, HSP701在处理60 min时达到最高, 之后随胁迫时间延长而降低, 其最大值出现的时间早于 ZmHSF-Like基因, 而 HSP704在处理90 min时达到最大, 与 ZmHSF-Like基因表达同步。
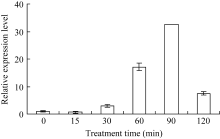
2.4 外源Ca2+诱导对 ZmHSF-Like基因表达的影响 单独用5 mmol L-1外源Ca2+处理也能诱导 ZmHSF-Like基因表达量的提高, 且随着处理时间的延长表达量逐步升高, 在处理90 min时达到最大值, 表达水平约为正常表达量的33倍(图4)。表明外源Ca2+处理能显著上调 ZmHSF-Like基因的表达。
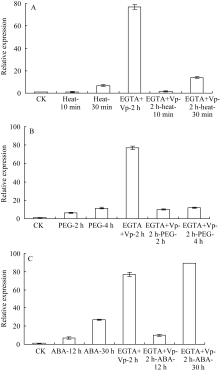
2.5 钙通道阻断剂和Ca2+螯合剂处理对 ZmHSF- Like基因表达的影响 从图5发现, 用钙通道阻断剂和Ca2+螯合剂联
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 10 mmol L-1 H2O2处理对玉米不同热激蛋白基因 表达的影响Fig. 3 Effect of 10 mmol L-1 H2O2treatment on expressions of HSP genes of maize seedlings |
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 5 mmol L-1 Ca2+诱导对玉米幼苗 ZmHSF-Like基因 表达的影响Fig. 4 Effect of 5 mmol L-1 Ca2+treatment on gene ZmHSF-Likeexpression of maize seedlings |
合处理2 h可大幅度提高 ZmHSF-Like基因的表达水平。与单独42℃热处理相比, 用钙通道阻断剂和Ca2+螯合剂联合预处理2 h再进行42℃热处理, 30 min时 ZmHSF-Like基因的表达并没有降低。表明抑制胞外Ca2+内流并不影响42℃热激上调的 ZmHSF-Like基因的表达。
与单独PEG-6000处理相比, 用钙通道阻断剂和Ca2+螯合剂联合预处理2 h再进行PEG-6000处理2 h和4 h时, ZmHSF-Like表达没有发生明显变化, 抑制胞外Ca2+内流不影响PEG-6000胁迫诱导基因的表达。
与单独ABA处理相比, 用钙通道阻断剂和钙离子螯合剂联合预处理2 h再进行ABA处理, 基因表达水平显著升高, 尤其是处理30 h时基因的表达量升高2倍多, 抑制胞外钙离子内流反而促进ABA诱导的 ZmHSF-Like基因的表达。
2.6 Ca2+诱导对下游热激蛋白基因表达的影响 从选取的4个热激蛋白基因的表达结果发现, Ca2+处理120 min内, 热激蛋白基因 HSP701和 HSP702均呈现随处理时间延长表达量先逐渐升高后降低的趋势, 在处理90 min达到最高值, 与 ZmHSF-Like基因的表达同步; 热激蛋白基因 HSPeu701在处理 60 min之内表达量变化不明显, 之后随处理时间延长呈逐步升高趋势; 与上述3个蛋白基因表达变化相比, 热激蛋白基因 HSP704在整个处理期间表达量变化不明显(图6)。
3 讨论3.1 玉米热激转录因子基因 ZmHSF-Like 对不同逆境胁迫响应的信号途径 植物对逆境的反应是一个多基因控制的复杂过程, 植物抗逆性不能依靠一两个蛋白或基因来解决,而研究植物抗逆调控基因或植物信号转导途径更有意义。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 钙通道阻断剂Vp和Ca2+螯合剂EGTA预处理玉米幼苗后逆境胁迫对 ZmHSF-Like基因表达的影响A: Vp和EGTA预处理2 h后再进行42℃热胁迫; B: Vp和EGTA预处理2 h后再进行20% PEG-6000渗透胁迫; C: Vp和EGTA预处理2 h后再用200 μmol L-1 ABA处理。Fig. 5 Effect of abiotic stresses on gene ZmHSF-Likeexpression after pretreated with 3 mmol L-1 EGTA and 120 mmol L-1 Vp in maize seedlingsA: Treated under 42℃ heat shock after pretreated with Vp and EGTA for 2 h; B: Treated with 20% PEG-6000 after pretreated with Vp and EGTA for 2 h; C: Treated with 200 μmol L-1 ABA after pretreated with Vp and EGTA for 2 h. |
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 5 mmol L-1 Ca2+处理对玉米不同热激蛋白基因表达的影响Fig. 6 Effect of 5 mmol L-1Ca2+ treatment on expression of HSP genes in maize seedlings |
热激转录因子(HSF)能够通过结合热激蛋白基因启动子区的热激元件(HSE)来调控热激蛋白基因的表达, 在传递逆境信号尤其是热胁迫以及在提高植物抗逆性中起重要调控作用[ 2, 5]。因此热激诱导的热激基因表达是由HSF参与的, HSF的活性调节是热激基因表达转录调节的中心机制[ 19]。不仅如此, 近年来研究发现, 对氧化还原状态敏感的HSF还是植物中一类重要的H2O2感受因子。在果蝇和哺乳动物细胞中, HSF体内或体外的寡聚化和DNA结合都可被热和H2O2诱导, 因此认为HSF可直接充当热和H2O2的感受因子[ 21, 22, 23]。Davletova等[ 24]第一次通过遗传证据提出, HSF是植物重要的H2O2的感受因子, 并且认为 HSF21/AtHsfA4a是一个很好的候选因子。热激转录因子 AtHSFA2在联系热和氧化胁迫信号反应中具有重要的作用[ 28]。另有研究表明, Ca2+-CaM信号转导系统在植物对环境信号(诸如干旱、ABA、盐害、冷害等)的感受、转导和响应过程中起重要作用[ 19], Ca2+对HSF激活的功能是特异的,可代替热激激活HSF的DNA结合活性, CaM在热激信号转导中的作用通过激活HSF的DNA结合活性实现[ 20]。上述研究均显示出HSF与H2O2和Ca2+之间存在密切联系。
本研究结果表明, H2O2处理能显著上调 ZmHSF- Like基因的表达, 42℃热激上调 ZmHSF-Like基因的表达依赖于H2O2的存在, ABA上调基因表达部分依赖于H2O2的存在, 而PEG-6000诱导基因表达不依赖于H2O2的存在。初步表明, ZmHSF-Like基因通过H2O2信号途径实现对热激和ABA胁迫的响应。Dang等[ 25]在水稻上的研究也表明, ABA对 OsHSF基因的诱导作用是通过ABA诱导产生的H2O2而实现的。这一点上我们的观点相一致。
本研究结果显示, 外源Ca2+处理也能上调 ZmHSF-Like基因表达, 但阻断和螯合胞外Ca2+并不能降低上述逆境胁迫上调的 ZmHSF-Like基因的表达, 似乎表明42℃热激、PEG-6000和ABA上调基因的表达均不通过Ca2+信号转导途径。作为Ca2+信号, Ca2+来源包括胞外Ca2+内流和胞内Ca2+库释放两种方式, 二者均可诱发Ca2+信号产生。本研究通过钙通道阻断剂和Ca2+螯合剂只是阻断了胞外Ca2+内流, 此时热激、PEG-6000和ABA胁迫同样能诱导 ZmHSF-Like基因的表达, 是否是通过胞内Ca2+库释放引发Ca2+信号途径还需要进一步的证据。事实上, 本实验室前期的研究表明, PEG-6000和ABA能显著诱导玉米根系细胞质膜电压门控性Ca2+通道打开, 引起胞外Ca2+内流, 从而引发一系列抗旱性生理生化反应[ 29]。从这一点分析, 我们认为PEG-6000上调 ZmHSF-Like基因表达应该通过Ca2+信号途径, 关于这一点需要通过胞内Ca2+的亚细胞分布加以证明。
本研究结果显示, 与正常对照相比, H2O2抑制剂和清除剂处理后 ZmHSF-Like基因的表达变化不明显, 而钙通道阻断剂Vp和Ca2+螯合剂EGTA处理能大幅度提高基因的表达, 这可能是化学试剂本身刺激造成的, 类似现象也出现在我们前期抗旱生理生化研究中[ 29]。尽管如此, 我们的研究充分表明, ZmHSF-Like基因通过不同的信号转导途径参与多种外界刺激的胞内响应过程, 也进一步证明玉米热激转录因子家族功能的多样性。
3.2 ZmHSF-Like结合的下游热激蛋白热激转录因子要行使其调控功能, 只有与热激蛋白基因的活性元件结合并加以调节, 才能实现对相关基因表达的调控[ 19]。因此, 热激蛋白基因的表达理论上应与HSF的表达同步或稍有滞后。本研究结果中, H2O2处理时间范围内, 热激蛋白基因 HSP704的表达与 ZmHSF-Like基因的表达同步, 初步表明HSP704可能是该途径中 ZmHSF-Like结合的下游热激蛋白。单独Ca2+诱导处理, 热激蛋白基因 HSP701、 HSP702和 HSPeu701的表达均与 ZmHSF-Like基因的表达同步, 这些热激蛋白可能是 ZmHSF-Like基因响应Ca2+反应的下游结合蛋白。 ZmHSF-Like是否与上述热激蛋白结合还可以通过酵母双杂交试验等进一步验证。本研究至少表明, ZmHSF-Like基因可能通过与下游不同热激蛋白的结合实现对不同逆境胁迫的响应, 也进一步证明玉米热激转录因子家族功能的复杂性。
4 结论H2O2和外源Ca2+处理均能上调 ZmHSF-Like基因转录的表达。 ZmHSF-Like基因通过H2O2信号途径实现对42℃热激和ABA胁迫的响应。热激蛋白HSP704是H2O2途径中 ZmHSF-Like结合的下游热激蛋白, 而热激蛋白HSP701、HSP702和HSPeu701可能是 ZmHSF-Like基因响应Ca2+反应的下游结合蛋白。ZmHSF-Like通过与下游不同热激蛋白的结合实现对不同逆境胁迫的调控。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] |
