* 通讯作者(Corresponding author): 刘炜, E-mail:wheiliu@163.com, Tel: 0531-83179572 收稿日期:2013-12-14 基金:
摘要
关键词:花生; SOS2类基因AhSOS2; 荧光定量PCR; 表达特性; 抗逆; 品质改良
Cloning and Functional Characterization of Peanut Gene
ZHANG Guo-Jia
Fund:
Abstract
Keyword:Peanut; SOS2 gene AhSOS2; Quantitative real-time PCR; Expression pattern; Stress resistance; Quality improvement
Show Figures
Show Figures






















土壤盐渍化是严重影响农作物生长和生态环境的非生物胁迫因素之一[ 1]。植物在生长过程中经常会受到高盐等不良环境影响, 导致植物水分亏缺, 进一步产生离子毒害及渗透胁迫, 从而影响植物的生长发育, 严重时会导致植物死亡[ 2]。植物在响应及适应盐胁迫的过程中, 形成了一系列调控机制[ 3], 如渗透调节、离子区域化、活性氧清除等。其中, 胁迫信号的感知和转导是引起植物产生理化响应及发生变化的关键步骤。SOS (salt overly sensitive)信号转导途径作为植物耐盐性相关的重要信号转导途径之一, 在模式植物拟南芥中已有较深入的研究。且已有证据证明, SOS信号途径除参与植物盐胁迫响应及抗逆过程外, 还可以和其他信号途径交叉成网络来共同发挥对不同生物学过程的调控作用[ 4, 5]。SOS信号途径首先由朱健康等报道, 他们利用快中子轰击(fast neutron bombardment)、T-DNA诱变以及化学突变(如EMS诱导)等方法, 创制了大量的拟南芥( Arabidopsis thaliana)突变植株, 从中筛选获得了5组盐敏感SOS突变体, 并进一步鉴定了5个SOS信号通路的基因, 即 AtSOS1、AtSOS2、AtSOS3、AtSOS4和 AtSOS5[ 6, 7, 8, 9, 10, 11, 12, 13, 14]。其中 SOS2是拟南芥中重要的耐盐基因之一[ 9]。 SOS2对调控植物细胞中Na+、K+平衡具有重要作用, 对环境中高浓度的Na+和低浓度的K+非常敏感, 其相关突变体缺乏对盐胁迫的耐受性。拟南芥中 AtSOS2基因位于5号染色体上, 预期编码丝氨酸/苏氨酸蛋白激酶, 其N-末端催化位点与酵母SNF1激酶和哺乳动物的AMPK激酶非常相似, 在盐胁迫下, 该基因在拟南芥根中表达明显被促进[ 9]。植物在受到高盐胁迫时, SOS信号通路中的SOS3作为Ca2+感受器, 能够激活体内的SOS2蛋白激酶, 并与SOS2结合形成SOS3-SOS2蛋白激酶复合物, 通过磷酸化激活SOS1, 使细胞膜上的Na+/H+逆向转运蛋白发挥作用, 将体内的Na+排出体外, 维持体内的离子平衡[ 15]。Hu等[ 16]从苹果中分离到CIPK基因 MdSOS2, 通过序列比对和系统进化树分析, 显示该基因与拟南芥中 AtSOS2基因相似性很高, 且该基因受盐胁迫诱导, 酵母双杂交试验证明, MdSOS2蛋白N-端可分别与 MdSOS3和 AtSOS3相互作用, 从而共同调控苹果的耐盐性。Quan等[ 17]通过质壁分离和GFP染色技术, 证明了SOS3的同系物SCABP8/CBL10可与SOS2蛋白激酶相互作用, 且SCABP8与SOS2还可共同激活SOS1, 从而协同作用以提高拟南芥幼苗的耐盐性。
花生( Arachis hypogaea L .)作为一种重要的经济和油料作物, 其产量和品质与人类生活密切相关[ 18, 19]。花生主要生长于干旱和半干旱地区, 对较低的叶片水势具有一定的耐受性[ 20]。在长期的恶劣环境及进化过程中, 其体内形成了一定的防御系统, 并选择性地积累了部分胁迫抗性基因, 在植株维持生命力及对逆境的适应中发挥了重要作用。然而, 目前有关花生耐盐抗逆及其在胁迫下体内离子稳态调节及适应机制的报道仍较少[ 21]。因此, 利用现代生物技术, 发掘花生抗逆相关基因并开展抗逆转基因育种具有非常重要的意义。本研究在以往对抗性SOS2类基因相关报道的基础上, 通过设计简并引物, 并结合5′Race和3′Race的方法, 从花生叶片中分离获得基因 AhSOS2, 进一步利用荧光定量PCR技术, 对正常生长及胁迫处理后的花生幼苗中 AhSOS2的表达特性进行了研究, 结果显示 AhSOS2的表达受盐害、干旱等胁迫诱导, 暗示该基因在抗盐及抗旱过程中具有一定生物学功能。同时, 通过构建 AhSOS2的植物表达载体获得了部分转基因水稻材料, 对基因功能的初步研究结果显示该基因在抗盐、抗逆过程中具有一定作用。这方面的研究成果, 预期将为揭示 AhSOS2参与耐盐及抗旱过程及其调控机制, 进而完善逆境下花生生长的防御网络构建, 及花生抗性育种和品质改良提供指导。
1 材料与方法1.1 试验材料将花生( Arachis hypogaea L.)品种鲁花14的种子置培养皿中, 光照16 h、25℃和黑暗8 h、20℃条件下浸泡2 d, 萌发后播于盛有沙石的花盆中, 充分浇水, 在温度25℃和相对湿度80%的条件下, 于温室培养15 d, 分别取生长一致的材料, 以浇灌及喷施的方式处理。(1)以30% PEG-6000模拟干旱, 分别处理0、3、6、12、24和48 h; (2)以250 mmol L-1 NaCl分别处理0、3、6、12、24和48 h。取每种处理的根、茎、叶、花、果针各0.2 g (其中花和果针取自大田生长植株), 经液氮速冻后, 保存于-80℃冰箱备用。
cDNA Synthesis Kit (D6210A TaKaRa)和DNA Purification Kit (DV805A TaKaRa), 均购自大连TaKaRa公司; 高纯质粒回收试剂盒(DP1002 Bio Teke)购自北京百泰克生物技术有限公司; 大肠杆菌Trans DH5α感受态细胞购自北京全式金生物技术有限公司; 引物由上海捷瑞生物工程有限公司合成及山东省农业科学院生物技术研究中心测序。
用于基因扩增的简并引物为AhSOS2j1: 5′-CAGATHAAAAGRGAGATATCNATHATGAA-3′及AhSOS2j2: 5′-GATARKGYAATCATCTCRAANGC ATTCAT-3′; 用于扩增 AhSOS2基因全长的引物为AhSOS21: 5′-GGTACCTAGATTAGCCGTTAGCGTTG T-3′及AhSOS22: 5′-TCTAGACTGGATCATACAGT CATTTGTCG-3′ (下画线分别表示 KpnI和 XbaI酶切位点), 用于5′ RACE扩增的2条嵌套引物为AhSOS25I: 5′-ACCGGAACATAGTTTCTCCTGAAC C-3′和AhSOS25O: CATTATCAAAGGACCTCCCTC AGTAC-3′, 用于3′ RACE扩增的2条嵌套引物为AhSOS23I: 5′-GAGGTGCTAGGCAATCAAGGTTAT G-3′和AhSOS23: 5′-CGGATTGAGTGCATTGAC AAAGC-3′; 用于Real-time PCR的引物为Real-R: 5′-CACAGAGACTTGAAGCCT-3′及Real-F: 5′-GGA GAACATCAACACCCT-3′; 以 Actin为内对照, 其引物序列为P677F: 5′-GTCATCGTCATCCTCTTCTC-3′和P677R: 5′-CATTCCTGTTCCATTGTCAC-3′。
1.2 花生RNA的提取及单链cDNA合成参照SDS法[ 22]提取花生RNA, 参照cDNA Synthesis Kit (D6210A TaKaRa)合成单链cDNA, 具体操作详见其说明书。
1.3 AhSOS2基因简并序列的克隆参考已发表的拟南芥 SOS2基因序列, 结合检索NCBI (http://www.ncbi.nlm.nih.gov/blast/)数据库, 获得不同物种中SOS2类基因序列信息, 其中包括: 大豆( Glycine max)中的 GmSOS2(GenBank登录号为XP_003549757), 胡杨( Populus euphratica)中的 PeSOS2(GenBank登录号为ACN76476), 蓖麻( Ricinus communis)中的 RcSOS2(GenBank登录号为XP_002524508), 葡萄( Vitis vinifera)中的 VvSOS2(GenBank登录号为XP_002285262), 芥菜( Brassica juncea)中的 BjSOS2(GenBank登录号为ABM66448), 毛果杨( Populus trichocarpa)中的 PtSOS2(GenBank登录号为XP_002324651), 百脉根( Lotus japonicus)中的 LjSOS2(GenBank登录号为BAD95978); 参考以上SOS2类基因的氨基酸序列并设计简并引物, PCR反应条件为94℃ 3 min; 之后94℃ 30 s、50℃ 30 s、72℃ 1 min、共30个循环; 最后72℃ 10 min; 初步获得 AhSOS2的EST序列。对扩增产物的测序结果进行BlastX分析, 以验证结果的正确性。
1.4 AhSOS2基因3°端和5°端序列的获得 在获得 AhSOS2基因EST序列的基础上, 分别设计5′Race和3′Race特异性引物, 参照试剂盒5′-Full RACE Kit (Code D315, TaKaRa)及3′-Full RACE Core Set (Code D314, TaKaRa)说明书扩增 AhSOS2的5′末端和3′末端, 利用CAP3软件拼接ESTs片段, 获得 AhSOS2基因电子拼接序列。
1.5 AhSOS2基因全长序列的获得 以花生叶片提取的RNA反转录获得的单链cDNA为模板, 以参照电子拼接获得的 AhSOS2全长序列设计的特异性引物AhSOS21和AhSOS22进行PCR扩增, 获得 AhSOS2基因的全序列, PCR反应条件为, 94℃ 3 min; 之后94℃ 30 s、56℃ 30 s、72℃ 1.5 min、共35个循环; 最后72℃ 10 min。将扩增产物进行测序和BlastX比对, 同时比对分析推导出的氨基酸序列与来源于其他物种的SOS2类基因的相应氨基酸序列。
1.6 实时荧光定量PCR对基因的表达模式分析分别提取花生根、茎、叶、花、果针的总RNA, 利用cDNA Synthesis Kit试剂盒反转录成单链cDNA, 根据获得的 AhSOS2基因全长序列, 设计荧光定量PCR特异性引物Real-R及Real-F, 以 Actin作为内对照, 反应在ABI PRISM 7900HT (Applied Biosystems)荧光定量PCR仪上进行, 反应体系为20 μL, 参考FastStart Universal SYBR Green Master (Rox) (13135900罗氏)说明书, 反应条件为95℃ 10 min; 95℃ 10 s; 60℃ 20 s; 72℃ 20 s; 40个循环。按照2-ΔΔCT法计算基因的相对表达量。用实时荧光定量PCR法分析花生 AhSOS2基因的组织表达模式、盐胁迫及干旱胁迫下的表达特性。
1.7 AhSOS2植物双元表达载体的构建及转化1.7.1 植物表达载体的构建 将PCR获得的 AhSOS2基因全长序列, 与在商业化载体pCAMBIA 1301基础上外源添加CaMV35S启动子及NOS终止子改造获得的植物表达载体pCAMBIA1301P[ 23], 分别用 KpnI和 XbaI双酶切, 回收酶切片段, 用T4DNA连接酶连接, 获得重组质粒, 命名为pCAMBIA 1301P- AhSOS2, 并测序验证。
1.7.2 水稻的遗传转化 将构建好的含有目的基因的植物表达载体pCAMBIA1301P- AhSOS2, 经液氮冻融法[ 24]导入根癌农杆菌LBA4404所制备的感受态细胞中, 通过PCR鉴定阳性克隆。参照刘巧泉等[ 25]的方法对水稻中花11愈伤组织进行遗传转化, 经共培养及抗性筛选, 目前已获得部分转基因水稻, 并对其功能进行初步分析。
1.8 转基因植株的组织化学染色及PCR鉴定1.8.1 GUS组织化学染色 按照Jefferson[ 26]的方法进行GUS组织化学染色分析。选取2~3 cm T1代转基因水稻叶片浸泡在预先配制好的GUS染液里, 37℃保温、染色过夜, 之后用75%乙醇脱色至阴性对照为白色, 于体视显微镜(LEICA S-系列)下观察染色结果, 照相并记录。
1.8.2 转基因植株的PCR检测 以经GUS组织化学染色筛选获得的阳性转基因植株为材料, 利用CTAB[ 27]法提取基因组DNA, 以其为模板, 以AhSOS21和AhSOS22为引物进行PCR, 确认转基因水稻。
1.9 转基因水稻对盐胁迫的耐受性检测为了测试转基因水稻对盐胁迫的耐受性, 挑取籽粒饱满的T1代转基因水稻种子, 黑暗下于培养皿中浸种2~3 d, 之后将萌动的种子移入放有水稻培养液的纸杯中, 于28℃, 16 h光照, 8 h黑暗条件下培养, 待生长7 d后, 水稻幼苗长至三叶期时分别进行0、100和250 mmol L-1 NaCl处理, 以相同处理条件下未转基因的水稻为对照, 对比观察转基因水稻和对照在盐胁迫条件下的生长状况, 及叶片的持绿性、萎蔫情况和根生长状况的异同, 并拍照记录。
2 结果与分析2.1 AhSOS2简并序列的克隆 以花生叶片提取的总RNA反转录的单链cDNA为模板, 以简并引物AhSOS2j1和AhSOS2j2对 AhSOS2的简并区域进行扩增, 获得PCR产物长度为780 bp, 与预期的大小一致(图1)。
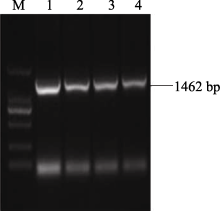
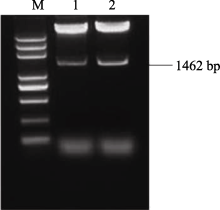
2.2 AhSOS2基因全长序列的克隆及分析 以所获得的 AhSOS2简并区序列为模板, 利用cDNA末端快速克隆技术, 设计5′ RACE和3′ RACE特异性引物, 参照相应试剂盒说明书分别扩增 AhSOS2的5′和3′末端, 扩增序列经BlastX比对验证。利用DNAMAN 5.0软件, 获得基因的电子拼接cDNA全长序列。参照拼接的基因全长序列设计特异性引物, 经RCR获得全长为1462 bp的基因 AhSOS2(图2)。将基因 AhSOS2的测序结果进行BlastX比对, 结果与基因电子拼接序列基本一致。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 利用简并引物对 AhSOS2序列的PCR扩增M: 100 bp DNA分子量; 1~3: AhSOS2在50℃、52℃和54℃解链温度下的PCR扩增产物。Fig. 1 PCR amplification of AhSOS2with degenerate primersM: 100 bp DNA ladder marker; 1-3: PCR products of AhSOS2with melting temperature ( Tm) at 50℃, 52℃, and 54℃. |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 AhSOS2的全长序列扩增M: 2 kb plus DNA marker; 1~4: AhSOS2的PCR产物。Fig. 2 Amplification of full-length cDNA of AhSOS2M: 2 kb plus DNA marker; 1-4: PCR products of AhSOS2. |
2.3 基因 AhSOS2的生物信息学分析 将获得的全长为1462 bp的 AhSOS2的cDNA序列经NCBI (http://ncbi.nlm.ncih.gov/) BlastX分析显示, AhSOS2基因包含一个1341 bp的开放阅读框, 110 bp的5′端非翻译区, 及11 bp的3′端非翻译区。利用在线网站Expasy (http://www.expasy.org/tools/ protparam.html)对 AhSOS2基因进行生物信息学分析, 结果显示, 花生 AhSOS2基因编码446个氨基酸残基, 分子量为51 kD, 等电点为8.68。
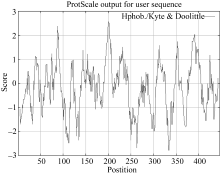
同时, 利用在线网站Expasy (http://web.expasy. org/cgi-bin/protscale/protscale.pl?1)对该基因氨基酸序列的亲水性/疏水性分析, 由图可看出(图3), AhSOS2编码蛋白的疏水区和亲水区交替出现, 依据氨基酸分值越低亲水性越强和分值越高疏水性越强的规律, 在整个肽链中, 亲水性氨基酸均匀分布, 且多于疏水性氨基酸。因此, 整个多肽链表现为亲水性, AhSOS2蛋白为亲水性蛋白。
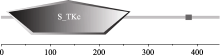
利用SMART (http://smart.embl-heidelberg.de/)网站, 对AhSOS2蛋白的结构域预测发现, AhSOS2蛋白在第11到264氨基酸之间含有一个S_TKc保守结构域, 为丝氨酸/苏氨酸蛋白激酶区(图4)。采用在线蛋白质序列信号肽分析工具Sigalp4.1对AhSOS2分析显示(图略), 蛋白N端无信号肽, 推测AhSOS2蛋白属非分泌型蛋白。利用TMHMM (http://www.cbs.dtu.dk/services/TMHMM-2.0)工具分析显示(图略), AhSOS2无跨膜结构域, 这一特征与蛋白激酶无跨膜结构域相吻合, 暗示该蛋白在细胞内不会发生迁移。
花生AhSOS2蛋白序列经Blastp比对, 获得一系列同源性较高的蛋白序列, 其中选取注释为SOS2类的蛋白序列, 利用DNAMAN5.0软件与AhSOS2序列进一步比对(图5)显示, AhSOS2与番茄中的SOS2类蛋白的相似性达到了76%, 与陆地棉、拟南芥、芥菜和大豆中相应序列的相似性分别达到了75%、75%、71%和50%。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 AhSOS2基因的疏水性/亲水性分析Fig. 3 Hydrophobicity/hydrophilicity analysis of AhSOS2 |
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 SMART网站对AhSOS2蛋白结构域预测Fig. 4 Domain prediction of AhSOS2 by SMART analysis |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 花生 AhSOS2编码氨基酸序列与其他物种中SOS2类基因编码的氨基酸序列的比对分析AtSOS2: 拟南芥( Arabidopsis thaliana); GmSOS2: 大豆( Glycine max); GpSOS2b: 陆地棉( Gossypium hirsutum); BjSOS2: 芥菜( Brassica juncea); SlSOS2: 番茄( Solanum lycopersicum)。Fig. 5 Comparison of amino acid sequences of SOS2 between Arachis hypogasaand some other speciesAtSOS2: ( Arabidopsis thaliana); GmSOS2: soybean ( Glycine max); GpSOS2b: cotton ( Gossypium hirsutum); BjSOS2: mustard ( Brassica juncea); SlSOS2: tomato ( Solanum lycopersicum). |
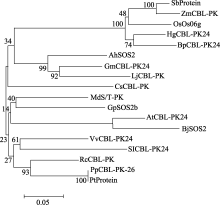
同时, 利用MEGA5.2软件对花生AhSOS2蛋白进行系统进化树分析(图6)显示, AhSOS2与其他物种的CIPK类蛋白激酶(CBL-interacting protein kinases)亲缘关系均达到了75%以上, 其中与大豆和百脉根中相应蛋白的同源性达到了85%, 与葡萄、蓖麻、胡杨中相应蛋白的同源性达到了80%, 与黄瓜、毛果杨中相应蛋白的同源性达到了79%。
2.4 AhSOS2基因的表达特性研究 2.4.1 AhSOS2基因的组织表达模式分析 分别
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 AhSOS2的氨基酸序列与其他物种中CIPK家族氨基酸序列的系统进化树分析SbProtein: 高粱( Sorghum bicolor); ZmCBL-PK: 玉米( Zea mays); OsOs06g: 水稻( Oryza sativa); HgCBL-PK24: 青稞( Hordeum vulgare subsp . spontaneum); BpCBL-PK24: 二穗短柄草( Brachypodium distachyon); AhSOS2: 花生( Arachis hypogaea); Gm CBL-PK24: 大豆( Glycine max); Lj CBL-PK: 百脉根( Lotus japonicus); CsCBL-PK: 黄瓜( Cucumis sativus); Md S/T-PK: 苹果( Malus × domestica); GpSOS2b: 陆地棉( Gossypium hirsutum); At CBL-PK24: 拟南芥( Arabidopsis thaliana); BjSOS2: 芥菜( Brassica juncea); Vv CBL-PK: 葡萄( Vitis vinifera); SlCBL-PK24: 番茄( Solanum lycopersicum); Rc-CBL-PK: 蓖麻( Ricinus communis); PpCBL-PK26: 胡杨( Populuseu phratica); Pt protein: 毛果杨( Populus trichocarpa)。Fig. 6 Phylogenetic tree analysis of amino acid sequences of SOS2 between Arachis hypogasaand some other speciesSbProtein: Chinese sorghum ( Sorghum bicolor); ZmCBL-PK: corn ( Zea mays); OsOs06g: rice ( Oryza sativa); HgCBL-PK24: barley ( Hordeum vulgare subsp. spontaneum); BpCBL-PK24: two spike Brachypodium ( Brachypodium distachyon); AhSOS2: peanut ( Arachis hypogaea); Gm CBL-PK24: soybean ( Glycine max); Lj CBL-PK: corniculatus ( Lotus japonicus); CsCBL-PK: cucumber ( Cucumis sativus); Md S/T-PK: apple ( Malus × domestica); GpSOS2b: cotton ( Gossypium hirsutum); At CBL-PK24: Arabidopsis ( Arabidopsis thaliana); BjSOS2: mustard ( Brassica juncea); Vv CBL-PK: grapes ( Vitis vinifera); SlCBL-PK24: tomato ( Solanum lycopersicum); Rc-CBL-PK: castor oil plant ( Ricinus communis); PpCBL-PK26: populus ( Populuseu phratica); Pt protein: populus ( Populustri chocarpa). |
提取花生鲁花14的根、茎、叶、花、果针的总RNA, 利用cDNA Synthesis Kit (TaKaRa)试剂盒反转录成单链cDNA, 根据所获得的 AhSOS2基因全长序列设计荧光定量特异性引物, 以花生 Actin作为内对照, 对目的片段进行扩增, 按照2-ΔΔCT法计算基因的相对表达量。结果显示(图7), 在正常生长条件下, AhSOS2在花生各组织中均表达, 但在花中表达强度较高, 表达量约为在其他组织中的12倍。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 荧光定量PCR对 AhSOS2基因的组织表达模式分析Fig. 7 Quantitative real-time PCR analysis of expression patterns of AhSOS2 |
2.4.2 盐及干旱胁迫下 AhSOS2的表达特性研究
生长15 d的花生幼苗, 按照材料和方法中所述分别以250 mmol L-1 NaCl和30% PEG-6000进行处理, 之后将植物材料提取RNA并利用cDNA Synthesis Kit (TaKaRa)试剂盒反转录成单链cDNA, 以之为模板, 以花生 Actin作为内对照, 以Real-R和Real-F作为 AhSOS2荧光定量特异性引物对目的片段进行扩增, 按照2-ΔΔCT法计算基因的相对表达量。
随250 mmol L-1 NaCl处理时间的延长, AhSOS2在花生的根、茎、叶中的表达量都有所上调, 但在茎中表达量变化最明显, NaCl处理48 h是未处理时的30倍以上; 而在根中, 随着NaCl处理时间的延长, 表达量逐渐上调, 在NaCl处理48 h后最高, 是未处理时的3.5倍; 而该基因在花生叶中的表达受NaCl诱导不是很明显, 表现先下调再上调的趋势, 且NaCl处理48 h仅比未处理时提高20% (图8)。
30% PEG-6000模拟干旱处理条件下, AhSOS2在花生的根、茎、叶中表达量都有所上调(图9), 在叶中, 经PEG处理48 h是未经处理时的12倍; 在茎中, 当PEG处理6 h是未经处理时的3.5倍, 而在PEG处理12 h表达量又略有下调, 处理24 h后又恢复到未处理时的3.4倍, 且随着处理时间的延长, 该基因表达水平又有所下调; 而在根中 AhSOS2基因对干旱的响应较弱, 经PEG处理12 h是未处理的1.7倍左右。结果表明, AhSOS2基因能够对盐及干旱处理产生响应, 基因表达受胁迫诱导, 暗示 AhSOS2
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 荧光定量PCR对盐胁迫下 AhSOS2表达模式分析A: 花生的根; B: 茎; C: 叶; 0、3、6、12、24和48 h: 250 mmol L-1 NaCl对花生的不同处理时间。Fig. 8 Quantitative real-time PCR analysis of the expression pattern of AhSOS2 under NaCl treatmentA: root; B: stem; L: leaf; 0, 3, 6, 12, 24, and 48 h: treatment time with 250 mmol L-1 NaCl. |
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 荧光定量PCR对干旱胁迫下 AhSOS2的表达模式分析A: 花生的根; B: 茎; C: 叶; 0、3、6、12、24和48 h: 30% PEG-6000处理花生的时间。Fig. 9 Quantitative real-time PCR analysis of the expression pattern of AhSOS2 under droughtA: root; B: stem; L: leaf; 0, 3, 6, 12, 24, and 48 h: treatment time with 30% PEG-6000. |
在花生抗盐和抗旱过程中具有一定的作用。
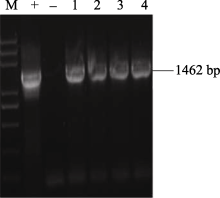
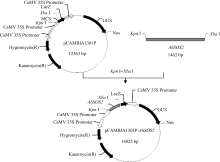
2.5 AhSOS2植物双元表达载体的构建及水稻的遗传转化 将植物表达载体pCAMBIA1301P- AhSOS2转化大肠杆菌Trans DH5α, 对重组阳性克隆进行酶切(图10)及菌液PCR鉴定(图11), 证明植物双元表达载体构建成功(图12)。
将构建好的植物表达载体pCAMBIA1301P- AhSOS2经液氮冻融法导入根癌农杆菌LBA4404感受态细胞, 经PCR菌液鉴定阳性克隆, 对水稻愈伤
图10
Fig. 10
| Figure OptionViewDownloadNew Window | |
 | 图10 重组质粒pCAMBIA1301P- AhSOS2的酶切鉴定M: DNA marker DL5000; 1~2: 重组质粒pCAMBIA1301P- AhSOS2的 KpnI和 XbaI双酶切检测。Fig. 10 Double digestion of recombinant plasmid of pCAMBIA1301P- AhSOS2M: DNA marker DL5000; 1-2: double digestion of recombinant plasmid pCAMBIA1301P- AhSOS2 by KpnI and XbaI. |
组织进行遗传转化, 目前已获得转基因水稻苗, 并对其功能进行初步分析。
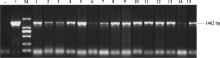
2.6 转基因植株的组织化学染色及PCR鉴定T1代转基因水稻植株GUS组织化学染色显示, 阴性对照的叶片中未观察到显示GUS活力的蓝色(图13), 仅在转基因水稻叶片中观察到有代表GUS活性的蓝色。PCR检测结果(图14)显示, 经GUS组织化学染色的阳性转基因水稻中大部分扩增出了与目的基因片段大小一致的特异性条带, 均为阳性植株, 未转基因的野生型水稻叶片中没有扩增出此特异条带。
图11
Fig. 11
| Figure OptionViewDownloadNew Window | |
 | 图11 重组质粒pCAMBIA1301P- AhSOS2的菌液PCR检测M: trans5K plus DNA marker; (+): 阳性对照; (-): 阴性对照; 1~4: 转化成功的重组质粒。Fig. 11 PCR identification of recombinant plasmid of pCAMBIA1301P- AhSOS2M: trans5K plus DNA marker; (+): positive control; (-): negative control; 1-4: The recombinant plasmid of pCAMBIA1301P- AhSOS2. |
图12
Fig. 12
| Figure OptionViewDownloadNew Window | |
 | 图12 植物表达载体pCAMBIA1301P- AhSOS2的质粒图谱Fig. 12 Plasmid map of expression vector pCAMBIA1301P- AhSOS2 |
图13
Fig. 13
| Figure OptionViewDownloadNew Window | |
 | 图13 转基因水稻叶片的GUS组织染色CK: 对照; T1: 转基因水稻叶片。Fig. 13 GUS staining of leaf of transgenic riceCK: control; T1: leaf of transgenic rice. |
2.7 转基因水稻对高盐的耐受性分析长至三叶期的转基因水稻T1代株系, 经不同浓
度的NaCl处理3 d后, 与对照水稻相比, 其盐胁迫的抗性及耐性均提高。如图15所示, 无论转 AhSOS2基因的水稻还是对照水稻, 在盐胁迫下, 随着NaCl处理浓度的提高, 植株生长均受到不同程度的损伤, 但总体来说, 转基因株系在不同NaCl浓度下的长势均优于对照植株。其中在250 mmol L-1NaCl处理下, 这种长势差异最为明显, 经250 mmol L-1NaCl处理3 d后, 对照株系叶片黄化和萎蔫程度都很严重, 茎杆因脱水严重而变细、抗倒伏能力降低, 且根部生长受抑制; 而转基因水稻叶片在短时间高盐处理下仅出现轻微的黄化和萎蔫, 茎部相对粗壮、抗倒伏能力较好, 虽然根部生长也受到一定程度的抑制, 但整体生长状态较好。
图14
Fig. 14
| Figure OptionViewDownloadNew Window | |
 | 图14 转基因株系的PCR鉴定M: 2 kb plus DNA marker; 1~15: 转基因株系; (+): 阳性对照; (-): 阴性对照。Fig. 14 PCR identification of transgenic linesM: 2 kb plus DNA marker; 1-15: transgenic lines; (+): positive control; (-): negative control. |
图15
Fig. 15
| Figure OptionViewDownloadNew Window | |
 | 图15 转基因水稻株系耐盐性鉴定CK: 盐胁迫处理3 d后的对照水稻, 从左至右分别为0、100和250 mmol L-1 NaCl处理; T1: 盐胁迫处理3 d后的转 AhSOS2基因水稻, 从左至右分别为0、100和250 mmol L-1 NaCl处理。Fig. 15 Salt-tolerance identification of transgenic riceCK: The phenotypes of wild-type rice after salt treatment for three days. From left to right: 0, 100, and 250 mmol L-1 NaCl treatment;T1: The phenotypes of transgenic rice after salt treatment for three days. From left to right: 0, 100, and 250 mmol L-1 NaCl treatment. |
3 讨论盐害和干旱胁迫严重影响作物的产量和品质。植物耐逆性研究不仅对作物遗传改良有重要意义, 还有助于人们理解诸如基因调控、信号传导、离子转运和矿质营养等生物学机制, 也是植物基础生物学研究的一个重要组成部分[ 28]。盐胁迫可破坏细胞的正常离子分布和动态平衡, 干扰代谢过程及产生大量的活性氧, 引起细胞膜脂过氧化和蛋白质破坏, 甚至植物死亡[ 29]。干旱胁迫可使植物生物膜结构与功能受到影响, 并引起叶绿素、核酸和蛋白质等大分子损伤, 进而导致一系列生理生化过程的改变及光合器官活性下降[ 30]。已知SOS信号途径在植物耐盐及抗逆过程中发挥重要作用。SOS途径成员 SOS1基因位于细胞质膜上, 编码Na+/H+逆向转运蛋白[ 31]。 SOS2基因编码丝氨酸/苏氨酸蛋白激酶, 包含C-端调控区和N-端催化区[ 9]。 SOS3基因包含一个N-豆蔻酰化结构域, 是植物实现耐盐性所必需的[ 32]。目前, 对拟南芥中SOS信号途径的研究比较清楚, Chinnusamy等[ 29]报道, 盐胁迫导致拟南芥体内Ca2+信号的产生及传递, 相关信号进一步激活编码Ca2+结合蛋白的 SOS3, 从而SOS3与蛋白激酶SOS2一起, 参与调控细胞质膜Na+/H+逆向转运蛋白SOS1以及其他通道蛋白, 从而对细胞内Na+的外排及细胞内外K+、Na+的均衡起调控作用。而 SOS2和 SOS3突变体植株, 由于SOS信号途径缺失, 导致细胞内Na+的外排及细胞内外K+、Na+平衡受到影响, 从而造成突变体植株生长异常[ 33, 34]。SOS类基因家族各成员在植物中的表达具有一定的组织特异性, 且其表达调控具有一定的复杂性, 说明该家族基因可能参与多种信号途径, 并在维持细胞稳态、活性氧的清除和生长调节等方面发挥重要的作用。
花生( Arachis hypogaeaL .)作为重要的油料作物, 其品质及产量对国民经济的发展具有重要影响。然而由于花生是异源四倍体, 基因组庞大, 目前尚无完整的花生基因组序列信息。为深入研究花生在盐害、干旱等胁迫条件下的生长、响应及防御机制, 我们参考其他物种中 SOS2的基因序列, 通过设计简并引物结合RACE的方法, 从花生中分离到了 SOS2基因, 命名为 AhSOS2。全长1462 bp, 包含一个1341 bp的开放阅读框、110 bp的5′端非翻译区及11 bp的3′端非翻译区。这与拟南芥[ 9]、苹果[ 16]、水稻[ 35]中已知 SOS2基因的结构特征相似。基因所编码的蛋白序列经多重比对显示, 花生AhSOS2和大豆、番茄、拟南芥、芥菜、陆地棉等植物中的SOS2类成员亲缘关系较近, 同源性在70%以上, 显示 AhSOS2属于 SOS2基因家族, 推测AhSOS2与拟南芥[ 36, 37]等植物中已报道的SOS2可能具有相似的生物学功能, 且在植物响应干旱、高盐、渗透胁迫等多种信号途径中发挥作用。
利用在线网站Expasy (http://www.expasy.org/ tools/protparam.html)对 AhSOS2基因进行生物信息学分析显示, 花生 AhSOS2基因所编码氨基酸序列的第11到第264位之间存在一个S_TKc保守结构域, 为丝氨酸/苏氨酸蛋白激酶区特征结构, 其N-端催化区与酵母SNF1 (sucrose nonfermenting l)及哺乳动物蛋白激酶AMPK (adenosine 5’-monophosphate-activated protein kinase)相似, C-端为调控区。蛋白质的磷酸化和去磷酸化过程在植物对逆境信号的识别及信号在植物体内的转导中起重要作用, 并普遍存在于如光合作用、细胞的生长发育、基因表达、甚至癌变等生命活动中[ 38, 39]。
AhSOS2的氨基酸序列与其他植物SOS2类基因编码的氨基酸序列的系统进化树分析显示, 其与蛋白激酶CIPK (CBL-interacting protein kinase)具有相似的保守结构域。以往研究报道, 蛋白激酶CIPK及SOS2均属蔗糖非酵解型相关蛋白激酶3 (SNF1- related protein kinase 3, SnRK3)亚家族[ 40]。已知SnRK家族是广泛存在于植物中的一类丝氨酸/苏氨酸蛋白激酶, 家族成员可不同程度地参与胁迫响应过程[ 38, 39, 41], 尤其在盐胁迫(包括离子、氧化及渗透胁迫)响应等方面发挥作用[ 40, 41], 在植物的抗逆生理研究中具有非常重要的作用。推测AhSOS2作为SnRK家族的一员, 在抗盐及胁迫响应方面也具有相似的生物学功能。同时, 结构域预测显示, AhSOS2蛋白质序列N-端无信号肽, 无跨膜结构域, 暗示AhSOS2是非分泌型蛋白, 在细胞内不易迁移。
用荧光定量PCR的方法研究 AhSOS2基因的组织表达特性显示, 正常生长条件下, AhSOS2基因在花生中为组成型表达, 且在花中表达丰度最高, 是在根、茎、叶、果针等组织中表达的12倍。鉴于表达部位与生物学功能的相关性, 推测花生 AhSOS2基因可能在调节花的发生和发育过程中发挥一定作用。诱导表达模式分析显示, 基因 AhSOS2的表达受盐胁迫及干旱的诱导, 在250 mmol L-1 NaCl处理条件下, 随处理时间的延长, AhSOS2基因在花生的根、茎、叶中表达量都有所上调, 尤以茎中明显增强, 约是未经处理时的30倍。这一现象与以往报道的高盐胁迫使胞质中游离Ca2+浓度快速上升[ 44, 45], 而Ca2+信使通过信号传递网络, 从而调控 AhSOS2基因参与高盐胁迫应答过程的结果相似[ 21]。而在30% PEG-6000模拟干旱处理条件下, 基因在花生幼苗叶中表达量升高幅度最大, 约是未经处理时的12倍, 在根和茎中表达量也有不同程度的上调。综合以上结果, 可以推断, AhSOS2基因通过响应盐及干旱胁迫, 进一步参与相关信号转导途径, 在花生抗盐、抗旱及其他抗逆过程中发挥作用。
利用植物基因工程技术可以明显加快抗逆植物新品种的培育进程。Hu等证明, 当NaCl浓度升高到150 mmol L-1和200 mmol L-1时, 与对照和 SOS2突变体相比, MdSOS2转基因株系表现出很高的耐盐性[ 16]。Zhu等[ 46]对培养5 d的野生型拟南芥和 SOS2突变体拟南芥进行50 mmol L-1和100 mmol L-1NaCl处理, 发现高盐抑制了植物的根部和地上部分的生长。本研究中, 鉴于花生的遗传转化周期较长、体系有待进一步完善, 目前已将基因 AhSOS2转化入模式植物水稻中, 并已获得转基因植株。对筛选获得的T1代转 AhSOS2基因的水稻株系耐盐能力初步分析显示, 该基因在水稻中的过表达可在一定程度上增强并提高受体材料对盐胁迫的抗性及耐受性。在此基础上, 我们拟对基因的生物学功能做进一步验证, 以期为作物的抗逆性研究及抗性育种提供新思路和候选基因。同时, 从蛋白水平上对基因编码产物的结构、活性及生物学功能研究正在进行, 希望为 SOS2基因及其家族成员参与植物抗逆及相关机理提供更多的理论证据。
4 结论从花生中克隆了基因 AhSOS2, 它与番茄等物种中SOS2类基因序列相近, 为SOS2类基因家族成员。正常生长条件下 AhSOS2基因为组成型表达。250 mmol L-1 NaCl和30% PEG-6000模拟干旱均可诱导 AhSOS2基因的表达, 暗示花生 AhSOS2基因在植物胁迫响应及抗逆过程中发挥重要的作用, 过表达 AhSOS2基因的转基因水稻增强了对盐的耐受性, 可作为候选基因进一步应用于农业生产。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] | |
| [36] | |
| [37] | |
| [38] | |
| [39] | |
| [40] | |
| [41] | |
| [42] | |
| [43] | |
| [44] | |
| [45] | |
| [46] |
