
 , 李俊辉3, 蔡冬波1, 马昕1, 陈守文1
, 李俊辉3, 蔡冬波1, 马昕1, 陈守文1 1. 湖北大学 生命科学学院 省部共建生物催化与酶工程国家重点实验室 湖北省环境微生物工程技术研究中心,湖北 武汉 430062;
2. 湖北工业大学 生物工程与食品学院 发酵工程教育部重点实验室 工业微生物湖北省重点实验室,湖北 武汉 430068;
3. 绿康生化股份有限公司,福建 浦城 353400
收稿日期:2020-09-28;接收日期:2021-01-14;网络出版时间:2021-01-26
基金项目:国家重点研发计划(No. 2018YFA0900300) 资助
摘要:杆菌肽是一种主要由芽胞杆菌产生的广谱性抗生素,目前作为兽药广泛应用于畜禽养殖领域。前体氨基酸供应不足可能是限制微生物发酵高产杆菌肽的重要因素。文中以杆菌肽工业生产菌株——地衣芽胞杆菌Bacillus licheniformis DW2为出发菌株,研究L-半胱氨酸供给模块强化对杆菌肽合成的影响。首先,构建了L-半胱氨酸合成酶基因cysK强化表达菌株,杆菌肽效价相比于对照菌株提高了9.47%。接着,为提高L-半胱氨酸合成前体供给,对L-丝氨酸乙酰转移酶基因cysE和硫代硫酸盐/硫酸盐胞内转运蛋白基因cysP进行强化,杆菌肽产量分别提高了7.23%和8.52%。随后,结果表明转运蛋白TcyP负责从胞外向胞内转运胱氨酸,强化表达TcyP后胞内L-半胱氨酸浓度和杆菌肽效价分别提高了29.19%和7.79%。通过组合代谢工程育种,在整合表达了基因cysK基础上,利用强启动子PbacA分别替换基因cysP、cysE和tcyP原始启动子,得到工程菌株CYS4 (DW2:: cysK-PbacA(cysP)- PbacA(cysE)-PbacA(tcyP)),杆菌肽效价达到910.02 U/mL,相比于出发菌株DW2 (747.71 U/mL) 提高了21.10%。最后,通过3 L发酵罐小试实验,进一步证实了强化L-半胱氨酸有利于杆菌肽合成。研究表明,强化胞内L-半胱氨酸供给水平是提高地衣芽胞杆菌中杆菌肽产量的有效策略,为杆菌肽工业生产提供了一株具有良好应用前景的菌株。
关键词:地衣芽胞杆菌杆菌肽L-半胱氨酸供给代谢工程
Metabolic engineering of L-cysteine supply modules for enhanced production of bacitracin in Bacillus licheniformis
Lingfeng Li1, Pei Liu1, Wen Luo1, Qin Wang1, Zhi Wang2, Xiaobin Chen3

 , Junhui Li3, Dongbo Cai1, Xin Ma1, Shouwen Chen1
, Junhui Li3, Dongbo Cai1, Xin Ma1, Shouwen Chen1 1. Environmental Microbial Technology Center of Hubei Province, State Key Laboratory of Biocatalysis and Enzyme Engineering, College of Life Sciences, Hubei University, Wuhan 430062, Hubei, China;
2. Hubei Provincial Key Laboratory of Industrial Microbiology, Key Laboratory of Fermentation Engineering (Ministry of Education), School of Food and Biological Engineering, Hubei University of Technology, Wuhan 430068, Hubei, China;
3. Lifecome Biochemistry Co. Ltd, Pucheng 353400, Fujian, China
Received: September 28, 2020; Accepted: January 14, 2021; Published: January 26, 2021
Supported by: National Key Research and Development Program of China (No. 2018YFA0900300)
Corresponding author: Shouwen Chen. Tel: +86-27-88666081; E-mail: chenshouwen@hubu.edu.cn.
Abstract: Bacitracin is a broad-spectrum antibiotics mainly produced by Bacillus, and is used as veterinary medicine in the fields of livestock and poultry breeding. Insufficient supply of precursor amino acids might be an important factor that hinders high-level microbial production of bacitracin. We investigated the effect of strengthening L-cysteine supply on bacitracin production by an industrial bacitracin producer, Bacillus licheniformis DW2. Overexpression of cysK encoding L-cysteine synthase led to a 9.17% increase of the bacitracin titer. Moreover, overexpression of cysE encoding L-serine acetyltransferase and cysP encoding thiosulfate/sulfate intracellular transporter increased the bacitracin titers by 7.23% and 8.52%, respectively. Moreover, overexpression of a putative cystine importer TcyP led to a 29.19% increase of intracellular L-cysteine, and bacitracin titer was increased by 7.79%. Subsequently, the strong promoter PbacA was used to replace the promoters of genes cysP, cysE and tcyP in strain DW2:: ysK, respectively. The resulted strain CYS4 (DW2:: cysK-PbacA-(cysP)-PbacA(cysE)- PbacA(tcyP) produced 910.02 U/mL bacitracin, which was 21.10% higher than that of the original strain DW2 (747.71 U/mL). Together with the experiments in 3 L fermenters, this research demonstrated that enhancing intracellular L-cysteine supply is an effective strategy to increase bacitracin production of B. licheniformis.
Keywords: Bacillus licheniformisbacitracinL-cysteinesupplymetabolic engineering
杆菌肽是一种主要由地衣芽胞杆菌Bacillus licheniformis和枯草芽胞杆菌Bacillus subtilis产生的环肽类抗生素,包含鸟氨酸(Orn)、D-苯丙氨酸(D-Phe)、组氨酸(His)、D-天冬氨酸(D-Asp)、天冬酰胺(Asn)、赖氨酸(Lys)、D-谷氨酸(D-Glu)、半胱氨酸(Cys)、亮氨酸(Leu)、异亮氨酸(Ile) 和缬氨酸(Val) 共11种氨基酸[1-3]。与青霉素、头孢菌素、万古霉素等多种抗生素的合成机制类似,杆菌肽由非核糖体肽合成酶(Nonribosomal peptide synthetase,NRPS)催化合成[4-5]。作为一种广谱性抗生素,杆菌肽能抑制细菌细胞壁合成,对革兰氏阳性细菌和部分革兰氏阴性菌有很强的抑制效果[6-7]。此外,其具有安全性高、稳定性好、吸收率低等优点,已作为肠道抗菌药物广泛用于动物疾病防治[8]。
目前报道的次级代谢产物高产菌株育种策略可大致归纳为:(1) 提高底物利用率[9];(2) 增强前体物供应[10];(3) 增强合成酶簇和转运蛋白表达[11];(4) 阻断副产物合成途径[12];(5) 辅因子工程[13];(6) 转录调节因子工程[14]等。增强前体物供应被认为是抗生素代谢工程育种最有效的策略,其对于杆菌肽合成也同样重要。支链氨基酸(BCAA) 转运蛋白基因yhdG敲除和brnQ强化表达均能促进BCAAs胞内积累,进而有利于杆菌肽合成[15]。L-半胱氨酸也是杆菌肽组成氨基酸,然而,其是否是杆菌肽合成的限制因素尚不清楚。
L-半胱氨酸是一种重要的含硫氨基酸[16]。由于其代谢途径较为复杂,且受到严谨的代谢调控,目前还未能实现工业化发酵生产[17]。目前报道的提高L-半胱氨酸产量的策略主要集中在大肠杆菌和谷氨酸棒状杆菌中。Joo等通过强化表达L-半胱氨酸合成酶基因cysK,使谷氨酸棒状杆菌中L-半胱氨酸的产量提高约39%[18]。Wei等通过强化表达L-丝氨酸合成酶基因serABC,增强了前体物L-丝氨酸供给,使谷氨酸棒状杆菌中L-半胱氨酸的产量提高23%[17]。Kishino等通过强化表达谷氨酸棒状杆菌中转运蛋白NCgl2566,使得L-半胱氨酸的产量提高约40%[19]。
地衣芽胞杆菌DW2是重要的杆菌肽工业生产菌株。本研究通过强化L-半胱氨酸及其前体物合成途径、改造胱氨酸转运途径等(图 1),研究了L-半胱氨酸胞内供给强化对杆菌肽合成的影响。本研究表明强化L-半胱氨酸胞内供给水平是提高杆菌肽产量的有效策略,提供了一株具有工业化应用前景的杆菌肽生产菌株,并为含半胱氨酸肽类抗生素高产菌株的代谢工程育种提供借鉴。
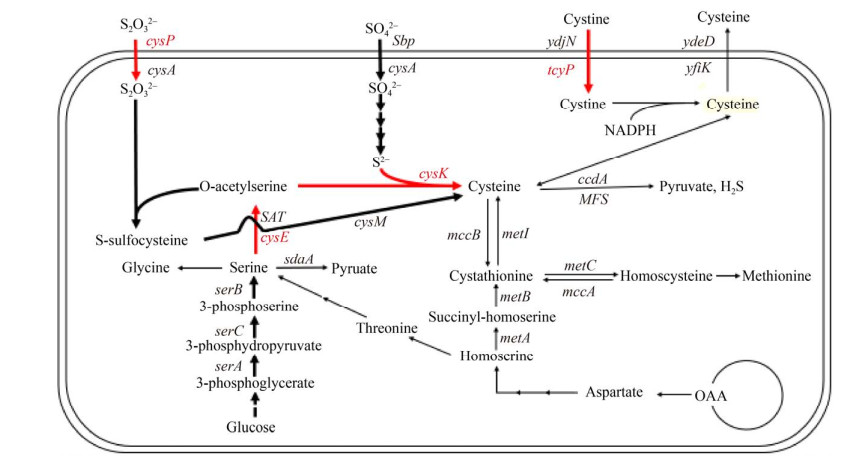 |
| 图 1 地衣芽胞杆菌DW2中L-半胱氨酸的代谢途径(红色线条代表强化表达途径) Fig. 1 Metabolic pathways of L-cysteine in B. licheniformis DW2. The red lines represent strengthened pathways. |
| 图选项 |
1 材料与方法1.1 菌株与质粒本研究的出发菌株是由绿康生化股份有限公司提供的地衣芽胞杆菌DW2 (CCTCC M2011344)。菌株与质粒见表 1。
表 1 本研究所用的菌株与质粒Table 1 Strains and plasmids used in this study
| Strains or plasmids | Relevant characteristics | Sources/References |
| Strains | ||
| ??Escherichia coli DH5α | F- Φ80d/lacZΔM15, Δ(lacZYA-argF) U169, recA1, endA1, hsdR17 (rK-, mK+), phoA, supE44, λ-, thi-1, gyrA96, relA1 | TaKaRa Co., Ltd |
| ??B. licheniformis DW2 | Industrial production strain (CCTCC M2011344) for Bacitracin | CCTCC |
| ??DW2/pHY-300 | DW2 harboring plasmid pHY300PLK | This study |
| ??DW2/pHY-cysP | DW2 harboring plasmid pHY-pHY-cysP | This study |
| ??DW2/pHY- cysE | DW2 harboring plasmid pHY-pHY-cysE | This study |
| ??DW2/pHY-cysK | DW2 harboring plasmid pHY-pHY-cysK | This study |
| ??DW2/pHY-tcyP | DW2 harboring plasmid pHY-pHY-tcyP | This study |
| ??DW2△tcyP | Knockout of gene tcyP in DW2 | This study |
| ??DW2-PbacA (tcyP) | Replace the original promoter PtcyP with PbacA in DW2 | This study |
| ??DW2-PbacA (cysP) | Replace the original promoter PcysP with PbacA in DW2 | This study |
| ??DW2-PbacA (cysE) | Replace the original promoter PcysE with PbacA in DW2 | This study |
| ??DW2:: cysK | Integration overexpression of cysK in DW2 | This study |
| ??CYS1 | Integration overexpression of cysK in DW2 | This study |
| ??CYS2 | Replace the original promoter PcysP with PbacA in CYS1 | This study |
| ??CYS3 | Replace the original promoter PcysE with PbacA in CYS2 | This study |
| ??CYS4 | Replace the original promoter PtcyP with PbacA in CYS3 | This study |
| Plasmids | ||
| ??pHY300PLK | E. coli-B. licheniformis shuttle vector, Apr (E. coli), Tcr (E. coli and B. licheniformis) | Lab collection |
| ??pHY-cysP | Plasmid pHY300PLK harboring gene cysP | This study |
| ??pHY-cysE | Plasmid pHY300PLK harboring gene cysE | |
| ??pHY-cysK | Plasmid pHY300PLK harboring gene cysK | This study |
| ??pHY-tcyP | Plasmid pHY300PLK harboring gene tcyP | |
| ??T2(2)-ori | E. coli-B. licheniformis shuttle vector, for gene knockout | This study |
| ??T2-PbacA(cysP) | T2(2)-Ori-PcysP (A+PbacA+B), to replace the promoter of PcysP | |
| T2(2)-Ori-PcysE (A+PbacA+B), to replace the promoter of PcysE | Lab collection | |
| ??T2-PbacA(cysE) | T2(2)-Ori-PtcyP (A+PbacA+B), to replace the promoter of PtcyP | This study |
| T2(2)-ori derivative containing homologous arms of gene tcyP, to delete tcyP | This study | |
| ??T2-PbacA(tcyP) | T2(2)-Ori-cysK (A+cysK expression cluster+B); to over-express cysK | This study |
| ??T2-ΔtcyP | This study | |
| ??T2: : cysK | This study |
表选项
1.2 主要试剂北京全式金生物科技有限公司:Pfu DNA聚合酶、Taq DNA聚合酶、dNTPs;宝生物工程(大连) 有限公司:DNA分子量标准、T4 DNA连接酶、DNA限制性内切酶;Omega Bio-tek公司:DNA回收纯化试剂盒、质粒小提试剂盒;北京擎科新业生物技术有限公司:引物合成及测序;Spanish公司:蛋白胨、酵母提取物、琼脂糖;阿拉丁试剂(上海) 有限公司:α-淀粉酶、抗生素(Amp、Kan、Tet);绿康生化股份有限公司:玉米淀粉、轻钙、豆粕;国药集团化学试剂有限公司:其他国产分析纯普通试剂。
1.3 培养基LB液体培养基和LB固体培养基配方[8]。
摇瓶发酵培养基配方[15]:豆粕10%、玉米淀粉4.5%、轻质碳酸钙0.6%、硫酸铵0.1%,自然pH (pH为6.85);
发酵罐小试培养基配方:豆粕8%、玉米淀粉3.6%、轻质碳酸钙0.6%、硫酸铵0.1%,自然pH (pH为6.85)。
培养基灭菌条件均为:121 ℃、20 min。
1.4 地衣芽胞杆菌工程菌株的构建1.4.1 地衣芽胞杆菌强化表达菌株的构建参考地衣芽胞杆菌强化表达菌株的构建方法[9],分别构建得到基因cysK、cysE、cysP、tcyP强化表达菌株DW2/pHY-cysK、DW2/pHY-cysE、DW2/pHY-cysP和DW2/pHY-tcyP。
1.4.2 地衣芽胞杆菌基因敲除菌株的构建参考地衣芽胞杆菌基因敲除菌株的构建方法[9],得到tcyP的缺失菌株DW2ΔtcyP。
1.4.3 地衣芽胞杆菌启动子替换菌株的构建参考地衣芽胞杆菌启动子替换菌株的构建方法[8],得到启动子替换菌株DW2-PbacA(cysK)、DW2-PbacA(cysE)、DW2-PbacA(cysP)、DW2-PbacA(tcyP)。
1.4.4 地衣芽胞杆菌基因整合表达菌株的构建参考地衣芽胞杆菌基因整合表达菌株的构建方法[13],得到cysK整合表达菌株DW2:: cysK。
1.5 发酵方法菌种活化:将保藏菌种在含抗性或无抗性LB平板上涂布,挑取单菌落在相应LB平板上划线,37 ℃培养12 h。种子液培养:从LB平板上挑取单菌落接种20 mL液体LB培养基(250 mL摇瓶),230 r/min、37 ℃振荡培养8-10 h。摇瓶发酵培养:以5%接种量将种子液接至20 mL杆菌肽发酵培养基(不添加抗生素),使用250 mL三角瓶,230 r/min、37 ℃培养约48 h,pH值到8.0时即达到发酵终点[8]。
3 L发酵罐小试实验:种子液以5%接种量接至含有1.5 L发酵液的3 L发酵罐(迪必尔生物工程有限公司) 中,发酵1-4 h控制搅拌转速为350 r/min,随后调至500 r/min至发酵结束,通气量为1 vvm。发酵pH值到8.0时即达到发酵终点。
1.6 分析方法杆菌肽效价检测采用安捷伦1260液相色谱仪检测[15]。氨基酸浓度检测使用安捷伦7890A气相色谱仪完成[15]。地衣芽胞杆菌生物量的测定采用稀释涂布法完成[8]。
1.7 统计分析本文所有实验均重复至少3次,并且每次设置3个平行。采用Origin 8.5和SPSS 18.0进行数据处理和分析(*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01))。
2 结果与分析2.1 外源L-半胱氨酸添加对地衣芽胞杆菌DW2杆菌肽发酵效价的影响为了验证地衣芽胞杆菌DW2杆菌肽发酵过程中L-半胱氨酸是否受限,首先进行L-半胱氨酸外源添加实验。结果表明,当L-半胱氨酸浓度为60 mg/L时,杆菌肽效价最高,达到821.91 U/mL,较对照组(747.71 U/mL) 提升9.92% (P < 0.05)。
2.2 增强L-半胱氨酸合成途径对杆菌肽合成的影响增强合成途径的代谢通量是提高胞内目标氨基酸产量的有效方法[20]。为了提高DW2中L-半胱氨酸合成水平,构建了L-半胱氨酸合成酶CysK强化表达菌株DW2/PHY-cysK。DW2/PHY-cysK杆菌肽效价达到758.18 U/mL,与DW2/PHY-300 (665.65 U/mL) 相比提高了13.90% (图 2A)。而DW2/pHY-300效价相比于DW2 (747.71 U/mL) 降低了12.32%,可能是游离质粒造成菌体代谢负担加重所致。将cysK基因整合至基因组中,构建了CysK整合表达菌株DW2:: cysK,杆菌肽效价达到820.54 U/mL,相比于DW2提高了9.47% (P < 0.05) (图 2A)。DW2:: cysK胞内L-半胱氨酸浓度大幅提高,发酵36 h时达到7.96 mg/L,较对照(5.72 mg/L) 提高39.15%。
 |
| 图 2 L-半胱氨酸合成酶基因cysK、L-丝氨酸乙酰转移酶基因cysE和硫代硫酸盐/硫酸盐转运蛋白CysP强化表达对杆菌肽合成的影响 Fig. 2 Effects of over-expression of L-cysteine synthase gene cysK (A), L-serine acetyltransferase gene cysE (B) and thiosulfate/sulfate transporter CysP (C) on bacitracin production. *, P < 0.05; **, P < 0.01. |
| 图选项 |
2.3 增强L-半胱氨酸合成前体供给对杆菌肽合成的影响L-半胱氨酸合成是以L-丝氨酸为前体,经过两步反应将L-丝氨酸上的羟甲基取代为硫醇基而成。其合成前体O-乙酰丝氨酸是由L-丝氨酸乙酰转移酶催化生成,而O-乙酰丝氨酸转化L-半胱氨酸需要硫原子的参与[20]。
2.3.1 强化L-丝氨酸乙酰转移酶表达对杆菌肽合成的影响为了研究O-乙酰丝氨酸供给对L-半胱氨酸及杆菌肽合成的影响,构建了L-丝氨酸乙酰转移酶基因cysE强化表达菌株DW2/PHY-cysE,杆菌肽效价达到743.53 U/mL,相比于DW2/PHY-300提高了11.70% (图 2B)。强启动子替换被确证是提高基因表达水平的有效策略,杆菌肽合成酶基因簇启动子PbacA被证实是一个强启动子[8]。通过将启动子PbacA替换cysE原始启动子,得到cysE强化表达菌株DW2-PbacA(cysE),其杆菌肽效价达到801.77 U/mL,与DW2相比提高了7.23% (P=6.37×10-2) (图 2B)。DW2-PbacA(cysE)胞内L-半胱氨酸浓度达到7.33 mg/L,相比于对照提高了28.14% (36 h)。
2.3.2 增强硫元素摄取对杆菌肽合成的影响为了增强胞内硫元素供给,构建了硫代硫酸盐/硫酸盐转运蛋白基因cysP强化表达菌株DW2/pHY-cysP。结果表明,强化表达CysP有利于杆菌肽合成,其效价相比于DW2/pHY300提高了12.80%。以启动子PbacA替换基因cysP启动子,得到cysP强化表达菌株DW2-PbacA(cysP),其杆菌肽效价为811.42 U/mL,相比于DW2提高了8.52% (P < 0.05) (图 2C)。DW2-PbacA(cysP) 胞内L-半胱氨酸浓度达到6.76 mg/L,相比于对照提高了18.81% (36 h)。
2.4 胱氨酸转运蛋白TcyP强化表达对杆菌肽合成的影响转运蛋白是影响氨基酸胞内外分布的重要因素之一[15]。胱氨酸在胞内可直接转化成半胱氨酸,TcyP被证实为胱氨酸转运蛋白,然而TcyP在地衣芽胞杆菌中的转运方向尚不清楚。分别构建了基因tcyP缺失及强化表达菌株DW2ΔtcyP和DW2/PHY-tcyP,结果表明,强化表达TcyP有利于杆菌肽合成,其效价(735.34 U/mL) 提高了10.47% (P < 0.05),缺失tcyP后杆菌肽效价降低至697.39 U/mL。采用启动子PbacA替换tcyP原始启动子,构建得到菌株DW2-PbacA(tcyP),杆菌肽效价达到805.96 U/mL,相比于DW2提高了7.79% (P=6.28×10-2) (图 3A)。由此推测,TcyP可能发挥着胱氨酸输入蛋白的功能。分别检测了tcyP强化表达及缺失菌株的胞内L-半胱氨酸浓度(图 3B),发现强化表达TcyP有利于胞内L-半胱氨酸积累,初步表明地衣芽胞杆菌DW2中TcyP可能发挥着胱氨酸输入蛋白的功能。
 |
| 图 3 胱氨酸转运蛋白基因tcyP强化表达/缺失对杆菌肽合成及胞内L-半胱氨酸浓度的影响 Fig. 3 Effects of over-expression or deletion of cystine transporter gene tcyP on bacitracin production (A) and intracellular L-cysteine concentration (B). |
| 图选项 |
2.5 组合代谢工程育种构建杆菌肽高产菌株组合代谢工程育种是目标代谢产物高产菌株育种的通用策略。为进一步提高杆菌肽合成水平,选择DW2:: cysK为出发菌株(CYS1),利用启动子PbacA替换基因cysE启动子,得到菌株CYS2 (DW2:: cysK-PbacA-(cysE))。CYS2杆菌肽效价达到847.52 U/mL,相比于DW2提高了12.74%。接着,以PbacA替换cysP原始启动子,得到菌株CYS3 (DW2:: cysK-PbacA-(cysE)-PbacA(cysP)),其效价达到872.51 U/mL,相比于DW2提高了16.10%。在CYS3基础上,利用PbacA替换基因tcyP原始启动子,得到菌株CYS4 (DW2:: cysK-PbacA-(cysP)-PbacA(cysE)- PbacA(tcyP))。CYS4效价达到910.02 U/mL,相比于DW2提高了21.10%。
进一步检测了菌株CYS4杆菌肽发酵过程曲线。CYS4杆菌肽效价一直高于DW2,且该菌株生物量也持续高于对照,这说明胞内L-半胱氨酸合成强化有利于细胞生长。发酵终点时,CYS4单位菌体杆菌肽效价为5.38×10-8 U/CFU,提高了12.55%。整个杆菌肽快速合成阶段,CYS4单位菌体杆菌肽合成水平均高于对照菌株(图 4)。
 |
| 图 4 菌株DW2和CYS4发酵过程中杆菌肽的效价和生物量 Fig. 4 Profiles of bacitracin titers (A) and biomass (B) of strains DW2 and CYS4 during fermentation. |
| 图选项 |
对菌株CYS4在24 h (生物量最高点)、36 h (杆菌肽合成最旺盛时期)、48 h (发酵终点) 的胞内L-半胱氨酸含量进行检测。结果表明,各时间点胞内L-半胱氨酸浓度均显著提高(图 5),其中杆菌肽合成最旺盛时期,CYS4胞内L-半胱氨酸浓度相比于DW2提高了46.36%。同时,L-半胱氨酸相关氨基酸的浓度也有不同幅度的提升。
 |
| 图 5 菌株DW2和CYS4发酵24 h、36 h、48 h胞内氨基酸浓度 Fig. 5 Intracellular amino acid concentrations of strains DW2 and CYS4 at 24 h (A), 36 h (B), 48 h (C). *, P < 0.05; **, P < 0.01. |
| 图选项 |
2.6 工程菌株CYS4的发酵罐小试研究在摇瓶发酵过程中,水分挥发造成发酵液体积减小(约减小30%)。因此,采用3 L发酵罐对菌株DW2和CYS4开展了发酵罐小试试验。相比于摇瓶条件,发酵罐周期缩短至36 h。由于发酵罐配方中玉米淀粉和豆粕浓度相比于摇瓶配方均有所降低(均为摇瓶配方浓度80%),其整体效价和生物量均低于摇瓶实验组。菌株DW2和CYS4发酵过程pH趋势基本一致。CYS4效价在整个发酵过程中均高于DW2,最高效价达到776.46 U/mL,相比于DW2提高了26.17%,生物量也有少许提高(图 6)。
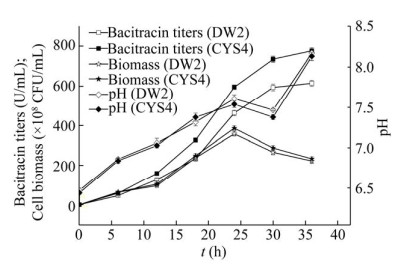 |
| 图 6 3 L发酵罐条件下菌株DW2和CYS4的发酵过程曲线 Fig. 6 Profile of B. licheniformis DW2 and CYS4 in 3 L fermenters. |
| 图选项 |
3 讨论L-半胱氨酸是一种重要含硫氨基酸,然而其是否是杆菌肽合成的限制性氨基酸并不清楚。本研究发现整合表达菌株DW2:: cysK效价与DW2相比提高了9.47%,且胞内L-半胱氨酸浓度提高了39.15%。通过强化表达L-丝氨酸乙酰转移酶基因cysE和硫酸盐/硫酸盐转运蛋白基因cysP,胞内L-半胱氨酸浓度分别提高了28.14%和18.81%,效价分别提高了7.23%和8.52%。强化表达胱氨酸转运蛋白TcyP后,胞内L-半胱氨酸得到积累,效价提高了7.79%,初步表明TcyP为输入型蛋白。本研究提出并证实了强化胞内L-半胱氨酸供给有利于杆菌肽合成。此外,L-半胱氨酸供给强化有利于菌体天冬氨酸家族氨基酸代谢,进而有利于菌体生长,这也是L-半胱氨酸供给强化促杆菌肽高产的原因之一。与此同时,芽胞杆菌在发酵后期存在芽胞萌发和菌体自溶,此时生物量显著降低(图 4B)。作为次级代谢产物,杆菌肽受到芽胞杆菌过渡态转录因子AbrB调控作用,稳定期AbrB表达量降低。因此,杆菌肽在发酵后期合成速率明显加快[21]。
然而,仍有一些工作需要在今后研究中加以完善。L-半胱氨酸胞内积累过多会造成菌体氧化应激[16],不利于细胞生长和产物合成,对细胞生长与产物合成关系的综合考虑和精细调控或成为下一步的研究重点。L-半胱氨酸合成途径与亮氨酸、异亮氨酸等[22]多种氨基酸合成相耦联,这些氨基酸也被认为是杆菌肽合成的限制性氨基酸。对其他组成氨基酸供给进行综合考量,对于实现杆菌肽合成前体氨基酸高效均衡供给可能更为有效。
综上,本研究通过系统代谢工程改造L-半胱氨酸供给途径,提高了胞内L-半胱氨酸供给水平及杆菌肽产量,为含半胱氨酸肽类抗生素高产菌株代谢工程育种提供了借鉴。
参考文献
| [1] | Drabl?os F, Nicholson D, R?onning M. EXAFS study of zinc coordination in bacitracin A. Biochim Biophys Acta, 1999, 1431(2): 433-442. DOI:10.1016/S0167-4838(99)00064-3 |
| [2] | Haavik H. Studies on the formation of bacitracin by Bacillus licheniformis: effect of glucose. J Gen Microbiol, 1974, 81(2): 383-390. |
| [3] | Tsuji KRJ. Improved high-performance liquid chromatographic method for polypeptide antibiotics and its application to study the effects of treatments to reduce microbial levels in bacitracin powder. J Chromatogr, 1975, 112: 663-672. DOI:10.1016/S0021-9673(00)99995-3 |
| [4] | Hur GH, Vickery CR, Burkart MD. Explorations of catalytic domains in non-ribosomal peptide synthetase enzymology. Nat Prod Rep, 2012, 29: 1074-1098. DOI:10.1039/c2np20025b |
| [5] | Konz D, Klens A, Sch?rgendorfer K, et al. The bacitracin biosynthesis operon of Bacillus licheniformis ATCC 10716: molecular characterization of three multi-modular peptide synthetases. Chem Biol, 1997, 4(12): 927-937. DOI:10.1016/S1074-5521(97)90301-X |
| [6] | Bernard R, El Ghachi M, Mengin-Lecreulx D, et al. BcrC from Bacillus subtilis acts as an undecaprenyl pyrophosphate phosphatase in bacitracin resistance. J Biol Chem, 2005, 280: 28852-28857. DOI:10.1074/jbc.M413750200 |
| [7] | Hancock REW. Mechanisms of action of newer antibiotics for Gram-positive pathogens. Lancet Infect Dis, 2005, 5: 209-218. DOI:10.1016/S1473-3099(05)70051-7 |
| [8] | Cai DB, Zhu J, Zhu S, et al. Metabolic engineering of main transcription factors in carbon, nitrogen, and phosphorus metabolisms for enhanced production of bacitracin in Bacillus licheniformis. ACS Synth Biol, 2019, 8: 866-875. DOI:10.1021/acssynbio.9b00005 |
| [9] | Cai D, Zhang B, Rao Y, et al. Improving the utilization rate of soybean meal for efficient production of bacitracin and heterologous proteins in the aprA-deficient strain of Bacillus licheniformis. Appl Microbiol Biotechnol, 2019, 103: 4789-4799. DOI:10.1007/s00253-019-09804-0 |
| [10] | Liu J, Chen YF, Wang WW, et al. Engineering of an Lrp family regulator SACE_Lrp improves erythromycin production in Saccharopolyspora erythraea. Metab Eng, 2017, 39: 29-37. DOI:10.1016/j.ymben.2016.10.012 |
| [11] | Deng Q, Zhou L, Luo MZ, et al. Heterologous expression of avermectins biosynthetic gene cluster by construction of a bacterial artificial chromosome library of the producers. Synth Syst Biotechnol, 2017, 2: 59-64. DOI:10.1016/j.synbio.2017.03.001 |
| [12] | Wu Q, Zhi Y, Xu Y. Systematically engineering the biosynthesis of a green biosurfactant surfactin by Bacillus subtilis 168. Metab Eng, 2019, 52: 87-97. DOI:10.1016/j.ymben.2018.11.004 |
| [13] | Zhu S, Cai DB, Liu ZW, et al. Enhancement of bacitracin production by NADPH generation via overexpressing glucose-6-phosphate dehydrogenase Zwf in Bacillus licheniformis. Appl Biochem Biotechnol, 2019, 187: 1502-1514. |
| [14] | He JM, Zhu H, Zheng GS, et al. Direct involvement of the master nitrogen metabolism regulator GlnR in antibiotic biosynthesis in Streptomyces. J Biol Chem, 2016, 291: 26443-26454. DOI:10.1074/jbc.M116.762476 |
| [15] | 李阳, 吴非, 蔡冬波, 等. 地衣芽胞杆菌DW2中敲除氨基酸转运蛋白基因yhdG提高杆菌肽产量. 生物工程学报, 2018, 34(6): 916-927. Li Y, Wu F, Cai DB, et al. Enhanced production of bacitracin by knocking out of amino acid permease gene yhdG in Bacillus licheniformis DW2. Chin J Biotech, 2018, 34(6): 916-927 (in Chinese). |
| [16] | Takagi H, Ohtsu I. L-cysteine metabolism and fermentation in microorganisms. Adv Biochem Eng Biotechnol, 2017, 159: 129-151. |
| [17] | Wei L, Wang H, Xu N, et al. Metabolic engineering of Corynebacterium glutamicum for L-cysteine production. Appl Microbiol Biotechnol, 2019, 103: 1325-1338. DOI:10.1007/s00253-018-9547-7 |
| [18] | Joo YC, Hyeon JE, Han SO. Metabolic design of Corynebacterium glutamicum for production of L-cysteine with consideration of sulfur- supplemented animal feed. J Agric Food Chem, 2017, 65: 4698-4707. DOI:10.1021/acs.jafc.7b01061 |
| [19] | Kishino M, Kondoh M, Hirasawa T. Enhanced L-cysteine production by overexpressing potential L-cysteine exporter genes in an L-cysteine- producing recombinant strain of Corynebacterium glutamicum. Biosci Biotechnol Biochem, 2019, 83: 2390-2393. DOI:10.1080/09168451.2019.1659715 |
| [20] | Kondoh M, Hirasawa T. L-cysteine production by metabolically engineered Corynebacterium glutamicum. Appl Microbiol Biotechnol, 2019, 103: 2609-2619. DOI:10.1007/s00253-019-09663-9 |
| [21] | Wang D, Wang Q, Qiu YM, et al. Enhancement of precursor amino acid supplies for improving bacitracin production by activation of branched chain amino acid transporter BrnQ and deletion of its regulator gene lrp in Bacillus licheniformis. Synth Syst Biotechnol, 2018, 3: 236-243. |
| [22] | Zhu J, Cai DB, Xu HX, et al. Untangling the transcription regulatory network of the bacitracin synthase operon in Bacillus licheniformis DW2. Res Microbiol, 2017, 168: 515-523. |
