
 , 刁梦雪2, 陆坚1
, 刁梦雪2, 陆坚1
 , 刘伟丰3, 陶勇3
, 刘伟丰3, 陶勇3 1. 广西大学 生命科学与技术学院,广西 南宁 530004;
2. 广西科学院 国家非粮生物质能源工程技术研究中心 非粮生物质酶解国家重点实验室 广西生物质工程技术研究中心,广西 南宁 530007;
3. 中国科学院微生物研究所,北京 100101
收稿日期:2020-10-21;接收日期:2021-03-06;网络出版时间:2021-04-14
基金项目:国家重点研发计划项目(No. 2019YFA0904300) 资助
摘要:角鲨烯因具有很强的抗氧化、抗菌和抗肿瘤活性,被普遍应用于医药、保健品和化妆品等领域。文中在实验室构建的高效合成萜类化合物底盘菌株工作的基础上,以角鲨烯为目标产物,通过过表达法尼基焦磷酸合酶基因ispA得到高效合成三萜化合物的底盘菌株;然后对原核生物来源的角鲨烯合酶进行系统发育分析、筛选、克隆和表达,得到两株高效合成角鲨烯的大肠杆菌Escherichia coli工程菌株。其中,导入来源于嗜热蓝细菌Thermosynechococcus elongatus和深蓝聚球蓝细菌Synechococcus lividus的角鲨烯合酶的工程菌株,角鲨烯产量分别达到(16.5±1.4) mg/g (细胞干重含量,后同) 和(12.0±1.9) mg/g,发酵液浓度达到(167.1±14.3) mg/L和(121.8±19.5) mg/L。相比于当前普遍使用的人源角鲨烯合酶及初代菌株,来源于T. elongatus和S. lividus的角鲨烯合酶分别使角鲨烯产量大幅提升了3.3倍和2.4倍,为原核细胞异源合成角鲨烯打下坚实的基础。
关键词:大肠杆菌角鲨烯生物合成原核基因筛选
Construction of squalene producing cell factories and screening, cloning and expression of key genes
Ning Li1, Bo Liu3

 , Mengxue Diao2, Jian Lu1
, Mengxue Diao2, Jian Lu1
 , Weifeng Liu3, Yong Tao3
, Weifeng Liu3, Yong Tao3 1. College of Life Science and Technology, Guangxi University, Nanning 530004, Guangxi, China;
2. National Engineering Research Center for Non-food Biorefinery, State Key Laboratory of Non-food Biomass Energy and Enzyme Technology, and Guangxi Key Laboratory of Biorefinery, Guangxi Academy of Sciences, Nanning 530007, Guangxi, China;
3. Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
Received: October 21, 2020; Accepted: March 6, 2021; Published: April 14, 2021
Supported by: National Key Research and Development Project of China (No. 2019YFA0904300)
Corresponding author: Bo Liu. Tel: +86-10-64807419; E-mail: ycliubo@qq.com;
Jian Lu. Tel: +86-771-3235707; E-mail: 923051916@qq.com.
Abstract: Squalene is widely used in pharmaceutical, nutraceutical, cosmetics and other fields because of its strong antioxidative, antibacterial and anti-tumor activities. In order to produce squalene, a gene ispA encoding farnesyl pyrophosphate synthase was overexpressed in a previously engineered Escherichia coli strain capable of efficiently producing terpenoids, resulting in a chassis strain that efficiently synthesizes triterpenoids. Through phylogenetic analysis, screening, cloning and expression of squalene synthase derived from different prokaryotes, engineered E. coli strains capable of efficiently producing squalene were obtained. Among them, squalene produced by strains harboring squalene synthase derived from Thermosynechococcus elongatus and Synechococcus lividus reached (16.5±1.4) mg/g DCW ((167.1±14.3) mg/L broth) and (12.0±1.9) mg/g DCW ((121.8±19.5) mg/L broth), respectively. Compared with the first-generation strains harboring the human-derived squalene synthase, the squalene synthase derived from T. elongatus and S. lividus remarkably increased the squalene production by 3.3 times and 2.4 times, respectively, making progress toward the cost-effective heterologous production of squalene.
Keywords: Escherichia colisqualenebiosynthesisprokaryotic gene screening
角鲨烯是由6个异戊二烯单位首尾连接形成的直链不饱和烯烃,因其最初来源于鲨鱼的肝脏,故而称为角鲨烯,又名鲨烯[1]。角鲨烯广泛存在于动植物以及微生物中,是合成三萜化合物和类固醇等工业产品的重要前体[2]。并且角鲨烯也因其一些良好的生物活性,被应用于食品[3]、医药[4]、化妆品[5]、保健品[6]等领域[7]。角鲨烯最初提取自鲨鱼的肝脏,随着鲨鱼种群数量的急剧下降以及相关动物保护条例的发布,已无法通过该渠道生产角鲨烯[8]。近年来,随着对角鲨烯的需求越来越大,为了满足市场需要,角鲨烯植物提取成为一种新的研究方向,但植物中角鲨烯含量很低,原材料处理困难,以及提取纯化工艺复杂等问题,导致生产成本太高和产量偏低,难以满足大批量的市场需求[9]。化学合成虽然可以实现角鲨烯大规模生产,但存在工艺步骤繁多、污染大和副产物等问题,导致下游分离纯化成本较高[10]。此外,化学合成来源的角鲨烯难以扩展到食品和保健品等应用领域。因此,建立新的角鲨烯绿色制造路线成为角鲨烯工业生产亟需解决的问题[11]。
作为三萜化合物的代表化合物,角鲨烯的合成与其他萜类化合物的生物合成途径一样,需要以关键中间体异戊烯焦磷酸(Isopentenyl diphosphate,IPP) 和二甲基烯丙基焦磷酸(Dimethylallyl-diphosphate,DMAPP) 为前体化合物[12]。目前已发现的合成IPP和DMAPP的途径主要有两条:甲基赤藓糖醇磷酸(2-C-methyl-D- erythritol 4-phosphate,MEP) 途径和甲羟戊酸(Mevalonate pathway,MVA) 途径[13] (图 1)。其中MVA途径主要存在于真核生物中,如植物、真菌等[14]。MEP途径主要存在于原核生物中,如大肠杆菌等[15]。
 |
| 图 1 MVA途径和MEP途径合成角鲨烯 Fig. 1 Synthesis of squalene via MVA pathway and MEP pathway. Ac-CoA: acetyl coenzyme A; MvaE Acetoacetyl-coenzyme A thiolase, MvaS Mevalonate synthase, HMG-CoA hydroxymethylglutaryl-CoA, MvaE hydroxymethylglutaryl-CoA reductase, MVA mevalonate, MVK mevalonate kinase, PMev mevalonate-5-phosphate, PMK phosphomevalonate kinase, PPMev mevalonate-5-diphosphate, MVD mevalonate pyrophosphate decarboxylase, IDI isopentenyl diphosphate isomerase, IspA farnesyl diphosphate synthase, FPP farnesyl diphosphate, PSPP pre-squalene diphosphate, SQS squalene synthase. |
| 图选项 |
大肠杆菌自身具备MEP途径,其主要利用该途径合成辅酶Q8参与细胞呼吸和电子传递链,因此该途径是生存必需途径[16]。此外,由于3-磷酸甘油醛(Glyceraldehyde-3-phosphate,G3P) 和丙酮酸(Pyruvate,PYR) 在大肠杆菌中央碳代谢途径中至关重要,若大量流入角鲨烯的生物合成途径,必然会影响大肠杆菌的生长[17]。因此本实验室前期借助实验室建立的新的位点特异性重组方法,先后将pSL91k-PM(A) 和pLB1s-ESK(A) 整合至lpxM位点(图 2)。将MVA途径整合至基因组,既解决多质粒易丢失的问题,又消除多质粒带给菌株生长的负担。最重要的是,得到一株高效供应IPP和DMAPP的大肠杆菌工程菌株(未发表工作),本研究在此基础上开展。当前角鲨烯合酶的筛选工作大多集中在真核来源,其中人源的角鲨烯合酶研究和应用最多。但真核来源的基因在原核细胞中表达时往往面临着表达量低和折叠错误等问题,使得利用可快速低成本培养的原核生物合成角鲨烯存在困难,因此需要挖掘原核来源的角鲨烯合酶。在已发表的关于原核角鲨烯合酶的文献中,来源于荚膜甲基球菌Methylococcus capsulatu[18]和嗜热蓝细菌Thermosynechococcus elongatus[19]的角鲨烯合酶已有生化数据发表(表 1),其中来源于T. elongatus的角鲨烯合酶的kcat/Km达到了1 800 L/(mmol·s),远高于人源的角鲨烯合酶510 L/(mmol·s)。本研究以此为基础,通过对KEGG中各属所有已注释的角鲨烯合酶进行系统发育分析,克隆了与之近源的角鲨烯合酶基因,并进行表达和角鲨烯产量测试。
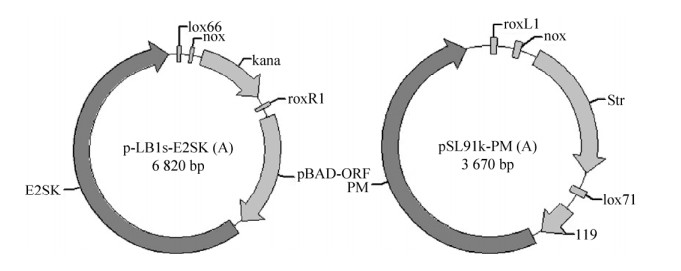 |
| 图 2 pSL91k-PM(A) 和pLB1s-E2SK(A) 图谱 Fig. 2 Map of pSL91k-PM(A) and pLB1s-ESK(A). E2SK: mvaE-mvaS-mvaE-mvK; PM: pmK-mvD. |
| 图选项 |
表 1 不同来源角鲨烯合酶kcat/Km值比较Table 1 Comparison of kcat/Km values of squalene synthase from different sources
| kcat/Km [L/mmol·s] | Substrates | Organisms | References |
| 35 | Farnesyl diphosphate | Methylococcus capsulatus | [18] |
| 510 | Homo sapiens | [19] | |
| 1 800 | Thermosynechococcus elongatus | [19] |
表选项
1 材料与方法1.1 材料1.1.1 菌株及质粒菌株:大肠杆菌Escherichia coli DH5α主要用于质粒构建,E. coli BW25113系列菌株主要用于蛋白表达与角鲨烯的合成,详细菌株及质粒信息见表 2。
表 2 菌株与质粒Table 2 Strains and plasmids used in this study
| Strains or plasmids | Genetic information |
| BW25113 | rrnBT14 ΔlacZWJ16 hsdR514 ΔaraBADAH33 ΔrhaBADLD78 [F?proAB lacIqZΔM15 Tn10 (Tetr)] |
| GY03 | BW25113, ΔlpxM: : pBAD-mvaE-mvaS-mvK-p119-pmK-mvD |
| T6 | GY03, p119-ispA |
| SQ01 | GY03, pLB1s-hSQS (Homo sapiens) |
| SQ02 | T6, pLB1s-hSQS (Homo sapiens) |
| SQ09 | T6, pLB1s-aSQS (Acaryochloris marina) |
| SQ10 | T6, pLB1s-tSQS (Thermosynechococcus elongatus BP-1) |
| SQ11 | T6, pLB1s-sSQS (Synechococcus lividus PCC 6715) |
| pLB1s-GFP | R6k replicon, streptomycin resistance, pBAD promoter expression vector |
| pKD46 | Realizing E. coli homologous recombination by expressing Red recombinase |
| pSB1s-Cre | Eliminating lox resistance marker by expressing fCre flipase |
| pSL91k-GFP | psc101 replicon, kanamycin resistant, lox66 and lox71 sites |
表选项
1.1.2 试剂及培养基配方1 000×抗生素:分别称取0.5 g链霉素和0.5 g卡那霉素溶解10 mL纯水中(PURELAB Ultra),0.22 μm无菌滤器(Millex-GP) 过滤后放置-30 ℃备用。
LB (Luria-Bertani) 培养基:蛋白胨10 g/L,酵母抽提物5 g/L,NaCl 10 g/L,固体培养基需另加15 g/L的琼脂粉,121 ℃灭菌20 min,液体培养基冷却至室温后添加所需的抗生素,放置4 ℃备用;固体培养基冷却至50 ℃左右添加所需的抗生素倒板,凝固后放置4 ℃备用。
感受态细胞制备试剂:CaCl2-MgCl2试剂含有80 mmol/L MgCl2和20 mmol/L CaCl2,CaCl2-甘油试剂含有100 mmol/L CaCl2和20%甘油,上述试剂115 ℃灭菌30 min,冷却至室温后放置4 ℃冰箱备用。
ZYM自诱导培养基:96 mL ZY培养基+ 2 mL 50×M salts+2 mL 50×5052+200 μL 1 mol/L硫酸镁+100 μL微量元素,抗生素按需添加。ZY培养基:10 g/L蛋白胨,5 g/L酵母提取物,121 ℃ 20 min灭菌后备用。
下列试剂均用0.22 μm滤膜除菌:
50×M salts:1.25 mol/L Na2HPO4,1.25 mol/L KH2PO4,2.5 mol/L NH4Cl和0.25 mol/L Na2SO4;50×5052:250 g/L甘油,25 g/L葡萄糖,100 g/L L-阿拉伯糖;1 mol/L MgSO4;1 000×微量元素:50 mmol/L FeCl3,20 mmol/L CaCl2,10 mmol/L MnCl2,10 mmol/L ZnSO4,CoCl2、NiCl2、Na2Mo4、Na2SeO3和H3BO3各2 mmol/L。
1.2 方法1.2.1 系统发育树的建立通过软件抓取KEGG数据库中所有Orthology为K00801 (EC 2.5.1.21) 的氨基酸序列,删除真核来源的氨基酸序列,然后每个属选取一个代表序列,整理成FASTA格式文件,同时加入人源角鲨烯合酶氨基酸序列,进行系统发育分析。将上述序列导入MEGA-X软件后,使用软件内的clustalW算法进行多重序列比对,采用最大似然法构建系统发育树。
1.2.2 基因克隆与载体构建基因由南京金斯瑞生物科技有限公司合成,以其合成的DNA片段为模板,用引物hSQS-NcoⅠ-F和hSQS-XhoⅠ-R,或者NcoⅠ-F和XhoⅠ-R进行PCR扩增,得到基因片段;以质粒pLB1s-GFP为模板,用引物XhoⅠ-KZ-F和NcoⅠ-KZ-R扩增得到载体片段,上述片段均采用胶回收的方式纯化回收,具体操作参见E.Z.N.A.? Gel Extraction Kit Centrifugation Protocol。将获得的基因片段与载体片段采用Gibson Assembly? Master Mix进行连接,构建重组质粒pLB1s-hSQS,pLB1s-tSQS,pLB1s-aSQS和pLB1s-sSQS,使用引物PBAD-F108和PBAD-R124对转化子进行PCR和测序鉴定,引物详情见表 3。
表 3 本研究所用引物Table 3 Primers used in this study
| Primers | Sequences (5′-3′) |
| hSQS-NcoⅠ-F | GCTAACAGGAGGAATTAACCATGGACCAAGATAGTCTGAG |
| hSQS-XhoⅠ-R | TAGTACCAGATCTACCCTCGAGATTCTGGGTGCGAATGGTGC |
| XhoⅠ-KZ-F | CTCGAGGGTAGATCTGGTACTA |
| NcoⅠ-KZ-R | GGTTAATTCCTCCTGTTAGC |
| NcoⅠ-F | GCTAACAGGAGGAATTAACC |
| XhoⅠ-R | TAGTACCAGATCTACCCTCGAG |
| PBAD-F108 | CGGCGTCACACTTTGCTATG |
| PBAD-R124 | TCGCATGGGGAGACCCCACA |
| 119(ispA)-kz-F | GCGCGTACAAATTCTGCTGTCTGACAATGAAGACGCCTCTCTAACCCCTTTTACACCGGACAATGAGTACACAGCTAACACCACGTCGT |
| 119(ispA)-kz-R | CCTGGTTGGCCTGCTTAACGCAGGCTTCGAGTTGCTGCGGAAAGTCCATGGTTAATTCCTCCTGTTAGCAAAGTTAAACAAAATTATTT |
| 119-F | TTGACAGCTAGCTCAGTCCT |
| ispA-500R | CGAAATTCTGTCGCGGTCCG |
表选项
1.2.3 工程菌株的自诱导培养和全细胞催化待测试菌株划线于37 ℃过夜培养后,随机挑取3个单菌落,接种到3 mL LB培养基,置于37 ℃ 220 r/min摇床过夜活化,按照1%的比例转接到ZYM培养基,置于30 ℃ 220 r/min摇床,培养12 h后收集60 OD细胞,重悬于3 mL 1×M9 10 g/L葡萄糖转化液中,在37 ℃ 220 r/min条件下全细胞催化24 h。
1.2.4 角鲨烯提取取400 μL发酵24 h的全细胞催化液,13 000×g离心10 min弃上清;加入400 μL生理盐水清洗发酵菌体,13 000×g离心10 min弃上清;加入ddH2O,充分混匀,定容至400 μL;超声破胞,工作功率20%,工作时长2 min,超声3 s,停止5 s;加入600 μL乙酸乙酯,立即晃动使其充分混合,放入超声波清洗机,超声两次,每次15 min,之后离心;取萃取相400 μL,用真空离心浓缩仪将萃取剂挥发去除,加入200 μL甲醇复溶,0.22 μm滤膜过滤,待测。
1.2.5 角鲨烯产量检测使用高效液相色谱对角鲨烯进行检测,色谱条件如下:色谱柱:Waters XBridgeTM C18 (3.5 μm 4.6 mm×150 mm);柱温:35 ℃;流动相:100%纯乙腈;流速:1 mL/min;检测器:光电二极管阵列检测器196 nm检测;检测时间: 16 min。
1.2.6 基因组上ispA启动子的替换将ispA启动子更换为119启动子,具体操作如下:以pSL91k-GFP为模板,使用引物119(ispA)-kz-F和119(ispA)-kz-R扩增得到含有卡那霉素抗性标记和119启动子的目的片段,DpnⅠ处理后脱盐回收得到打靶片段。将pKD46转入GY03,接种至含2 g/L阿拉伯糖的LB培养基中,生长至OD600为0.8后收菌,置于冰上,用10%的甘油清洗两遍后,制备得到电转感受态细胞。将打靶片段电转入GY03感受态细胞,涂于卡那霉素抗性的LB平板,转化子用119-F和ispA-500R引物对进行PCR和测序鉴定。
2 结果与分析2.1 原核生物角鲨烯合酶系统发育树建立分析与基因合成本研究从KEGG一共整理了152个属的角鲨烯合酶氨基酸序列(共155个),包括一个真核来源(人源) 序列和154个原核来源序列。通过系统发育分析,发现从进化的角度上来讲,原核角鲨烯合酶可分为6大分支(图 2)。从聚类上来看,比较意外的是来源于Halocella、Halanaerobium、Halothermothrix、Fluviicola和Brachyspira五个属的角鲨烯合酶与人类的近源,且该分支多为嗜盐菌。甲基球菌和嗜热聚球藻聚集到了一个分支,其中甲基球菌的角鲨烯合酶已有研究报道,普遍活性不高。据2015年Katabami等[19]的报道,来源于T. elongatus的角鲨烯合酶效率最高(kcat/Km值)。但是其最适生长温度为55 ℃,而大肠杆菌的最适生长温度为37 ℃。考虑到要在大肠杆菌中使用该酶构建角鲨烯合成途径,因此我们分析了嗜热聚球藻分支中最适生长温度在25-42 ℃之间的原核生物,发现了除T. elongatus之外的两个候选酶,分别来源于Acaryochloris marina和S. lividus,其中A. marina的最适生长温度是28 ℃[19],S. lividus的最适生长温度是25 ℃[20]。因此,我们对T. elongatus、A. marina和S. lividus来源的角鲨烯合酶基因进行了全基因合成,并且根据大肠杆菌密码子偏好性进行了序列优化(图 3)。
 |
| 图 3 角鲨烯合酶系统发育分析(最大似然法) Fig. 3 Phylogenetic analysis of squalene synthase (maximum likelihood method). |
| 图选项 |
2.2 人源与原核来源角鲨烯合酶基因表达载体的构建为了与新筛选的原核来源角鲨烯合酶进行比较,我们首先克隆并表达了人源角鲨烯合酶。以实验室前期合成的人源角鲨烯合酶基因为模板进行扩增与构建。目的基因核酸电泳结果如图 4A所示,扩增片段电泳条带与目的基因理论大小一致,均是1.1 kb。载体核酸电泳结果如图 4B所示,扩增片段电泳条带与载体理论大小一致,均是4.5 kb。阳性质粒克隆核酸电泳结果如图 4C所示,菌液PCR电泳条带与理论条带大小一致,均是1.3 kb。上述结果表明,人源角鲨烯合酶表达载体构建成功。
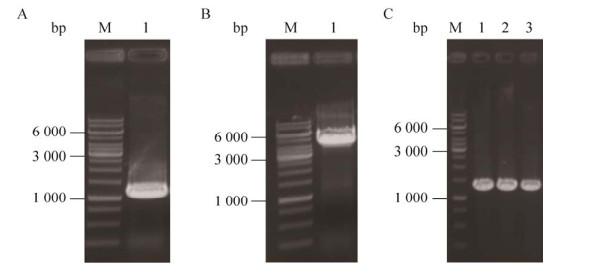 |
| 图 4 人源角鲨烯合酶的克隆 Fig. 4 Cloning of human squalene synthase. M: nucleic acid molecular weight marker. (A) Nucleic acid electrophoresis of target gene fragment, 1: hSQS gene fragment. (B) Nucleic acid electrophoresis of target vector fragment, 1: amplification of pLB1s. (C) Nucleic acid electrophoresis of positive monoclonal identification, 1-3: pLB1s-hSQS. |
| 图选项 |
以2.1中合成的来源于T. elongatus、A. marina和S. lividus的角鲨烯合酶基因为模板进行扩增与构建,经菌液PCR和测序,结果均正确,表明3种原核来源的角鲨烯合酶表达载体构建成功。将以上4种不同来源的角鲨烯合酶重组质粒化转入底盘细胞GY03,对其进行自诱导培养,其SDS-PAGE分析结果如图 5所示,人源角鲨烯合酶hSQS在37.4 kDa有较为明显的条带,而分别来源于T. elongatus (tSQS)、A. marina (aSQS) 和S. lividus (sSQS) 的角鲨烯合酶在39.5 kDa处无明显条带。
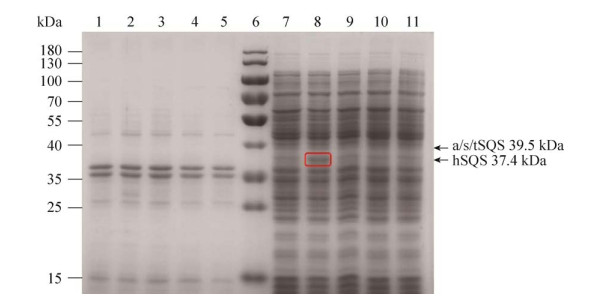 |
| 图 5 四种不同来源角鲨烯合酶的SDS-PAGE分析 Fig. 5 SDS-PAGE analysis of squalene synthase from four different sources. 1-5: the supernatants of GY03, SQ09, SQ11, SQ02 and SQ10; 6: marker; 7-11: the precipitates of SQ10, SQ02, SQ11, SQ09 and GY03 in turn. |
| 图选项 |
2.3 基因组上过表达ispA基因菌株的构建基因ispA启动子更换的打靶片段核酸电泳结果如图 6A 1和2所示,扩增片段电泳与目的片段理论大小一致,均是3.5 kb。重构菌株核酸电泳结果如图 6B 1-5所示,菌液PCR电泳条带与理论条带大小一致,均是600 bp,阴性对照无条带。以上结果经测序均正确,表明基因组原位点过表达ispA的菌株构建成功,命名为T6。
 |
| 图 6 基因组原位点ispA启动子替换 Fig. 6 The ispA promoter replacement at the original site of the genome. (A) nucleic acid electrophoresis of targeted fragment, 1-2: p119-ispA targeted fragment. (B) nucleic acid electrophoresis of positive monoclonal identification, 1-4: T6. 5: negative control. |
| 图选项 |
2.4 人源产角鲨烯大肠杆菌工程菌株的构建与优化将人源角鲨烯合酶表达载体pLB1s-hSQS转入高通量萜类化合物合成底盘菌株GY03,得到角鲨烯合成初代菌株SQ01。该菌株可以有效地合成角鲨烯,在24 h内角鲨烯胞内含量可以达到(5.0±0.8) mg/g,发酵液含量达到(49.9±8) mg/L (图 7)。
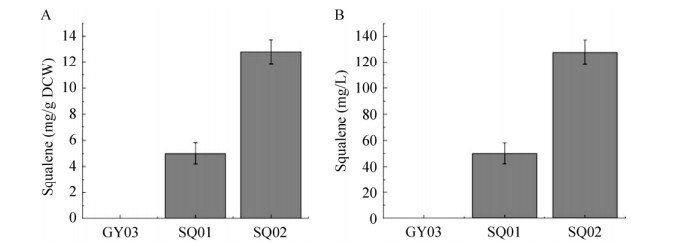 |
| 图 7 角鲨烯产量 Fig. 7 Specific squalene production ability (A) and titer of squalene in fermentation broth (B). GY03: terpenoids producing chassis; SQ01: the control strain harboring hSQS; SQ02: ispA overexpressing strain harboring hSQS. |
| 图选项 |
IspA是法尼基焦磷酸合酶(Farnesyl diphosphate synthase),也是三萜类化合物合成的关键酶和限速酶。大肠杆菌本底表达ispA基因所获得的法呢基焦磷酸(Farnesyl diphosphate,FPP) 仅能满足自身合成辅酶Q8供生长所需。为了进一步提高FPP的供应,为角鲨烯合成提供足量的FPP,将ispA启动子更换为119启动子,得到菌株T6;将pLB1s-hSQS转入T6,得到菌株SQ02。在24 h内,SQ02胞内角鲨烯含量可以达到(12.8±0.9) mg/g,发酵液含量达到(127±9) mg/L。
2.5 原核来源角鲨烯合酶合成角鲨烯将2.1、2.2和2.4中筛选、优化和构建的来源于原核生物A. marina、T. elongatus和S. lividus的角鲨烯合酶表达载体转入宿主T6,分别得到角鲨烯合成工程菌株SQ09、SQ10和SQ11。通过ZYM诱导和全细胞催化测试其角鲨烯产量,结果发现来源于A. marina的角鲨烯合酶效果最差,在24 h内其胞内仅能积累(1.6±0.5) mg/g,发酵液含量为(15.8± 0.7) mg/L,无法满足生产的要求。来源于S. lividus的角鲨烯合酶效果与人源相当,在24 h内其胞内能积累(12.0±1.9) mg/g,发酵液含量为(121.8±19.5) mg/L。来源于T. elongatus的角鲨烯合酶效果最好,在24 h内其胞内能积累(16.5±1.4) mg/g,发酵液含量为(167.1±14.3) mg/L,相比于人源的工程菌株,细胞干重产量提升31% (图 8-9)。
 |
| 图 8 角鲨烯产量 Fig. 8 Specific squalene production ability (A) and titer of squalene in fermentation broth (B). Strains SQ02, SQ09, SQ10, and SQ11 were constructed based on strain T6, harboring squalene synthase from human, A. marina, T. elongates and S. lividus, respectively. |
| 图选项 |
 |
| 图 9 SQ01、SQ02、SQ09、SQ10、SQ11菌株的高效液相色谱图 Fig. 9 High performance liquid chromatogram of strains SQ01, SQ02, SQ09, SQ10 and SQ11. |
| 图选项 |
3 讨论大肠杆菌自身具有生长周期短、繁殖快、易操作等特点,且可以在短时间获得基因表达产物,所需成本低,故成为异源基因首选的表达系统[20]。大肠杆菌本身没有角鲨烯合酶,不能生成角鲨烯。所以,对于角鲨烯的生物合成来说,是一个“空白”的背景。因此,以大肠杆菌为研究对象,也更能反映导入的角鲨烯合酶的活力,排除研究对象自身存在的干扰。此外。本研究以实验室已异源引入MVA途径,于质粒水平进行模块优化,并最终整合至基因组的菌株为底盘菌,大大提高了前体化合物的供应,借助高效液相色谱的检测手段,可以更加直观地比较各个酶合成角鲨烯的能力,为角鲨烯合酶的筛选提供良好的条件。
本研究针对角鲨烯异源生物合成过程中,关键基因角鲨烯合酶基因的研究多集中在人源,原核来源的角鲨烯合酶研究较少等问题,进行了系统性的研究。通过对已测序各属的角鲨烯合酶氨基酸序列进行收集和整理,进而以最大似然法为基础构建系统发育树,对原核来源的角鲨烯合酶进行了系统性的梳理,发现这些酶从进化的关系上可分为6大分支(图 2)。
通过克隆、优化表达与测试人源的角鲨烯合酶,我们构建了一株角鲨烯合成初代菌株,进而通过在基因组上提高限速酶IspA的表达量,构建了高效合成倍半萜和三萜的底盘菌株,可用于对角鲨烯合酶的筛选与评测。
据文献报道[19],来源于嗜热聚球藻的角鲨烯合酶具有很高的转化数。因此,我们从该分支筛选了来源于T. elongatus及近源部分属常温生物的角鲨烯合酶。通过基因密码子优化、克隆、表达与测试,在上述构建的底盘菌株中筛选到一个与人源基因效果相当的角鲨烯合酶。与此同时,我们还筛选到了一个效果优于人源的角鲨烯合酶,使角鲨烯细胞干重产量提升了约31%。通过筛选新的酶资源与优化底盘菌株,我们构建的产角鲨烯工程菌株的角鲨烯产量比于初代菌株提高了3.3倍(T. elongatus)和2.4倍(S. lividus),为角鲨烯在原核生物中异源合成打下了坚实的基础。
近年来,利用生物合成的方式生产角鲨烯已取得一定的成绩。Ghimire等[21]在大肠杆菌中导入并表达hopA、hopB和hopD三个基因,得到4.1 mg/L的角鲨烯;在此基础上以质粒的形式过表达MEP途径中的限速酶1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS) 和异戊烯基二磷酸异构酶(Isopentenyl pyrophosphate isomerase,IDI),将角鲨烯的产量提高到11.8 mg/L。与其类似,张亦男等[22]通过过表达MEP途径中的限速酶IDI和DXS,然后导入人源角鲨烯合酶,后期对发酵条件进行优化。最终,角鲨烯产量为73.88 mg/L。Xu等[23]通过提高NADPH/NADP+比值,修改类异戊二烯途径供给模块,阻断甲基萘醌代谢途径,然后导入人源角鲨烯合酶。最终,构建的大肠杆菌工程菌株角鲨烯产量为52.1 mg/L。本研究所构的工程菌株,角鲨烯产量为167.1 mg/L,已具备一定的角鲨烯工业化生产潜力。后续,可以通过对角鲨烯代谢通路的调控[24]、胞内辅因子的平衡[25]、发酵条件的优化[22]等方式,对该菌株的性能和生产角鲨烯的能力进一步提升,达到可以工业化生产角鲨烯的水平。
参考文献
| [1] | Heller JH, Heller MS, Springer S, et al. Squalene content of various shark livers. Nature, 1957, 179(4566): 919-920. |
| [2] | Dong LM, Pollier J, Bassard JE, et al. Co-expression of squalene epoxidases with triterpene cyclases boosts production of triterpenoids in plants and yeast. Metabo Eng, 2018, 49: 1-12. DOI:10.1016/j.ymben.2018.07.002 |
| [3] | Naziri E, Tsimidou MZ. Formulated squalene for food related applications. Recent Patents on Food, Nutr Agric, 2013, 5(2): 83-104. DOI:10.2174/1876142911305020001 |
| [4] | Chen YK, Chen X, Luo GG, et al. Discovery of potential inhibitors of squalene synthase from traditional Chinese medicine based on virtual screening and in vitro evaluation of lipid-lowering effect. Molecules, 2018, 23(5): 1040. DOI:10.3390/molecules23051040 |
| [5] | Huang ZR, Lin YK, Fang JY. Biological and pharmacological activities of squalene and related compounds: potential uses in cosmetic dermatology. Molecules, 2009, 14(1): 540-554. DOI:10.3390/molecules14010540 |
| [6] | 李颂, 刘洋, 王春玲. 角鲨烯的健康功效及应用. 食品研究与开发, 2016, 37(14): 206-209. Li S, Liu Y, Wang CL. The health benefits and application of squalene. Food Res Dev, 2016, 37(14): 206-209 (in Chinese). DOI:10.3969/j.issn.1005-6521.2016.14.050 |
| [7] | Rouquette M, Ser-Le Roux K, Polrot M, et al. Towards a clinical application of freeze-dried squalene-based nanomedicines. J Drug Target, 2019, 27(5/6): 699-708. |
| [8] | 吴时敏. 角鲨烯开发利用. 粮食与油脂, 2001(1): 36. Wu SM. Developments and application of squalene. Grains Fats, 2001(1): 36 (in Chinese). DOI:10.3969/j.issn.1008-9578.2001.01.015 |
| [9] | Nachar A, Saleem A, Arnason JT, et al. Regulation of liver cell glucose homeostasis by dehydroabietic acid, abietic acid and squalene isolated from balsam fir (Abies balsamea (L.) Mill.) a plant of the Eastern James Bay Cree traditional pharmacopeia. Phytochemistry, 2015, 117: 373-379. DOI:10.1016/j.phytochem.2015.07.001 |
| [10] | Popjak G, Cornforth JW, Cornforth RH, et al. Studies on the biosynthesis of cholesterol. XVI. Chemical synthesis of 1-H2-3-2-C-14- and 1-D2-2-C-14-trans-trans-farnesyl pyrophosphate and their utilization in squalene biosynthesis. J Biol Chem, 1962, 237: 56-61. DOI:10.1016/S0021-9258(18)81360-6 |
| [11] | Pan JJ, Solbiati JO, Ramamoorthy G, et al. Biosynthesis of squalene from farnesyl diphosphate in bacteria: three steps catalyzed by three enzymes. ACS Central Sci, 2015, 1(2): 77-82. DOI:10.1021/acscentsci.5b00115 |
| [12] | Tritsch D, Hemmerlin A, Bach TJ, et al. Plant isoprenoid biosynthesis via the MEP pathway: in vivo IPP/DMAPP ratio produced by (E)-4-hydroxy-3-methylbut-2-enyl diphosphate reductase in tobacco BY-2 cell cultures. FEBS Lett, 2010, 584(1): 129-134. DOI:10.1016/j.febslet.2009.11.010 |
| [13] | Gastaldo C, Lipko A, Motsch E, et al. Biosynthesis of isoprene units in Euphorbia lathyris laticifers vs. other tissues: MVA and MEP pathways, compartmentation and putative endophytic fungi contribution. Molecules, 2019, 24(23): 4322. DOI:10.3390/molecules24234322 |
| [14] | Bansal S, Narnoliya LK, Mishra B, et al. HMG-CoA reductase from Camphor Tulsi (Ocimum kilimandscharicum) regulated MVA dependent biosynthesis of diverse terpenoids in homologous and heterologous plant systems. Sci Rep, 2018, 8: 3547. DOI:10.1038/s41598-017-17153-z |
| [15] | Simpson K, Quiroz LF, Rodriguez-Concepción M, et al. Differential contribution of the first two enzymes of the mep pathway to the supply of metabolic precursors for carotenoid and chlorophyll biosynthesis in carrot (Daucus carota). Front Plant Sci, 2016, 7: 1344. |
| [16] | Lu WQ, Ye L, Xu H, et al. Enhanced production of coenzyme Q10 by self-regulating the engineered MEP pathway in Rhodobacter sphaeroides. Biotechnol Bioeng, 2014, 111(4): 761-769. DOI:10.1002/bit.25130 |
| [17] | Cho H S, Seo S W, Mi Kim Y, et al. Engineering glyceraldehyde-3-phosphate dehydrogenase for switching control of glycolysis in Escherichia coli. Biotechnol Bioeng, 2012, 109(10): 2612-2619. DOI:10.1002/bit.24532 |
| [18] | Huang D, Yao YP, Zhang H, et al. Directed optimization of a newly identified squalene synthase from Mortierella alpine based on sequence truncation and site-directed mutagenesis. J Ind Microbiol Biotechnol, 2015, 42(10): 1341-1352. DOI:10.1007/s10295-015-1668-8 |
| [19] | Katabami A, Li L, Iwasaki M, et al. Production of squalene by squalene synthases and their truncated mutants in Escherichia coli. J Biosci Bioeng, 2015, 119(2): 165-171. DOI:10.1016/j.jbiosc.2014.07.013 |
| [20] | Sadeghian-Rizi T, Ebrahimi A, Moazzen F, et al. Improvement of solubility and yield of recombinant protein expression in E. coli using a two-step system. Res Pharmaceut Sci, 2019, 14(5): 400-407. DOI:10.4103/1735-5362.268200 |
| [21] | Ghimire GP, Lee HC, Sohng JK. Improved squalene production via modulation of the methylerythritol 4-phosphate pathway and heterologous expression of genes from Streptomyces peucetius ATCC 27952 in Escherichia coli. Appl Environ Microbiol, 2009, 75(22): 7291-7293. DOI:10.1128/AEM.01402-09 |
| [22] | 张亦男, 刘振, 毛相朝. 大肠杆菌角鲨烯合成途径的构建与调控. 工业微生物, 2019, 49(3): 1-6. Zhang YN, Liu Z, Mao XZ. Construction and regulation of squalene synthesis pathway in Escherichia coli. Ind Microbiol, 2019, 49(3): 1-6 (in Chinese). DOI:10.3969/j.issn.1001-6678.2019.03.001 |
| [23] | Xu W, Yao J, Liu LJ, et al. Improving squalene production by enhancing the NADPH/NADP+ ratio, modifying the isoprenoid-feeding module and blocking the menaquinone pathway in Escherichia coli. Biotechnol Biofuels, 2019, 12: 68. DOI:10.1186/s13068-019-1415-x |
| [24] | 刘伟丰, 陶勇. 蛋白质预算: 合成生物学的成本标尺. 生物工程学报, 2013, 29(8): 1123-1132. Liu WF, Tao Y. Protein budget: cost estimating criteria for synthetic biology. Chin J Biotech, 2013, 29(8): 1123-1132 (in Chinese). |
| [25] | Jarstfer MB, Zhang DL, Poulter CD. Recombinant squalene synthase. Synthesis of non-head-to-tail isoprenoids in the absence of NADPH. J Am Chem Soc, 2002, 124(30): 8834-8845. DOI:10.1021/ja020410i |
