

北华大学 医学技术学院,吉林 吉林 132013
收稿日期:2020-09-05;接收日期:2021-01-05;网络出版时间:2021-02-07
基金项目:吉林省科技发展计划项目(Nos. 20190301014NY, 20190304115YY),吉林省教育厅“十三五”科学技术项目(No. JJKH20190657KJ),北华大学研究生创新项目(No. 2019015) 资助
摘要:运用生物信息学方法进行东北林蛙抗菌肽dybowskin-1ST的进化、结构及抗原表位预测,分析其抑菌机理及结构性质,应用小鼠伤口愈合实验及体外抑菌实验进行活性验证。同时为改良亲本肽、进行新型衍生肽的研发提供理论基础。使用软件MEGA_X对dybowskin-1ST及其他蛙类抗菌肽进行同源性比对并绘制系统进化树;通过在线软件ProtParam、ProtScale、PeptideCutter、SignalP、TMHMM Server分别预测抗菌肽dybowskin-1ST的理化参数、亲/疏水性、剪切位点、信号肽及跨膜区域;分别应用SOPMA、Jpred4及DNAstar Protean软件多重分析预测dybowskin-1ST的二级结构,利用SWISS-MODEL和I-TASSER软件进行三级结构预测。通过在线软件ABCpred和SYFPEITHI进行T/B抗原表位预测。构建小鼠伤口模型,观察dybowskin-1ST促进伤口愈合活性。应用纸片法及96孔板法,确定dybowskin-1ST的抑菌活性。抗菌肽dybowskin-1ST含有59个氨基酸,其中亮氨酸占16.9%,分子式为C318H510N80O93S2,理论等电点为5.10,电荷量为-2。抗菌肽dybowskin-1ST与东北林蛙抗菌肽dybowskin-1CDYa亲缘较近。三种方法二级结构预测结果相似,dybowskin-1ST中α-螺旋、延伸链、β-转角、无规卷曲,所占比例分别为44.07%、16.95%、3.39%、35.39%。三级结构预测中显示该抗菌肽大部分为α-螺旋结构,抗菌肽dybowskin-1ST总体预测为亲水性蛋白,具有信号肽序列。亚细胞定位分析显示,其分泌线粒体靶向肽的可能性为0.944。该蛋白属于膜外蛋白,无跨膜结构区,有7个磷酸化位点,3个T细胞抗原表位和8个B细胞抗原表位。dybowskin-1ST具有促进伤口愈合的作用,能够有效抑制大肠杆菌和金黄色葡萄球菌活性,但对真菌及耐药菌的抑菌活性有限。dybowskin-1ST结构中虽富含α-螺旋,但验证实验表明其抑菌能力仍有待加强,原因可能是由于其带负电荷且为亲水性蛋白,以提高正电荷数及改变疏水性为基本思路进行氨基酸改造可获得活性升级的衍生肽。
关键词:林蛙抗菌肽生物信息学伤口愈合抑菌作用
Structure prediction and biological activity analysis of dybowskin-1ST antimicrobial peptide in Rana dybowskii
Yue Liu, Xuechao Shao, Tiantian Wang, Xinying Wang, Nan Li, Yundong Zhao, Liyuan Sun


School of Medicine, Beihua University, Jilin 132013, Jilin, China
Received: September 5, 2020; Accepted: January 5, 2021; Published: February 7, 2021
Supported by: Jilin Province's Science and Technology Development Project, China (Nos. 20190301014NY, 20190304115YY), The "13th Five-Year" Science and Technology Project of Jilin Provincial Education Department, China (No. JJKH20190657KJ), Graduate Innovation Program of Beihua University, China (No. 2019015)
Corresponding author: Liyuan Sun. Tel/Fax: +86-18604498551; E-mail: jlsunliyuan@163.com.
Abstract: The evolution, structure and antigenic epitopes prediction of Rana dybowskii antimicrobial peptide dybowskin-1ST were carried out using bioinformatics software available online. Its antibacterial mechanism and structural properties were analyzed, and its activity was verified by applying wound healing assay in mice and bacteriostatic assay in vitro. This provides the theoretical basis for the improvement of parental peptide and the development of novel derivative peptides. The software MEGA_X were used to conduct homology alignment and to construct a phylogenetic tree. The online software ProtParam, ProtScale, PeptideCutter, signal, TMHMM Server were respectively used to predict the physicochemical parameters, hydrophilia/hydrophobicity, shear sites, signal peptides, and transmembrane domains of dybowskin-1ST. The online software SOPMA, Jpred4, DNAstar Protean were used to predict the secondary structure of dybowskin-1ST, and SWISS-MODEL, I-TASSER were used to predict the tertiary structure. ABCpred and SYFPEITHI were respectively used to predict its B-and T-cell epitopes. The effect of dybowskin-1ST on the wound healing was observed on experimental mice. Kirby-Bauer method and dilution method were used to determine the bacteriostatic activity of dybowskin-1ST. The dybowskin-1ST consists of 59 amino acid residues, of which leucine accounts for 16.9%, with a molecular formula of C318H510N80O93S2. Its theoretical isoelectric point is 5.10 and the charge is -2. The dybowskin-1ST and dybowskin-1CDYa are closely related phylogenetically. The secondary structure of dybowskin-1ST predicted by the three methods were similar, which consisted of α-helix (44.07%), extended strand (16.95%), β-turns (3.39%), and random coil (35.39%). The prediction of tertiary structure showed that dybowskin-1ST was mainly composed of α-helix, and it was regarded as a hydrophilic protein with signal peptide sequence. Subcellular localization analysis showed that the probability of secreting the mitochondrial targeted peptides was 0.944. Dybowskin-1ST is an extracellular protein with no transmembrane structure region, but contains seven phosphorylation sites, three T-cell epitopes and eight B-cell epitopes. The dybowskin-1ST promoted wound healing and effectively inhibited the growth of Escherichia coli and Staphylococcus aureus. However, it had limited antibacterial activity against fungi and drug-resistant bacteria. Although the structure of dybowskin-1ST is rich in α-helix, the verification experiments showed that its antibacterial ability needs to be enhanced. The reason may be that it is a negatively charged and hydrophilic protein, and amino acid modification with the aim of increasing the number of positive charges and changing the hydrophobicity may be used to obtain derived peptides with enhanced activity.
Keywords: Ranaantimicrobial peptidebioinformatics analysiswound healingbacteriostasis
抗菌肽(Antimicrobialpeptides,AMPs) 是一类小型阳离子两亲肽,可由各种动物、昆虫和植物体产生[1]。大部分对抗菌肽作用机制的研究表明,抗菌肽可以整合并渗透入微生物膜,发挥抑菌作用[2],不易产生耐药性,且抗菌谱广[3]。近年来,抗菌肽被广泛认为是最有潜力的抗生素替代药物[4]。同时,研究认为[5]抗菌肽能够与核糖体结合,干扰细菌蛋白质合成过程。两栖类动物的皮肤分泌物因其独特的化学性质和生物合成途径以及潜在的临床应用价值而备受关注[6]。东北林蛙作为典型的两栖动物,在我国东北及邻近地区广泛分布,具有重要的药用价值[7]。dybowskin-1ST是由林蛙皮中提取的具有59个氨基酸残基的抗菌肽,它能够抑制革兰氏阴性菌、革兰氏阳性菌的生长,同时具有促进伤口愈合、抗病毒等作用[8-12]。
抗菌肽的基本结构为多肽链,氨基酸序列决定其理化性质及二级结构等因素,从而决定抗菌肽抑菌活性。Wang等[13]的研究中用精氨酸取代赖氨酸可增强抗菌肽的抑菌活性,拓宽其抗菌谱。然而,移除抗菌肽Bac7[14]N-端的两个精氨酸残基使其大部分抑菌活性丧失。没有根据地进行氨基酸替换、抗菌肽合成、抑菌性能验证,会造成时间及成本损耗。应用生物信息学方法,对氨基酸序列进行有关抑菌性能的参数预测,对于进一步了解抗菌肽的活性及作用机理具有重要意义。本文对东北林蛙抗菌肽dybowskin-1ST的理化性质、二级结构、磷酸化位点、疏水性、剪切位点等特征进行分析,并构建林蛙抗菌肽的系统发育树,同时对东北林蛙抗菌肽dybowskin-1ST的生物学活性进行实验验证,以期深入理解抗菌肽dybowskin-1ST的抑菌机制,为进行下一步蛋白质改造提供可行思路。
1 材料与方法1.1 dybowskin-1ST抗菌肽从NCBI中下载东北林蛙抗菌肽dybowskin- 1ST序列,基因ID:GU249565.1,蛋白ID:ADC54260.1。其氨基酸序列为MFTLKKSLLLLFFLGTISLSLCEEERNAEEERRDYPEERDVEVEKRIIPLPLGYFAKKT。实验用dybowskin-1ST抗菌肽(纯度95%),由上海楚肽生物科技有限公司合成。
1.2 实验动物北华大学实验动物中心提供30例SPF级KM小鼠,随机将其分为观察组、对照组,其中观察组有小鼠20只,平均体重(26.7±9.6) g。对照组小鼠10只,平均体重(27.3±9.4) g。两组小鼠均为雄性,性别、体重等组间数据差异不显著。
1.3 菌种大肠埃希菌ATCC 43889、金黄色葡萄球菌ATCC 6538、白假丝酵母菌ATCC 90028、铜绿假单胞菌CMCC(B)10104,由中国科学院微生物研究所提供。
1.4 试剂及器材8 mm口径小鼠皮肤打孔器,薇婷脱毛膏,创可贴,LB培养基(购于青岛海博生物技术有限公司),四环素纸片(购于比克曼生物科技有限公司)。
1.5 dybowskin-1ST生物信息学预测1.5.1 构建dybowskin-1ST系统发育树利用MEGA_X对东北林蛙抗菌肽dybowskin-1ST (GenBank登录号:GU249565.1) 与黑龙江林蛙抗菌肽Temporin-AM (GenBank登录号:JF922737.1、JF922736.1)、Amurin-3 (GenBank登录号:AM233687.1),北美豹蛙抗菌肽Temporin-1P (GenBank登录号:AM493728.1)、湿地林蛙抗菌肽Temporin H (GenBank登录号:Y09394.1)、Temporin B (GenBank登录号:Y09393.1)、东北林蛙抗菌肽dybowskin-1CDYa (GenBank登录号:EU827807.1)、福建大头蛙抗菌肽Limnonectin-1Fb (FR733639.1)、Limnonectin-1Fa (GenBank登录号:FR733638.1)、花臭蛙抗菌肽Brevinin-1S (GenBank登录号:AJ971790.1)、沼泽林蛙抗菌肽Brevinin-1 PLc (GenBank登录号:AM745088.1) 进行同源性比对,并绘制系统进化树。
1.5.2 dybowskin-1ST理化性质预测利用专门收录抗菌肽的数据库APD中进行抗菌肽生物信息学分析的网站ExPASy (https://web.expasy.org/) 上的ProtParam软件进行蛋白质结构预测,此方式可得到其相关理化参数及疏水性,理化参数包括:理论等电点、分析氨基酸及原子组成、半衰期、GRAVY指数(Grand average of hydropathicity)、脂溶性指数、不稳定指数等
1.5.3 dybowskin-1ST疏水性预测利用抗菌肽生物信息学分析的网站ExPASy (https://web.expasy.org/) 中Protscale软件分析dybowskin-1ST的疏水性。
1.5.4 dybowskin-1ST剪切位点预测利用抗菌肽生物信息学分析的网站ExPASy (https://web.expasy.org/) 中PeptideCutter软件预测各胰蛋白酶及其他酶类物质作用于dybowskin-1ST的潜在剪切位点。
1.5.5 dybowskin-1ST信号肽剪切位点及亚细胞定位预测为了在各种系统中表达抗菌肽,需要进行信号肽的预测。基因翻译需经过信号肽分拣、运输、定位。信号肽用来引导蛋白质从胞浆进入内质网、线粒体、叶绿体及核内。信号肽引导的新生多肽可通过内质网膜进入腔内,最终到达胞外。信号肽通常从合成后的蛋白质被信号肽酶水解而被除去。本研究使用SignalP-5.0 (http://www.cbs.dtu.dk/services/SignalP) 进行信号肽检测。同时应用TargetP 1.1 Server (http://www.cbs.dtu.dk/services/TargetP-1.1/index.php) 进行抗菌肽的亚细胞定位分析。
1.5.6 dybowskin-1ST的跨膜区预测生物体内的蛋白质中,20%–30%都属于膜蛋白,因此膜蛋白在细胞的功能中占据重要地位。然而,对膜蛋白进行多系统表达,存在一定的难度。跨膜区域通常由有极性的α-螺旋构成,在细胞中常执行信号传导或转运通道的功能。对抗菌肽的多肽链的跨膜区域进行预测,能够对其异源表达提供指导作用。本研究使用TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/) 对dybowskin-1ST的跨膜区进行预测。
1.5.7 dybowskin-1ST磷酸化位点预测磷酸化是重要的蛋白质翻译后修饰之一,本研究运用NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/)预测dybowskin-1ST磷酸化位点。
1.5.8 dybowskin-1ST二级结构预测二级结构一般是抗菌肽抑菌活性的表达区域,二级结构组成在抗菌肽构成细菌膜孔的过程中起决定性作用。Lv等[15]的研究表明猪抗菌肽PMAP-36的α-螺旋区域结构为与细菌膜相互作用的多肽区。相关研究表明[16],β-折叠中包含的半胱氨酸能够形成二硫键,稳定抗菌肽构象。本研究采用ExPASy的SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)、Jpred4 (http://www.compbio.dundee.ac.uk/jpred/)和DNAstar Protean分别分析抗菌肽dybowskin-1ST的二级结构,多重预测其潜在抑菌性能。
1.5.9 dybowskin-1ST三级结构预测用在线建模软件SWISS-MODEL (https://swissmodel.expasy.org/) 及穿线法在线结构预测软件I-TASSER (http://zhanglab.ccmb.med.umich.edu/I-TASSER/)预测抗菌肽dybowskin-1ST的三级结构。
1.6 dybowskin-1ST的伤口愈合作用1.6.1 分组及建立皮肤伤口模型实验组(dybowskin-1ST),对照组(甘油80%)。小鼠背部涂抹脱毛膏停留5 min,刮去小鼠背部毛,蒸馏水清洗后用75%乙醇棉球擦洗皮肤消毒。无菌条件下用小鼠皮肤打孔器在小鼠背部制造两个直径为8.0 mm圆形创面(去除全层皮肤)。
1.6.2 创面处理伤口模型建立后,用打孔器在创可贴上打出相同大小的孔,用剪刀稍稍扩大创可贴开口面积使其粘贴于小鼠创口周围,局部固定小鼠伤口周围皮肤,使皮肤不易滑动,使得小鼠皮肤伤口的愈合只能靠细胞再生实现。用无菌棉球清理小鼠创口处血污,分别用80%甘油、dybowskin-1ST (1 500 mg/L)、生理盐水以0.1 mL/只的剂量涂抹于相应组小鼠的创口处,实验组小鼠左侧伤口涂抹dybowskin-1ST,右侧伤口涂抹生理盐水;对照组小鼠左侧伤口涂抹80%甘油,右侧伤口涂抹生理盐水。自然暴露创口,每天定时用药1次,连续用药15 d,观察记录创口愈合情况。
1.7 dybowskin-1ST体外抑菌实验1.7.1 菌种活化配置1 mL液体培养基:取10 μL大肠杆菌、金黄色葡萄球菌、白假丝酵母菌、铜绿假单胞菌在37 ℃下摇床过夜培养12–15 h,使其浊度对应0.5麦氏比浊,应用生理盐水将上述菌液稀释100倍,使其含菌量在(1×105–1×106) cfu/mL左右,备用。
1.7.2 纸片法抑菌实验将空白纸片浸润于100 mg/L的dybowskin- 1ST中,取出后去除其多余水分,得到浓度约为100 mg/L的dybowskin-1ST纸片。菌液混匀后,用棉签蘸取均匀涂布于LB固体培养基表面。以四环素纸片为阳性对照,将100 mg/L的dybowskin- 1ST纸片与四环素纸片放置于平板培养基适当位置,每组实验重复2次。将平板置37 ℃培养箱中静置过夜培养8 h后,取出,观察结果。
1.7.3 dybowskin-1ST最低抑菌浓度(MIC) 测定采用微量肉汤稀释法测定dybowskin-1ST及庆大霉素对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌的最小抑菌浓度(Minimal inhibit concentration,MIC)。在96孔板的每个对应孔中加入100 μL稀释好的菌液(1×106 CFU/mL),dybowskin-1ST (1.5 mg/mL–0.09375 mg/mL) 及庆大霉素(128 μg/mL–0.25 μg/mL) 药液倍比稀释后加入100 μL,放置在37 ℃恒温培养箱中培养18 h。次日取出96孔板,以小孔内完全抑制细菌生长的最小药物浓度为该药的MIC值。分别设置菌液阳性对照及生理盐水阴性对照。
2 结果与分析2.1 抗菌肽dybowskin-1ST基因序列同源性比对及系统进化树通过MEGA_X进行同源性比对,结果如图 1所示,东北林蛙抗菌肽dybowskin-1ST与黑龙江林蛙抗菌肽Temporin-AM、Amurin-3、北美豹蛙抗菌肽Temporin-1P、湿地林蛙抗菌肽Temporin H、Temporin B、东北林蛙抗菌肽Dybowskin-1CDYa、福建大头蛙抗菌肽Limnonectin-1Fb、Limnonectin- 1Fa、花臭蛙抗菌肽Brevinin-1S、沼泽林蛙抗菌肽Brevinin-1 PLc的参考序列,同源性均在80.00%左右,其中与东北林蛙抗菌肽dybowskin-1CDYa的同源性最高,为94.97%。其次是与湿地林蛙抗菌肽Temporin B的同源性较高,为81.99%。系统进化树分析结果如图 2所示,抗菌肽dybowskin-1ST与东北林蛙抗菌肽dybowskin-1CDYa位于同一分支上,具有较近的亲缘关系。
 |
| 图 1 Dybowskin-1ST与其他蛙类抗菌肽核苷酸序列的同源比对 Fig. 1 Homology alignment of nucleotide sequences of dybowskin-1ST with other antibacterial peptides of Rana. |
| 图选项 |
 |
| 图 2 Dybowskin-1ST与其他蛙类抗菌肽的系统发育树分析 Fig. 2 Phylogenetic tree analysis of dybowskin-1ST and other antibacterial peptides of Rana. |
| 图选项 |
2.2 理化性质预测结果经ProtParam分析,抗菌肽dybowskin-1ST中含59个氨基酸残基,分子式为C318H510N80O93S2,总原子数为1 003。dybowskin-1ST氨基酸序列组成分析见图 3。dybowskin-1ST疏水性氨基酸占总氨基酸的38.98%。抗菌肽的杀菌活性与疏水性呈正相关,但疏水性氨基酸的占比并不决定整个抗菌肽的疏水性,只能起到一定的参考作用。其他参数如分子量、等电点、带电氨基酸数目、半衰期、稳定性、疏水性和亲水性信息见表 1。当不稳定指数大于40时,说明蛋白不稳定。多肽中脂肪族氨基酸丙氨酸、缬氨酸、亮氨酸、异亮氨酸的含量可以决定其脂溶性指数[17]。脂肪指数反映了蛋白质和多肽的热稳定性,同时可以决定疏水面的深度,从而影响抗菌肽疏水性[13]。从检测结果可以看出dybowskin-1ST的热稳定性较好,半衰期较长。一般来说,亲水性平均系数(Grand average of hydropathicity,GRAVY) 取值在?2到+2之间,负值表明为亲水性蛋白。该抗菌肽GRAVY为?0.358,表明该蛋白亲水性较强。
 |
| 图 3 Dybowskin-1ST氨基酸组成分析 Fig. 3 Amino acid composition of dybowskin-1ST. |
| 图选项 |
表 1 Dybowskin-1ST理化性质分析结果Table 1 Physical and chemical properties of dybowskin-1ST predicted by ProtParam
| Physical and chemical properties | Parameter |
| Number of amino acids | 59.000 |
| Molecular weight/Da | 7 006.150 |
| pI | 5.100 |
| Total number of negatively charged residues | 12.000 |
| Total number of positively charged residues | 10.000 |
| Estimated half-life in mammalian reticulocytes, vitro/h | 30.000 |
| Estimated half-life in yeast, vivo/h | > 20 |
| Estimated half-life in Escherichia coli, vivo/h | > 10 |
| Instability index | 58.280 |
| Aliphatic index | 99.150 |
| GRAVY | ?0.358 |
表选项
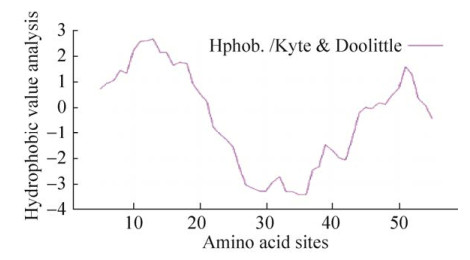
2.3 疏水性预测结果通过ProtScale工具在线分析发现(本实验使用Kyte和Doolittle等计算出的氨基酸疏水参数预测抗菌肽的疏水性),dybowskin-1ST的最大疏水指数为2.689,位于第13位氨基酸,最小疏水指数为?3.378,位于第35位氨基酸,见图 4。根据图 4可知,dybowskin-1ST多肽链两端显示为亲水性,且总体亲水性要大于疏水性,预测为亲水性蛋白,与理化性质分析结果一致。
 |
| 图 4 Dybowskin-1ST疏水性预测 Fig. 4 Prediction of the hydrophobicity of dybowskin-1ST. |
| 图选项 |
2.4 剪切位点预测结果通过PeptideCutter软件分析得出,dybowskin-1ST中的大多数氨基酸位点可分别被18种活性物质剪切(表 2),其中被剪切可能性最大的位点集中在多肽链两端,分别是第1、9、10、54、55位氨基酸。在上文疏水性分析中得知,dybowskin-1ST两端大多显示出亲水性,亲水性区域的稳定性较弱,因此此处氨基酸位点较易被剪切。另外,剪切位点较多的酶主要有蛋白酶K、胃蛋白酶(pH > 2)、嗜热菌蛋白酶、胃蛋白酶(pH 1.3)。
表 2 Dybowskin-1ST剪切位点预测Table 2 The predicted shear sites of dybowskin-1ST
| Name of enzymes | No. of cleavages | Positions of cleavage sites |
| Proteinase K | 36 | 2 3 4 8 9 10 11 12 13 14 16 17 19 21 23 24 25 28 29 30 31 35 37 38 41 42 43 44 47 48 50 52 54 55 56 59 |
| Pepsin (pH > 2) | 18 | 1 2 3 4 9 10 11 12 13 14 18 19 20 21 51 53 54 55 |
| Thermolysin | 17 | 1 3 7 8 9 10 11 12 13 16 18 20 27 46 51 54 55 |
| Trypsin | 17 | 1 3 7 8 9 10 11 12 13 16 18 20 27 46 51 54 55 |
| Pepsin (pH1.3) | 17 | 1 2 3 4 9 10 11 12 13 14 18 19 20 21 51 54 55 |
| Chymotrypsin-low specificity | 15 | 1 2 4 8 9 10 11 12 13 14 19 21 52 54 55 |
| Asp-N endopeptidase+N-terminal Glu | 12 | 22 23 24 28 29 30 33 36 37 39 41 43 |
| Glutamyl endopeptidase | 10 | 23 24 25 29 30 31 37 38 42 44 |
| Chymotrypsin-high specificity | 5 | 2 12 13 54 55 |
| Clostripain | 5 | 26 32 33 39 46 |
| LysC | 5 | 5 6 45 57 58 |
| LysN | 5 | 4 5 44 56 57 |
| Staphylococcal peptidase Ⅰ | 5 | 23 29 37 42 44 |
| Arg-C proteinase | 5 | 26 32 33 39 46 |
| Formic acid | 2 | 34 40 |
| Asp-N endopeptidase | 2 | 33 39 |
| CNBr | 1 | 1 |
| NTCB | 1 | 21 |
表选项
2.5 信号肽剪切位点及亚细胞定位预测结果经SignalP-5.0分析,该抗菌肽可能存在信号肽区域。如图 5所示,X轴为dybowskin-1ST蛋白序列的59个氨基酸残基;Y轴表示各参数的数值;C值表示剪切位点存在可能性,为图中红线所示;S值为信号肽存在可能性,为图中绿线所示;Y值是结合S值和C值进行综合分析给出的值,为图中蓝线所示。据预测结果显示,C值最大值在第27–28位氨基酸残基,在此区域最有可能出现剪切位点,其次为19位氨基酸。综合Y值和S值,S值超过阈值0.5,而Y值未超过,表明抗菌肽dybowskin-1ST可能具有信号肽。dybowskin-1ST亚细胞定位分析显示,分泌通路信号肽的可能性为0.024, 线粒体靶向肽的可能性为0.944,其他蛋白的可能性为0.054。
 |
| 图 5 Dybowskin-1ST信号肽预测 Fig. 5 Prediction of signal peptide of dybowskin-1ST. |
| 图选项 |
2.6 跨膜区预测结果据TMHMM Server v.2.0分析结果显示(图 6),品红色线表示各氨基酸处于膜外的概率,结果表明dybowskin-1ST多肽链不含跨膜区域,且该蛋白属于膜外蛋白。
 |
| 图 6 dybowskin-1ST跨膜区预测 Fig. 6 Prediction of transmembrane region of dybowskin-1ST. |
| 图选项 |
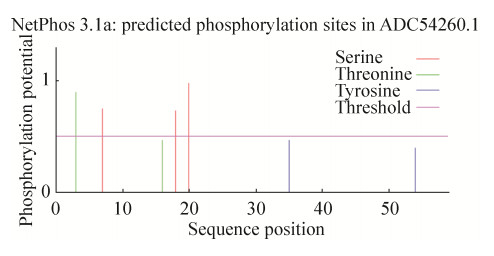
2.7 dybowskin-1ST磷酸化位点预测结果NetPhos 3.1 Server预测抗菌肽dybowskin- 1ST (图 7) 3位、16位苏氨酸残基处存在磷酸化修饰位点,7位、18位、20位丝氨酸残基处存在磷酸化修饰位点,35位、54位酪氨酸残基处存在磷酸化修饰位点。
 |
| 图 7 Dybowskin-1ST磷酸化位点预测 Fig. 7 Predication of phosphorylation sites of dybowskin-1ST. |
| 图选项 |
2.8 dybowskin-1ST二级结构预测结果采用SOPMA在线软件预测dybowskin-1ST的二级结构。如图 8A所示,dybowskin-1ST二级结构主要由α-螺旋(Alpha helix)、延伸链(Extended strand)、β-转角(Beta turn)和无规卷曲(Random coil)构成,其中有26个氨基酸参与α-螺旋(蓝色)的形成,占44.07%;10个氨基酸参与延伸链(红色) 的形成,占16.95%;2个氨基酸参与β-转角(绿色) 的形成,占3.39%;21个氨基酸参与无规卷曲(紫色) 的形成,占35.39%。二级结构预测表明该蛋白主要以α-螺旋为主,可推测该抗菌肽具有较强的抑菌活性。应用Jpred4进行二级结构分析的结果见图 8B,此方式预测结果有限,红色线条代表α-螺旋区域,分别在Leu4-Ile17、Arg39-Glu44、Pro49-Ala56,而其他类型二级结构未能得出预测结果。为了进一步获得二级结构在多肽链中的具体区域,利用DNAstar Protean软件的Garnier-Robson法和Chou-Fasman法进一步分析蛋白质二级结构,如图 8C所示,结果见表 3。两种方法都显示dybowskin-1ST二级结构中α-螺旋占比较高,与上述结论基本相符。
 |
| 图 8 Dybowskin-1ST二级结构预测(A: SOPMA; B: Jpred4; C: DNAstar) Fig. 8 Secondary structure prediction of dybowskin-1ST. (A) SOPMA. (B) Jpred4. (C) DNAstar. |
| 图选项 |
表 3 Dybowskin-1ST的二级结构预测Table 3 Secondary structure of dybowskin-1ST predicted by DNAstar Protean
| Methods | Alpha | Beta | Turn | Coil |
| Garnier-Robson | 1–9 | 10–14 | 15–16 | 17–21 |
| 22–32 | 47–50 | 33 | 34–35 | |
| 36–45 | 52–54 | 51 | ||
| 54–58 | 59 | |||
| Chou-Fasman | 1–15 | 6–19 | 32–35 | – |
| 18–31 | 45–49 | 50–53 | ||
| 36–49 | 54–56 | |||
| 54–59 |
表选项
2.9 dybowskin-1ST三级结构预测结果利用SWISS-MODEL在线同源建模对dybowskin-1ST三级结构的预测结果(图 9A),由于缺乏同类型模板及同源结构,此方式无法给出dybowskin-1ST的结构域组成及互作方式,显示仅为dybowskin-1ST的Leu10到Arg32范围内的三级结构示意图。使用穿线法在线预测软件I-TASSER进行三级结构预测结果(图 9B),两种结果都显示结构中α-螺旋数量较多。
 |
| 图 9 Dybowskin-1ST三级结构预测(A: SWISS- MODEL; B: I-TASSER) Fig. 9 Tertiary structure prediction of dybowskin-1ST. (A) SWISS-MODEL. (B) I-TASSER. |
| 图选项 |
2.10 dybowskin-1ST B细胞表位/T细胞表位预测结果使用ABCpred服务器预测(阈值为0.85)dybowskin-1ST含有3个B细胞抗原表位(表 4)。利用SYFPEITHI在线软件,经HLA-A*02:01 (限制性CTL细胞表位) 分析(阈值为19) dybowskin-1ST共有6个T细胞抗原表位(表 5)。经MHC分型RT1.AI预测(阈值为19),发现有2个T细胞抗原表位(表 5)。
表 4 Dybowskin-1ST B细胞表位预测Table 4 Prediction of B cell antigen epitopes of dybowskin-1ST (threshold: 0.85)
| Rank | Sequence | Start position | Score |
| 1 | EERRDYPEERDVEVEK | 30 | 0.95 |
| 2 | EEERRDYPEERDVEVE | 29 | 0.89 |
| 3 | LGTISLSLCEEERNAE | 14 | 0.85 |
表选项
表 5 Dybowskin-1ST T细胞表位预测Table 5 Prediction of T cell antigen epitopes of dybowskin-1ST (threshold: 19)
| Rank | Sequence | Start position | Score | Method |
| 1 | LLLFFLGTI | 9–17 | 28 | HLA-A*02:01 |
| 2 | TLKKSLLLL | 3–11 | 24 | |
| 3 | FLGTISLSL | 13–21 | 24 | |
| 4 | LLLLFFLGT | 8–16 | 21 | |
| 5 | FTLKKSLLL | 2–10 | 19 | |
| 6 | LFFLGTISL | 11–19 | 19 | |
| 1 | KSLLLLFFL | 6–14 | 20 | RT1.AI |
| 2 | NAEEERRDY | 27–25 | 20 |
表选项
2.11 dybowskin-1ST的伤口愈合作用小鼠皮肤伤口模型见图 10。经观察,涂抹dybowskin-1ST的小鼠伤口表面肉芽组织排列较为整齐,胶原分布均匀,大体无脓性分泌物,炎症反应较轻,表明抗菌肽一定程度地抑制了创面的细菌生长,同时愈合边缘较为整齐;而甘油对照组创面有白色脓性分泌物,肉芽组织干燥皱缩,新生胶原较少且排列紊乱(图 11)。
 |
| 图 10 小鼠皮肤伤口模型 Fig. 10 Wound model of mouse skin. |
| 图选项 |
 |
| 图 11 实验第5天的伤口对比图(A: 80%甘油;B: dybowskin-1ST) Fig. 11 A comparison of the wounds on day 5. (A) 80% glycerol; (B) dybowskin-1ST). |
| 图选项 |
2.12 dybowskin-1ST的体外抑菌作用通过纸片法测定dybowskin-1ST (经紫外分光光度计法测定浓度为100 mg/L) 对大肠杆菌、金黄色葡萄球菌、白假丝酵母菌的抑菌作用,结果表明dybowskin-1ST对大肠杆菌、金黄色葡萄球菌具有一定的抑菌效果,但对白假丝酵母菌无明显抑菌效果,结果见图 12和表 6。
 |
| 图 12 Dybowskin-1ST的抑菌效果A:大肠杆菌;B:金黄色葡萄球菌;C:白假丝酵母菌 Fig. 12 Antimicrobial effect of dybowskin-1ST. (A) Escherichia coli. (B) Staphylococcus aureus. (C) Candida albicans. |
| 图选项 |
表 6 Dybowskin-1ST对大肠杆菌、金黄色葡萄球菌、白假丝酵母菌的抑菌圈大小Table 6 Antimicrobial ring size of dybowskin-1ST against three indicator strains
| Bacteria | Escherichia coli ATCC 43889 | Staphylococcus aureus ATCC 6538 | Candida albicans ATCC 90028 |
| Inhibitory zone diameter (cm) | 1.19 | 1.23 | 0.60 |
表选项
采用96孔板法测定dybowskin-1ST对大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌的最低抑菌浓度(MIC),结果见表 7。
表 7 Dybowskin-1ST对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌的MIC检测结果Table 7 Determination of the MIC of dybowskin-1ST against three indicator strains
| Bacteria | Escherichia coli ATCC 43889 | Staphylococcus aureus ATCC 6538 | Pseudomonas aeruginosa CMCC(B)10104 |
| MIC (mg/mL) | 0.375 | 0.75 | > 1.5 mg/mL |
表选项
3 讨论多重耐药菌逐渐成为公共健康危机,包括院内感染耐药菌及抗生素滥用导致的家禽养殖常见菌等,导致多产业生物健康问题,人们迫切需要研发出区别于传统抗生素作用机制的新型抗菌剂[18-19]。抗菌肽属于机体固有免疫组分,在许多组织和细胞中表达,以响应Toll样受体(TLR) 信号通路的激活[20]。有研究表明,抗菌肽可通过调节体内抗菌肽表达加强人体先天免疫[21]。抗菌肽被广泛认可的“成孔模型”抑菌机制,导致其不易产生耐药性。de Breij等[19]的研究表明,抗菌肽SAAP-148能够通过对细菌膜产生渗透作用抑制部分多重耐药菌株生长和生物膜形成。然而,抗菌肽血清稳定性低,易被胰蛋白酶等水解,存在细胞毒性、生物利用度低及生产成本高等问题,限制了其进一步深入的临床应用。因此,目前研究人员以天然抗菌肽为基础,应用氨基酸替换、截断等方案进行蛋白质改造,克服天然抗菌肽的不足,提高应用性。同时,Bhonsle等[22]认为将非天然氨基酸应用于抗菌肽改造方案中,能够提高其代谢稳定性和药代动力学等相关参数。总之,应用于抗菌肽的蛋白质改造已成为其发展为稳定抗菌剂的必然方向。
林蛙作为天然两栖类动物,皮肤等腺体可分泌大量多肽类物质。dybowskin-1ST是东北林蛙皮肤分泌物中筛选出的新型抗菌肽,能够促进小鼠伤口愈合,可有效抑制大肠杆菌和金黄色葡萄球菌活性,但对于真菌及耐药菌的作用较弱。为改良亲本肽活性,设计出具有更高抑菌活性和稳定性的抗菌肽,本研究对dybowskin-1ST进行生物信息学分析,结果显示其理论等电点为5.10,电荷量为?2,亲水性平均系数为?0.358,负电荷氨基酸总数为12,正电荷氨基酸总数为10。蛋白内含有较多的亮氨酸、谷氨酸、精氨酸和赖氨酸,疏水性氨基酸含量较少,可能会导致其整合到脂质双层膜中介导细菌膜的渗透和破坏的能力较弱。dybowskin-1ST所带的负电荷和亲水肽的特性可能是限制其抑菌能力的主要原因。经预测,dybowskin-1ST可分别被共18种物质剪切,这可能是因为蛋白酶切割位点主要集中于赖氨酸和精氨酸。SignalP-5.0及TMHMM Server v.2.0结果显示,dybowskin-1ST有信号肽,无跨膜区,提示dybowskin-1ST可能为分泌蛋白,可通过构建载体进行表达和提取。经抗原表位预测,dybowskin-1ST具有T细胞表位和B细胞表位,可应用抗菌肽的抗原性进行定量检测。在对dybowskin-1ST多肽链的二级结构及三级结构预测中,α-螺旋均占比较高,这与其抗菌活性的体现存在直接相关性。
dybowskin-1ST为59个氨基酸的抗菌肽,寻找到其抑菌活性表达区域是降低生产成本并有效保留活性的关键。对dybowskin-1ST进行N-端和C-端截短并通过生物信息学方法进一步预测,结果显示,将C-端截短至保留N-端17个氨基酸时,该多肽链的α-螺旋占比、稳定性、电荷数较为符合高活性抗菌肽要求,因此笔者团队计划以保留dybowskin-1ST N-端17个氨基酸的多肽链(MFTLKKSLLLLFFLGTI) 为基础进行氨基酸修饰,以求获得较高抑菌活性的新型抗菌肽。同时为提高衍生肽疏水性,以疏水性氨基酸替换15位Gly、16位Thr (亲水氨基酸),同时可形成完整的α-螺旋肽链;使用Arg、Lys替换3位Thr、15位Gly、16位Thr,使衍生肽电荷数在+4至+6之间,避免过高的电荷量导致细胞毒性增加[13]。抗菌肽的疏水性与其抑菌活性及细胞毒性均呈正相关,因此,需要在疏水性、细胞毒性和活性之间取得适当的平衡。为避免使衍生肽疏水性过强,应在一定范围内(疏水力矩0.08–0.12及疏水性0.8–1.2) 进行疏水性氨基酸替换。整体来讲,对抗菌肽进行氨基酸改造应注重结构及参数的平衡,避免破坏原有结构[16]。通过以上思路进行母肽的氨基酸截短和修饰,选择其中电荷数、疏水性及稳定性等性质较为适中且符合研究要求的进行后续实验,包括抑菌实验、细胞毒性实验、生物膜抑制实验等。由于抗菌肽不是通过单一受体或免疫系统的线性信号通路发挥作用的简单免疫调节剂,生物信息学方法能够通过构造蛋白质空间结构预测抑菌活性,但筛选出潜在抑菌活性较强的衍生肽后,仍需加以进一步实验验证,以此希望获得能够解决抗生素耐药性问题的新型抗菌肽。
参考文献
| [1] | Hancock RE, Haney EF, Gill EE. The immunology of host defence peptides: beyond antimicrobial activity. Nat Rev Immunol, 2016, 16(5): 321-334. DOI:10.1038/nri.2016.29 |
| [2] | Cheng KT, Wu CL, Yip BS, et al. High level expression and purification of the clinically active antimicrobial peptide P-113 in Escherichia coli. Molecules, 2018, 23(4): 800. DOI:10.3390/molecules23040800 |
| [3] | Omardien S, Drijfhout JW, Vaz FM, et al. Bactericidal activity of amphipathic cationic antimicrobial peptides involves altering the membrane fluidity when interacting with the phospholipid bilayer. Biochim Biophys Acta Biomembr, 2018, 1860(11): 2404-2415. DOI:10.1016/j.bbamem.2018.06.004 |
| [4] | Wang JJ, Dou XJ, Song J, et al. Antimicrobial peptides: promising alternatives in the post feeding antibiotic era. Med Res Rev, 2019, 39(3): 831-859. DOI:10.1002/med.21542 |
| [5] | Graf M, Mardirossian M, Nguyen F, et al. Proline-rich antimicrobial peptides targeting protein synthesis. Nat Prod Rep, 2017, 34(7): 702-711. DOI:10.1039/C7NP00020K |
| [6] | Xu XQ, Lai R. The chemistry and biological activities of peptides from amphibian skin secretions. Chem Rev, 2015, 115(4): 1760-1846. |
| [7] | 谢锋, 叶昌媛, 费梁, 等. 中国东北地区林蛙属物种的分类学研究(两栖纲: 蛙科). 动物分类学报, 1999, 24(2): 224-231. Xie F, Ye CY, Fei L, et al. Taxonomic study of the genus Rana in Northeast China (Amphibia: Ranidae). Acta Zootaxonom Sin, 1999, 24(2): 224-231 (in Chinese). DOI:10.3969/j.issn.1000-0739.1999.02.021 |
| [8] | 郭娜. 东北林蛙皮肤抗菌肽dybowskin-1ST毕赤酵母表达体系的构建[D]. 哈尔滨: 东北林业大学, 2011. Guo N. Expression and research of antibacterial peptide dybowskin-1ST from the skin of Rana dybowskii[D]. Harbin: Northeast Forestry University, 2011 (in Chinese). |
| [9] | 郭娜, 肖向红, 徐义刚, 等. 东北林蛙皮肤抗菌肽dybowskin-1ST的表达、纯化及抑菌活性分析. 中国农业科学, 2011, 44(15): 3246-3251. Guo N, Xiao XH, Xu YG, et al. Expression, purification and antibacterial activity analysis of Rana dybowskii antimicrobial peptide dybowskin-1ST. Sci Agric Sin, 2011, 44(15): 3246-3251 (in Chinese). |
| [10] | 周旋, 肖向红, 李玉. 东北林蛙皮肤抗菌肽dybowskin-1ST的抗病毒活性分析. 野生动物, 2013, 34(3): 171-173. Zhou X, Xiao XH, Li Y. Antiviral activity analysis of Rana dybowskii antimicrobial peptide dybowskin- 1ST. Chin J Wildl, 2013, 34(3): 171-173 (in Chinese). DOI:10.3969/j.issn.1000-0127.2013.03.013 |
| [11] | 苗慧敏, 肖向红, 孙婷婷, 等. 东北林蛙皮肤抗菌肽dybowskin-1ST对小鼠皮肤创伤愈合的作用. 中国实验方剂学杂志, 2011, 17(23): 125-128. Miao HM, Xiao XH, Sun TT, et al. Study on effect of antimicrobial peptides dybowskin-1 ST from skin of Rana dybowskii on wound healing skin of mice. Chin J Exp Tradit Med Formul, 2011, 17(23): 125-128 (in Chinese). DOI:10.3969/j.issn.1005-9903.2011.23.038 |
| [12] | 李玉, 刘琦, 王敬之, 等. 东北林蛙重组抗菌肽dybowskin-1ST部分理化特性和生物学活性研究. 野生动物学报, 2016, 37(2): 129-133. Li Y, Liu Q, Wang JZ, et al. The physicochemical properties and biological activity of recombinant antimicrobial peptide-dybowskin-1ST in Rana dybowskii. Chin J Wildlife, 2016, 37(2): 129-133 (in Chinese). |
| [13] | Wang JJ, Song J, Yang ZY, et al. Antimicrobial peptides with high proteolytic resistance for combating gram-negative Bacteria. J Med Chem, 2019, 62(5): 2286-2304. DOI:10.1021/acs.jmedchem.8b01348 |
| [14] | Guida F, Benincasa M, Zahariev S, et al. Effect of size and N-terminal residue characteristics on bacterial cell penetration and antibacterial activity of the proline-rich peptide Bac7. J Med Chem, 2015, 58(3): 1195-1204. DOI:10.1021/jm501367p |
| [15] | Lv YF, Wang JJ, Gao H, et al. Antimicrobial properties and membrane-active mechanism of a potential α-helical antimicrobial derived from cathelicidin PMAP-36. PLoS ONE, 2014, 9(1): e86364. DOI:10.1371/journal.pone.0086364 |
| [16] | Wang JJ, Dou XJ, Song J, et al. Antimicrobial peptides: promising alternatives in the post feeding antibiotic era. Med Res Rev, 2019, 39(3): 831-859. |
| [17] | Hao G, Le GW, Shi YH, et al. Molecular design, structural analysis and bactericidal activity of derivatives of antimicrobial peptide buforinⅡ. Acta Pharmaceut Sin, 2013, 48(3): 366-371. |
| [18] | Neogi SB, Islam MM, Islam SKS, et al. Risk of multi-drug resistant Campylobacter spp.and residual antimicrobials at poultry farms and live bird markets in Bangladesh. BMC Infect Dis, 2020, 20: 278. DOI:10.1186/s12879-020-05006-6 |
| [19] | de Breij A, Riool M, Cordfunke RA, et al. The antimicrobial peptide SAAP-148 combats drug-resistant bacteria and biofilms. Sci Transl Med, 2018, 10(423): eaan4044. DOI:10.1126/scitranslmed.aan4044 |
| [20] | Dou XJ, Han JL, Song WT, et al. Sodium butyrate improves porcine host defense peptide expression and relieves the inflammatory response upon Toll-like receptor 2 activation and histone deacetylase inhibition in porcine kidney cells. Oncotarget, 2017, 8(16): 26532-26551. DOI:10.18632/oncotarget.15714 |
| [21] | Andersson DI, Hughes D, Kubicek-Sutherland JZ. Mechanisms and consequences of bacterial resistance to antimicrobial peptides. Drug Resist Updat, 2016, 26: 43-57. |
| [22] | Bhonsle JB, Clark T, Bartolotti L, et al. A brief overview of antimicrobial peptides containing unnatural amino acids and ligand-based approaches for peptide ligands. Curr Top Med Chem, 2013, 13(24): 3205-3224. DOI:10.2174/15680266113136660226 |
