

1. 泉州师范学院 纺织与服装学院,福建 泉州 362000;
2. 天津大学 化工学院,天津 300350
收稿日期:2020-08-16;接收日期:2020-12-02;网络出版时间:2021-01-05
基金项目:福建省中青年教师教育科研项目(No. JT180374),泉州市科技计划项目(No. 2019C014R) 资助
摘要:合成生物学和代谢工程是构建微生物细胞工厂、实现化学品绿色生物制造的重要方法,目前主要集中在微生物代谢网络的改造及调控上,很少考虑到微生物细胞特性的影响。形态工程通过改造微生物细胞形态相关蛋白,有目的地对微生物细胞形态及分裂方式进行合理调控,从而优化微生物细胞的特性,是降低生物炼制成本的一种新兴生物工程技术。文中首先介绍了与微生物细胞形态相关的各类蛋白,并重点总结了形态工程在生物基化学品合成方面的应用进展,包括调控细胞体积以提高胞内产物积累量、改善细胞通透性以促进胞外产物分泌、实现高密度发酵以降低生产成本、控制产物水解程度以提高产品性能。最后,提出了形态工程面临的主要问题并展望了其未来的发展趋势。
关键词:形态工程细胞体积调控细胞通透性调控细胞密度调控
Development of morphology engineering for production of bio-based chemicals
Lili Feng1, Zhiwen Wang2


1. College of Textiles and Apparel, Quanzhou Normal University, Quanzhou 362000, Fujian, China;
2. School of Chemical Engineering and Technology, Tianjin University, Tianjin 300350, China
Received: August 16, 2020; Accepted: December 2, 2020; Published: January 5, 2021
Supported by: Fujian Provincial Department of Education, Chian (No. JT180374), Quanzhou Science and Technology Project, China (No. 2019C014R)
Corresponding author: Zhiwen Wang. Tel: +86-22-85356617; E-mail: zww@tju.edu.cn.
Abstract: Synthetic biology and metabolic engineering have been widely used to construct microbial cell factories for efficient production of bio-based chemicals, which mainly focus on the modification and regulation of metabolic pathways. The characteristics of microorganisms themselves, e.g. morphology, have rarely been taken into consideration in the biotechnological production processes. Morphology engineering aims to control cell shapes and cell division patterns by manipulating the genes related to cell morphology, providing a new strategy for developing efficient microbial cell factories. This review summarized the proteins related to cell morphology, followed by illustrating a few examples of using morphology engineering strategies for improving production of bio-based chemicals. This includes increasing intracellular product accumulation by regulating cell size, enhancing extracellular secretion of target products by improving cell permeability, reducing production cost by achieving high cell density, and improving product performance by controlling the degree of product hydrolysis. Finally, challenges and perspectives for the development of morphology engineering were discussed.
Keywords: morphology engineeringcell size regulationcell permeability regulationcell density regulation
在能源危机以及清洁化生产的背景下,以生物炼制替代传统化学合成越来越受到研究者的重视。高效微生物细胞工厂的构建是生物炼制的核心技术,该方法是利用代谢工程和合成生物学技术对细胞内复杂的代谢网络进行重构和调控,使其在宿主中最大化行使功能,从而高效制备化工和医药产品。其中,多样性的原核微生物因其结构简单、基因操作便捷,被广泛地应用于平台化学品(如2, 3-丁二醇[1]、丁二酸[2]等)、氨基酸(如苏氨酸[3]、l-天冬氨酸[4]等)、生物材料(如聚羟基烷酸[5]) 等各类产品的生产上,并取得了令人瞩目的成果。
然而,在生物基化学品的合成过程中,由于细胞体积及细胞通透性等微生物自身生理特性的限制,目标产物在细胞内过度积累,引起复杂的反馈抑制和调控等效应,降低了微生物细胞工厂的生产效率;此外,在产物分离阶段,由于微生物体积过小,常采用高速离心或微孔过滤等方式去除发酵液中的菌体,分离工艺复杂,且对设备要求较高。
形态工程(Morphology engineering) 这一名词最早由Jiang等[6]于2016年提出,是指利用基因技术或其他技术,通过改造微生物细胞形态相关蛋白,有目的地对微生物细胞形态及分裂方式进行合理调控,从而优化微生物细胞的特性,比如增大细胞体积,改善细胞通透性以及提高细胞生长速率等,使其更加适应工业化生产环境。形态工程的出现,为进一步构建高效的微生物细胞工厂提供了新的思路。本文介绍了微生物中与细胞形态相关的各类蛋白,并在此基础上总结了形态工程在生物基化学品合成方面的应用及调控策略,提出了形态工程面临的主要问题并展望了其未来的发展趋势。
1 细胞形态相关蛋白影响微生物细胞形态的蛋白很多,总体而言,可以分为3大类,即细胞分裂蛋白、细胞骨架蛋白、细胞壁合成及水解蛋白(表 1),这些蛋白不仅在微生物维持细胞正常形态、提高机械强度、抵抗各种环境压力胁迫等方面发挥重要作用,而且与细胞的胞质运动、物质运输、信息传递、基因表达、分裂和分化等生命活动密切相关。
表 1 与细胞形态相关的各类蛋白Table 1 Proteins related to cell morphology
| Classification | Protein | Function | References |
| Cell division | FtsZ | Essential for cell division, forming Z-ring in the middle of the cell during cell division | [7] |
| FtsA | Recruiting other cell division related proteins to the division site | [8] | |
| FtsW | Stabilizing Z-ring | [9] | |
| ZipA | Stabilizing Z-ring and anchoring it to the membrane | [10] | |
| MinC, MinD | Inhibiting FtsZ polymerization | [11] | |
| MinE | Promoting the pole-to -pole oscillation of MinCD | [12] | |
| SulA | SOS-inducible protein, inhibiting FtsZ function | [13] | |
| Cytoskeletal proteins | MreB | The cytoskeletal protein critical for maintaining the rod-shape | [14] |
| Mbl, MreBH | MreB-like proteins, regulating cell length | [15] | |
| MreC, MreD, RodZ | MreB-associated protein | [16] | |
| RodA | Transglycosylase, promoting PBP2 function | [17] | |
| Synthesis and hydrolysis of cell wall | MurA-MurF MraY, MurG | Essential proteins for synthesis of peptidoglycan precursors | [18] |
| PBPs | Penicillin-binding proteins, catalyzing final reactions of peptidoglycan synthesis | [19] | |
| AmiA-AmiD, AmpD | Amidase, catalyzing the hydrolysis of peptidoglycan | [20] | |
| CwlO, LytZ | Endopeptidase, cleaving the septum during cell division | [21] | |
| LytD | Glycosidase, involved in peptidoglycan extension | [21] | |
| LytC | Amidase, involved in peptidoglycan extension | [21] |
表选项
1.1 细胞分裂蛋白在原核微生物细胞分裂过程中,起核心作用的是丝状温度敏感蛋白FtsZ,最早发现于大肠杆菌中[22]。FtsZ是一种具有GTP酶活性的GTP结合蛋白,可在结合GTP后快速自聚合形成单线状原丝纤维[23-24],并在细胞潜在分裂位点与细胞内膜结合,形成具有收缩功能的环状结构(Z-环)。随后,在其他蛋白(如FtsA、ZipA及FtsW等)的共同作用下,Z-环不断收缩,最终在该位点形成隔膜,完成原核细胞的分裂(图 1)。FtsZ功能的缺陷或丧失会导致细胞无法正常分裂,形成纤维状细胞。
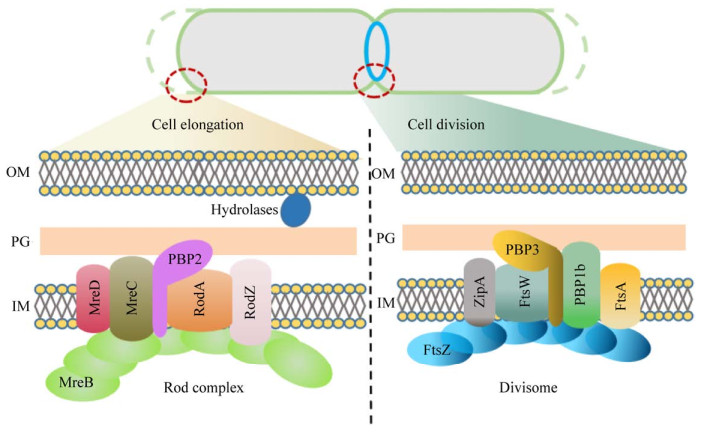 |
| 图 1 参与细胞分裂、细胞壁合成和细胞形态维持的蛋白 Fig. 1 Proteins related to cell division, cell wall synthesis and maintenance of cell morphology. The rod complex containing MreB, RodZ, RodA, PBP2, MreC and MreD, plays an important role in cell elongation. MreB interacts with MreC and MreD to maintain cell shape in most non-spherical bacteria. PBP2: transpeptidase, is required during cell elongation. RodA: Lipid Ⅱ flippase, regulates cell length. RodZ modulates geometric localization of MreB for its correct assembly. Hydrolases: accelerate cell wall cleavage during cell wall synthesis. Divisome forming by FtsZ and its related proteins such as FtsA, Ftsw and PBP3, are essential for proper cell division. For simplicity, other cell-division proteins are not shown in this diagram. OM: outer membrane; PG: peptidoglycan; IM: inner membrane. |
| 图选项 |
原核细胞在分裂过程中存在多个潜在分裂位点,分裂位点的选择受到Min系统(包括MinC、MinD和MinE) 的精确调控,其中,MinC含有MinD结合位点,可与其形成MinCD复合体[25],当细胞处于非分裂状态时,MinCD复合体会同时占据细胞的潜在的分裂位点,从而阻止FstZ蛋白的聚集[26]。MinE是一个由88个氨基酸组成的小功能蛋白,可在细胞中形成移动的螺旋环状结构,当细胞分裂启动时,MinE驱使MinCD复合体向细胞两极移动,解除对细胞中部分裂位点的阻碍,使FtsZ蛋白可以正确定位到细胞中部。当MinE蛋白失活时,MinCD复合体会同时封闭细胞的所有潜在分裂位点,导致细胞无法分裂,从而形成纤维状细胞。如果Min系统同时无法行使功能,细胞分裂会发生在各个潜在的分裂位点,导致无核小细胞、正常细胞以及纤维状细胞的产生。
为保证细胞的正常分裂,FtsZ还受到一系列负调控蛋白的作用,它们通过与FtsZ的直接或间接作用来抑制细胞的分裂活动。SulA是一类重要的细胞分裂抑制蛋白,当细胞处于极端环境时,为避免受损的DNA传递给子代细胞,细胞会触发SOS保护机制[27],诱导SulA的表达,该蛋白通过与FstZ的相互作用导致GTP水解,阻止FtsZ蛋白聚合形成Z环,从而抑制细胞分裂。
1.2 细胞骨架蛋白细胞骨架蛋白是维持细胞形态及生命必需活动的一类重要蛋白,最初是在真核生物中发现的,并被认为是真核生物的特有结构。但是,1989年Wachi等[28]首次发现大肠杆菌Escherichia coli中的MreB具有维持杆状细菌形态的功能。随后,研究人员[29]对MreB的晶体结构及功能进行解析,发现其三维结构类似于真核的肌动蛋白,呈螺旋丝状结构环绕于细胞膜内壁上,且主要功能域的氨基酸序列具有较高的同源性,由此确认MreB是细菌的骨架蛋白[30]。近年来,研究人员发现,MreB可招募与肽聚糖及磷壁酸合成相关的酶蛋白,通过调控细菌细胞壁合成途径来参与细胞形态的维持(图 1)。当大肠杆菌及沙门氏菌等杆状细菌的MreB发生突变时,细胞会由杆状突变为球状[31]。
大多数革兰氏阴性菌中仅有一种MreB,但是在革兰氏阳性菌中则发现多种MreB类似蛋白,如Mbl以及MreBH等[15]。在枯草芽孢杆菌Bacillus subtilis中,Mbl与MreB共同参与杆状细胞形态的维持,其中,MreB主要调控细胞的宽度,而Mbl则负责细胞长度的维持[32]。因此,mreB突变菌的细胞形态呈现球形或变宽的趋势,而mbl突变菌的细胞形态异常则主要表现为细胞伸长和无规则卷曲状态。
1.3 细胞壁合成及水解蛋白细胞壁是细菌、真菌等微生物的重要结构,具有坚韧性和弹性,在决定和维持细胞形态方面发挥了重要作用。不同种类细菌的细胞壁成分各不相同,主要包含肽聚糖、脂多糖和磷壁酸等,其中对细胞壁生理功能起主要作用的为肽聚糖,是由双糖单位(N-乙酰葡萄糖胺和N-乙酰胞壁酸) 及四肽链聚合而成的多层网状大分子结构,几乎存在于所有的细菌细胞壁中。
作为细胞壁的核心部分,肽聚糖的合成总体上可以分为3个阶段,需要多种酶蛋白和调控因子的共同参与。肽聚糖的起始反应发生在细胞质内,由6种“Mur”蛋白参与反应(包括MurA-MurF),合成N-乙酰胞壁酸五肽;第二阶段是在细胞膜上由N-乙酰胞壁酸五肽和N-乙酰葡萄糖胺合成肽聚糖单体-双糖肽亚单位,该阶段由MraY和MurG参与;第三阶段主要发生在细胞膜外,双糖肽在各种青霉素结合蛋白(Penicillin-binding proteins,PBPs) 的作用下,进行肽链间及糖链间的交联反应,完成肽聚糖的组装。
按照氨基酸序列的相似度可将PBPs分为高分子量PBPs (HMW-PBPs) 和低分子量PBPs (LMW-PBPs),其中HMW-PBPs是主要的肽聚糖合成酶,可通过转糖基和转肽反应将双糖肽连接到细胞壁的网状结构上,而LMW-PBPs具有羧肽酶的活性,是一种肽聚糖水解酶,可以催化d-丙氨酰-d-丙氨酸之间的肽链断裂,释放d-丙氨酰残基,在肽聚糖的交联过程中起着重要的作用。不同菌属的PBPs数量不同,其功能也有所差别。如大肠杆菌中共有12个PBPs,其中包括5个HMW-PBPs,分别为PBP1a、PBP1b、PBP1c、PBP2和PBP3。PBP1a和PBP1b具有转肽酶和转糖酶双重活性,是维持细胞形态的重要蛋白,但是需要与PBP2及PBP3共同发挥作用,单独敲除PBP1a或者PBP1b并不会引起菌株的死亡[19]。PBP2具有转肽酶活力,是维持棒状杆菌形态的重要调控蛋白,该蛋白功能受损会使细胞突变为圆形,最终导致细胞溶解死亡。PBP3参与细胞分裂,可通过转肽反应催化肽聚糖的合成,是细胞隔膜形成的必需蛋白,该基因的失活会影响细菌细胞的分裂,形成丝状细胞[33]。
除合成酶外,肽聚糖水解酶在细胞壁合成、细胞分裂以及细胞形态维持方面也发挥重要的作用。肽聚糖水解酶可根据作用位点的差异分为糖苷酶(Glycosidase)、酰胺酶(Amidases)、羧肽酶(Carboxypeptidases) 以及肽链内切酶(Endopeptidases)。其中,糖苷酶水解N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1, 4糖苷键,酰胺酶主要水解N-乙酰胞壁酸与l-丙氨酸之间的酰胺键,肽链内切酶或羧肽酶则水解肽桥中间以及氨基酸侧链的肽键,如图 2所示。肽聚糖水解酶的活性受到严格调控,既要满足细胞生长及分裂的需要,也要防止过度降解细胞壁造成细菌的自溶。
 |
| 图 2 肽聚糖水解酶的作用位点 Fig. 2 Cleavage sites of peptidoglycan hydrolases. (A) In the Gram-positive bacteria, the alternating subunits of N-acetylglucosamine (GlcNAc) and N-acetylmuramic acid (MurNAc) are amide linked to the l-alanine (l-Ala) of the stem peptide. To connect peptidoglycan chains, a pentaglycine interpeptide branches off the amino group of the l-lysine (l-Lys) of the stem peptide to the d-Ala in the position of a neighboring chain; (B) In the Gram-negative bacteria, the stem peptides is linked to the lactyl group of MurNAc, and most cross-links result from the Meso-diaminopimelic acid (m-DAP) at position 3 of one stem peptide with the d-Ala at position 4 of a second stem peptide of a neighboring glycan strand. Glycosidases cleave the β-1, 4-glycosidic bond between GlcNAc and MurNAc; Amidases hydrolyse the amide bonds between the lactyl group of MurNAc and the l-Ala of the stem peptide; Endopeptidases cleave amide bonds in the peptides; Carboxypeptidases hydrolyse peptide bonds to remove C-terminal d- or l-amino acids. |
| 图选项 |
大肠杆菌至少具有13种肽聚糖水解酶,其中包括AmiA、AmiB、AmiC、AmiD及AmpD在内的5种酰胺酶,AmiA、AmiB、AmiC可通过降解分裂隔膜的肽聚糖,使得子代细胞分离,而AmiD和AmpD是大肠杆菌中仅有具备水解N-乙酰胞壁酸-l-丙氨酸脱水环活力的酰胺酶,参与细胞生长过程中肽聚糖的重组和循环[20]。
在枯草芽孢杆菌中已经发现了35种水解酶,其中,肽链内切酶CwlO和LytZ降解分裂隔膜的肽聚糖,参与细胞分裂,这两种蛋白的缺失会导致细胞分裂停滞。LytC、LytD可以水解旧的肽聚糖从而使新的肽聚糖得以延伸,这两种蛋白的缺失会使细胞聚集形成长链[21]。
2 形态工程的应用进展微生物细胞的形态对生物基化学品的合成及分离具有重要影响,利用形态工程对微生物细胞形态及分裂方式进行合理调控,优化微生物细胞的特性,可以显著提高微生物细胞工厂生产大宗化学品的能力。目前,形态工程已逐渐应用于提高胞内外生物基化学品产量、简化下游工艺以及改善产品质量等领域(表 2)。
表 2 形态工程在生物基化学品合成中的应用Table 2 Application of morphology engineering for production of bio-based chemicals
| Strain | Product | Modification strategy | Biological outcome | References |
| Escherichia coli | PHB | Overexpression of sulA gene to inhibit the cell division FtsZ ring assembly | Forming filamentary cells with larger internal space, with a PHB yield of 2.19 g/L corresponding to a PHB accumulation of 26.54 wt%, which is more than 100% increase in the PHB content and cell dry weights compared to the control strain | [34] |
| Halomonas campaniensis | PHB | Overexpression of cell division inhibitor genes minCD | Generating larger Halomonas TD cells, resulting in enhanced PHB accumulation from 69 wt% to 82 wt% | [35] |
| Escherichia coli | PHB | Weak expression of mreB in mreB deletion mutant under inducible expression of sulA | Forming larger spherical E. coli cells, with a PHB yield of 10.67 g/L corresponding to a PHB accumulation of 80.41 wt%, achieving 109% PHB accumulation increase | [36] |
| Escherichia coli | PHB | Regulating expression intensities of ftsZ or/and mreB using CRISPRi | Generating diverse morphologies accompanied by PHB accumulations ranging from 40 wt% to 80 wt%, achieving the highest PHB yield of 9.4 g/L | [37] |
| Escherichia coli | PHB | Weakening cell wall synthesis via repressing expressions of murE, murD, mraY and/or ftsW | Generating flexible cell shapes with increasing flexibility for cell size expansions, achieving 93% PHB accumulation in cell wall weakened E. coli | [38] |
| Corynebacterium glutamicum | 5-ALA | Deletion of HMW-PBPs genes pbp1a, pbp1b and pbp2b | Improving cell permeability, leading to an increase in 5-ALA production of 13.53%, 29.47%, and 22.22%, respectively | [39] |
| Bacillus subtilis | Riboflavin | Overexpression of lytC gene | Improving cell permeability, achieving an increased riboflavin production in Bacillus subtilis | [40] |
| Pseudomonas mendocina | AO | Overexpression of mreB gene | Forming longer cells with 0.961 g/L AO, which was 5.86-fold higher than wild-type strain | [41] |
| Escherichia coli | PHB | Overexpression of ftsZ gene | Suppressing cell filamentation, achieving an increased PHB yield from 81 g/L to 149 g/L with high productivity of 3.4 g of PHB/liter/h using the pH-stat fed-batch culture | [43] |
| Escherichia coli | PHB | Deletion of minC and minD, together with overexpression of division-related genes (ftsQ, ftsL, ftsW, ftsN, ftsZ) and the cell shape control gene mreB | Changing E. coli growth pattern from binary division to multiple fission, generating longer and larger cells, enhanced PHB accumulation from 53.22 wt% to 82.13 wt% | [44] |
| Bacillus subtilis | Amylase | Deletion of lytC | Reducing cell autolysis of Bacillus subtilis, accompanied by a prolongation of the exponential and the transient growth phase and results in larger amounts of secreted amylase | [45] |
| Bacillus amyloliquefaciens | γ-PGA | Deletion of three degradation genes pgdS, ggt and cwlO | Forming shorter cells in NK-pc strain with the double deletion of pgdS and cwlO, achieving 93% increase in γ-PGA yield and 26% increase in γ-PGA molecular weight | [46] |
| Bacillus amyloliquefaciens | γ-PGA | Modulating transcript levels of mreB, mbl or mreBH | Forming longer cells, achieving 55.7% γ-PGA yield increase and 8.1% molecular weight increase in the mreB inhibition mutant, while 56.7% γ-PGA yield increase and 19.4% molecular weight increase in the mreBH inhibition mutant | [47] |
表选项
2.1 调控细胞体积以提高胞内产物积累量聚-β-羟丁酸(Poly-β-hydroxybutyrate,PHB)是一种由微生物合成的高分子化合物,因其具有良好的生物相容性和生物可降解性,被广泛应用于医疗、农业及包装等领域,该类化合物在微生物细胞体内以内含物的形式存在,其积累量受到微生物细胞体积的限制,较大的细胞体积有利于提高胞内PHB的含量。Z环在分裂位点的形成被公认为是细胞分裂的起点,其核心蛋白FtsZ是调控细胞形态的重要蛋白,在大肠杆菌中过表达FstZ的负调控蛋白SulA,可以抑制FtsZ蛋白发挥功能,导致细胞分裂受阻,从而使细胞形态由正常状态下的杆状突变为纤维状,其长度可达50 μm以上,细胞干重提高了104%,在引入PHB合成途径后,胞内目标产物积累量可提高120%[34]。除SulA蛋白外,MinCD复合体也可以有效抑制FtsZ蛋白的表达,Tan等[35]在以嗜盐单胞菌Halomonas companiensis TD01为宿主构建PHB微生物细胞工厂时,通过过表达MinCD使得胞内PHB含量由69%提高至82%。同时,工程菌的细胞长度增长至数百微米,菌体之间相互缠绕下沉,静置一段时间后,大部分纤维状细胞会在重力作用下沉淀下来,实现菌体和发酵液的自动分离。由此可以看出,通过形态工程改变微生物细胞形状和尺寸,不仅可以提高胞内产物浓度,同时也有利于菌体的分离,简化下游分离工艺,有效降低产物分离成本。
MreB作为细胞骨架蛋白,主要在宽度上影响杆菌形态,其缺失可以使大肠杆菌由杆状变为球状,提高细菌细胞的体积比,但同时也会导致工程菌生长速率降低,不利于生物基化学品的大规模工业化生产。在此情况下,合理设计MreB蛋白的表达强度就成为了研究者的关注重点。Jiang等[36]在大肠杆菌mreB缺失菌株中,对MreB进行低水平回补,使突变菌细胞形态由球形变回杆状,但与野生菌株相比,回补后工程菌株的细胞明显变大,细胞干重和PHB产量分别提高了18%和62%。随后,研究人员[37]采用CRISPRi技术对大肠杆菌中MreB的表达强度进行更加精细的调控,胞内PHB积累量随着MreB抑制程度的增加而明显提高。此外,MreB与FtsZ具有显著的组合效应,将低水平MreB及FtsZ进行组合,细胞会明显变长变圆,培养24 h后,细胞干重和PHB含量分别提高了18%和71%。
细胞壁是细菌的重要结构,其刚性直接影响细胞形态,因此,细胞壁合成及水解蛋白也被认为是形态工程的重要组成部分。Zhang等[38]研究了大肠杆菌细胞壁刚性对胞内PHB积累的影响,发现下调细胞壁合成相关基因(如murC、murD及murE等) 的表达强度,可以显著降低细胞壁刚性,使细胞由正常的杆状突变为多种形态,增大细菌细胞的体积,胞内PHB的积累最大可达细胞干重的93%。
改变微生物细胞形态,提高细胞的有效体积,进而提高胞内产物的积累是形态工程在生物基化学品合成中最广泛并且比较成熟的应用方式。但是,受菌株特性的影响,形态蛋白及调控策略的选择都会给细胞生长和目标产物积累带来不同的影响,因此,哪些策略可用于调控形态相关蛋白以获得最佳效果仍需要进一步探索。
2.2 改善细胞通透性以促进胞外产物分泌在构建微生物细胞工厂时,由于细胞壁的屏障作用,目标产物在细胞内过度积累,降低了微生物细胞工厂的生产效率。在不破坏细胞整体结构的情况下改善细胞的通透性,使得小分子物质和一些较大分子物质能够自由进出细胞,可以较大幅度地提升工程菌株的性能。笔者[39]在利用代谢工程改造谷氨酸棒杆菌Corynebaterium glutamicum合成5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA) 时,发现敲除部分PBPs编码基因可以改善细胞的通透性,其中pbp2b的单敲除使谷氨酸棒杆菌的细胞变长,胞内5-ALA浓度降低了10%,缓解了其对5-ALA合成途径关键酶的反馈抑制效应,5-ALA产量提高了22%。pbp1a和pbp1b的单敲除虽然没有使工程菌株的细胞形态发生明显变化,但在不同程度上改善了细胞的通透性,胞外5-ALA的产量分别提高了14%和30%。
除肽聚糖合成酶外,水解酶也是改善微生物细胞通透性的重要靶点。笔者课题组[40]在对突变菌B. subtilis 24/pMX45过量积累核黄素的遗传调控机理研究过程中发现,过量表达水解酶LytC编码基因使得细胞壁部分裂解,提高了细胞的通透性,从而部分解调控嘌呤合成途径,增加了核黄素合成前体物GTP的供给,最终提升突变菌合成核黄素的能力。笔者进一步将该优良性状分子机制应用于谷氨酸棒状杆菌合成5-ALA,目标产物的产量提高了20%以上,这说明通过调控细胞形态相关蛋白改造微生物细胞的通透性进而提高生物基化学品产量的策略具有一定的通用性。
此外,微生物也是一些大分子物质的重要来源,宿主菌的分泌能力是限制这类产物合成的主要瓶颈之一,采用形态工程改善微生物细胞通透性,提高细胞对目标产物的运输能力,有利于更多生产菌株的开发及利用。Fan等[41]在利用门多萨假单胞菌Pseudomonas mendocina NK-01合成褐藻多糖(Alginate oligosaccharides,AO) 时,采用过表达MreB的策略使细胞的长度和宽度分别提高了1.27倍和1.49倍,在这种情况下,虽然工程菌的生长速率和褐藻多糖合成酶的活性有一定程度的降低,但是较大的细胞空间为产物的胞外分泌提供了更多的运输途径,最终使目标产物的产量达到0.961 g/L,是对照菌株的5.86倍。
目前,利用形态工程提高胞外代谢物产量的研究较少,微生物细胞形态和胞外产物分泌之间的作用机制还不是很透彻,此外,细胞形态的调控不仅会改变细胞的通透性,也会对目标产物的代谢产生影响,如何平衡细胞形态和相关酶的活性也是后续研究需要解决的问题。
2.3 实现高密度发酵以降低生产成本工程菌的高密度发酵是在工业微生物领域实现大规模生产的一种有效手段。在大肠杆菌中过表达FtsZ,可使细胞分裂提前开启,增加细胞分裂频率,从而产生大量微小细胞,实现工程菌的高密度发酵[42]。在引入PHB合成途径后,目标产物的产量由原来的81 g/L提升至149 g/L,生产速率可达3.4 g/(L·h)[43]。此外,由于MinCD复合体对Z环定位的调控作用,在大肠杆菌中敲除MinC和MinD编码基因,会导致Z环定位异常,从而改变大肠杆菌的分裂方式,使其由正常的二次对称分裂突变为不对称分裂,产生纤维状细胞和大量微小细胞,在此背景下,同时过表达细胞分裂相关基因(ftsQ、ftsW、ftsN、ftsL及ftsZ) 和细胞骨架蛋白MreB编码基因,可明显提高细胞生长速度和尺寸,细胞干重达到11.58 g/L,胞内PHB含量由53.22 wt%提升至82.13 wt%,达到9.51 g/L[44]。
枯草芽孢杆菌具有优秀的蛋白分泌能力,是工业酶制剂的重要生产菌株,但其生长后期会产生自溶现象,不利于菌株的高密度发酵,甚至影响目标蛋白的分泌。Kabisch等[45]在开发B. subtilis ATCC 6051作为高效分泌外源蛋白的微生物细胞工厂时,发现LytC缺失可以有效抑制细胞自溶,特别是对数期的自溶,这使得lytC突变菌具有较长的对数生长期和较高的细胞密度,因此,与野生菌株相比,lytC突变菌更加具备生产外源蛋白的潜力。
2.4 控制产物水解程度以提高产品性能γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA) 是一种由微生物发酵合成的天然聚合物,广泛应用于化妆品、食品、医药等领域,具有很大的商业价值和社会价值。由于该化合物是由谷氨酸单体通过酰胺键连接而形成的阴离子多肽,很多切割多肽的酶几乎都能够作用于γ-PGA,这导致其在微生物合成过程中极易水解。不同分子量γ-PGA的用途各不相同,如肥料级5×103-10×103、食品级100×103-700×103、化妆品级700×103-1100×103、药品级1200×103-2000×103,因此,降低γ-PGA的水解,实现γ-PGA分子量的准确控制有利于其进一步发展和应用。CwlO和PgdS是解淀粉芽孢杆菌Bacillus amyloliquefaciens中γ-PGA的两个重要水解酶。其中,敲除CwlO编码基因,可以使突变菌的细胞由杆状向球状转变,γ-PGA的产量和分子量分别提高28%和29%,而同时敲除CwlO和PgdS编码基因,γ-PGA的产量提高了93%,而分子量则可以提高26%[46]。
MreB及其类似蛋白Mbl和MreBH不仅在维持细胞形态上发挥重要作用,而且与基因表达及胞质运输等各项生命活动密切相关。最近研究表明,在解淀粉芽孢杆菌中抑制MreB的表达,可以使突变菌的细胞明显变长,γ-PGA的产量提高了55.7%。同时,由于MreB突变对γ-PGA水解酶CwlO和LytE的抑制作用,降低了γ-PGA的水解程度,γ-PGA的分子量提高了8.1%,而mreBH抑制菌株中,γ-PGA的产量和分子量则分别提高了56.7%和19.4%[47]。
目前,对细胞形态相关蛋白的改造虽然在一定程度上减少了γ-PGA的水解,但γ-PGA分子量的提升幅度较小,未来随着对相关细胞形态蛋白及调控因子作用机制的深入了解,并结合元件组装、多元基因编辑等合成生物学技术,可以进行菌种的全方面精准优化,获得一系列不同分子量的γ-PGA,进一步实现γ-PGA分子量的可设计性和可控性。
3 总结与展望当前,各种代谢工程和合成生物学技术被用于改造微生物细胞的代谢网络和调控网络,从而构建高效的微生物细胞工厂,实现大宗化学品的工业化生产。但是由于微生物自身形态及生理性能的限制,导致其不能很好地适应工业生产环境,无法最大限度地发挥催化潜力。在此背景下,通过调控微生物的形态和分裂方式,可以有效增大微生物细胞体积、提高菌株的生长速率、改善细胞的通透性,从而达到提高胞内外生物基化学品产量、简化菌体分离工艺、降低生物制造成本的目的。但总体而言,形态工程正处于发展初级阶段,相关研究和应用还有待进一步深入。
目前用于形态工程的蛋白主要集中在FtsZ、SulA、MinCD、MreB及其类似蛋白等少数蛋白上,某些与细胞壁合成及水解相关的蛋白在细胞分裂和形态维持方面也发挥重要作用,随着人们对相关蛋白及调控因子作用机制的深入研究,将会使更多细胞形态蛋白及调控因子的应用成为可能。
与细胞形态相关的蛋白通常是微生物生长的必需蛋白,其表达强度直接影响微生物的生长速率和细胞周期,因此需要结合各种合成生物学元件,精确控制相关蛋白在不同生长时期的表达水平,平衡微生物生长和细胞形态之间的关系。同时,对于某些生物基化学品来说,处于对数生长后期的微生物细胞更加有利于产品的积累,而大多数诱导型表达系统在高密度条件下无法很好地表达,因而开发适应高密度环境的诱导型高效表达系统也迫在眉睫。
形态工程的发展为构建高效的微生物细胞工厂、促进生物基化学品的产业化进程提供了有力的技术支持。除了提高细胞尺寸及生长速率外,形态工程的应用也会提高细胞对底物和产物的通透性,改变细胞内代谢流量的分配。此外,细胞形态的变化也会对发酵液的流变特性产生影响,因此,深入研究形态工程与细胞通透性、代谢通量分配以及发酵液流变特性之间的关系,有利于进一步降低生物制造成本。
目前,形态工程仅在大肠杆菌及解淀粉芽孢杆菌等少数细菌中得以应用,但是其他细菌和真菌中也存在类似的细胞形态蛋白,这表明形态工程具有巨大的应用潜力。随着人们对形态工程理解的加深以及精准化形态工程的开发,实现微生物细胞形态的程序化控制,同时结合代谢工程和合成生物技术对细胞的代谢网络和调控网络进行重构和改造,将极大地提高微生物细胞工厂生产大宗化学品的能力,是未来工业生物技术的重要发展方向。
参考文献
| [1] | Zhang X, Han RM, Bao T, et al. Synthetic engineering of Corynebacterium crenatum to selectively produce acetoin or 2, 3-butanediol by one step bioconversion method. Microb Cell Fact, 2019, 18(1): 128-140. DOI:10.1186/s12934-019-1183-0 |
| [2] | Li C, Gao S, Yang XF, et al. Green and sustainable succinic acid production from crude glycerol by engineered Yarrowia lipolytica via agricultural residue based in situ fibrous bed bioreactor. Bioresour Technol, 2018, 249: 612-619. DOI:10.1016/j.biortech.2017.10.011 |
| [3] | Zhao H, Fang Y, Wang XY, et al. Increasing L-threonine production in Escherichia coli by engineering the glyoxylate shunt and the L-threonine biosynthesis pathway. Appl Microbiol Biotechnol, 2018, 102(13): 5505-5518. DOI:10.1007/s00253-018-9024-3 |
| [4] | Li YJ, Wei HB, Wang T, et al. Current status on metabolic engineering for the production of L-aspartate family amino acids and derivatives. Bioresour Technol, 2017, 245: 1588-1602. DOI:10.1016/j.biortech.2017.05.145 |
| [5] | 严群, 李寅, 陈坚, 等. 微生物合成中链聚羟基烷酸酯研究进展. 生物工程学报, 2001, 17(5): 485-490. Yan Q, Li Y, Chen J, et al. Progress on the biosynthesis of medium-chain-length polyhydroxyalkanoates by microorganisms. Chin J Biotech, 2001, 17(5): 485-490 (in Chinese). DOI:10.3321/j.issn:1000-3061.2001.05.002 |
| [6] | Jiang XR, Chen GQ. Morphology engineering of bacteria for bio-production. Biotechnol Adv, 2016, 34(4): 435-440. DOI:10.1016/j.biotechadv.2015.12.007 |
| [7] | 陈云雨, 牛夏忆, 李淼, 等. 大肠杆菌FtsZ蛋白原核表达及多克隆抗体的制备与鉴定. 生物工程学报, 2019, 35(6): 1117-1125. Chen YY, Niu XY, Li M, et al. Bacterial expression, preparation and identification of polyclonal antibody against Escherichia coli FtsZ. Chin J Biotech, 2019, 35(6): 1117-1125 (in Chinese). |
| [8] | Loose M, Mitchison TJ. The bacterial cell division proteins FtsA and FtsZ self-organize into dynamic cytoskeletal patterns. Nat Cell Biol, 2014, 16(1): 38-46. DOI:10.1038/ncb2885 |
| [9] | Mistry BV, Del Sol R, Wright C, et al. FtsW is a dispensable cell division protein required for Z-ring stabilization during sporulation septation in Streptomyces coelicolor. J Biotechnol, 2008, 190(16): 5555-5566. |
| [10] | Geissler B, Elraheb D, Margolin W. A gain-of-function mutation in ftsA bypasses the requirement for the essential cell division gene zipA in Escherichia coli. Proc Natl Acad Sci USA, 2003, 100(7): 4197-4202. DOI:10.1073/pnas.0635003100 |
| [11] | Ghosal D, Trambaiolo D, Amos LA, et al. MinCD cell division proteins form alternating copolymeric cytomotive filaments. Nat Commun, 2014, 5: 5341. DOI:10.1038/ncomms6341 |
| [12] | Arumugam S, Petrá?ek Z, Schwille P. MinCDE exploits the dynamic nature of FtsZ filaments for its spatial regulation. Proc Natl Acad Sci USA, 2014, 111(13): E1192-E1200. DOI:10.1073/pnas.1317764111 |
| [13] | Chen YD, Milam SL, Erickson HP. SulA inhibits assembly of FtsZ by a simple sequestration mechanism. Biochemistry, 2012, 51(14): 3100-3109. DOI:10.1021/bi201669d |
| [14] | Takacs CN, Poggio S, Charbon G, et al. MreB drives de novo rod morphogenesis in Caulobacter crescentus via remodeling of the cell wall. J Bacteriol, 2010, 192(6): 1671-1684. DOI:10.1128/JB.01311-09 |
| [15] | Kawai Y, Asai K, Errington J. Partial functional redundancy of MreB isoforms, MreB, Mbl and MreBH, in cell morphogenesis of Bacillus subtilis. Mol Microbiol, 2009, 73(4): 719-731. DOI:10.1111/j.1365-2958.2009.06805.x |
| [16] | Morgenstein RM, Bratton BP, Nguyen JP, et al. RodZ links MreB to cell wall synthesis to mediate MreB rotation and robust morphogenesis. Proc Natl Acad Sci USA, 2015, 112(40): 12510-12515. DOI:10.1073/pnas.1509610112 |
| [17] | Arora D, Chawla Y, Malakar B, et al. The transpeptidase PbpA and noncanonical transglycosylase RodA of Mycobacterium tuberculosis play important roles in regulating bacterial cell lengths. J Biol Chem, 2018, 293(17): 6497-6516. DOI:10.1074/jbc.M117.811190 |
| [18] | Sangshetti JN, Joshi SS, Patil RH, et al. Mur ligase inhibitors as anti-bacterials: a comprehensive review. Curr Pharm Des, 2017, 23(21): 3164-3196. |
| [19] | Sauvage E, Kerff F, Terrak M, et al. The penicillin-binding proteins: structure and role in peptidoglycan biosynthesis. FEMS Microbiol Rev, 2008, 32(2): 234-258. DOI:10.1111/j.1574-6976.2008.00105.x |
| [20] | Uehara T, Park JT. An anhydro-N-acetylmuramyl-L-alanine amidase with broad specificity tethered to the outer membrane of Escherichia coli. J Bacteriol, 2007, 189(15): 5634-5641. DOI:10.1128/JB.00446-07 |
| [21] | Blackman SA, Smith TJ, Foster SJ. The role of autolysins during vegetative growth of Bacillus subtilis 168. Microbiology, 1998, 144(1): 73-82. DOI:10.1099/00221287-144-1-73 |
| [22] | Lutkenhaus JF, Wolf-Watz H, Donachie WD. Organization of genes in the ftsA-envA region of the Escherichia coli genetic map and identification of a new fts locus (ftsZ). J Bacteriol, 1980, 142(2): 615-620. DOI:10.1128/jb.142.2.615-620.1980 |
| [23] | De Boer P, Crossley R, Rothfield L. The essential bacterial cell-division protein FtsZ is a GTPase. Nature, 1992, 359(6392): 254-256. DOI:10.1038/359254a0 |
| [24] | Van Teeffelen S, Renner LD. Recent advances in understanding how rod-like bacteria stably maintain their cell shapes. F1000 Res, 2018, 7: 241. DOI:10.12688/f1000research.12663.1 |
| [25] | Taviti AC, Beuria TK. Bacterial Min proteins beyond the cell division. Crit Rev Microbiol, 2019, 45(1): 22-32. DOI:10.1080/1040841X.2018.1538932 |
| [26] | Levin PA, Shim JJ, Grossman AD. Effect of minCD on FtsZ ring position and polar septation in Bacillus subtilis. J Bacteriol, 1998, 180(22): 6048-6051. DOI:10.1128/JB.180.22.6048-6051.1998 |
| [27] | Vedyaykin A, Rumyantseva N, Khodorkovskii M, et al. SulA is able to block cell division in Escherichia coli by a mechanism different from sequestration. Biochem Biophys Res Commun, 2020, 525(4): 948-953. DOI:10.1016/j.bbrc.2020.03.012 |
| [28] | Wachi M, Matsuhashi. Negative control of cell division by mreB, a gene that functions in determining the rod shape of Escherichia coli cells. J Bacteriol, 1989, 171(6): 3123-3127. DOI:10.1128/jb.171.6.3123-3127.1989 |
| [29] | Van Den Ent F, Amos LA, L?we J. Prokaryotic origin of the actin cytoskeleton. Nature, 2001, 413(6851): 39-44. DOI:10.1038/35092500 |
| [30] | Strahl H, Bürmann F, Hamoen LW. The actin homologue MreB organizes the bacterial cell membrane. Nat Commun, 2014, 5: 3442. DOI:10.1038/ncomms4442 |
| [31] | Bendezú FO, Hale CA, Bernhardt TG, et al. RodZ (YfgA) is required for proper assembly of the MreB actin cytoskeleton and cell shape in E. coli. EMBO J, 2009, 28(3): 193-204. DOI:10.1038/emboj.2008.264 |
| [32] | Jones LJF, Carballido-López R, Errington J. Control of cell shape in bacteria: helical, actin-like filaments in Bacillus subtilis. Cell, 2001, 104(6): 913-922. DOI:10.1016/S0092-8674(01)00287-2 |
| [33] | Den Blaauwen T, De Pedro MA, Nguyen-Distèche M, et al. Morphogenesis of rod-shaped sacculi. FEMS Microbiol Rev, 2018, 32: 321-344. |
| [34] | Wang Y, Wu H, Jiang XR, et al. Engineering Escherichia coli for enhanced production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate) in larger cellular space. Metab Eng, 2014, 25: 183-193. DOI:10.1016/j.ymben.2014.07.010 |
| [35] | Tan D, Wu Q, Chen JC, et al. Engineering Halomonas TD01 for the low-cost production of polyhydroxyalkanoates. Metab Eng, 2014, 26: 34-47. DOI:10.1016/j.ymben.2014.09.001 |
| [36] | Jiang XR, Wang H, Shen R, et al. Engineering the bacterial shapes for enhanced inclusion bodies accumulation. Metab Eng, 2015, 29: 227-237. DOI:10.1016/j.ymben.2015.03.017 |
| [37] | Elhadi D, LV L, Jiang XR, et al. CRISPRi engineering E. coli for morphology diversification. Metab Eng, 2016, 38: 358-369. DOI:10.1016/j.ymben.2016.09.001 |
| [38] | Zhang XC, Guo YY, Liu X, et al. Engineering cell wall synthesis mechanism for enhanced PHB accumulation in E. coli. Metab Eng, 2018, 45: 32-42. DOI:10.1016/j.ymben.2017.11.010 |
| [39] | Feng LL, Zhang Y, Fu J, et al. Metabolic engineering of Corynebacterium glutamicum for efficient production of 5-aminolevulinic acid. Biotechnol Bioeng, 2016, 113(6): 1284-1293. DOI:10.1002/bit.25886 |
| [40] | Wang GL, Shi T, Chen T, et al. Integrated whole-genome and transcriptome sequence analysis reveals the genetic characteristics of a riboflavin-overproducing Bacillus subtilis. Metab Eng, 2018, 48: 138-149. DOI:10.1016/j.ymben.2018.05.022 |
| [41] | Fan X, Gong T, Wu YB, et al. Enhanced synthesis of alginate oligosaccharides in Pseudomonas mendocina NK-01 by overexpressing MreB. 3 Biotech, 2019, 9(9): 344. DOI:10.1007/s13205-019-1873-7 |
| [42] | Ward JE Jr, Lutkenhaus J. Overproduction of FtsZ induces minicell formation in E. coli. Cell, 1985, 42(3): 941-949. DOI:10.1016/0092-8674(85)90290-9 |
| [43] | Wang F, Lee SY. Production of poly(3-hydroxybutyrate) by fed-batch culture of filamentation-suppressed recombinant Escherichia coli. Appl Environ Microbiol, 1997, 63(12): 4765-4769. DOI:10.1128/aem.63.12.4765-4769.1997 |
| [44] | Wu H, Fan ZY, Jiang XR, et al. Enhanced production of polyhydroxybutyrate by multiple dividing E. coli. Microb Cell Fact, 2016, 15: 128. DOI:10.1186/s12934-016-0531-6 |
| [45] | Kabisch J, Thürmer A, Hübel T, et al. Characterization and optimization of Bacillus subtilis ATCC 6051 as an expression host. J Biotechnol, 2013, 163(2): 97-104. DOI:10.1016/j.jbiotec.2012.06.034 |
| [46] | Feng J, Gao WX, Gu YY, et al. Appl Microbiol Biotechnol, 2014, 98(14): 6397-6407. |
| [47] | Gao WX, Zhang ZX, Feng J, et al. Effects of MreB paralogs on poly-γ-glutamic acid synthesis and cellmorphology in Bacillus amyloliquefaciens. FEMS Microbiol Lett, 2016, 363(17): fnw187. DOI:10.1093/femsle/fnw187 |
