

南华大学 药学院 肿瘤微环境响应药物研究湖南省重点实验室 湖南省分子靶标新药研究协同创新中心,湖南 衡阳 421001
收稿日期:2020-08-17;接收日期:2020-10-10;网络出版时间:2020-10-22
基金项目:湖南省自然科学基金(No. 2018JJ3436),湖南省卫生健康委科研课题(No. 202113022002),衡阳市指导性科技计划项目(No. 2020jh042809),湖南省大学生研究性学习和创新性实验计划(No. S202010555112X),南华大学大学生研究性学习和创新性实验计划(Nos. X2019175, X202010555406X) 资助
摘要:作为一种无支架的组织工程技术,组织工程细胞片不仅可以避免支架材料带来的不利影响,而且可通过组装进一步形成更为复杂的三维功能化组织,因而在生物医学领域备受关注。细胞片的构建主要是基于敏感性材料所构建的培养基底,通过改变温度、酶、光、离子、氧化还原pH、糖等刺激因素,调节基底对细胞的粘附行为使细胞发生自然脱附,从而获取细胞片。近年来,随着研究的深入进行,特别是各种新型的敏感性培养基底的不断发展,各种简单高效的细胞片构建技术不断涌现,得到的各种具有优良性能的细胞片极大地扩展了其应用的广度和深度。文中对组织工程细胞片的各种构建方法进行了阐述,对其存在的问题及发展前景进行了分析和展望。
关键词:细胞片敏感性材料细胞粘附细胞脱附组织工程
Construction of tissue engineered cell sheet
Fuan Xiao, Xueting Jian, Xiaoyi Feng, Junyan Tan, Wanling Xiong, Ye Zhi, Yuan Xu, Yang Liu


Hunan Province Cooperative Innovation Center for Molecular Target New Drug Study, Hunan Provincial Key Laboratory of Tumor Microenvironment Responsive Drug Research, College of Pharmacy, University of South China, Hengyang 421001, Hunan, China
Received: August 17, 2020; Accepted: October 10, 2020; Published: October 22, 2020
Supported by: Natural Science Foundation of Hunan Province, China (No. 2018JJ3436), Scientific Research Projects of Health Commission of Hunan Province, China (No. 202113022002), Hengyang Guided Science and Technology Project, China (No. 2020jh042809), College Students' Research Based Learning and Innovative Experiment Program of Hunan Province, China (No. S202010555112X), College Students' Research based Learning and Innovative Experiment Program of University of South China (Nos. X2019175, X202010555406X)
Corresponding author: Yang Liu. Tel: +86-734-8282914; E-mail: liuyanghxl@126.com.
Abstract: Scaffold-free tissue engineered cell sheet is an emerging technology in biomedical field. It can avoid the adverse effects of scaffold materials, and can be further assembled to form more complex three-dimensional functional tissues. The construction of cell sheet is mainly based on the culture substrate composed of sensitive materials. By changing the stimulation factors such as temperature, enzyme, light, ion, redox, pH and sugar, the adhesion behavior of the substrate to the cells could be changed to make the cells detach naturally, thus generating the cell sheet. Recent years have seen the development of various simple and efficient construction technologies of cell sheet due to the development of a variety of novel sensitive culture substrates. The resulted cell sheets with excellent performance have greatly expanded their applications. This review summarized the construction methods of tissue engineered cell sheet and discussed the challenges and future perspectives in this field.
Keywords: cell sheetsensitive materialscell adhesioncell detachmenttissue engineering
由于在组织器官缺损和修复中的巨大应用前景,组织工程技术备受关注[1]。它最早是由Langer和Vacanti于20世纪80年代末提出[2],基本原理是将正常细胞植入到支架材料内形成细胞-支架复合物并进行培养,待器官组织成型或功能完备以后,植入病患体内,同时支架材料逐步被降解和吸收,最终达到组织修复和重建的目的。但是,经过多年研究发现,该技术对支架材料的生物相容性要求较高,支架植入体内后容易发生免疫排斥反应,引起组织纤维化。2004年,Yamato等首次提出了一种无支架的组织工程技术,即细胞片技术[3]。它是将细胞在特殊培养基底上培养,待细胞粘附生长后,通过改变外界条件,使细胞从基底表面自动脱附,从而获得完整的包含细胞外基质的细胞片层结构。细胞片技术可以避免支架材料带来的不良影响以及获取过程中对细胞的损害,且获得的细胞片可进一步通过组织工程技术叠加组装形成更为复杂的三维功能化组织,因而近年来在生物医学领域受到了广泛关注[4-7]。
目前,国内外针对组织工程细胞片的研究主要分为两大类:一类是制备方法的探索,以构建各种具有优良性能的细胞片,另一类是关于细胞片的临床应用的研究。其中,借助于材料学和生物学的手段,探索制备各种新型的培养基底,以促进细胞的粘附和生长,提高细胞片的收获效率,进而扩展其应用规模和范围,已经成为当前研究的热点。目前利用各种温敏性材料构建培养基底并调控细胞的粘附在研究中已引起广泛关注[8]。此外,采用酶、光、离子、氧化还原pH和糖等其他敏感性材料构建细胞片培养和收获系统,在研究中也显示出良好的应用前景[9]。本文主要从敏感性培养基底的角度针对组织工程细胞片的各种构建方法进行了系统的归纳和阐述(图 1),以期为各种优异性能的细胞片的制备提供参考和借鉴。
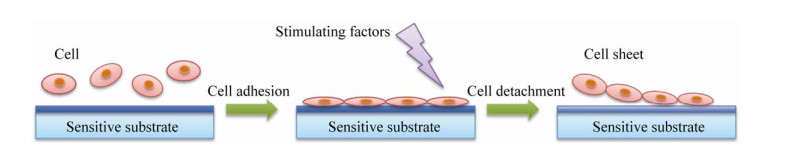 |
| 图 1 组织工程细胞片的构建示意图 Fig. 1 Schematic diagram of the construction of tissue engineered cell sheet. |
| 图选项 |
1 温度敏感性培养系统目前,由温敏性材料构建的温度敏感性培养系统由于操作简单、易于控制等优点已经被广泛应用于组织工程细胞片的制备。许多温敏性材料存在最低临界溶解温度(Loner critical solation temperature,LCST),当外界温度高于LCST时,其呈现疏水性,细胞可以粘附在其表面并生长形成细胞片,而当温度低于LCST时,其逐渐由疏水转变为亲水状态,从而不利于细胞粘附,导致细胞自然脱附,进而可以获得完整的细胞片结构[10]。
研究中最受关注的温敏性材料是聚(N-异丙基丙烯酰胺) (PNIPAM),其LCST在32 ℃左右,接近人的体温[11]。Yamada等[12]首次通过辐射引发聚合将PNIPAM线型分子接枝到培养皿表面,用于研究牛肝细胞的培养、粘附及脱附。在37 ℃下,细胞可以很好地粘附和生长;当将温度降低到4 ℃并维持60 min后,几乎所有的细胞都能够以紧密相连的细胞片的形式脱附下来,且仍然维持活性,可以继续粘附和生长。但是该方法需要较为复杂的辐射设备,培养基底的制作成本较高。
由于PNIPAM易于改性修饰,且制备机理较为简单,研究者采用不同方法制备得到了各种具有不同形态和功能的PNIPAM基底。Sudo等[13]利用可逆加成-断裂链转移聚合得到了超支化的聚苯乙烯-g-聚(N-异丙基丙烯酰胺) (HBPSt-g- PNIPAM),再利用HBPSt与培养板之间的亲和力,采用简单的滴涂法得到了稳定的温敏性培养基底,用于小鼠NTH 3T3成纤维细胞的培养。4 d后,细胞融合形成了完整的细胞片层结构。再将其置于20 ℃并维持15 min后,即可得到细胞片。而为了加快细胞片的获取,Xia等[14]通过自由基聚合得到了NIPAM和苯乙烯共聚微凝胶,再利用旋涂法或滴涂法在玻璃片、培养板等普通基底上得到了具有良好稳定性和可重复性的温敏微凝胶单层膜。当温度降低到28 ℃以下时,NIH 3T3成纤维细胞在几分钟内就会与基底脱离,且活性没有损失。
近年来,研究者往往通过向PNIPAM中引入其他共聚基团或活性分子,以调节基底的性质,达到促进细胞的粘附与生长、加速细胞片的回收等目的。如Pan等[15]首次采用分子印迹法将精氨酸-甘氨酸-天冬氨酸(RGD) 细胞粘附肽引入到PNIPAM基底上,得到了分子印迹水凝胶。在生理条件下,该凝胶能够特异性地识别细胞表面的RGD肽,从而加快细胞粘附。当温度降低到20 ℃时,又能够迅速释放结合的RGD肽,从而获取细胞片。Xia等[16]则通过原位自由基聚合制备得到了氧化石墨烯纳米片(GO)掺杂的PNIPAM复合水凝胶。GO的引入,增加了水凝胶的生物相容性,促进了猴成纤维细胞(COS7) 的粘附和增殖。当降低温度至20 ℃时,能够快速地收获完整的COS7细胞片。同时,利用该方法可以通过设计微图案化的水凝胶,获得复合细胞片。Liu等[17]在黏土存在的条件下,将聚乙二醇(PEG) 大分子单体聚甲基丙烯酸乙二醇酯与NIPAM通过聚合制备得到了纳米复合温敏水凝胶。黏土的引入增加了凝胶的机械强度,促进了细胞粘附;PEG的引入,增加了凝胶的表面粗糙度,加速了细胞片的脱附。当温度降低至20 ℃时,小鼠成纤维细胞能够在15 min内快速与凝胶分离。
随着研究的深入进行,研究人员发现PNIPAM基底也存在着生物相容性缺乏、制备成本高昂等缺点,因而其他温敏性材料也逐渐被应用于组织工程细胞片的构建,极大地扩展了温敏性培养系统的应用范围。Desseaux等[18]以2-(2-甲氧基乙氧基) 乙基甲基丙烯酸甲酯、甲基丙烯酸羟乙酯和聚乙二醇甲基丙烯酸酯等为单体,通过表面引发原子转移自由基聚合形成了温敏性的刷型共聚物薄膜。该共聚物刷的LCST在35 ℃左右,当温度降低到23 ℃时,能够获取细胞片。与PNIPAM相比,这种含有PEG的温敏性材料具有优越的生物相容性。而Altomare等[19]利用甲基纤维素(MC) 制备可逆的温敏水凝胶用于细胞片的制备。作者研究了不同种类和浓度的盐对MC凝胶形成的影响,发现由8% (W/V) MC和0.05 mol/L Na2SO4组成的凝胶具有较好的稳定性,且具有37 ℃的转变温度。将其置于4 ℃下,凝胶会逐渐发生液化,导致表面粘附的细胞与基底脱离。30 min内,可以获得紧密连接的细胞片。Hoo等[20]也利用甲基丙烯酸酐(MA) 改性的羟丙基纤维素(HPC) 为原料,通过紫外光交联制备得到了温敏性的HPC-MA水凝胶。该凝胶的LCST为37–38 ℃,将温度降低到4 ℃,在30 min内也可以获得细胞片。与PNIPAM相比,纤维素类材料来源广泛,成本低廉,更适合规模化应用。
目前,温敏性的培养系统已成为制备组织工程细胞片的主要方法,以其构建的细胞片在临床应用中已显示出良好的应用前景。如Miyagawa等[21]选取了15例缺血性心肌病患者,将从患者自体肌肉中提取的细胞经过温敏性基底进行培养得到的细胞片经左胸切口移植到左心室游离壁上,进行了Ⅰ期临床试验。结果发现试验过程中无手术相关的主要并发症产生,大多数患者血清脑钠尿肽水平、肺动脉压、肺毛细血管楔压、肺静脉阻力和左室壁应力显著降低,缺血症状明显改善,证明了细胞片在治疗中的可行性。通过对温敏性基底进行修饰和改良,以进一步提高细胞片的获取效率,并扩展其临床应用,是未来的主要发展方向之一。
2 酶敏感性培养系统通过向培养基底中引入酶敏感性的材料,再接种细胞进行培养,待细胞增殖形成完整的片层结构后,加入特异性的酶使基底发生降解,也可以用于获取细胞片。
羧甲基纤维素(CMC) 具有良好的亲水性和生物相容性,在生物医用领域中应用广泛。同时CMC易被纤维素酶降解,因而可应用于细胞片的脱附和获取。但是由于CMC亲水性太强,因此对细胞粘附蛋白的吸附能力较弱,不利于细胞的粘附。为了解决这一问题,Ko等[22]通过酰胺缩合反应将CMC接枝在玻璃片表面,再共价连接纤连蛋白以促进细胞粘附。结果发现,猪主动脉内皮细胞可以很好地粘附在其表面并形成融合的单层。当将其浸入纤维素酶溶液中时,由于CMC层被酶消化,细胞片会自发地从基底表面上分离,且细胞与细胞的连接仍然保存完好,说明酶的处理对细胞无明显毒害。而Sakai等[23]则利用CMC与酪胺盐酸盐的酰胺缩合反应向其中引入酚羟基,再通过过氧化物酶的催化氧化反应,在细胞培养板上制备得到了具有足够疏水性的CMC凝胶层。接种L929成纤维细胞并培养4 h后,发现76.9%的细胞均粘附在凝胶上;培养168 h后,细胞在凝胶上增殖并形成融合的单层膜。在使用纤维素酶消化凝胶大约5 min后,可以分离收获细胞片,且细胞显示出与消化前相似的良好形态。Hong等[24]则向CMC中共价引入了多巴胺(DA),在玻璃片上形成了CMC-DA涂层。由于具有良好的粘附性,DA增加了细胞在CMC表面的粘附。将人骨髓间充质干细胞或角膜缘上皮细胞培养在CMC-DA基底上,再用纤维素酶处理10 min使CMC发生降解,可以收获细胞片,且细胞的活性和功能均得到了很好的保存。相关研究均表明,采用纤维素酶处理纤维素是一种快速、有效、安全的获取细胞片的方法。
此外,Nagai等[25]利用来源于鲑鱼新鲜皮肤的去端肽胶原蛋白,在培养皿上制备得到了胶原酶敏感的胶原纤维凝胶。在其上接种人牙周韧带(HLPL) 细胞并培养10 d形成完整的细胞片层结构后,可以用镊子将凝胶连同细胞一同完整的取下,将其转移到胶原酶中进行处理,2 h内可以将胶原凝胶消化,得到完整的细胞片。胶原酶的处理对细胞的活性几乎无影响,细胞骨架和纤维结合蛋白基质的水平在处理前后也保持不变。利用该方法通过叠加还可以方便地得到多层细胞片。
Liu等[26]也利用海藻酸钠对海藻酸裂解酶的敏感性来制备和获取细胞片;他们将海藻酸钠以及明胶分别与酪胺盐酸盐发生酰胺缩合反应向其中引入酚羟基,再通过辣根过氧化物酶的催化交联偶联,在培养板上制备得到了海藻酸钠-明胶复合水凝胶。接种人主动脉内皮细胞(HAE) 或小鼠胚胎成纤维细胞(10T1/2),经过培养获得融合的细胞层后,加入海藻酸裂解酶处理20–25 min后,也可以得到完整的细胞片。
与温敏性培养系统相比,酶敏感性系统采用的基底材料一般是天然生物大分子,具有良好的生物相容性,且原料易得、成本低廉。同时,由于酶一般具有良好的特异性和高效性,利用该方法能快速获取细胞片,且对细胞和细胞外基质几乎无损伤。
3 光敏感性培养系统由于具有良好的空间可控性和时间可控性,光照是一种非常理想的控制细胞粘附的手段。因而,基于光敏感性材料构建光响应性的培养体系,并通过光照改变基底对细胞的粘附性,也可以用于制备和收获细胞片。该方法操作简单,对细胞的直接损害小,在研究中备受关注。
二氧化钛(TiO2) 是一种良好的紫外光敏感性材料,在光照作用下,其表面吸附的蛋白会逐渐发生解离,导致表面润湿性由疏水性转变为高度亲水性,因而可以用于细胞粘附和脱附研究。Wang和Chen课题组利用TiO2纳米薄膜进行了大量关于细胞片的制备研究工作[27-33]。该课题组通过相分离诱导自组装法在石英片上制备得到了由直径为30–110 nm的TiO2纳米点形成的薄膜,用于培养小鼠颅盖来源的前成骨细胞(MC3T3-E1)[27]。经过5 d的培养可以得到相互融合的单层细胞膜,再经365 nm紫外线照射20 min后即可获得完整的细胞片。该细胞片的获取方法无基底材料残余,不会引起培养环境的改变,且通过简单的调节光的波长、照射强度和时间等参数有望精确地控制细胞的脱附。得到的细胞片中97%以上的细胞仍然保持良好的活性,可以继续粘附和生长。研究发现,改变TiO2纳米薄膜的结构,可以调节细胞片的获取效率[28]。通过向TiO2纳米点薄膜中引入RGD肽[29-30]、层粘连蛋白Laminin-521[31]或碳量子点[32]等活性物质,可以调节细胞的粘附、活性和功能。该培养体系也可以用于多种细胞组成的复合细胞片的制备,促进血管化网络结构的形成,显示出良好的发展潜力和应用前景[33]。
另外,Kim等[34]利用胶原的细胞亲和性及其在近红外光(NIR) 照射下的解离,也提供了一种快速的非侵入性的细胞片制备方法。通过在聚苯乙烯(PS) 基底上进行溶液浇铸聚合得到了聚(3, 4-亚乙基二氧噻吩) (PEDOT),再通过滴涂法在PEDOT表面得到了厚度为14–18 μm的Ⅰ型胶原层。接种成纤维细胞并培养3 d后,采用808 nm的NIR进行5 min的照射,由于PEDOT的光热效应,基底温度会升高到41.4 ℃,从而导致胶原由三螺旋结构展开成可溶解的单螺旋结构,进一步使表面的细胞脱离基底而获得完整的活细胞片。
4 离子敏感性培养系统离子敏感性培养系统一般利用的是基底材料对离子的响应特性,当改变离子含量时,会引起基底材料发生降解或解离,从而将表面粘附生长的细胞释放出去。该方法在细胞脱附时,细胞表面的粘附蛋白仍然保留,对细胞几乎无损害。
Yan等[35]发明了一种简单廉价的利用钙交联的海藻酸钙水凝胶获取细胞片的方法。在其上接种细胞并培养3 d后,加入25 mmol/L的柠檬酸钠处理20 min,由于柠檬酸钠对Ca2+的更强的螯合作用,导致海藻酸钙水凝胶的交联被破坏,因而细胞与基底脱附,形成完整的细胞片。将获得的细胞片堆叠在一起时,片层之间可以继续相互粘附,可应用于更为复杂的多层细胞片的构建。Baek等[36]利用细胞跨膜受体CAMs在二价离子耗尽的情况下会发生由开放构象向封闭构象的转变从而改变细胞粘附状态的原理来制备细胞片。其以疏水性的二乙烯基苯(DVB) 和亲水性的4-乙烯基吡啶(4VP) 为原料,采用化学气相沉积法在培养板上制备得到了聚(二乙烯基苯-co-4-乙烯基吡啶)。通过调节DVB和4VP的比例,可以实现对细胞-基质相互作用的精确调节,从而控制细胞粘附和生长。在生理条件下,将培养液替换为不含Ca2+和Mg2+等二价离子的培养液,在100 s内就可以快速获取细胞片。动物模型实验显示,获得的细胞片可显著改善糖尿病患者的伤口愈合和缺血肢体的血液再灌注,表明该细胞片具有良好的临床应用前景。
最近,利用静电自组装形成的聚电解质薄膜的离子敏感性构建细胞片也引起了越来越多的注意。Zahn等[37]利用聚乙烯基亚胺(PEI)、透明质酸(HA) 和聚赖氨酸(PLL) 构建了一种具有亚铁氰根离子敏感性的聚电解质多层膜(PEMs)。接种小鼠C2C12成肌细胞并培养形成单层膜后,向其中加入低浓度的无毒的亚铁氰根离子,由于其与PLL上的氨基的作用更强,PLL与HA之间的静电作用遭到破坏,导致PEMs发生解离,因而处理5 min左右,细胞就能够从基底表面脱附。得到的细胞片上没有聚电解质的残留,且仍然保留有细胞外基质,细胞无损伤。该方法是一种较为通用的细胞片制备方法,在通常的玻璃和PS基底上都适用,且可以根据细胞的特点有针对性地选择合适的电解质。
5 氧化还原敏感性培养系统与离子敏感性培养系统类似,氧化还原敏感性系统所采用的基底材料在特殊环境下能够发生氧化还原反应而被破坏或解离,从而获得细胞片。
二硫键与巯基间的相互转变是生命活动中的一种常见的氧化还原反应,因而可以利用该原理制备细胞片。Chassepot等[38]以含有二硫键的聚乙烯基苯甲酸衍生物阴离子(PVBACOO-)和聚乙烯基苯甲酸衍生物阳离子(PVBANH3+),以及聚烯丙胺盐酸盐(PAH) 和聚苯乙烯磺酸盐(PSS)为原料,在玻璃片上通过自组装形成了(PVBANH3+/ PVBACOO–)10-(PAH/PSS)10-PAH多层膜。加入5 mmol/L的三(2-羧乙基)膦(TCEP) 进行处理后,由于多层膜基底中的二硫键发生还原而断裂,导致基底发生破坏,从而可以获得细胞片。Moriyama等[39]则以巯基化的聚乙二醇(PEG-SH)和巯基化的明胶(Gela-SH),通过辣根过氧化物酶的催化形成了含有二硫键的水凝胶。当L929成纤维细胞在其表面生长融合形成单层膜后,加入10 mmol/L的胱胺溶液温和处理30 min,由于胱胺与二硫键发生反应使之断裂,导致凝胶解离,因而可以获得完整的细胞片。利用氧化还原反应获取细胞片的方法一般操作较为简单,对细胞的损伤较少,但是对基底材料的要求较高,制备过程相对较为复杂。
利用氧化还原敏感性培养系统也可以获取由多种细胞组成的复合细胞片。Lee等[40]将金片置于端炔醌-烷硫醇和三(乙二醇) 端基烷硫醇中进行组装,再利用点击反应获得了末端带有RGD的电活性金片。其可以促进细胞的粘附和增殖,依次接种NIH 3T3细胞和HaCaT角质形成细胞,通过共培养最终可以形成一种类皮肤的细胞单层。采用?800 ?mV的电压处理3 min后,由于基底中的醌基被还原为相应的对苯二酚,引起分子内环合并诱导键断裂,导致细胞从表面脱附,从而得到完整的细胞片。
6 pH敏感性培养系统pH敏感性系统主要基于pH响应性材料,通过改变环境pH值使得培养基底材料发生降解或解离,导致粘附在其表面的细胞自然脱离而获得细胞片。但是该培养体系需要注意pH值不能过高或过低,且处理时间尽量短,以减少对细胞的损伤。
Guillaume-Gentil等[41]以PAH和PSS通过层层自组装在ITO电极上构建了聚电解质多层膜。该薄膜可以促进人胎盘源性间充质干细胞(PD-MSCs) 的生长和增殖,且细胞保留了其表型特征和中胚层分化潜能。通过降低环境pH值,能够促进电解质薄膜的解离和破坏,从而快速获取完整的活细胞片。研究表明,当pH降低到4.0时,2–3 min内就可以得到细胞片,且细胞仍然保持活力,具有向成脂肪细胞和成骨细胞分化的能力。
而Sugiyama等[42]在培养板上原位制备了大小为几微米的具有pH响应性的碳酸钙(CaCO3)颗粒,将人骨髓间质干细胞(HMSC) 接种培养24 h后,可以得到相互融合的细胞片层。当降低pH值到4.1时,由于CaCO3颗粒在酸性条件下的分解,导致细胞在15 min内发生自然脱附。由于CaCO3分解速度快,缩短了细胞片的获取时间,因而抑制了酸性条件下的细胞衰亡。研究显示,获得的细胞片中97.8%的细胞仍然保持活性。
7 糖敏感性培养系统苯硼酸(PBA) 基团能够与具有顺式二醇结构的物质(如葡萄糖、果糖) 结合,形成苯硼酸酯键,从而增加体系的带电荷量。研究者常将PBA引入到聚合物中,以构建糖敏感性系统,广泛应用于药物释放、组织工程等领域。通过在细胞培养基底上引入PBA,研究者可以加入不同浓度和种类的糖来调节基底材料的带电荷量,从而调控基底的亲疏水性,进而控制细胞的粘附和脱附,因此其也可应用于细胞片的制备。
Reddy等[43]以4-乙烯基苯硼酸(VPBA)、N, N-二甲氨基甲基丙烯酸乙酯和丙烯酰胺类单体等通过氧化还原引发聚合得到了具有糖敏感性的三元聚合物,其在生理条件下能够与聚乙烯醇反应生成苯硼酸酯键而形成水凝胶。接种NIH 3T3细胞并增殖形成相互连接的单层膜后,加入果糖处理20 min,凝胶发生解离,从而可得到完整的细胞片。
Guo等[44]采用NIPAM、3-丙烯酰胺基苯硼酸(APBA) 等通过氧化还原引发聚合,制备得到了具有糖和温度双敏感性的水凝胶。将MC3T3-E1细胞接种在水凝胶上,并经过2 d的培养后,细胞增殖形成了融合的单层膜。在37 ℃下往其中加入10 g/L的果糖并处理42 min后,细胞完全与凝胶基质剥离,从而获得完整的细胞片。若同时降低温度,可以进一步协同缩短细胞片的获取时间,提高细胞片的获取效率。
8 总结与展望随着组织工程的不断发展,细胞片技术已经成为生物医学领域的重要工具,在心脏、骨骼、牙周组织等器官或组织的病变治疗或重建中发挥了重要作用。通过对培养基底进行合理设计,引入敏感性基元或生物活性分子,可以促进细胞的粘附和生长,加速细胞片的获取,通过进一步的加工和叠加,可以获得各种具有优异性能的复合细胞片,从而不断扩展细胞片的研究和应用范围,推动细胞片在临床中的大规模应用。其中,采用温敏性基底构建细胞片是研究最早也是最为广泛的一种方法。通过引入生物活性分子或基团,调控温敏性基底的组成、结构和性质,从而对细胞片的构建产生影响,是当前的研究热点和未来的主要发展方向。而采用酶、光、离子、氧化还原、pH、糖等敏感性材料设计培养基底,由于具有优良的特异性和专属性,在各种特殊性能的细胞片的构建中也起着越来越重要的作用,极大地扩展了细胞片的应用范围。
然而,目前组织工程细胞片的构建和研究中仍然存在着一些待解决的问题:(1) 细胞片的收获时间可能较长,存在细胞衰亡的风险,影响细胞的活性;(2) 采用细胞片叠加形成复杂的三维组织,需要大量细胞片,而目前细胞片的大批量生产仍然存在问题;(3) 由于无支架的参与,构建的细胞片的强度可能不足,在一定程度上限制了后续组织或器官的修复和重建;(4) 由于缺乏功能性血管,目前多层细胞片的厚度受到了限制,有可能使内部细胞缺乏氧气和营养物质,导致细胞死亡。因此,组织工程细胞片的构建仍存在着较大的发展空间,各种敏感性的培养基底有待进一步的研究和开发,但是其良好的临床应用前景值得期待。
参考文献
| [1] | Khademhosseini A, Langer R. A decade of progress in tissue engineering. Nat Protocols, 2016, 11(10): 1775-1781. DOI:10.1038/nprot.2016.123 |
| [2] | Langer R, Vacanti JP. Tissue engineering. Science, 1993, 260(5110): 920-926. DOI:10.1126/science.8493529 |
| [3] | Yamato M, Okano T. Cell sheet engineering. Mater Today, 2004, 7(5): 42-47. DOI:10.1016/S1369-7021(04)00234-2 |
| [4] | Owaki T, Shimizu T, Yamato M, et al. Cell sheet engineering for regenerative medicine: current challenges and strategies. Biotechnol J, 2014, 9(7): 904-914. DOI:10.1002/biot.201300432 |
| [5] | Li MX, Ma J, Gao YB, et al. Cell sheet technology: a promising strategy in regenerative medicine. Cytotherapy, 2018, 21(1): 3-16. |
| [6] | Chen GN, Qi YY, Niu L, et al. Application of the cell sheet technique in tissue engineering. Biomed Rep, 2015, 3(6): 749-757. DOI:10.3892/br.2015.522 |
| [7] | Kirby GTS, Michelmore A, Smith LE, et al. Cell sheets in cell therapies. Cytotherapy, 2018, 20(2): 169-180. DOI:10.1016/j.jcyt.2017.11.004 |
| [8] | Tang ZL, Okano T. Recent development of temperature-responsive surfaces and their application for cell sheet engineering. Regen Biomater, 2014, 1(1): 91-102. DOI:10.1093/rb/rbu011 |
| [9] | Patel NG, Zhang G. Responsive systems for cell sheet detachment. Organogenesis, 2013, 9(2): 93-100. DOI:10.4161/org.25149 |
| [10] | Nash ME, Healy D, Carroll WM, et al. Cell and cell sheet recovery from pNIPAm coatings; motivation and history to present day approaches. J Mater Chem, 2012, 22(37): 19376-19389. DOI:10.1039/c2jm31748f |
| [11] | 刘阳, 尹玉利, 贺艳. 聚N-异丙基丙烯酰胺温敏水凝胶的研究与应用进展. 高分子通报, 2019, 7: 13-19. Liu Y, Yin YL, He Y. The research and application progress of poly(N-isopropylacrylamide) thermosensitive hydrogels. Polym Bull, 2019, 7: 13-19 (in Chinese). |
| [12] | Yamada N, Okano T, Sakai H, et al. Thermo-responsive polymeric surfaces; control of attachment and detachment of cultured cells. Macromol Rapid Commun, 1990, 11(11): 571-576. DOI:10.1002/marc.1990.030111109 |
| [13] | Sudo Y, Sakai H, Nabae Y, et al. Preparation of hyperbranched polystyrene-g-poly(N-isopropylacrylamide) copolymers and its application to novel thermo-responsive cell culture dishes. Polymer, 2015, 70: 307-314. DOI:10.1016/j.polymer.2015.06.035 |
| [14] | Xia YQ, He XL, Cao MW, et al. Thermoresponsive microgel films for harvesting cells and cell sheets. Biomacromolecules, 2013, 14(10): 3615-3625. DOI:10.1021/bm4009765 |
| [15] | Pan GQ, Guo QP, Ma Y, et al. Thermo-responsive hydrogel layers imprinted with RGDS peptide: a system for harvesting cell sheets. Angew Chem Int Ed, 2013, 52(27): 6907-6911. DOI:10.1002/anie.201300733 |
| [16] | Xia YQ, Wu H, Tang DC, et al. Graphene oxide nanosheet-composited poly(N-isopropylacrylamide) hydrogel for cell sheet recovery. Macromol Res, 2019, 27(7): 679-685. DOI:10.1007/s13233-019-7099-z |
| [17] | Liu D, Wang T, Liu XX, et al. Accelerated cell sheet detachment by copolymerizing hydrophilic PEG side chains into PNIPAm nanocomposite hydrogels. Biomed Mater, 2012, 7(5): 055008. DOI:10.1088/1748-6041/7/5/055008 |
| [18] | Desseaux S, Klok HA. Temperature-controlled masking/unmasking of cell-adhesive cues with poly (ethylene glycol) methacrylate based brushes. Biomacromolecules, 2014, 15(10): 3859-3865. DOI:10.1021/bm501233h |
| [19] | Altomare L, Cochis A, Carletta A, et al. Thermo-responsive methylcellulose hydrogels as temporary substrate for cell sheet biofabrication. J Mater Sci Mater Med, 2016, 27(5): 95. DOI:10.1007/s10856-016-5703-8 |
| [20] | Hoo SP, Sarvi FM, Li WH, et al. Thermoresponsive cellulosic hydrogels with cell-releasing behavior. ACS Appl Mater Interfaces, 2013, 5(12): 5592-5600. DOI:10.1021/am4009133 |
| [21] | Miyagawa S, Domae K, Yoshikawa Y, et al. Phase Ⅰ clinical trial of autologous stem cell-sheet transplantation therapy for treating cardiomyopathy. J Am Heart Assoc, 2017, 6(4): e003918. |
| [22] | Ko IK, Kato K, Iwata H. A thin carboxymethyl cellulose culture substrate for the cellulase-induced harvesting of an endothelial cell sheet. J Biomater Sci Polym Ed, 2005, 16(10): 1277-1291. DOI:10.1163/156856205774269511 |
| [23] | Sakai S, Ogushi Y, Kawakami K. Enzymatically crosslinked carboxymethylcellulose-tyramine conjugate hydrogel: cellular adhesiveness and feasibility for cell sheet technology. Acta Biomater, 2009, 5(2): 554-559. DOI:10.1016/j.actbio.2008.10.010 |
| [24] | Hong S, Sunwoo JH, Kim JS, et al. Conjugation of carboxymethyl cellulose and dopamine for cell sheet harvesting. Biomater Sci, 2019, 7(1): 139-148. DOI:10.1039/C8BM00971F |
| [25] | Nagai N, Yunoki S, Satoh Y, et al. A method of cell-sheet preparation using collagenase digestion of salmon atelocollagen fibrillar gel. J Biosci Bioeng, 2004, 98(6): 493-496. DOI:10.1016/S1389-1723(05)00319-1 |
| [26] | Liu Y, Sakai S, Taya M. Impact of the composition of alginate and gelatin derivatives in bioconjugated hydrogels on the fabrication of cell sheets and spherical tissues with living cell sheaths. Acta Biomater, 2013, 9(5): 6616-6623. DOI:10.1016/j.actbio.2013.01.037 |
| [27] | Hong Y, Yu MF, Weng WJ, et al. Light-induced cell detachment for cell sheet technology. Biomaterials, 2013, 34(1): 11-18. DOI:10.1016/j.biomaterials.2012.09.043 |
| [28] | Cheng K, Wan HP, Weng WJ. A facile approach to improve light induced cell sheet harvesting through nanostructure optimization. RSC Adv, 2015, 5(108): 88965-88972. DOI:10.1039/C5RA17116D |
| [29] | Cheng K, Wang TT, Yu ML, et al. Effects of RGD immobilization on light-induced cell sheet detachment from TiO2 nanodots films. Mater Sci Eng, 2016, 63: 240-246. DOI:10.1016/j.msec.2016.02.072 |
| [30] | Yu ML, Yu MF, Zhu LQ, et al. The effects of TiO2 nanodot films with RGD immobilization on light-induced cell sheet technology. Biomed Res Int, 2015, 2015: 582359. |
| [31] | Jiang ZW, Xi Y, Lai KC, et al. Laminin-521 promotes rat bone marrow mesenchymal stem cell sheet formation on light-induced cell sheet technology. Biomed Res Int, 2017, 2017: 9474573. |
| [32] | Wang XZ, Cheng K, Weng WJ, et al. Light-induced cell-sheet harvest on TiO2 films sensitized with carbon quantum dots. Chem Plus Chem, 2016, 81(11): 1166-1173. |
| [33] | Zhou Y, Dong LQ, Liu C, et al. Engineering prevascularized composite cell sheet by light-induced cell sheet technology. RSC Adv, 2017, 7(52): 32468-32477. DOI:10.1039/C7RA05333A |
| [34] | Kim JD, Heo JS, Park T, et al. Photothermally induced local dissociation of collagens for harvesting of cell sheets. Angew Chem Int Ed, 2015, 54(20): 5869-5873. DOI:10.1002/anie.201411386 |
| [35] | Yan J, Chen F, Amsden BG. Cell sheets prepared via gel-sol transition of calcium RGD-alginate. Acta Biomater, 2016, 30: 277-284. DOI:10.1016/j.actbio.2015.10.046 |
| [36] | Baek J, Cho Y, Park HJ, et al. A surface-tailoring method for rapid non-thermosensitive cell-sheet engineering via functional polymer coatings. Adv Mater, 2020, 32(16): 1907225. DOI:10.1002/adma.201907225 |
| [37] | Zahn R, Thomasson E, Guillaume-Gentil O, et al. Ion-induced cell sheet detachment from standard cell culture surfaces coated with polyelectrolytes. Biomaterials, 2012, 33(12): 3421-3427. DOI:10.1016/j.biomaterials.2012.01.019 |
| [38] | Chassepot A, Gao LC, Nguyen I, et al. Chemically detachable polyelectrolyte multilayer platform for cell sheet engineering. Chem Mater, 2012, 24(5): 930-937. DOI:10.1021/cm2024982 |
| [39] | Moriyama K, Wakabayashi R, Goto M, et al. Enzyme-mediated preparation of hydrogels composed of poly(ethylene glycol) and gelatin as cell culture platforms. RSC Adv, 2014, 5(4): 3070-3073. |
| [40] | Lee J, Jung W, Yeo WS. Preparation of co-cultured cell sheets using electroactive surfaces. Bull Korean Chem Soc, 2016, 37(6): 954-957. DOI:10.1002/bkcs.10782 |
| [41] | Guillaume-Gentil O, Semenov OV, Zisch AH, et al. pH-controlled recovery of placenta-derived mesenchymal stem cell sheets. Biomaterials, 2011, 32(19): 4376-4384. DOI:10.1016/j.biomaterials.2011.02.058 |
| [42] | Sugiyama H, Hakamada M, Mabuchi M. Detachment of mesenchymal stem cells and their cell sheets using pH-responsive CaCO3 particles. Mater Trans, 2019, 60(11): 2456-2463. DOI:10.2320/matertrans.MT-M2019104 |
| [43] | Reddy RM, Srivastava A, Kumar A. Monosaccharide-responsive phenylboronate-polyol cell scaffolds for cell sheet and tissue engineering applications. PLoS ONE, 2013, 8(10): e77861. DOI:10.1371/journal.pone.0077861 |
| [44] | Guo BB, Pan GQ, Guo QP, et al. Saccharides and temperature dual-responsive hydrogel layers for harvesting cell sheets. Chem Commun, 2015, 51(4): 644-647. DOI:10.1039/C4CC08183H |
