
 , 周志楠1,2, 吴雨1,2, 宋汝谋3, 陈伟1,2
, 周志楠1,2, 吴雨1,2, 宋汝谋3, 陈伟1,2 1. 贵州大学 高原山地动物遗传育种与繁殖教育部重点实验室 贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025;
2. 贵州大学 动物科学学院,贵州 贵阳 550025;
3. 畜牧技术推广站,贵州 安顺 561000
收稿日期:2020-07-27;接收日期:2020-11-09;网络出版时间:2020-11-26
基金项目:贵州省农业领域重点项目(黔科合NY[2015]3002号) 资助
摘要:本研究旨在探究生长激素(Growth hormone,GH) 对贵州地方黄牛骨骼肌细胞增殖的表达调控,探明超表达GH基因对骨骼肌细胞增殖的影响。首先利用反转录PCR扩增黄牛GH基因的蛋白质编码区(Coding sequence,CDS),将其克隆至pUCM-T载体,并连接转化构建超表达载体pEGFP-N3-GH。同时使用实时荧光定量PCR检测GH基因在贵州地方黄牛骨骼肌相关组织(腰大肌与背最长肌) 中的表达情况,然后培养牛原代骨骼肌细胞并进行鉴定,并将GH基因超表达载体导入细胞以研究GH基因对牛骨骼肌细胞增殖以及骨骼肌生长发育相关因子胰岛素样生长因子-1 (Insulin like growth factor 1,IGF-1) 与胰岛素样生长因子-2 (Insulin like growth factor 2,IGF-2)基因表达的影响。实时荧光定量PCR结果显示,GH基因在贵州地方黄牛腰大肌中的表达量均高于背最长肌,其中在关岭牛和威宁牛腰大肌中的表达量显著高于背最长肌(P < 0.05)。细胞转染及增殖结果表明,相比于pEGFP-N3,pEGFP-N3-GH能极显著提高GH与IGF-1、IGF-2基因在骨骼肌细胞中的表达量,且在被检测的4个时期(6 h、12 h、24 h、48 h),超表达GH基因组也能够极显著地提高骨骼肌细胞的增殖速率(P<0.01)。结果提示,GH基因可促进贵州地方黄牛骨骼肌细胞的增殖,对其具有正向的调控作用,这为进一步探究GH基因对贵州地方黄牛生长发育的影响机制奠定基础。
关键词:GH基因贵州地方黄牛生长性能骨骼肌细胞
Cloning and expression of the growth hormone gene and its effect on the proliferation of skeletal muscle cells of Guizhou cattle
Xiang Chen1,2

 , Zhinan Zhou1,2, Yu Wu1,2, Rumou Song3, Wei Chen1,2
, Zhinan Zhou1,2, Yu Wu1,2, Rumou Song3, Wei Chen1,2 1. Key Laboratory of Animal Genetics and Breeding and Reproduction of Plateau and Mountain Animals of Guizhou University, Guizhou Key Laboratory of Animal Genetics and Breeding and Reproduction, Guiyang 550025, Guizhou, China;
2. School of Animal Science, Guizhou University, Guiyang 550025, Guizhou, China;
3. Livestock Technology Extension Station, Anshun 561000, Guizhou, China
Received: July 27, 2020; Accepted: November 9, 2020; Published: November 26, 2020
Supported by: Guizhou Province's Key Agricultural Project, China (No. Qiankehe NY[2015]3002)
Corresponding author: Xiang Chen. Tel: +86-851-88298006; E-mail: Xchen2@gzu.edu.cn.
Abstract: The aim of this study was to investigate the expression of growth hormone (GH) gene on skeletal muscle cell proliferation of Guizhou cattle. The coding sequence of cattle GH gene was amplified by reverse transcription PCR, cloned into the pUCM-T vector and then used to construct the GH gene overexpression vector pEGFP-N3-GH. The expression of the GH gene in skeletal muscle-related tissues (psoas major and longissimus dorsi) of Guizhou cattle was determined by real-time fluorescent quantitative PCR (RT-qPCR). This was followed by culturing and identification of the bovine primary skeletal muscle cells. Subsequently, we introduced the GH gene overexpression vector into the cells to investigate its effect on the proliferation of bovine skeletal muscle cells and the expression of insulin like growth factor 1 and 2 genes related to skeletal muscle growth and development. RT-qPCR results showed that the expression level of GH gene was higher in the psoas major than in the longissimus dorsi of Guizhou cattle, and the expression level in the psoas major of Guanling cattle and Weining cattle was significantly higher than in the longissimus dorsi (P < 0.05). The transfection and proliferation results showed that pEGFP-N3-GH significantly increased the expression of GH, IGF-1, and IGF-2 genes in skeletal muscle cells compared to pEGFP-N3 (P < 0.05), and that overexpression of the GH gene also significantly increased the proliferation rate of skeletal muscle cells at the four periods examined (P < 0.01). Our results suggest that GH gene can promote the proliferation of skeletal muscle cells of Guizhou cattle and exerts a positive regulatory effect. This lays the foundation for further exploring the mechanism by which the GH gene affects the growth and development of Guizhou cattle.
Keywords: growth hormone geneGuizhou local cattlegrowth performanceskeletal muscle cells
生长激素(Growth hormone,GH) 与泌乳素(Prolactin,PRL)、胎盘催乳素(Placental Lacto gens,PL) 属同一基因家族,在动植物的生长发育过程中发挥着关键作用。牛GH基因位于第19号染色体,包含5个外显子和4个内含子,全长约为1 800 bp[1-4]。早期研究认为GH只在动物和人类幼年时期生长起作用,后来逐渐认识到GH还控制着全生命周期中骨骼内的钙平衡[5]。GH基因通过促进RNA与蛋白质的合成,促使软骨骨化和软骨细胞分裂,进而促进骨骼肌的生长发育[6]。在细胞培养基中添加不同浓度的GH可诱导鸡原代成肌细胞表达胰岛素样生长因子-1 (Insulin like growth factor 1,IGF-1)[7],而IGF-1基因在动物肌肉发育过程中发挥着重要作用[8],这说明GH对鸡骨骼肌细胞的增殖分化具有重要影响。还有研究表明,GH含量不足会导致儿童发育缓慢,增加骨折的风险。而GH分泌过量则会导致成人骨骺融合及肢端肥大症[9]。同时GH含量较高的老年小鼠更加容易患糖尿病、癌症等慢性疾病[10-11]。此外,GH可参与骨骼肌的代谢,在运动时给肌肉供给营养[12]、调控脂肪组织含量并影响其在人体内的分布。GH通过刺激脂肪分解、抑制其生成来调节脊椎动物脂肪组织的脂肪含量[13-14]。现如今GH基因的多态性也对牛的生长发育具有重要作用。谷朝勇等[15]研究发现,GH基因g.2 639C > G的突变位点可能是影响鲁西黄牛体重、体高、体斜长、胸围和肉用指数的优势位点。蒋秋斐等[16]在研究西门塔尔杂种牛发现,GH基因存在g.204C > T、g.420G > A、g.3699G > C、g.4000G > T、g.4001A > G等5处突变,这说明GH基因多态性丰富,选择潜力较大。但目前,尚无GH基因对贵州地方黄牛生长性能的影响的研究报道。
贵州省地处我国云贵高原东侧,冬暖夏凉,降水丰富,孕育了当地丰富的黄牛种群资源,拥有关岭牛、思南牛、威宁牛等优秀的黄牛品种,经多年选育,当地的黄牛品种具有适应性强、耐粗饲、抗病性强等特点。但由于长期历史发展和当地自然环境限制,贵州地方黄牛均有体型短小、生长缓慢、增重缓慢的缺点,限制了地方黄牛作为优质肉牛的产业化发展,当前环境下作为肉牛品种发展效益较低[17]。因此本课题通过研究贵州地方黄牛GH基因遗传特性,了解其对骨骼肌细胞增殖的影响,以期为贵州黄牛选育提供遗传背景资料参考。
1 材料与方法1.1 材料贵州地方黄牛分别来自贵州省关岭县、思南县与威宁县,挑取18月龄健康无病、免疫程序相同、体况良好的9头牛(其中关岭牛、思南牛、威宁牛各3头)。采取地方黄牛骨骼肌相关组织(腰大肌与背最长肌),用灭菌锡箔纸包装编号,放入液氮罐(?196 ℃) 中保存,带回实验室进行RNA提取。此外,以60日龄的关岭胎牛为对象,屠宰后采取腰大肌组织置于含青霉素和链霉素的PBS缓冲液中,带回实验室进行骨骼肌细胞的分离培养。
1.2 试验试剂TRIzol? Reagent等其余RNA提取检测试剂、cDNA第一链合成试剂盒均购自贵州艾瑞特生物有限公司;荧光定量试剂购自北京GenStar公司;抗性菌种、DNA克隆等相关试剂购自生工生物工程(上海) 股份有限公司;限制性核酸内切酶Xho Ⅰ、BamHⅠ购自宝生物工程(大连) 股份有限公司;质粒小提与无内毒素质粒提取试剂盒购自天根生化科技(北京) 有限公司;pEGFP-N3载体由本实验室保存。
1.3 方法1.3.1 RNA的提取与第一链cDNA的合成按照TRIzol? Reagent说明书提取地方黄牛骨骼肌相关组织(背最长肌与腰大肌) 中的总RNA。将浓度定为200 ng/μL。并采用GenStar公司的第一链cDNA逆转录合成试剂盒将提取的RNA通过碱基互补配对原则逆转录合成第一链cDNA。配制20 μL逆转录反应预混液,包括RNA template 1 μL、Oligo (dT) Primer 1 μL、DEPC-ddH2O 7 μL、Reaction mix (2×) 10 μL、StarScriptⅡ RT mix 1 μL。预混液配置完毕后,短暂离心,42 ℃反应50 min,85 ℃加热5 min,加热完毕后,将PCR产物放置?20 ℃冰箱保存。
1.3.2 引物的设计与合成依据GenBank中黄牛GH基因序列(登录号:NM_180996.1),利用Primer Premier 5.0软件分别设计引物,在GH基因克隆引物的5?端添加限制性内切酶XhoⅠ的酶切位点,在3?端添加BamHⅠ的酶切位点并增加相应的保护碱基以提高切割的准确性,以骨骼肌细胞生长关键因子IGF-1 (登录号:NM_001077828.1)、IGF-2 (登录号:NM_001367627.1) 为对照,引物信息见表 1。以黄牛GAPDH (登录号:NM_001034034) 为管家基因。引物交由生工生物工程(上海) 股份有限公司合成。
表 1 引物序列信息Table 1 The sequences information of primers
| Primer name | Sequence (5′–3′) | Tm (℃) | Size (bp) |
| q-GH | F: GTTTGCCAACGCTGTGCT R: CTGGGTGTTCTGGATGGAGTA | 60.0 | 118 |
| GH | F(XhoⅠ): CCGCTCGAGATGATGGCTGCAGGCCCCCG R(BamHⅠ): CGCGGATCCCTAGAAGGCACAGCTGGCCT | 60.0 | 654 |
| q-IGF-1 | F: TCAGCAGTCTTCCAACCCAA R: AAGGCGAGCAAGCACAGG | 60.0 | 118 |
| q-IGF-2 | F: AAGTGAGCCAAAGTGTCGTAA R: GGACGGTACAGGGATTTCA | 60.0 | 108 |
| GAPDH | F: TGAGGACCAGGTTGTCTCCTGCG R: CACCACCCTGTTGCTGTAGCCA | 60.0 | 145 |
| Note: the underlined is the restriction site to the corresponding endonuclease, and the shaded part is the protected base to the corresponding endonuclease. | |||
表选项
1.3.3 实时荧光定量PCR反应采用SYBR GreenⅠ染料法进行RT-qPCR反应。反应体系设置为20 μL,其中包含第一链cDNA模板0.8 μL、2× RealStar Green Fast Mixture 10 μL、上游以及下游引物(10 μmol/L) 各0.8 μL、ddH2O 7.6 μL。RT-qPCR程序为预变性95 ℃ 2 min,在40个循环下进行(95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30s) 反应,循环后添加由机器自动设置的溶解曲线。每个样品设置3个重复,并加上相应的阴性对照,对GH基因在贵州地方黄牛腰大肌、背最长肌组织中的实际表达水平进行检测;并用2-Ct相对定量法计算基因表达量,分别在0.05与0.01水平判断差异性标准。
1.3.4 GH基因亚克隆载体pUCM-T-GH的构建黄牛GH基因编码序列经PCR扩增后,使用琼脂糖凝胶成像系统进行拍照并进行胶回收实验。胶回收后,将产物与pUCM-T载体16 ℃下连接12 h,转化至大肠杆菌Escherichia coli DH5α感受态细胞中,随后将平板放置37 ℃恒温培养箱中培养,用枪头挑取平板上的白色斑点进行PCR验证,在使用琼脂糖凝胶电泳检测相应产物,筛选出有目的条带的菌液送至生工生物工程(上海)股份有限公司进行测序验证。
1.3.5 GH基因超表达载体pEGFP-N3-GH的构建菌液经DNA Star软件进行比对后,将比对正确的菌液取出,并用质粒小提试剂盒提取质粒,
质粒提取后使用XhoⅠ与BamHⅠ双酶切进行鉴定与胶回收实验,在利用T4 DNA连接酶将胶回收产物与酶切后的pEGFP-N3真核表达载体进行连接,并再次转化至大肠杆菌E. coli DH5α感受态细胞中,涂板、过夜培养与菌液PCR验证后,筛选出具有目的条带的菌液送至生工生物工程(上海) 股份有限公司测序,将测序比对正确的阳性菌液再次使用双酶切鉴定,并使用无内毒素质粒提取试剂盒提取质粒,?20 ℃保存备用。
1.3.6 黄牛骨骼肌细胞的分离培养及鉴定以贵州省关岭县保种场中的关岭胎牛为材料,采集腰大肌组织,使用PBS缓冲液与75%乙醇反复清洗3遍,用灭菌后的剪刀将其剪碎成约2 mm3左右的小块,加入胶原酶37 ℃水浴1 h,待消化完全后加入DMEM/F-12完全培养基终止消化;依次使用灭菌纱布,200、400目细胞筛进行过滤,1 500 r/min离心5 min,弃上清,DMEM/F-12完全培养基悬浮沉淀,在细胞培养箱中培养5 h后,更换培养基。待细胞密度达到90%以上后接种6孔板,待6孔板中细胞密度再次达80%时,用H-E染色试剂盒对骨骼肌细胞进行鉴定。
1.3.7 pEGFP-N3-GH转染至黄牛骨骼肌细胞在脂质体转染试剂盒Lipofectamine 2000说明书的指导下将超表达载体pEGFP-N3-GH、空载体pEGFP-N3分别转染至黄牛骨骼肌细胞中,轻微摇匀后,放入37 ℃、5% CO2细胞培养箱中进行培养,24 h后使用荧光显微镜观察细胞的转染效率,根据细胞中绿色荧光蛋白GFP的发光情况初步判断载体的转染效果。
1.3.8 实时荧光定量PCR检测GH及相关基因在细胞水平的表达变化将pEGFP-N3-GH转染至牛骨骼肌细胞后,利用TRIzol? Reagent试剂盒提取黄牛骨骼肌细胞中的总RNA并反转录为cDNA第一链,用于实时荧光定量PCR测定pEGFP-N3-GH对目的基因GH及骨骼肌细胞生长关键因子IGF-1与IGF-2表达的变化,反应体系、程序、数据处理与1.3.3中方法相同。
1.3.9 GH基因对细胞增殖水平的影响以pEGFP-N3为对照,通过CCK-8法检测pEGFP-N3-GH转染后对黄牛骨骼肌细胞的增殖状态,比较骨骼肌细胞的增殖速率。简而言之,就是将细胞从培养瓶中消化后,铺至96孔板,通过细胞计数将每孔的细胞密度定为1.05×107个/mL,载体转染24 h后加入CCK8试剂,每个孔加入10 μL,再使用枪头吹打混匀,放入37 ℃、5% CO2培养箱培养4 h后,待CCK8与骨骼肌细胞反应完全后,利用酶标仪在450 nm处依次检测细胞在0 h、6 h、12 h、24 h、48 h的吸光度值变化,判断转染后细胞的增殖状态。
2 结果与分析2.1 GH基因荧光引物与克隆引物特异性检测将GH基因的荧光定量引物与克隆引物与逆转录的黄牛骨骼肌相关组织cDNA第一链结合进行PCR扩增反应,由图 1可见,GH基因的PCR扩增克隆产物(图 1A) 与荧光定量PCR引物(图 1B) 大小与目的片段大小一致,条带明亮,可用于下一步实验研究。
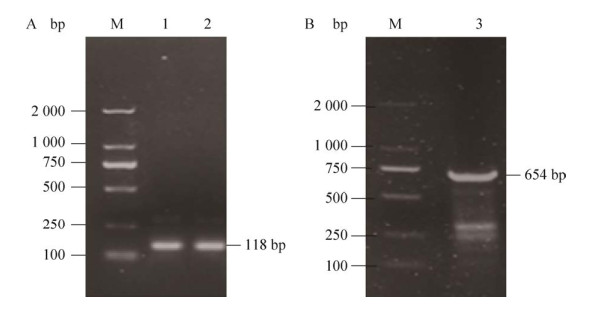 |
| 图 1 琼脂糖凝胶电泳检测结果 Fig. 1 Agarose gel electrophoresis results. (A) GH gene PCR amplification electrophoresis. M: DNA marker 2 000; 1-2: GH (B) GH gene PCR amplification electrophoresis. M: DNA marker 2000; 3: GH (CDS) |
| 图选项 |
2.2 GH基因在贵州地方黄牛骨骼肌相关组织中的表达由图 2可知,GH基因mRNA在贵州地方黄牛骨骼肌相关组织中均有表达,在腰大肌中的表达量均普遍高于背最长肌。品种内比较可知,GH基因在关岭牛和威宁牛的腰大肌中的表达量显著高于背最长肌(P < 0.05),在思南牛中则无显著差异。而品种间比较可知,GH基因在关岭牛腰大肌中的表达量显著高于思南牛与威宁牛(P < 0.05),在关岭牛背最长肌中的表达量显著高于威宁牛(P < 0.05),其余比较无显著差异。
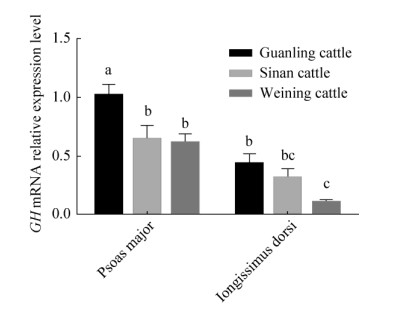 |
| 图 2 GH基因在贵州地方黄牛骨骼肌相关组织中的表达 Fig. 2 Expression of GH gene in skeletal muscle- related tissues of Guizhou cattle. Different lowercase letters represent significant difference (P < 0.05). |
| 图选项 |
2.3 pUCM-T-GH亚克隆载体与pEGFP-N3- GH超表达载体的鉴定将连接成功的pUCM-T-GH与pEGFP-N3-GH载体进行XhoⅠ和BamHⅠ的双酶切鉴定,琼脂糖凝胶电泳检测酶切产物,电泳检测条带如图 3所示,可见各载体酶切后均获得两个条带,4 729 bp代表pEGFP-N3空载体片段,654 bp代表GH基因CDS区片段,而2 773 bp则代表pUCM-T空载体片段,与预测结果相符,进一步测序结果表明,pEGFP-N3-GH测序结果正确比对率高达99%,仅发生一处同义突变,但不会引起氨基酸的改变(图 4)。双酶切检验及测序验证结果表明,贵州地方黄牛GH基因亚克隆载体pUCM-T-GH与超表达载体pEGFP-N3-GH构建成功。
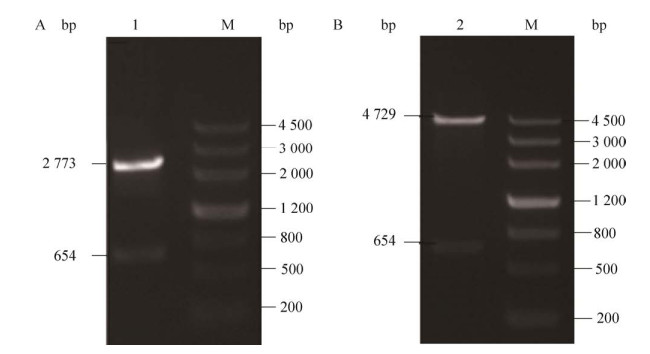 |
| 图 3 琼脂糖凝胶电泳检测结果 Fig. 3 Agarose gel electrophoresis results. (A) Double digestion validation map. M: DNA marker 5 000; 1 pUCM-T-GH. (B) Double digestion validation map. M: DNA Marker 5000; 2 pEGFP-N3-GH. |
| 图选项 |
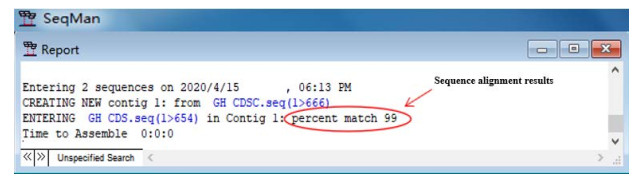 |
| 图 4 pEGFP-N3-GH重组载体测序结果 Fig. 4 Sequencing results of pEGFP-N3-GH recombinant vector. |
| 图选项 |
2.4 贵州地方黄牛骨骼肌细胞的分离培养分别在牛原代骨骼肌细胞培养12 h、24 h、36 h与72 h时进行拍照(图 5),发现细胞在培养第12 h时已经贴壁,且大多呈“点”状并逐渐变大、变圆,到第24 h时,细胞“条状”已经开始出现,细胞增殖速率明显加快,到第36 h时,骨骼肌细胞形态大小基本形成,形成前后短,中间宽的梭形细胞,有规律且紧密平行排列,细胞密度以达到50%–60%。72 h时,细胞已铺满细胞培养瓶,可进行传代试验。
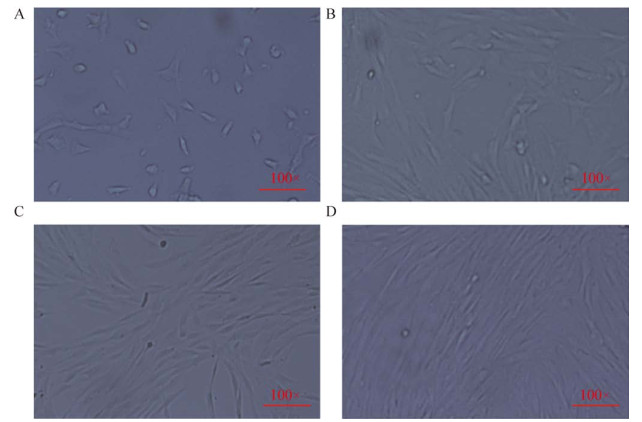 |
| 图 5 原代骨骼肌细胞的分离培养(100×) Fig. 5 Isolation and culture of primary skeletal muscle cells (100×). (A) Cell culture for 12 h. (B) Cell culture for 24 h. (C) Cell culture for 36 h. (D) Cell culture for 72 h. |
| 图选项 |
2.5 贵州地方黄牛骨骼肌细胞的鉴定待培养的原代细胞汇合度达90%以上时,更换为诱导培养基进行诱导培养,经H-E染色,结果如图 6所示,倒置显微镜下观察细胞形态发现,诱导分化后细胞融合,形成多核的肌管,细胞核被苏木精(Hematoxylin) 染成紫色,细胞质与细胞核均在同一平面,表明牛原代骨骼肌细胞培养成功。
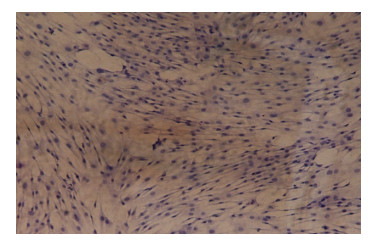 |
| 图 6 骨骼肌细胞的鉴定(100×) Fig. 6 Identification of skeletal muscle cells (100×). |
| 图选项 |
2.6 各载体转染牛骨骼肌细胞效率检测pEGFP-N3、pEGFP-N3-GH转染牛骨骼肌细胞的效率如图 7所示,空白对照细胞较漆黑,无绿色荧光蛋白出现,相比于空白对照,pEGFP-N3空载体、pEGFP-N3-GH真核表达载体均在转染后24 h内,细胞中呈现绿色荧光(图中高亮部分),阳性细胞较高,细胞培养板中无漂浮的死细胞,证实各重组载体转染成功,且转染效率良好,在牛骨骼肌细胞存在表达,可用于下一步研究。
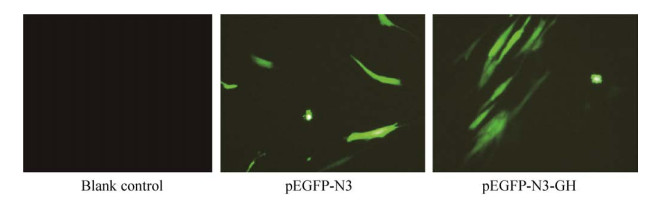 |
| 图 7 各重组质粒在细胞中的发光效率检测(100×) Fig. 7 Detection of the fluorescence efficiency of each recombinant plasmid in the cell (100×). |
| 图选项 |
2.7 RT-qPCR检测真核表达GH基因在牛骨骼肌细胞中对相关基因表达的影响以pEGFP-N3组为空白对照组,将pEGFP-N3、pEGFP-N3-GH重组载体转染牛骨骼肌细胞后,RT-qPCR结果如图 8所示,与空载体pEGFP-N3相比,重组质粒pEGFP-N3-GH能极显著提高GH基因在骨骼肌细胞中的表达(P < 0.01),同时对骨骼肌细胞生长关键因子IGF-1与IGF-2也具有极显著的上调作用(P < 0.01)。
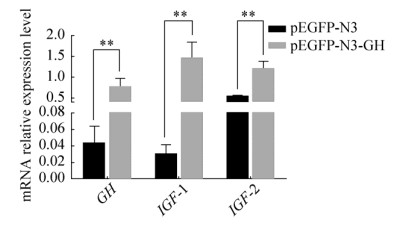 |
| 图 8 pEGFP-N3-GH转染后对GH与IGF-1、IGF-2基因表达的影响 Fig. 8 Effect of pEGFP-N3-GH transfection on the expression of GH, IGF-1 and IGF-2 genes. **P < 0.01. |
| 图选项 |
2.8 GH基因对牛骨骼肌细胞增殖的影响为了进一步验证GH基因对骨骼肌细胞增殖的情况,本研究利用CCK-8试剂检测超表达GH基因后牛骨骼肌细胞的增殖速率发现,将pEGFP-N3-GH导入细胞后,与pEGFP-N3组相比,pEGFP-N3-GH超表达载体对细胞增殖速率明显高于pEGFP-N3组,除0 h外,超表达组各时段数值均极显著高于pEGFP-N3组(P<0.01) (图 9),表明GH基因能够促进牛骨骼肌细胞的增殖,对其具有正向调控作用。
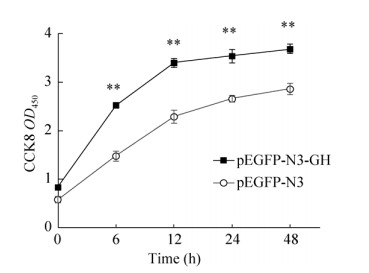 |
| 图 9 GH基因表达对细胞增殖的影响 Fig. 9 Effect of GH gene expression on cell proliferation. **P < 0.01. |
| 图选项 |
3 讨论生长激素是一种单链多肽激素,由垂体前叶分泌,是一种生长调节类激素[18-19]。Vasilatos等[20]研究表明,GH与其受体结合后,能刺激局部组织产生胰岛素生长因子来调节骨骼肌的生长发育。进一步研究表明,GH基因在动物幼年时期高表达于骨骼肌。相关研究人员通过检测高脚鸡、矮脚鸡、百宜黑鸡与乌蒙凤鸡的组织表达发现,同一品种不同组织GH基因的表达量均以腿肌最高[21-22];此外,王金洲等[23]研究发现,GH基因在6月龄的威宁绵羊的肌肉组织表达最高。综上所述,GH基因在动物骨骼肌中均有表达,且高表达于幼年时期骨骼肌中。本研究显示,GH基因在3个牛种(关岭牛、思南牛、威宁牛) 的骨骼肌组织中均有表达,且表达趋势趋于一致,均高表达于腰大肌,这与上述何琦、陆静、王金洲等的研究结果相符[21-23],均高表达于骨骼肌,这说明GH基因对动物机体骨骼肌的发育具有重要作用。
骨骼肌干细胞又称骨骼肌卫星细胞,相关研究表明,骨骼肌干细胞是由相关转录因子激活形成单核成肌细胞,通过细胞进一步增殖分化,形成多核肌细胞。多核肌细胞相互连接、融合最终形成肌纤维[24]。在动物生长发育过程中,动物肌肉的发育好坏对其生长具有重要影响,肌肉的发育情况直接影响了动物的生长速度和肉品质[25]。本研究采用60日龄关岭胎牛的腰大肌组织分离培养骨骼肌细胞,构建GH基因超表达载体导入细胞后验证其对骨骼肌生长发育影响因子表达水平的影响,旨在为GH基因对贵州地方黄牛生长发育的分子机制提供基础。
细胞增殖是生物体的重要生命特征,而细胞分裂是细胞增殖的主要方式,细胞通过分裂不仅可以产生新的细胞,还可以将所复制的遗传物质,平均地分配到下一代细胞。可见,细胞增殖是生物体生长、发育、繁殖和遗传的基础。类胰岛素生长因子(IGFs) 又称生长介素,包含胰岛素样生长因子-1 (Insulin like growth factor 1,IGF-1) 和胰岛素样生长因子-2 (Insulin like growth factor 2,IGF-2)[26-27],研究显示,GH促进动物生长的作用可通过IGFs途径实现[28],相关研究表明,超表达IGF-1可促进骨骼肌细胞的增殖与分化,使肌纤维再生和肥大[29-30]。同样的IGF-2以自分泌的方式促进肌细胞系的分化[31],通过刺激胰岛素样生长因子-1受体(Insulin like growth factor 1 Receptor,IGF1R) 与磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K) 表达,从而维持早期成肌细胞活力[32]。这表明IGF-1、IGF-2基因可能对骨骼肌细胞的增殖分化具有正向促进作用,故本研究选取IGF-1与IGF-2基因作为骨骼肌细胞增殖相关因子以此验证GH基因对骨骼肌细胞增殖机制。本研究通过CCK-8法检测发现,超表达GH基因能够提高骨骼肌细胞的增殖速率,其中在6 h、12 h、24 h、48 h能极显著促进细胞的增殖(P < 0.01),这表明,超表达GH基因可明显地促进贵州地方黄牛骨骼肌细胞的增殖,为了阐明该机制,本研究以IGF-1、IGF-2为对照,发现GH基因的超表达能够极显著提高骨骼肌生长关键因子IGF-1、IGF-2基因的表达量(P < 0.01),这提示我们提高GH基因的表达量可提高骨骼肌细胞生长因子的表达,同样提示我们GH基因的超表达可以促进贵州地方黄牛骨骼肌细胞的生长。综上所述,本研究推测GH基因可能是通过提高牛骨骼肌细胞中相关基因的表达以及促进细胞生长,从而促进牛骨骼肌的生长发育。
4 结论本研究通过RT-qPCR检测发现,GH基因在腰大肌中的表达量高于背最长肌,且本研究首次扩增出贵州地方黄牛GH基因的CDS区并构建GH基因超表达载体,导入细胞后发现超表达GH能极显著提高GH、IGF-1、IGF-2基因在骨骼肌细胞中的表达,并促进牛骨骼肌细胞的增殖,提示GH基因对骨骼肌细胞的增殖具有正向调控作用,可作为提高牛生长发育性能的候选基因。
参考文献
| [1] | Woychik RP, Camper SA, Lyons RH, et al. Cloning and nucleotide sequencing of the bovine growth hormone gene. Nucleic Acids Res, 1982, 10(22): 7197-7210. DOI:10.1093/nar/10.22.7197 |
| [2] | Gordon DF, Quick DP, Erwin CR, et al. Nucleotide sequence of the bovine growth hormone chromosomal gene. Mol Cell Endocrinol, 1983, 33(1): 81-95. DOI:10.1016/0303-7207(83)90058-8 |
| [3] | Hediger R, Johnson SE, Barendse W, et al. Assignment of the growth hormone gene locus to 19q26-qter in cattle and to 11q25-qter in sheep by in situ hybridization. Genomics, 1990, 8(1): 171-174. DOI:10.1016/0888-7543(90)90241-L |
| [4] | 孙涛, 柴团耀, 刘戈宇, 等. 植物GH3基因家族研究进展. 生物工程学报, 2008, 24(11): 1860-1866. Sun T, Chai TY, Liu GY, et al. Progress in the plant GH3 gene family. Chin J Biotech, 2008, 24(11): 1860-1866 (in Chinese). DOI:10.3321/j.issn:1000-3061.2008.11.002 |
| [5] | Goeddel DV, Heyneker HL, Hozumi T, et al. Direct expression in Escherichia coli of a DNA sequence coding for human growth hormone. Nature, 1979, 281(5732): 544-548. DOI:10.1038/281544a0 |
| [6] | O'Dor RK, Wells MJ. Reproduction versus somatic growth: hormonal control in octopus vulgaris. J Exp Biol, 1978, 77: 15-31. DOI:10.1242/jeb.77.1.15 |
| [7] | 张丽, 王章, 李婷, 等. GH蛋白诱导鸡原代成肌细胞表达IGF1条件优化. 农业生物技术学报, 2017, 25(3): 511-516. Zhang L, Wang Z, Li T, et al. The Effect of GH protein on the expression of IGF1 in chicken (Gallus gallus) myoblast cells. Chin J Agric Biotechol, 2017, 25(3): 511-516 (in Chinese). |
| [8] | Mavalli MD, DiGirolamo DJ, Fan Y, et al. Distinct growth hormone receptor signaling modes regulate skeletal muscle development and insulin sensitivity in mice. J Clin Investig, 2010, 120(11): 4007-4020. DOI:10.1172/JCI42447 |
| [9] | Parkinson C, Kassem M, Heickendorff L, et al. Pegvisomant-induced serum insulin-like growth factor-Ⅰ normalization in patients with acromegaly returns elevated markers of bone turnover to normal. J Clin Endocrinol Metab, 2003, 88(12): 5650-5655. DOI:10.1210/jc.2003-030772 |
| [10] | Duran-Ortiz S, Noboa V, Kopchick JJ. Disruption of the GH receptor gene in adult mice and in insulin sensitive tissues. Growth Horm IGF Res, 2018, 38: 3-7. DOI:10.1016/j.ghir.2017.11.003 |
| [11] | Basu R, Qian YR, Kopchick JJ. Mechanisms in Endocrinology: lessons from growth hormone receptor gene-disrupted mice: are there benefits of endocrine defects?. Eur J Endocrinol, 2018, 178(5): R155-R181. DOI:10.1530/EJE-18-0018 |
| [12] | Badin PM, Langin D, Moro C. Dynamics of skeletal muscle lipid pools. Trends Endocrinol Metab, 2013, 24(12): 607-615. DOI:10.1016/j.tem.2013.08.001 |
| [13] | Junnila RK, List EO, Berryman DE, et al. The GH/IGF-1 axis in ageing and longevity. Nat Rev Endocrinol, 2013, 9(6): 366-376. DOI:10.1038/nrendo.2013.67 |
| [14] | Yang HL, Sun C, Sun C, et al. Effect of suppressor of cytokine signaling 2 (SOCS2) on fat metabolism induced by growth hormone (GH) in porcine primary adipocyte. Mol Biol Rep, 2012, 39(9): 9113-9122. DOI:10.1007/s11033-012-1783-9 |
| [15] | 谷朝勇. 鲁西黄牛GH基因3'末端序列多态性及其与生产性状的关联分析. 中国畜牧兽医, 2010, 37(10): 144-147. Gu CY. Polymorphism and correlation analysis with growth traits of Luxi cattle population GH gene. China Animal Husband Vet Med, 2010, 37(10): 144-147 (in Chinese). |
| [16] | 蒋秋斐. 西门塔尔杂种牛生长速度相关基因与生长性状关联性的研究[D]. 银川: 宁夏大学, 2015. Jiang QF. Study on correlation between growth rate genes and growth traits in hybrid Simmental Cattle[D]. Yinchuan: Ningxia University, 2015 (in Chinese). |
| [17] | 彭梦阳, 王大会, 贺花, 等. 贵州地方黄牛种业现状、存在问题及对策. 中国牛业科学, 2019, 45(4): 55-58. Peng MY, Wang DH, He H, et al. Current situation, problems and countermeasures of Guizhou local cattle breeding industry. China Cattle Science, 2019, 45(4): 55-58 (in Chinese). DOI:10.3969/j.issn.1001-9111.2019.04.013 |
| [18] | 孙逊, 朱尚权. 生长激素的结构与功能. 国外医学(生理、病理科学与临床分册), 1999, 19(1): 6-9. Sun X, Zhu SQ. The structure and function of growth hormone. For Med Sci Sect Pathophyaiol Clin Med, 1999, 19(1): 6-9 (in Chinese). |
| [19] | 魏岳. GH基因、IGF-I基因多态性及其与京海黄鸡生产性能的相关性研究[D]. 扬州: 扬州大学, 2009. Wei Y. Single Nucleotide polymorphism of GH gene and IGF-Ⅰ gene associated with production performance in Jinghai yellow chicken[D]. Yangzhou: Yangzhou University, 2009 (in Chinese). |
| [20] | Vasilatos-Younken R, Zhou Y, Wang X, et al. Altered chicken thyroid hormone metabolism with chronic GH enhancement in vivo: Consequences for skeletal muscle growth. J Endocrinol, 2000, 166(3): 609-620. DOI:10.1677/joe.0.1660609 |
| [21] | 何琦, 杨红, 张勇, 等. 生长激素(GH)基因在不同胫长性状鸡种中的差异表达分析. 广东农业科学, 2015, 42(15): 82-87. He Q, Yang H, Zhang Y, et al. Expression differences of growth hormone (GH) gene in chickens with different shank length. Guangdong Agric Sci, 2015, 42(15): 82-87 (in Chinese). DOI:10.3969/j.issn.1004-874X.2015.15.015 |
| [22] | 陆静, 骆科印, 王现科, 等. 乌蒙凤鸡生长激素基因多态性及生物信息分析. 中国畜牧兽医, 2018, 45(11): 3122-3133. Lu J, Luo KY, Wang XK, et al. Polymorphism and bioinformatics analysis of growth hormone gene in Wumeng crested chickens. China Animal Husband Vet Med, 2018, 45(11): 3122-3133 (in Chinese). |
| [23] | 王金洲, 易鸣, 程朝友, 等. 威宁绵羊GH基因cDNA克隆及组织表达研究. 黑龙江畜牧兽医, 2018(17): 86-88. Wang JZ, Yi M, Cheng ZY, et al. Study on cDNA cloning and tissue expression of GH gene in Weining sheep. Heilongjiang Animal Husband Vet Med, 2018(17): 86-88 (in Chinese). |
| [24] | Hughes SM, Blau HM. Migration of myoblasts across basal lamina during skeletal muscle development. Nature, 1990, 345(6273): 350-353. DOI:10.1038/345350a0 |
| [25] | 李刚, 李琦华, 徐志强, 等. IGF-Ⅰ调节骨骼肌生长发育的研究进展. 黑龙江畜牧兽医, 2015, 3(5): 48-50. Li G, Li QH, Xu ZQ, et al. Research progress on the insulin-like growth factor 1 regulating the growth and development of skeletal muscle. Heilongjiang Animal Sci Vet Med, 2015, 3(5): 48-50 (in Chinese). |
| [26] | Li L, Yu H, Schumacher F, et al. Relation of serum insulin-like growth factor-Ⅰ(IGF-Ⅰ) and IGF binding protein-3 to risk of prostate cancer (United States). Cancer Cause Control, 2003, 14(8): 721-726. DOI:10.1023/A:1026383824791 |
| [27] | Murphy LJ, Bell GI, Friesen HG. Tissue distribution of insulin-like growth factor Ⅰ and Ⅱ messenger ribonucleic acid in the adult rat. Endocrinology, 1987, 120(4): 1279-1282. DOI:10.1210/endo-120-4-1279 |
| [28] | Woelfle J, Chia DJ, Rotwein P. Mechanisms of growth hormone (GH) action: identification of conserved STAT5 binding sites that mediate GH-induced insulin-like growth factor-Ⅰ gene activation. J Biol Chem, 2003, 278(51): 51261-51266. DOI:10.1074/jbc.M309486200 |
| [29] | Song YH, Song JL, Delafontaine P, et al. The therapeutic potential of IGF-Ⅰ in skeletal muscle repair. Trends Endocrin Met, 2013, 24(6): 310-319. DOI:10.1016/j.tem.2013.03.004 |
| [30] | 王晓林, 王庸晋, 荣书玲, 等. IGF-1基因转染对大鼠成肌细胞增殖和分化的影响. 长治医学院学报, 2013, 27(6): 401-405. Wang XL, Wang YJ, Rong SL, et al. Effects of IGF-1 gene transfection on the proliferation and differentiation of myoblasts in rat. J Changzhi Med Coll, 2013, 27(6): 401-405 (in Chinese). |
| [31] | Alzhanov DT, Mcinerney SF, Rotwein P. Long range interactions regulate Igf2 gene transcription during skeletal muscle differentiation. J Biol Chem, 2010, 285(50): 38969-38977. DOI:10.1074/jbc.M110.160986 |
| [32] | Duan CM, Ren HX, Gao S. Insulin-like growth factors (IGFs), IGF receptors, and IGF-binding proteins: roles in skeletal muscle growth and differentiation. Gen Comp Endocrinol, 2010, 167(3): 344-351. DOI:10.1016/j.ygcen.2010.04.009 |
