

1. 江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;
2. 江南大学 药学院,江苏 无锡 214122
收稿日期:2020-07-18;接收日期:2020-10-16
基金项目:国家自然科学基金(Nos. 21808083, 21978113),国家轻工技术与工程一流学科自主课题(No. LITE2018-08) 资助
摘要:微生物细胞工厂以可再生资源为原料,为工业化学品的可持续生产提供了一种有前景的替代方案。然而,不适的外界环境显著影响了微生物细胞的存活率,降低了微生物细胞工厂的生产性能。通过延长微生物细胞的时序寿命,可以显著提升微生物细胞工厂的生产性能。首先,基于存活率的变化建立了细胞时序寿命和半时序寿命的评价体系;然后,发现半胱氨酸、肌肽、氨基胍和氨基葡萄糖抗衰老药物可以使大肠杆菌Escherichia coli细胞的时序寿命分别延长80%、80%、50%和120%;最后,延长E. coli时序寿命可以显著改善E. coli细胞工厂的生产性能,可以用于改善具有本源代谢合成路径的E. coli细胞工厂的生产性能,使乳酸和丙酮酸的得率分别提升30.0%和25.0%,也可以用于改善具有异源代谢合成路径的E. coli细胞工厂的生产性能,使苹果酸的得率提升27.0%。这些研究结果表明延长E. coli细胞寿命提供了一种潜在的改善细胞工厂的生产性能的方法。
关键词:大肠杆菌微生物细胞工厂时序寿命抗衰老药物
Application of chronological lifespan in the construction of Escherichia coli cell factories
Jia Liu1,2, Liang Guo1, Qiuling Luo1, Xiulai Chen1,2, Cong Gao1,2, Wei Song2, Liming Liu1,2


1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
2. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: July 18, 2020; Accepted: October 16, 2020
Supported by: National Natural Science Foundation of China (Nos. 21808083, 21978113), The National First-class Discipline Program of Light Industry Technology and Engineering (No. LITE2018-08)
Corresponding author: Liming Liu. Tel: +86-510-85197357; Fax: +86-510-85197875; E-mail: mingll@jiangnan.edu.cn.
Abstract: Microbial cell factories capable of producing valuable chemicals from renewable feedstocks provide a promising alternative towards sustainability. However, environmental stress remarkably affects the performance of microbial cell factories. By extending the chronological lifespan of microbial cells, the performance of microbial cell factories can be greatly improved. Firstly, an evaluation system for chronological lifespan and semi-chronological lifespan was established based on the changes in survival rates. Secondly, the addition of anti-aging drugs such as cysteine, carnosine, aminoguanidine and glucosamine increased the chronological lifespan of E. coli by 80%, 80%, 50% and 120%, respectively. Finally, we demonstrated that extending the chronological lifespan of E. coli increased the yield of metabolites produced by E. coli cell factories with endogenous (lactic acid and pyruvic acid) or exogenous (malic acid) metabolic pathway by 30.0%, 25.0%, and 27.0%, respectively. The strategy of extending chronological lifespan of E. coli provides a potential approach for enhancing the performance of microbial cell factories.
Keywords: Escherichia colimicrobial cell factorieschronological lifespanantiaging drugs
微生物细胞工厂提供了一种利用可再生资源生产工业化学品的方法,可有效解决石油化工炼制和植物提取对自然资源的依赖与对环境的危害[1-5]。为了提高微生物细胞工厂的效率,已开发多种工程策略,例如传统育种策略和理性代谢工程策略[6]。最近Chen等[1]提出一种技术结构概念——设计-构建-评价-优化(Design-construction-evaluation- optimization,DCEO) 生物技术,用于调控碳流的流量、流向和速率,其包括发现和组合生化途径以构建生产目标化学品的合成路径,在宿主菌株中高效快速地组装代谢途径,通过确定理想条件和实际条件之间的差异精确地确定代谢瓶颈,并修改代谢途径以优化目标化学品的生产。使用DCEO生物技术可以显著提高工业菌株的代谢能力。事实上,微生物细胞工厂的效率取决于其代谢能力、生理状态和环境条件。
衰老是细胞生物体随年龄增长而发生退行性变化的总和[7]。衰老的酿酒酵母Saccharomyces cerevisiae会使发酵过程中糖耗速率减慢,发酵周期延长,发酵过程中代谢产物不稳定,对于发酵过程有较大的影响,使用衰老的S. cerevisiae会给企业带来巨大的经济损失。衰老是一种渐变的形态和功能变化,会扰乱维持稳态的能力并增加细胞死亡的可能性。细胞老化是S. cerevisiae和Escherichia coli的最基本生理特征之一,可分为复制型和时序型的衰老。根据衰老的分类,S. cerevisiae和E. coli的寿命可以分为(1) 复制寿命(Replicative lifespan,RLS),其由衰老之前产生的子代细胞的数量决定[8-9],以及(2) 时序寿命(Chronological lifespan,CLS),在特定条件下,一定数量的不分裂的细胞所存活的时间[9]。S. cerevisiae在到达稳定期时,其只分裂5–10次,远小于其复制寿命的最大值20–30次[10]。同样,E. coli一个母细胞可以分裂上百次,而且在死亡之前其生长速率基本上没有变化[8]。所以在分批发酵过程中微生物细胞远没有达到其复制寿命的最大值。CLS也表示为静止细胞(Stationary cells) 在非分裂状态下保持活力的能力[11],在改变CLS的同时往往也增加了工程菌抗胁迫的能力。发酵主要是由非分裂的细胞完成,例如葡萄酒发酵过程中主要发生在酿酒酵母的非分裂时期[12],采用延长酿酒酵母细胞的CLS可以提高细胞活力,改善了葡萄酒的生产[12-14]。采用双输入四输出逻辑门工程化改造E. coli细胞的CLS,可以使丁酸产量增加到29.8 g/L[2]。因此CLS与发酵更为相关,因此常采用工程化改造CLS提高工程菌的发酵性能[12-13]。此外,添加外源性抗衰老药物,例如氨基胍和二甲双胍不仅可以增加S. cerevisiae的CLS而且可以增加E. coli的CLS[15-16]。
本研究以E. coli为模型,通过延长E. coli细胞的CLS,用于改善E. coli微生物细胞工厂的生产性能。首先,基于存活率的变化建立了细胞CLS和HCLS的评价体系;其次,根据细胞CLS和HCLS的变化筛选出延长E. coli细胞CLS的抗衰老药物;最后,研究了延长E. coli细胞的CLS对具有本源和异源代谢合成路径E. coli细胞工厂发酵性能的影响。结果表明延长E. coli细胞寿命可以显著提升细胞工厂的生产性能。
1 材料与方法1.1 材料1.1.1 菌株本研究所使用的菌株均列于表 1中,LB培养基和平板用于培养E. coli以进行存活率的检测。含有50 g/L葡萄糖的NBS无机盐培养基用于评价细胞工厂的发酵性能。
表 1 本实验所用的菌株Table 1 Strains used in this study
| Strains name | Strain characteristics | Source |
| E. coli ATCC 8739 | Wild type | ATCC |
| E. coli GL0002 | E. coli ATCC 8739 ΔadhEΔackA | [6] |
| E. coli F0601 | E. coli W3110 ΔldhAΔpoxBΔpflBΔpta-ackAΔadhE | [23] |
| E. coli FH009 | MG1655 ?ptsG?frdBC?fumABC?maeAB?aspC?ldhA?adhE | [24] |
| E. coli FH989 | FH009 with pEM-CF59 | [24] |
表选项
1.1.2 培养基LB培养基:酵母提取物5 g/L、蛋白胨10 g/L、NaCl 10 g/L,pH自然,固体培养基添加2%的琼脂。
NBS培养基:葡萄糖40 g/L、KH2PO4 3.5 g/L、K2HPO4 5.0 g/L、(NH4)2HPO4 3.5 g/L、CaCl2·2H2O 15 mg/L、微量元素液0.667 mL/L,灭菌后补加MgSO4·7H2O 0.25 g/L、VB1 0.5 mg/L、盐酸甜菜碱1 mol/L。
NBS微量元素液配方:FeCl3·6H2O 2.4 g/L、CoCl2·6H2O 0.3 g/L、CuCl2 0.15 g/L、ZnCl2·4H2O 0.3 g/L、NaMnO4 0.3 g/L、H3BO3 0.075 g/L、MnCl2·4H2O 0.5 g/L,溶于0.1 mol/L HCl中配制。
1.2 方法1.2.1 培养方法从甘油管取100 μL菌液接种于LB培养基中(20 mL/100 mL的三角瓶),在37 ℃、200 r/min培养12 h。按照1︰100 (V/V) 的接种量转接到新鲜的LB培养基中,同时添加相应的抗衰老药物(抗衰老药物的工作浓度如表 2所示),在37 ℃、200 r/min振荡培养。
表 2 本研究所用抗衰老药物Table 2 Anti-aging drugs used in this study
| Chemicals | Carnosine[16] | Folic acid[16] | Aminoguanidine[16] | Glucosamine[20] | Metformin[21] | Cysteine[16, 22] |
| Working concentration | 20 mmol/L | 0.5 mmol/L | 0.1 mmol/L | 5 mmol/L | 1 mmol/L | 1 mmol/L |
| Mother solution concentration | 2 mol/L | 0.05 mol/L | 0.1 mol/L | 0.5 mol/L | 1 mol/L | 1 mol/L |
| Cost (¥/L) | 122.5 | 1.57 | 0.071 | 23.3 | 0.038 | 0.038 |
表选项
1.2.2 存活率检测方法从LB平板上挑选2–3个单菌落接种至5 mL LB培养基中,在200 r/min中过夜培养。将上述培养物接种至50 mL/250 mL的三角瓶中培养12 h。在4 ℃、5 000 r/min条件下离心,采用过滤除菌的方式过滤上清液,并收集菌体。菌体用无菌生理盐水洗涤两次,用已过滤的上清液重悬洗涤后的菌体,将菌体浓度控制在每mL约1.5×109个菌落形成单位(CFU)。采用梯度稀释的方式获得菌落形成单位,根据最后一次稀释后样品的菌落形成单位,将0 h样品的存活率定为100%,用于评价细胞存活率的变化,一直检测到存活率降低至1%。
1.2.3 抗衰老药物的添加方法根据Pepper等[16]的报道,选择肌肽、叶酸和氨基胍作为延长E. coli细胞寿命的抗衰老药物。根据Burcham[17]和Storelli等[18]的报道,选择氨基葡萄糖和二甲双胍作为延长E. coli细胞寿命的抗衰老药物。此外,由于半胱氨酸包含关键的巯基(硫醇基),使其成为有效的抗氧化剂,可以减少胞内活性氧的积累,从而有效地减缓细胞损伤和细胞衰老[19],因此也选择作为延长E. coli细胞寿命的抗衰老药物。
不同抗衰老药物的工作浓度如表 2所示,其中肌肽、叶酸和氨基胍的工作浓度参考Pepper等[16]的报道;氨基葡萄糖的工作浓度参考Fang等[20]的报道;二甲双胍的工作浓度参考Ruggiero- Lopez等[21]报道。此外,Awano等[22]报道过高浓度的半胱氨酸影响E. coli细胞抵抗氧化胁迫的能力,本研究中通过预实验将半胱氨酸添加量控制在1 mmol/L。
1.2.4 发酵实验丙酮酸的发酵控制参考Dong等的报道[23]。乳酸的发酵控制参考Guo等的报道[6]。苹果酸的发酵控制参考Hu等的报道[24]。
1.2.5 分析方法丙酮酸、乳酸和苹果酸均采用高效液相色谱检测,使用色谱柱为Aminex HPX-87H (7.8 mm× 300 mm;Bio-Rad),在30 ℃条件下采用0.05 mmol/L硫酸作为流动相,进样量为10 μL,流速为0.6 mL/min。
2 结果与分析2.1 抗衰老药物对大肠杆菌存活率的影响存活率是指每一个微生物细胞经过一定时间培养以后生存的机率,存活率是研究细胞CLS的主要方法[25-27]。因此,我们首先检测了肌肽、叶酸、氨基胍、氨基葡萄糖、二甲双胍和半胱氨酸6种抗衰老药物对E. coli存活率的影响。此外,利用代谢工程策略可以将E. coli ATCC8739改造为优秀的微生物细胞工厂,已被用于改造生产苹果酸[28]、琥珀酸[28]、丁酸[2]、莽草酸[29]、葡萄糖二酸[30]和聚乳酸-3-羟基丁酸[31]等多种工业化学品,因此本研究选择E. coli ATCC8739作为筛选抗衰老药物的模式微生物。如图 1所示,可以得出如下结论:(1) 培养48 h后,抗衰老药物氨基胍、氨基葡萄糖、半胱氨酸和肌肽分别使E. coli的存活率增加了9.8%、351.0%、56.9%和47.1%,有研究表明微生物在生长过程中由非酶促反应积累的晚期糖基化终产物可以加速细胞衰老,在原核微生物中,抗衰老药物氨基胍、半胱氨酸、肌肽和叶酸可以抑制晚期糖基化的形成,从而减缓细胞衰老,延长细胞寿命[16];半胱氨酸包含关键的巯基(硫醇基),使其成为有效的抗氧化剂,可以减少胞内活性氧的积累,从而有效地减缓细胞损伤减缓细胞衰老[19]。(2) 在培养48–148 h时间段内,抗衰老药物氨基葡萄糖可以显著增加E. coli的存活率,文献报道氨基葡萄糖可以作为脂质过氧化产物的丙二醛清除剂,从而保护细胞并延缓其衰老[20];氨基葡萄糖能够通过激活AMP活化蛋白激酶以降低葡萄糖代谢,同时促进线粒体生物合成,其机制为N-乙酰氨基葡萄糖能够提高内质网蛋白内稳态,进而起到延长细胞寿命的作用[32],所以氨基葡萄糖可以显著改善菌体的存活率。(3) 培养120 h后,在相同的检测时间点,实验组与对照组的E. coli存活率差异越来越小,表明抗衰老药物增加存活率的能力随着培养时间的增加而逐渐减弱,说明添加的抗衰老药物是参与了菌体自身的代谢而被消耗,即抗衰老药物维持菌体的存活率具有时效性,这也表明抗衰老药物只是延长了菌体存活的时间(延缓了菌体衰老),但是随着培养时间的进行菌体还是会老化(死亡)。
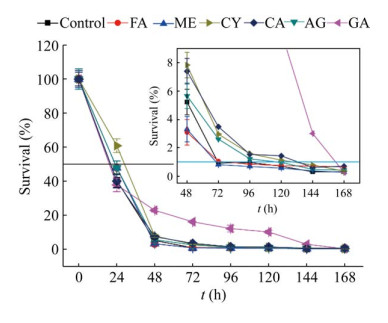 |
| 图 1 不同抗衰老药物对E. coli存活率的影响 Fig. 1 Effect of anti-aging drugs on the survival rate of E. coli. FA: folic acid; ME: metformin; AG: aminoguanidine; GA: glucosamine; CY: cysteine; CA: carnosine. |
| 图选项 |
2.2 延长时序寿命的抗衰老药物的筛选当99%的酵母细胞在YPD培养板上无法形成菌落时,酵母在此之前存活的时间就是其时序型寿命时间CLS[33]。借鉴酵母细胞CLS的概念,我们定义当99%的E. coli在LB培养板上无法形成菌落时,E. coli在此之前存活的时间就是其CLS,CLS越长说明该菌株存活能力越强。同时借鉴半衰期的概念,我们也定义当50%的E. coli在LB培养板上无法形成菌落时,E. coli在此之前存活的时间就是其半时序型寿命(Half chronological lifespan,HCLS),HCLS越大说明该菌株活力越强。根据图 1中E. coli的存活率的变化,计算出E. coli在添加不同抗衰老药物条件下的HCLS,结果见图 2A:(1) 添加抗衰老药物半胱氨酸对E. coli的HCLS延长效果最为明显,增加了54%,达到29.1 h;(2) 添加叶酸、二甲双胍和氨基胍分别使E. coli的HCLS均增加21.0%;(3) 添加氨基葡萄糖使E. coli的HCLS短了7.4%,而添加肌肽对E. coli的HCLS没有显著的作用效果。对E. coli的HCLS延长能力为:半胱氨酸 > 叶酸=二甲双胍=氨基胍。CLS的变化如图 2B所示:(1) 添加抗衰老药物氨基葡萄糖对E. coli的CLS延长效果最为显著,增加了1.2倍;(2) 添加半胱氨酸、肌肽和氨基胍分别使E. coli的CLS延长了80.0%、80.0%和50.0%;(3) 添加叶酸和二甲双胍对E. coli的CLS延长了效果不明显,仅增加了10.0%。因此,我们选择的6种抗衰老药物,对E. coli的CLS延长能力为:氨基葡萄糖 > 半胱氨酸=肌肽 > 氨基胍 > 叶酸=二甲双胍 > 对照组。
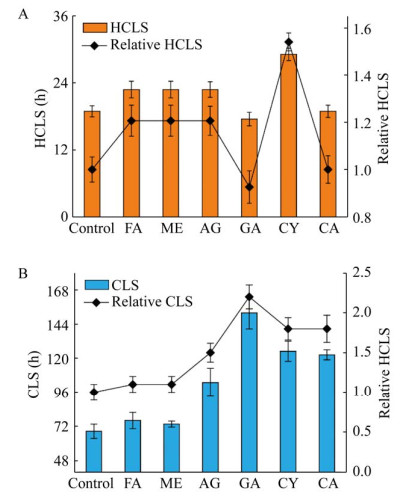 |
| 图 2 不同抗衰老药物对E. coli时序寿命的影响 Fig. 2 Effects of FA, ME, AG, GA, CY and CA on the HCLS and CLS of E. coli. (A) Effects of FA, ME, AG, GA, CY and CA on the HCLS of E. coli. (B) Effects of FA, ME, AG, GA, CY and CA on the CLS of E. coli. |
| 图选项 |
以上结果表明相同的抗衰老药物对E. coli的HCLS和CLS的作用效果是不同的。此外,根据抗衰老药物对HCLS的影响,我们选择半胱氨酸进行下一步实验;其次,根据抗衰老药物对CLS的影响,我们选择氨基葡萄糖、氨基胍和肌肽进行下一步实验。
2.3 时序寿命对内源路径细胞工厂的影响2.3.1 检测抗衰老药物延长时序寿命的适用性为了评价延长CLS的抗衰老药物是否具有菌株特异性,我们检测半胱氨酸、氨基葡萄糖、氨基胍和肌肽4种抗衰老药物对不同E. coli细胞CLS的影响。E. coli F0601 (F0601) 是在E. coli W3110中敲除乳酸脱氢酶、丙酮酸氧化酶、丙酮酸甲酸裂解酶、磷酸乙酰转移酶-乙酸激酶和乙醇脱氢酶,获得一株产丙酮酸的E. coli[23],我们检测了半胱氨酸、氨基葡萄糖、氨基胍和肌肽4种抗衰老药物对F0601的HCLS (图 3A) 和CLS (图 3B)的影响:4种抗衰老药物对F0601的HCLS延长能力为:肌肽 > 氨基胍 > 半胱氨酸 > 氨基葡萄糖;4种抗衰老药物对F0601的CLS延长能力为:氨基葡萄糖 > 肌肽 > 氨基胍 > 半胱氨酸。
 |
| 图 3 不同抗衰老药物对F0601和GL0002时序寿命的影响 Fig. 3 Effects of AG, GA, CY and CA on the HCLS and CLS of E. coli. (A) Effects of AG, GA, CY and CA on the HCLS of F0601. (B) Effects of AG, GA, CY and CA on the CLS of F0601. (C) Effects of AG, GA, CY and CA on the HCLS of GL0002. (D) Effects of AG, GA, CY and CA on the CLS of GL0002. |
| 图选项 |
E. coli GL0002 (GL0002) 是在E. coli ATCC8739中敲除乙酸激酶和乙醇脱氢酶获得的一株产乳酸的E. coli[6],考察半胱氨酸、氨基葡萄糖、氨基胍和肌肽4种抗衰老药物对GL0002的HCLS (图 3C)和CLS (图 3D),4种抗衰老药物对GL0002的HCLS延长能力为:肌肽 > 半胱氨酸 > 氨基葡萄糖 > 氨基胍;4种抗衰老药物对GL0002的CLS延长能力为:肌肽 > 半胱氨酸 > 氨基胍 > 氨基葡萄糖。因此半胱氨酸、肌肽、氨基胍和氨基葡萄糖4种抗衰老药物提供了一种无菌株特异性的延长E. coli细胞CLS的方法。
2.3.2 时序寿命对内源路径细胞工厂的影响为了评价延长CLS对E. coli细胞工厂发酵性能的影响,考察添加抗衰老药物后F0601工程菌发酵性能的变化,对F0601发酵终点丙酮酸的产量和得率进行比较分析,结果如图 4所示:(1) 相对于对照组,延长CLS可以不同程度地增加丙酮酸产量和得率;(2) 当添加半胱氨酸时丙酮酸的产量增加了21.7%,达到了17.4 g/L (对照组14.3 g/L),丙酮酸的得率增加了25.0%,达到了0.40 g/g (对照组0.32 g/g);(3) 当添加氨基胍、氨基葡萄糖和肌肽时,丙酮酸的产量分别为15.8 g/L、16.7 g/L和15.8 g/L,相对于对照组分别增加了10.5%、16.8%和10.5%。
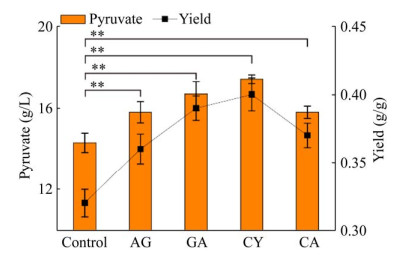 |
| 图 4 不同抗衰老药物对F0601发酵性能的影响 Fig. 4 Effects of AG, GA, CY and CA on the fermentation performance of F0601. |
| 图选项 |
进一步研究添加抗衰老药物对GL0002工程菌发酵性能的影响,对GL0002发酵终点乳酸的产量和得率进行了比较分析,由图 5可知:(1) 延长CLS可以不同程度地改变乳酸产量;(2) 发酵36 h,乳酸产量达到最大,其中添加氨基葡萄糖的实验组,乳酸产量增加8.8%,达到了23.4 g/L (对照组21.5 g/L);(3) 半胱氨酸和肌肽的实验组,乳酸的产量相对于对照组分别增加了5.6%和2.8%,达到22.7 g/L和22.1 g/L;(4) 添加氨基胍的实验组乳酸得率增加了30%,达到了0.52 g/g (对照组0.4 g/g);(5) 添加氨基葡萄糖、半胱氨酸和肌肽的实验组乳酸的得率分别为0.44 g/g、0.44 g/g和0.43 g/g,相较于对照组分别增加了10.0%、10.0%和7.5%。
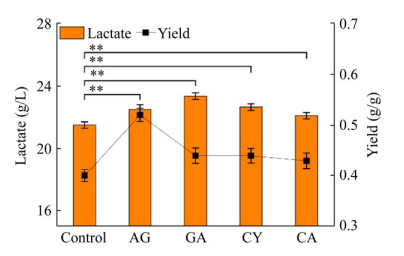 |
| 图 5 不同抗衰老药物对GL0002发酵性能的影响 Fig. 5 Effects of AG, GA, CY and CA on the fermentation performance of GL0002. |
| 图选项 |
上述研究结果表明,添加的抗衰老药物不仅增加了工程菌F0601和GL0002的CLS,而且也增加了丙酮酸和乳酸的产量与得率,表明延长细胞CLS可以提高具有内源性代谢路径E. coli细胞工厂的生产性能。
2.4 时序寿命对异源路径细胞工厂的影响E. coli FH989 (FH989) 是在E. coli中引入来源于集胞藻PCC 6803的5-磷酸核酮糖激酶、1, 5-二磷酸核酮糖羧化酶/加氧酶、碳酸酐酶和来源于产琥珀酸放线杆菌的磷酸烯醇式丙酮酸羧激酶,构建了一株产苹果酸工程菌[24]。考察半胱氨酸、氨基葡萄糖、氨基胍和肌肽对工程菌FH989的发酵性能的影响,图 6A表示添加不同抗衰老药物对FH989菌体浓度的影响,采用菌体浓度变化的趋势线来反应菌体死亡情况,并定义趋势线的斜率代表菌体的死亡速率(单位时间内菌体浓度的减少量),斜率越小说明其死亡速率越大。由图 6A可知:(1) 通过添加抗衰老药物延长CLS可以不同程度地减缓菌体的死亡;(2) 抗衰老药物减缓菌体的能力依次为肌肽 > 氨基葡萄糖 > 氨基胍 > 半胱氨酸。
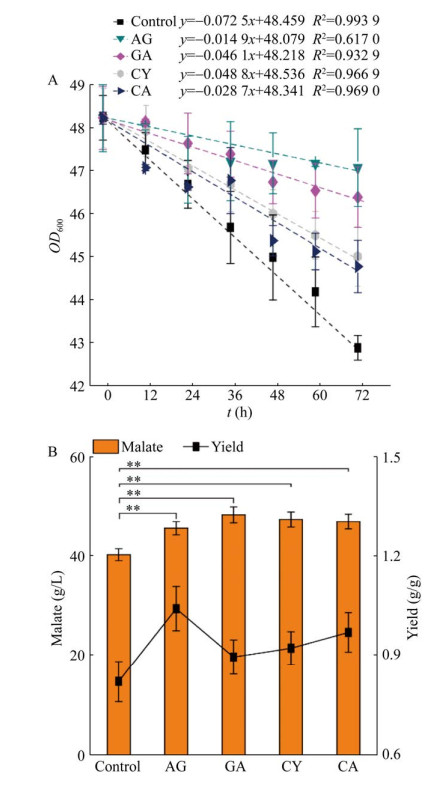 |
| 图 6 不同抗衰老药物对FH989发酵性能的影响 Fig. 6 Effects of AG, CA, CY and CA on the fermentation performance of FH989. (A) Effects of AG, CA, CY and CA on the cell growth of FH989. (B) Effects of AG, CA, CY and CA on the malate production of FH989. |
| 图选项 |
在发酵终点(72 h) 检测苹果酸产量和得率的变化(图 6B),可以得出以下结论:(1) 通过添加抗衰老药物延长CLS可以增加苹果酸的产量和得率;(2) 添加氨基胍、氨基葡萄糖、半胱氨酸和肌肽的实验组苹果酸的产量分别增加了13.3%、20.0%、16.7%和17.6%,达到了45.6 g/L、48.2 g/L、47.3 g/L和46.9 g/L;(3) 添加氨基胍、氨基葡萄糖、半胱氨酸和肌肽的实验组苹果酸的得率分别增加了27.0%、9.1%、12.3%和18.2%,达到了1.04 g/g、0.893 g/g、0.92 g/g和0.968 g/g。本研究获得的苹果酸产量和得率的最高产量都非常接近Hu等[24]的报道苹果酸的产量(51.8 g/L) 和得率(1.08 g/g) 最大值。因此,延长CLS也可以增加具有异源代谢路径的E. coli细胞工厂的生产性能。
3 讨论通过添加抗衰老药物可以延长微生物细胞的CLS,同时改善细胞工厂的发酵性能。抗衰老药物半胱氨酸、肌肽、氨基胍和氨基葡萄糖提供一种无菌株特异性的延长E. coli细胞CLS和HCLS的方法。延长E. coli细胞CLS不仅可以增加具有本源代谢路径的E. coli细胞工厂的性能用于改善乳酸和丙酮酸的生产,而且也可以增加具有异源代谢路径的E. coli细胞工厂的性能用于改善苹果酸的生产。Causey等[34]通过对E. coli进行基因工程改造和发酵优化,在葡萄糖过量的情况下,使丙酮酸的产量和得率分别达到65.8 g/L和0.75 g/g。Zhou等[35]通过对E. coli冗余代谢支路的去除,以及结合乳酸脱氢酶基因转录水平微调,使乳酸的产量和得率分别达到125.0 g/L和0.866 g/L。虽然本研究获得丙酮酸和乳酸的产量与得率与上述文献报道的最优生产性能还有一定的差距,但是本研究所采取的调控微生物细胞寿命的方法对构建E. coli细胞仍具有一定的参考价值。此外,本研究还发现微生物细胞CLS并不是越长越有利于提高细胞工厂的性能,这表明微生物细胞的CLS与细胞工厂生产性能之间存在一种平衡。
总之,延长微生物细胞寿命提供了一种潜在的改善细胞工厂生产性能的方法。延长微生物细胞寿命不仅可以改善微生物细胞工厂的生理状态,而且还可以将细胞工厂的新陈代谢与细胞命运耦合。尽管E. coli历经了数百万年的进化,但其细胞CLS却是可塑性的,因此有望促进代谢工程和合成生物学的发展。
参考文献
| [1] | Chen XL, Gao C, Guo L, et al. DCEO biotechnology: tools to design, construct, evaluate, and optimize the metabolic pathway for biosynthesis of chemicals. Chem Rev, 2018, 118(1): 4-72. DOI:10.1021/acs.chemrev.6b00804 |
| [2] | Guo L, Diao WW, Gao C, et al. Engineering Escherichia coli lifespan for enhancing chemical production. Nat Catal, 2020, 3(3): 307-318. DOI:10.1038/s41929-019-0411-7 |
| [3] | Guo L, Pang ZX, Gao C, et al. Engineering microbial cell morphology and membrane homeostasis toward industrial applications. Curr Opin Biotech, 2020, 66: 18-26. DOI:10.1016/j.copbio.2020.05.004 |
| [4] | 薛飞燕, 杨明峰, 马兰青, 等. 微生物法合成红景天苷. 生物工程学报, 2019, 35(7): 1184-1192. Xue FY, Yang MF, Ma LQ, et al. Microbial synthesis of salidroside. Chin J Biotech, 2019, 35(7): 1184-1192 (in Chinese). |
| [5] | 叶超, 徐楠, 陈修来, 等. 应用代谢网络模型解析工业微生物胞内代谢. 生物工程学报, 2019, 35(10): 1901-1913. Ye C, Xu N, Chen XL, et al. Application of metabolic network model to analyze intracellular metabolism of industrial microorganisms. Chin J Biotech, 2019, 35(10): 1901-1913 (in Chinese). |
| [6] | Guo L, Zhang F, Zhang C, et al. Enhancement of malate production through engineering of the periplasmic rTCA pathway in Escherichia coli. Biotechnol Bioeng, 2018, 115(6): 1571-1580. DOI:10.1002/bit.26580 |
| [7] | Ksi??ek K. Bacterial aging: from mechanistic basis to evolutionary perspective. Cell Mol Life Sci, 2010, 67(18): 3131-3137. DOI:10.1007/s00018-010-0417-4 |
| [8] | Boehm A, Arnoldini M, Bergmiller T, et al. Genetic manipulation of glycogen allocation affects replicative lifespan in E. coli. PLoS Genet, 2016, 12(4): e1005974. DOI:10.1371/journal.pgen.1005974 |
| [9] | Longo VD, Shadel GS, Kaeberlein M, et al. Replicative and chronological aging in Saccharomyces cerevisiae. Cell Metab, 2012, 16(1): 18-31. DOI:10.1016/j.cmet.2012.06.002 |
| [10] | Orozco H, Matallana E, Aranda A. Genetic manipulation of longevity-related genes as a tool to regulate yeast life span and metabolite production during winemaking. Microb Cell Fact, 2013, 12: 1. DOI:10.1186/1475-2859-12-1 |
| [11] | Picazo C, Orozco H, Matallana E, et al. Interplay among Gcn5, Sch9 and mitochondria during chronological aging of wine yeast is dependent on growth conditions. PLoS ONE, 2015, 10(2): e0117267. DOI:10.1371/journal.pone.0117267 |
| [12] | Orozco H, Matallana E, Aranda A. Two-carbon metabolites, polyphenols and vitamins influence yeast chronological life span in winemaking conditions. Microb Cell Fact, 2012, 11: 104. DOI:10.1186/1475-2859-11-104 |
| [13] | Finkel SE. Long-term survival during stationary phase: evolution and the GASP phenotype. Nat Rev Microbiol, 2006, 4(2): 113-120. DOI:10.1038/nrmicro1340 |
| [14] | Piper PW, Harris NL, MacLean M. Preadaptation to efficient respiratory maintenance is essential both for maximal longevity and the retention of replicative potential in chronologically ageing yeast. Mech Ageing Dev, 2006, 127(9): 733-740. DOI:10.1016/j.mad.2006.05.004 |
| [15] | Kazi RS, Banarjee RM, Deshmukh AB, et al. Glycation inhibitors extend yeast chronological lifespan by reducing advanced glycation end products and by back regulation of proteins involved in mitochondrial respiration. J Proteomics, 2017, 156: 104-112. DOI:10.1016/j.jprot.2017.01.015 |
| [16] | Pepper ED, Farrell MJ, Nord G, et al. Antiglycation effects of carnosine and other compounds on the long-term survival of Escherichia coli. Appl Environ Microb, 2010, 76(24): 7925-7930. DOI:10.1128/AEM.01369-10 |
| [17] | Burcham PC. Potentialities and pitfalls accompanying chemico-pharmacological strategies against endogenous electrophiles and carbonyl stress. Chem Res Toxicol, 2008, 21(4): 779-786. DOI:10.1021/tx700399q |
| [18] | Storelli G, Téfit M, Leulier F. Metformin, microbes, and aging. Cell Metab, 2013, 17(6): 809-811. DOI:10.1016/j.cmet.2013.05.014 |
| [19] | 孙全贵, 龙子, 张晓迪, 等. 抗氧化系统研究新进展. 现代生物医学进展, 2016, 16(11): 2197-2200, 2190. Sun QG, Long Z, Zhang XD, et al. Novel progress in antioxidant system. Prog Mod Biomed, 2016, 16(11): 2197-2200, 2190 (in Chinese). |
| [20] | Fang C, Peng MJ, Li GL, et al. New functions of glucosamine as a scavenger of the lipid peroxidation product malondialdehyde. Chem Res Toxicol, 2007, 20(6): 947-953. DOI:10.1021/tx700059b |
| [21] | Ruggiero-Lopez D, Lecomte M, Moinet G, et al. Reaction of metformin with dicarbonyl compounds. possible implication in the inhibition of advanced glycation end product formation. Biochem Pharmacol, 1999, 58(11): 1765-1773. DOI:10.1016/S0006-2952(99)00263-4 |
| [22] | Awano N, Wada M, Mori H, et al. Identification and functional analysis of Escherichia coli cysteine desulfhydrases. Appl Environ Microb, 2005, 71(7): 4149-4152. DOI:10.1128/AEM.71.7.4149-4152.2005 |
| [23] | Dong XX, Chen XL, Qian YY, et al. Metabolic engineering of Escherichia coli W3110 to produce L-malate. Biotechnol Bioeng, 2017, 114(3): 656-664. DOI:10.1002/bit.26190 |
| [24] | Hu GP, Zhou J, Chen XL, et al. Engineering synergetic CO2-fixing pathways for malate production. Metab Eng, 2018, 47: 496-504. DOI:10.1016/j.ymben.2018.05.007 |
| [25] | Han B, Sivaramakrishnan P, Lin CCJ, et al. Microbial genetic composition tunes host longevity. Cell, 2017, 169(7): 1249-1262.e3. DOI:10.1016/j.cell.2017.05.036 |
| [26] | Orlandi I, Stamerra G, Strippoli M, et al. During yeast chronological aging resveratrol supplementation results in a short-lived phenotype Sir2-dependent. Redox Biol, 2017, 12: 745-754. DOI:10.1016/j.redox.2017.04.015 |
| [27] | Orman MA, Brynildsen MP. Inhibition of stationary phase respiration impairs persister formation in E. coli. Nat Commun, 2015, 6: 7983. DOI:10.1038/ncomms8983 |
| [28] | Jantama K, Haupt MJ, Svoronos SA, et al. Combining metabolic engineering and metabolic evolution to develop nonrecombinant strains of Escherichia coli C that produce succinate and malate. Biotechnol Bioeng, 2008, 99(5): 1140-1153. DOI:10.1002/bit.21694 |
| [29] | Gao C, Hou JS, Xu P, et al. Programmable biomolecular switches for rewiring flux in Escherichia coli. Nat Commun, 2019, 10(1): 3751. DOI:10.1038/s41467-019-11793-7 |
| [30] | Hou JS, Gao C, Guo L, et al. Rewiring carbon flux in Escherichia coli using a bifunctional molecular switch. Metab Eng, 2020, 61: 47-57. DOI:10.1016/j.ymben.2020.05.004 |
| [31] | Ding Q, Ma DL, Liu GQ, et al. Light-powered Escherichia coli cell division for chemical production. Nat Commun, 2020, 11(1): 2262. DOI:10.1038/s41467-020-16154-3 |
| [32] | Weimer S, Priebs J, Kuhlow D, et al. D-glucosamine supplementation extends life span of nematodes and of ageing mice. Nat Commun, 2014, 5: 3563. DOI:10.1038/ncomms4563 |
| [33] | Norris A, Boeke JD. Silent information regulator 3: the Goldilocks of the silencing complex. Genes Dev, 2010, 24(2): 115-122. DOI:10.1101/gad.1865510 |
| [34] | Causey TB, Shanmugam KT, Yomano LP, et al. Engineering Escherichia coli for efficient conversion of glucose to pyruvate. Proc Natl Acad Sci USA, 2004, 101(8): 2235-2240. DOI:10.1073/pnas.0308171100 |
| [35] | Zhou L, Niu DD, Tian KM, et al. Genetically switched D-lactate production in Escherichia coli. Metab Eng, 2012, 14(5): 560-568. DOI:10.1016/j.ymben.2012.05.004 |
