
 , 廖朝美1, 谭光辉1, 李杰章1, 李万贵2
, 廖朝美1, 谭光辉1, 李杰章1, 李万贵2 1. 贵州大学 动物科学学院 高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025;
2. 贵州省六盘水市农业农村局,贵州 六盘水 553001
收稿日期:2020-08-29;接收日期:2020-12-15;网络出版时间:2021-01-16
基金项目:国家自然科学基金(No. 31760663),贵州省科技人才补助项目(No. [2017]5788),贵州省千层次创新型人才项目(No. 701030174401)
摘要:肌醇1, 4, 5-三磷酸受体Ⅰ型(Inositol 1, 4, 5-trisphosphate receptor 1,ITPR1) 是细胞内Ca2+释放的重要通道。为探讨ITPR1基因过表达对鸭子宫上皮细胞Ca2+浓度和脂质含量的调控效应及其对钙转运相关基因的影响,文中构建鸭ITPR1基因结构域的真核表达载体,转染鸭子宫上皮细胞,检测细胞ITPR1基因的过表达量、Ca2+浓度、细胞的脂质含量以及其他6个钙转运相关基因的表达量。结果显示,转染后子宫上皮细胞内的Ca2+浓度显著降低(P < 0.05),甘油三酯含量极显著升高(P < 0.01),高密度脂蛋白含量极显著降低(P < 0.01);相关性分析结果显示,C端ITPR1基因过表达量与总胆固醇含量呈极显著正相关(P < 0.01),与低密度脂蛋白含量呈显著正相关(P < 0.05),N端ITPR1基因过表达量与甘油三酯含量呈极显著正相关(P < 0.01),与Ca2+浓度呈显著负相关(P < 0.05);RT-qPCR结果显示,C端ITPR1基因过表达对IP3R2、VDAC2、CAV1基因的表达有显著抑制作用,N端ITPR1基因过表达对IP3R3、CACNA2D1基因的表达有显著促进作用。总之,ITPR1基因过表达能促进鸭子宫上皮细胞内Ca2+释放,促进甘油三酯、低密度脂蛋白和胆固醇的合成,抑制高密度脂蛋白的生成,且ITPR1基因过表达对6个钙转运相关基因的表达均产生影响。
关键词:ITPR1基因子宫上皮细胞Ca2+浓度钙转运相关基因脂质含量
Effects of the ITPR1 gene overexpression on Ca2+ concentration, lipid content and calcium transport-related genes in duck uterine epithelial cells
Minfang You1, Yuanyu Qin1, Yiyu Zhang1

 , Chaomei Liao1, Guanghui Tan1, Jiezhang Li1, Wangui Li2
, Chaomei Liao1, Guanghui Tan1, Jiezhang Li1, Wangui Li2 1. Key Laboratory of Genetics, Breeding and Reproduction of Plateau Mountain Animals, Ministry of Education, College of Animal Science, Guizhou University, Guiyang 550025, Guizhou, China;
2. The Agriculture and Rural Affairs Bureau of Liupanshui, Liupanshui 553001, Guizhou, China
Received: August 29, 2020; Accepted: December 15, 2020; Published: January 16, 2021
Supported by: National Natural Science Foundation of China (No. 31760663), Guizhou Province Science and Technology Talents Subsidy Project, China (No. [2017]5788), Guizhou Province Thousand-level Innovative Talent Project, China (No. 701030174401)
Corresponding author: Yiyu Zhang. Tel: +86-851-88298005; E-mail: zyy8yyc@163.com.
Abstract: Inositol 1, 4, 5-trisphosphate receptor 1 (ITPR1) is an important intracellular channel for releasing Ca2+. In order to investigate the effects of the ITPR1 overexpression on Ca2+ concentration and lipid content in duck uterine epithelial cells and its effects on calcium transport-related genes, the structural domain of ITPR1 gene of duck was cloned into an eukaryotic expression vector and transfected into duck uterine epithelial cells. The overexpression of the ITPR1 gene, the concentration of Ca2+, the lipid content, and the expression of other 6 calcium transport-related genes was determined. The results showed that the concentration of Ca2+ in uterine epithelial cells was significantly reduced after transfection (P < 0.05), the triglyceride content was significantly increased (P < 0.01), and the high-density lipoprotein content was significantly decreased (P < 0.01). The correlation analysis results showed that the overexpression of the C-terminal half of the ITPR1 gene was significantly positively correlated with the total cholesterol content (P < 0.01), which was significantly positively correlated with the low-density lipoprotein content (P < 0.05). The overexpression of the N-terminal half of the ITPR1 gene was significantly positively correlated with the triglyceride content (P < 0.01), which was significantly negatively correlated with the concentration of Ca2+ (P < 0.05). RT-qPCR results of 6 calcium transport-related genes showed that the overexpression of the C-terminal half of the ITPR1 gene significantly inhibited the expression of the IP3R2, VDAC2 and CAV1 genes, and the overexpression of the N-terminal half of the ITPR1 gene significantly promoted the expression of the IP3R3 and CACNA2D1 genes. In conclusion, the ITPR1 gene overexpression can promote Ca2+ release in duck uterus epithelial cells, promote the synthesis of triglyceride, low-density lipoprotein and cholesterol, and inhibit the production of high-density lipoprotein, and the ITPR1 gene overexpression affected the expression of all 6 calcium transport-related genes.
Keywords: ITPR1 geneuterine epithelial cellsCa2+ concentrationcalcium transport-related geneslipid content
劣质蛋壳影响蛋的储存、运输和孵化,已经逐渐成为制约养禽业发展的主要因素。因此,通过改善蛋壳品质来提高生产效益和经济效益已成为家禽育种者和养殖生产者亟待解决的问题。完整的禽类蛋壳中Ca2+约为蛋壳质量的38%–40%,可见Ca2+与蛋壳品质紧密联系[1-4]。肌醇1, 4, 5-三磷酸受体Ⅰ型(Inositol 1, 4, 5-trisphosphate receptor 1,ITPR1) 是细胞内Ca2+释放的重要通道,在大多数真核生物的内质网膜上都有表达[5],ITPR1基因通过调控动物机体细胞Ca2+的吸收、释放和转运,调节多种生理反应[6-8]。Cao等研究发现,缺少ITPR1结合结构域的ORP4L失去了增强细胞内Ca2+释放的能力,被鉴定为与ORP4L相互作用的ITPR1 C端胞质尾部包含一个卷曲的线圈结构域,通过与介导IP3调控的N端结构域的相互作用,在钙转运通道中起着至关重要的作用[9]。Chan等和林丽莉等报道,ITPR1基因通过调控Ca2+来影响人类胚胎干细胞早期分化和平滑肌的收缩[10-11]。Lin等研究表明,IP3R介导的血管内皮细胞Ca2+释放在调节血管舒张和生理血压中起重要作用[12]。ITPR1基因通过调控Ca2+浓度也会对脂质含量产生影响,吕彬等证实,膳食钙通过对胞外Ca2+浓度的增加,抑制ITPR1基因的表达,减少钙库中Ca2+向细胞质的流入,细胞内钙浓度升高,引起脂肪合成减弱和脂肪代谢加强,表现出减肥作用[13]。Luo等研究表明,ITPR1介导的溶酶体钙超载导致前体脂肪细胞溶酶体损伤和炎症,提出改善溶酶体钙稳态可能是治疗肥胖诱导炎症的一种新策略[14]。此外,ITPR1蛋白水解后至少产生两个受体片段:N端片段和C端片段,片段化的ITPR1引起的Ca2+浓度变化可以特异性地激活不同的下游效应[15]。但目前检索到在家禽中关于ITPR1基因过表达后对Ca2+浓度、脂质代谢和其他钙转运相关基因的调控机制的报道极为少见。基于此,本研究通过构建ITPR1基因N端和C端的过表达载体,探讨其过表达后对蛋鸭子宫上皮细胞中Ca2+浓度、脂质含量和钙转运相关基因表达量的影响,来阐明它们之间的联系,为今后选择具有优良蛋壳品质的种质资源群体奠定理论基础。
1 材料与方法1.1 主要试验材料45周龄的蛋鸭品种三穗鸭来源于贵州大学动物科学院家禽试验场,用于分离培养子宫上皮细胞。胎牛血清(FBS) 购自美国Gibco公司;Lipofectamine?3000购自美国Invitrogen公司;甘油三酯(TG) 试剂盒、总胆固醇(TCHO) 试剂盒、高密度脂蛋白(HDL) 试剂盒、低密度脂蛋白(LDL) 测定试剂盒购自南京建成生物工程研究所;钙离子荧光探针Fluo-3/AM检测试剂盒购自美国Sigma公司;ELISA试剂盒购自江苏酶免实业有限公司。
1.2 方法1.2.1 ITPR1基因真核表达载体的构建运用SMART在线程序(http://smart.embl-heidelberg.de/index2.cgi) 预测ITPR1蛋白质结构域,根据预测结果运用同源重组法构建包含MIR和RYDR_ITPR结构域的ITPR1基因N端真核表达载体(N-ITPR1-pcDNA3.1),构建包含RIH_assoc和Ion_trans结构域的C端真核表达载体(C-ITPR1-pcDNA 3.1),由北京擎科生物科技有限公司合成。
1.2.2 鸭子宫上皮细胞的分离培养在无菌条件下取出处于产蛋高峰期三穗鸭的输卵管子宫部,用含青霉素、链霉素的HBSS漂洗6–8次,剔除脂肪组织及血管,并将子宫组织内部朝外平铺在培养皿中央,漂洗3–4次之后用干净的眼科剪将组织剪成1 mm大小的组织块,放入干净的50 mL离心管中,加入组织3–5倍体积的0.2%胶原酶Ⅳ置于37 ℃水浴锅中消化35 min,将消化液用200目和400目不锈钢细胞过滤筛进行过滤,在滤液中加入等体积的完全培养基终止消化,1 200 r/min离心10 min,弃上清,加入适量的培养基重悬细胞,均匀滴至含有培养基的6孔板中,37 ℃、5% CO2条件下培养[16]。
1.2.3 ITPR1基因真核表达载体转染鸭子宫上皮细胞待6孔板上的细胞密度达到80%后,将N-ITPR1-pcDNA3.1、C-ITPR1-pcDA3.1-Flag分别与pEGFP-N3共转染子宫上皮细胞,以空载体pcDNA3.1为对照,转染7个孔,每孔3个重复,48 h后观察细胞转染情况,置于100倍荧光倒置显微镜下拍照记录。
1.2.4 子宫细胞中ITPR1基因过表达量、Ca2+浓度和脂质含量的检测按照鸭Flag标签ELISA试剂盒的步骤检测转染48 h后N-ITPR1-pcDNA3.1和C-ITPR1- pcDNA3.1的过表达量;按照钙离子荧光探针Fluo-3/AM检测试剂盒说明书对Ca2+进行荧光负载,倒置荧光显微镜观察负载效果,并利用酶标仪检测其荧光值,通过公式[Ca2+]i=Kd*F/F0计算出子宫上皮细胞内Ca2+浓度(F为表达载体的荧光值,F0为水对照组的荧光值,Kd为Ca2+的解离常数224);按照脂质含量测定试剂盒的操作步骤测定鸭子宫上皮细胞的脂质含量。
1.2.5 钙转运相关基因表达引物的设计参照KEGG信号通路(https://www.kegg.jp/kegg/pathway.html)和王晓萌[17]的文章找出与钙转运有关的其他6个基因,根据GenBank登录号分别设计IP3R2 (NC_040046.1)、IP3R3 (NC_040072.1)、CACNA2D1 (NC_040046.1)、CAV1 (NC_040046.1)、VDAC1 (NC_040059.1)、VDAC2 (NC_040051.1)的荧光标记引物,以β-actin (EF667345)为内参基因(表 1),将设计的引物送至生工生物工程(上海) 股份有限公司合成。
表 1 钙转运相关基因的表达引物Table 1 Primers for the expression of calcium transport-related genes
| Primer name | Sequence (5′–3′) | Product length (bp) | Gene location (bp) | Annealing temperature (℃) |
| IP3R2 | F: AGAGCCATGTCGCTGGTTAG R: AGCCCAGCCTCTGCTTATTC | 169 | CDS g.7 923-g.8 091 | 62 |
| IP3R3 | F: TTCCTGCTCGGGTTGTCTAC R: GTCCCGTTCGAGTCCACATA | 187 | CDS g.7 934-g.8 103 | 63 |
| CACNA2D1 | F: GTGAAATTGACCCAGGCCTG R: CGAAGCCCACCATCCTAGAT | 179 | CDS g.930-g.1 104 | 63 |
| CAV1 | F: AACGACGACGTGGTCAAGA R: GCAGGAATGACAAGATGGCA | 199 | CDS g.121-g.319 | 63 |
| VDAC1 | F: ACTGCTGTGAACCTTGCTTG R: GCCATCCAACAAAGCTGACA | 186 | CDS g.688-g.873 | 62 |
| VDAC2 | F: CAAGTGGGCTGAATATGGGC R: CCGAGGTTTAGGCATTCACG | 192 | CDS g.278-g.469 | 62 |
| β-actin | F: GGGTTCAGGGGAGCCTCTGT R: AACTGGGATGACATGGAGAAGA | 107 | CDS g.282-g.388 |
表选项
1.2.6 RT-qPCR法检测钙转运相关基因的表达量RT-qPCR法检测各个钙转运相关基因在鸭子宫上皮细胞内的表达情况。RT-qPCR反应体系:2×Ts Fast qPCR Mix 10 μL,cDNA 1 μL,上、下游引物各0.5 μL,无酶无菌水补足20 μL。每个样品设置3个重复,反应条件:95 ℃预变性5 min;95 ℃变性30 s,62–63 ℃退火延伸30 s,共39个循环。
1.3 统计学分析Chromas、MegAlign软件对测序结果进行序列比对;Microsoft Excel 2010进行统计分析,采用公式2–ΔΔCt计算钙转运相关基因在细胞中的相对表达量,并用GraphPad Prism 6作图;SPSS 18.0对试验数据进行相关性分析,数值用平均值±标准误(x±s) 表示。
2 结果与分析2.1 ITPR1基因真核表达载体的验证将N-ITPR1-pcDNA3.1 (KpnⅠ/BamHⅠ)、C-ITPR1-pcDNA3.1 (BamHⅠ/Xba Ⅰ) 2个真核表达载体分别用限制性内切酶进行双酶切验证和序列比对,序列比对分析结果显示,2个真核表达载体的碱基序列与NCBI数据库中原碱基序列同源性为100%,没有发现移码突变或者缺失、增添的情况,表明构建ITPR1基因的真核表达载体正确。
2.2 鸭子宫上皮细胞的鉴定及其转染效率待细胞汇合度达到90%以上,利用间接免疫荧光法对其进行鉴定。角蛋白是上皮细胞中的特异性蛋白,图 1中红色荧光部分为标记的上皮细胞中特有的角蛋白(图 1A),由于成纤维细胞中不含有角蛋白,故不显红色。蓝色荧光为DAPI标记的椭圆形有规则的细胞核(图 1B)。结合阴性对照组(图 1D) 和明场图(图 1E) 可知,培养的细胞为鸭原代子宫上皮细胞,即蓝红重合显色的部分为鸭子宫上皮细胞(图 1C)。待细胞长至80%以后进行转染,将N-ITPR1-pcDNA3.1、C-ITPR1- pcDA3.1分别与空载体pEGFP-N3共转染子宫上皮细胞,如图 2所示,GFP绿色荧光正常表达,且转染效率较高。
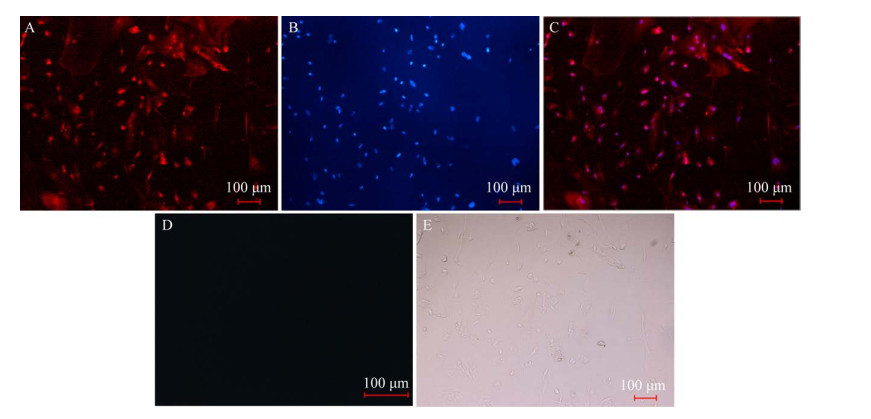 |
| 图 1 鸭子宫上皮细胞的鉴定(100×) Fig. 1 Identification of duck uterine epithelial cells. |
| 图选项 |
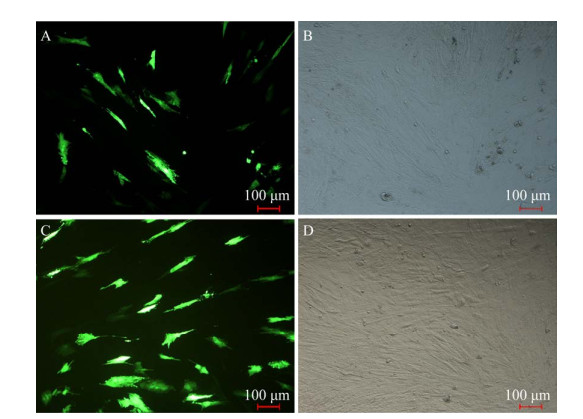 |
| 图 2 真核表达载体与pEGFP-N3共转染图(100×) Fig. 2 The eukaryotic expression vector was co-transfected with pEGFP-N3. (A) The co-transfection of C-ITPR1-pcDNA3.1 with pEGFP-N3. (B) The open field diagram of A. (C) The co-transfection of N-ITPR1-pcDNA3.1 with pEGFP-N3. (D) The open field diagram of C. |
| 图选项 |
2.3 子宫细胞中ITPR1基因过表达量、Ca2+浓度和脂质含量测定鸭子宫上皮细胞内ITPR1基因过表达量、Ca2+浓度和各个脂质指标的测定结果见表 2 (表中数据均为3个重复的均值),由表可知,N端ITPR1基因的过表达量高于C端;子宫上皮细胞内转染ITPR1基因真核表达载体组Ca2+浓度都显著低于空载体组;脂质含量测定结果显示,转染真核表达载体后TG含量极显著高于空载体对照组(P < 0.01),TCHO含量高于空载体对照组,HDL含量极显著低于空载体对照组(P < 0.01),LDL含量均升高,且C-ITPR1-pcDNA3.1组LDL含量显著高于空载体对照组(P < 0.05)。
表 2 鸭子宫上皮细胞中的ITPR1基因过表达量、Ca2+浓度和脂质含量Table 2 ITPR1 gene overexpression, Ca2+ concentration and lipid content in uterine epithelial cells of ducks
| Group | ITPR1 gene overexpression (ng/mL) | [Ca2+]i (nmol/L) | TCHO (mmol/g prot) | LDL (mmol/g prot) | TG (mg/mL) | HDL (mmol/g prot) |
| N-ITPR1-pcDNA3.1 | 5.005±2.707 | 21.176±2.470b | 0.222±0.153 | 0.224±0.111 | 0.214±0.261A | 0.182±0.383B |
| pcDNA3.1 | – | 30.074±2.589a | 0.188±0.079 | 0.180±0.113 | 0.043±0.045B | 0.983±0.284A |
| C-ITPR1-pcDNA3.1 | 3.702±2.387 | 15.921±4.569b | 0.258±0.436 | 0.244±0.267a | 0.114±0.081A | 0.086±0.182B |
| pcDNA3.1 | – | 32.938±0.349a | 0.190±0.078 | 0.141±0.140b | 0.088±0.118B | 1.138±0.996A |
| Note: different lowercase letters indicate significant difference (P < 0.05), while different uppercase letters indicate extremely significant difference (P < 0.01). | ||||||
表选项
2.4 ITPR1基因过表达量与Ca2+浓度及脂质含量的关联性分析将[Ca2+]i值与ITPR1过表达量及脂质含量进行相关性分析,结果显示,N端ITPR1基因过表达量与TG含量呈极显著正相关(P < 0.01),与Ca2+浓度呈显著负相关(P < 0.05);C端ITPR1基因过表达量与TCHO含量呈极显著正相关(P < 0.01),与LDL含量呈显著正相关(P < 0.05),TCHO含量与LDL含量显著相关(P < 0.05) (表 3)。
表 3 ITPR1基因过表达量与Ca2+浓度和脂质含量的相关性Table 3 Correlation of ITPR1 gene overexpression with Ca2+ concentration and lipid content
| Lipid indicators | TCHO | LDL | TG | HDL | ITPR1 gene overexpression | [Ca2+]i |
| TCHO | 1.000 | 0.424* | 0.256 | –0.118 | 0.546** | –0.270 |
| LDL | 0.167 | 1.000 | 0.097 | –0.261 | 0.395* | –0.166 |
| TG | 0.307 | 0.098 | 1.000 | –0.149 | 0.233 | –0.266 |
| HDL | –0.311 | –0.227 | –0.247 | 1.000 | –0.063 | 0.330 |
| ITPR1 gene overexpression | 0.130 | 0.276 | 0.532** | –0.193 | 1.000 | –0.044 |
| [Ca2+]i | –0.380 | –0.276 | –0.302 | 0.043 | –0.394* | 1.000 |
| Note: ** indicates that the difference is extremely significant (P < 0.01); * indicates that the difference is significant (P < 0.05). The lower triangle was the correlation between the C-terminal half of the ITPR1 expression and Ca2+ concentration and lipid content; The lower triangle was the correlation between the N-terminal half of the ITPR1 expression and Ca2+ concentration and lipid content. | ||||||
表选项
2.5 钙转运相关基因转录的定量检测6个Ca2+相关基因转录的RT-qPCR结果见图 3,由图可知,ITPR1基因C端过表达对IP3R2、VDAC2、CAV1基因的表达有显著抑制作用,对IP3R3的表达有抑制作用,但无统计学意义,对VDAC1和CACNA2D1基因的表达有促进作用;ITPR1基因N端过表达对IP3R3、CACNA2D1基因的表达有显著促进作用,对IP3R2、VDAC1、VDAC2和CAV1基因均表现为抑制作用,但不显著(P > 0.05)。
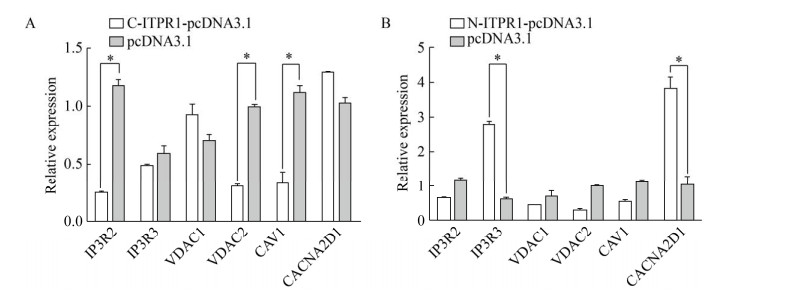 |
| 图 3 ITPR1基因C端和N端诱导的钙转运相关基因表达水平 Fig. 3 The expression of calcium transport-related genes induced by the C- or N-terminal half of the ITPR1 gene. * indicates that the difference is significant (P < 0.05). |
| 图选项 |
3 讨论3.1 ITPR1基因对Ca2+和脂质含量的调控研究ITPR1作为调节Ca2+释放的重要离子通道,它在内质网膜上以四聚体形式来调节细胞内钙信号[18]。Arruda等和Shi等发现,ITPR1基因的过表达可以使肥胖小鼠细胞质和线粒体中Ca2+浓度增加,导致线粒体功能障碍和代谢稳态障碍,而ITPR1基因表达下降可导致胆汁淤积症发生[19-20]。此外,钠钙交换器(NCX1) 和ITPR1受体的复合物参与了炎症损伤期间Ca2+稳态调节[21]。Malcuit等报道,抑制ITPR1基因C末端的抗体可以阻断与小鼠受精相关的Ca2+释放[22]。可见,ITPR1基因对动物机体中组织和细胞Ca2+的释放发挥着重要作用。在本研究中,ITPR1基因在鸭子宫上皮细胞中过表达后,N端结构域载体的表达量高于C端结构域载体的表达量,推测这可能与ITPR1基因的功能结构域有关系,N端结构包括肌醇1, 4, 5-三磷酸受体和Ca2+跨膜转运及释放的通道,C端主要为胞外结构域,IP3结合站点和Na+、K+、Ca2+传输通道相互调控,进一步说明IP3受体主要位于N端,容易与胞内ITPR1结合。本研究中,转染ITPR1基因过表达载体后,鸭子宫上皮细胞内Ca2+浓度均呈现降低趋势,提示ITPR1基因促进了Ca2+释放,促进Ca2+从内质网释放到胞质中,由于高浓度的Ca2+对细胞的毒性作用,该离子释放后通过Na+/Ca2+交换器或者钙泵迅速从胞质将Ca2+输出到细胞外,进而导致胞内Ca2+浓度降低[23-24],进一步证实ITPR1基因在子宫细胞内促进Ca2+释放。本研究发现,C端的Ca2+浓度较低,说明C端ITPR1基因对胞内Ca2+通道的调控作用更强,促进离子通道释放Ca2+到胞外的更多,同时也与ITPR1基因C末端控制离子通道开放的功能密切相关。许多生物功能是由细胞内Ca2+调节的,若胞内Ca2+浓度升高,细胞内钙质易于沉积,容易参与动脉粥样硬化形成,可能为糖尿病和冠心病等慢性病发生的原因之一[25-26],由此推测,ITPR1基因还可作为预防或缓解鸭动脉粥样硬化等慢性疾病的候选基因。
Feriod等报道,特异性敲除小鼠肝脏的ITPR1基因导致线粒体钙信号通路受损、肝脏甘油三酯减少、脂滴形成减少和脂肪基因表达水平降低[27],这与本研究发现的ITPR1基因对甘油三酯的影响效应一致,可能是由于ITPR1基因的表达量增加引起细胞内Ca2+浓度降低,细胞在低钙环境里会促进脂肪生成,抑制脂肪分解,导致低密度脂蛋白和甘油三酯的沉积[13, 28]。胆固醇是禽蛋中的甾醇类物质,一部分来自蛋鸡饲粮,另一部分源于低密度脂蛋白的代谢而在肝脏中合成[29],所以,随着低密度脂蛋白含量的升高,胆固醇的含量也相应升高。这为改善鸭体内脂肪沉积提供了科学参考。此外,禽蛋的脂质组分主要存在于蛋黄中,由约65%的甘油三酯、28%–30%的磷脂和4%–5%的胆固醇组成[30],在今后的育种工作中,可以通过控制产蛋高峰期ITPR1基因的表达来调控蛋鸭的蛋品质。
3.2 ITPR1基因对钙转运相关基因的影响效应Torrealba等研究显示,IP3R2基因表达降低将有利于内质网释放Ca2+调节各种生理功能,本实验中随着子宫细胞内ITPR1基因的表达,促进Ca2+释放,IP3R2、CAVI、VDAC2等基因的表达量随之降低[31],与前人的研究成果一致。CAVI是ITPR1基因的上游调控基因,ITPR1基因表达量的增加使CAVI的表达量降低,表明ITPR1基因对CAVI有反向调控作用。Murata等研究显示,CAVI可以调节低密度脂蛋白和高密度脂蛋白等胆固醇受体上胆固醇的流入或者流出[32]。此外,敲除CAV1基因的小鼠会出现扩张性心肌病以及肺动脉高压的病状[33]。可见,CAV1基因表达的下降可预防一些脂质代谢疾病的发生。CACNA2D1基因是编码动物L-型钙离子通道的α2δ1亚基基因,可影响钙离子通道钙流的性质[34]。此外,本研究发现,IP3R3基因的表达趋势为N端的表达量提高C端的表达量下降,提示N端ITPR1基因能促进IP3R3基因的表达,C端ITPR1基因可抑制IP3R3基因的表达。在IP3Rs中,IP3R3被认为只产生单相Ca2+瞬态[35],IP3R2是持久的Ca2+振荡,而ITPR1介导的规律性Ca2+振荡较少。Kuchay等发现,IP3R3基因能够控制Ca2+从内质网释放到线粒体,若IP3R3基因调控Ca2+持续释放使线粒体超载,会导致细胞的凋亡[5],IP3R3与ITPR1促进细胞凋亡的功能相似,推测在子宫上皮细胞中ITPR1基因对Ca2+的调控作用与IP3R3基因一致。
4 结论ITPR1基因过表达能促进鸭子宫上皮细胞内Ca2+释放,并促进甘油三酯、低密度脂蛋白和胆固醇的合成,抑制高密度脂蛋白的生成。C端ITPR1基因过表达对IP3R2、VDAC2、CAV1基因的表达有显著抑制作用,N端ITPR1基因过表达对IP3R3、CACNA2D1基因的表达有显著促进作用。
参考文献
| [1] | Bar A. Differential regulation of calbindin in the calcium-transporting organs of birds with high calcium requirements. J Poult Sci, 2009, 46(4): 267-285. DOI:10.2141/jpsa.46.267 |
| [2] | Bar A. Calcium transport in strongly calcifying laying birds: mechanisms and regulation. Comp Biochem Physiol A Mol Integr Physiol, 2009, 152(4): 447-469. DOI:10.1016/j.cbpa.2008.11.020 |
| [3] | Jonchère V, Réhault-Godbert S, Hennequet-Antier C, et al. Gene expression profiling to identify eggshell proteins involved in physical defense of the chicken egg. BMC Genomics, 2010, 11: 57. DOI:10.1186/1471-2164-11-57 |
| [4] | 李杰章, 罗华伦, 谭光辉, 等. SCD-1基因过表达对鸭子宫上皮细胞钙离子和脂质含量的效应. 生物工程学报, 2020, 36(5): 899-907. Li JZ, Luo HL, Tan GH, et al. Effects of SCD-1 gene overexpression on the content of calcium ion and lipids in duck uterine epithelial cells. Chin J Biotech, 2020, 36(5): 899-907 (in Chinese). |
| [5] | Kuchay S, Giorgi C, Simoneschi D, et al. PTEN counteracts FBXL2 to promote IP3R3- and Ca2+-mediated apoptosis limiting tumour growth. Nature, 2017, 546(7659): 554-558. DOI:10.1038/nature22965 |
| [6] | Mikoshiba K, Furuichi T, Miyawaki A. Structure and function of IP3 receptors. Semin Cell Biol, 1994, 5(4): 273-281. DOI:10.1006/scel.1994.1033 |
| [7] | Avisek M, Tamal S, Abhilash P, et al. Essential role of NFATC4-S-palmitoylation to promote IP3R1-expression required for lysosomal Ca2+ homeostasis dysregulated in INCL mice. FASEB J, 2020, 34(S1): 1. |
| [8] | Usui R, Yabe D, Fauzi M, et al. GPR40 activation initiates store-operated Ca2+ entry and potentiates insulin secretion via the IP3R1/STIM1/Orai1 pathway in pancreatic β-cells. Sci Rep, 2019, 9: 15562. DOI:10.1038/s41598-019-52048-1 |
| [9] | Cao XY, Chen JN, Li D, et al. ORP4L couples IP3 to ITPR1 in control of endoplasmic reticulum calcium release. FASEB J, 2019, 33(12): 13852-13865. DOI:10.1096/fj.201900933RR |
| [10] | Chan HYS, Cheung MC, Gao Y, et al. Expression and reconstitution of the bioluminescent Ca2+ reporter aequorin in human embryonic stem cells, and exploration of the presence of functional IP3 and ryanodine receptors during the early stages of their differentiation into cardiomyocytes. Sci China Life Sci, 2016, 59(8): 811-824. DOI:10.1007/s11427-016-5094-6 |
| [11] | 林丽莉, 时昭红, 石拓, 等. 旋覆代赭汤含血清对胃窦平滑肌细胞IP3受体及钙离子浓度影响的实验研究. 甘肃中医, 2010, 23(3): 34-36. Lin LL, Shi ZH, Shi T, et al. Experimental study on XuanFu DaiZhe decoction ccontaining serum of gastric antral smooth muscle cells IP3 receptors and concentration of calcium ion. Gansu J Traditl Chin Med, 2010, 23(3): 34-36 (in Chinese). DOI:10.3969/j.issn.1004-6852.2010.03.016 |
| [12] | Lin QS, Zhao LY, Jing R, et al. Inositol 1, 4, 5-trisphosphate receptors in endothelial cells play an essential role in vasodilation and blood pressure regulation. J Am Heart Assoc, 2019, 8(4): e011704. |
| [13] | 吕彬, 王勇, 解芸菲, 等. 钙信号通过IP3通路对肥胖小鼠脂肪合成代谢的影响. 西北农林科技大学学报(自然科学版), 2011, 39(9): 41-47. Lv B, Wang Y, Xie YF, et al. Effect of calcium signaling by IP3 pathway on the fat deposition of obese mice. J Northwest A & F Univ (Nat Sci Ed), 2011, 39(9): 41-47 (in Chinese). |
| [14] | Luo XX, Li YP, Yang P, et al. Obesity induces preadipocyte CD36 expression promoting inflammation via the disruption of lysosomal calcium homeostasis and lysosome function. E-Bio Med, 2020, 56: 102797. |
| [15] | Wang LW, Wagner Ⅱ LE, Alzayady KJ, et al. Region-specific proteolysis differentially regulates type 1 inositol 1, 4, 5-trisphosphate receptor activity. J Biol Chem, 2017, 293(34): 11714-11726. |
| [16] | 罗华伦. 鸭SCD-1基因对子宫上皮细胞Ca2+的效应及其启动子活性研究[D]. 贵阳: 贵州大学, 2019. Luo HL. Effect of duck SCD-1 gene on Ca2+ in uterine epithelial cells and its promoter activity research[D]. Guiyang: Guizhou University, 2019 (in Chinese). |
| [17] | 王晓萌. 钙信号传导通路基因多态性与皮肤黑色素瘤特异生存期的关联性研究[D]. 长春: 吉林大学, 2019. Wang XM. Association between genetic variants in the calcium signaling pathway genes and cutaneous melaloma-specific survival[D]. Changchun: Jilin University, 2019 (in Chinese). |
| [18] | Zhang SB, Fritz N, Ibarra C, et al. Inositol 1, 4, 5-trisphosphate receptor subtype-specific regulation of calcium oscillations. Neurochem Res, 2011, 36(7): 1175-1185. DOI:10.1007/s11064-011-0457-7 |
| [19] | Arruda AP, Pers BM, Parlakgül G, et al. Chronic enrichment of hepatic endoplasmic reticulum-mitochondria contact leads to mitochondrial dysfunction in obesity. Nat Med, 2014, 20(12): 1427-1435. DOI:10.1038/nm.3735 |
| [20] | Shi BK, Hirata K, Robert ME, et al. Loss of inositol 1, 4, 5-trisphosphate receptors from bile duct epithelia is a common event in cholestasis. Gastroenterology, 2003, 125(4): 1175-1187. DOI:10.1016/S0016-5085(03)01201-0 |
| [21] | Zhao M, Jia HH, Liu LZ, et al. Acetylcholine attenuated TNF-α-induced intracellular Ca2+ overload by inhibiting the formation of the NCX1-TRPC3-IP3R1 complex in human umbilical vein endothelial cells. J Mol Cell Cardiol, 2017, 107: 1-12. DOI:10.1016/j.yjmcc.2017.04.001 |
| [22] | Malcuit C, Knott JG, He CL, et al. Fertilization and inositol 1, 4, 5-trisphosphate (IP3)-induced calcium release in type-1 inositol 1, 4, 5-trisphosphate receptor down-regulated bovine eggs. Biol Reprod, 2005, 73(1): 2-13. DOI:10.1095/biolreprod.104.037333 |
| [23] | Jonchère V, Brionne A, Gautron J, et al. Identification of uterine ion transporters for mineralisation precursors of the avian eggshell. BMC Physiol, 2012, 12: 10. DOI:10.1186/1472-6793-12-10 |
| [24] | Perocchi F, Gohil VM, Girgis HS, et al. MICU1 encodes a mitochondrial EF hand protein required for Ca2+ uptake. Nature, 2010, 467(7313): 291-296. DOI:10.1038/nature09358 |
| [25] | Goh GBB, Pagadala MR, Dasarathy J, et al. Clinical spectrum of non-alcoholic fatty liver disease in diabetic and non-diabetic patients. BBA Clin, 2014, 3: 141-145. |
| [26] | V?lzke H, Robinson DM, Kleine V, et al. Hepatic steatosis is associated with an increased risk of carotid atherosclerosis. World J Gastroenterol, 2005, 11(12): 1848-1853. DOI:10.3748/wjg.v11.i12.1848 |
| [27] | Feriod CN, Oliveira AG, Guerra MT, et al. Hepatic inositol 1, 4, 5-trisphosphate receptor type 1 mediates fatty liver. Hepatol Commun, 2017, 1(1): 23-35. DOI:10.1002/hep4.1012 |
| [28] | Zemel MB. Mechanisms of dairy modulation of adiposity. J Nutr, 2003, 133(1): 252S-256S. DOI:10.1093/jn/133.1.252S |
| [29] | Griffin HD. Manipulation of egg yolk cholesterol: a physiologist's view. World Poult Sci J, 1992, 48(2): 101-112. DOI:10.1079/WPS19920010 |
| [30] | Mine Y. Egg Bioscience and Biotechnology. Hoboken: John Wiley & Sons, Inc., 2008: 289-305. |
| [31] | Torrealba N, Navarro-Marquez M, Garrido V, et al. Herpud1 negatively regulates pathological cardiac hypertrophy by inducing IP3 receptor degradation. Sci Rep, 2017, 7: 13402. DOI:10.1038/s41598-017-13797-z |
| [32] | Murata M, Per?nen J, Schreiner R, et al. VIP21/caveolin is a cholesterol-binding protein. Proc Natl Acad Sci USA, 1995, 92(22): 10339-10343. DOI:10.1073/pnas.92.22.10339 |
| [33] | Zhao YY, Liu Y, Stan RV, et al. Defects in caveolin-1 cause dilated cardiomyopathy and pulmonary hypertension in knockout mice. Proc Natl Acad Sci USA, 2002, 99(17): 11375-11380. DOI:10.1073/pnas.172360799 |
| [34] | Robinson RL, Curran JL, Ellis FR, et al. Multiple interacting gene products may influence susceptibility to malignant hyperthermia. Ann Hum Genet, 2000, 64(4): 307-320. DOI:10.1046/j.1469-1809.2000.6440307.x |
| [35] | Miyakawa T, Maeda A, Yamazawa T, et al. Encoding of Ca2+ signals by differential expression of IP3 receptor subtypes. EMBO J, 1999, 18(5): 1303-1308. DOI:10.1093/emboj/18.5.1303 |
