

1. 四川大学 华西口腔医学院,四川 成都 610041;
2. 四川大学 华西口腔医学院实验教学示范中心,四川 成都 610041
收稿日期:2020-08-07;接收日期:2020-11-24
基金项目:川大学华西口腔医院探索与研发项目(No. RD-02-202010),国家自然科学基金(Nos. 81970931,81771062),四川大学大学生创新创业训练计划项目(Nos. C2020108360) 资助
摘要:壳聚糖是一种天然高分子多糖,在食品、纺织、美容、医疗等行业被广泛应用。在口腔医学领域,壳聚糖及其衍生物因多种优良的生物学性能,如抗菌性能、载药功能、再矿化性能和成骨作用等,被广泛应用于多种口腔常见疾病的预防和治疗。文中介绍了壳聚糖的生物学性能、壳聚糖常见衍生物,与壳聚糖及其衍生物在口腔疾病防治方面的最新应用研究进展。
关键词:壳聚糖壳聚糖衍生物抗菌性再矿化口腔疾病防治
Advances of chitosan and its derivatives in the prevention and treatment of oral diseases
Yanling Chen1, Li Zhang1, Linglin Zhang1,2, Kun Wang1,2


1. West China School of Stomatology, Sichuan University, Chengdu 610041, Sichuan, China;
2. National Demonstration Center for Experimental Stomatology Education, West China School of Stomatology, Sichuan University, Chengdu 610041, Sichuan, China
Received: August 7, 2020; Accepted: November 24, 2020
Supported by: Research and Development Project of West China Stomatological Hospital of Sichuan University (No. RD-02-202010), National Natural Science Foundation of China General Program (Nos. 81970931, 81771062), Sichuan University College Student Innovation and Entrepreneurship Training Program, China (No. C2020108360)
Corresponding author: Kun Wang. Tel: +86-28-85501448; E-mail: wangk0613@126.com.
Abstract: Chitosan is a natural polysaccharide that is widely used in food, textile, cosmetics, and medical industries. In the field of stomatology, chitosan and its derivatives are widely used in the treatment of many common oral diseases due to a variety of excellent biological properties, such as anti-infection, drug-loading, remineralization and osteogenesis. This review summarized the latest advances in the biological properties of chitosan and its derivatives, as well as their applications in the prevention and treatment of oral diseases.
Keywords: chitosanchitosan derivativeantibacterialremineralizationprevention and treatment of oral diseases
壳聚糖是一种来自甲壳素的线性的、半结晶态的天然多糖,主要存在于甲壳类动物和真菌的细胞壁中,其单体为β-(1→4)-2-乙酰氨基-2-脱氧-b-d-葡聚糖和β-(1→4)-2-氨基-2-脱氧b-d-葡聚糖,分子量在10?1 000 kDa之间。壳聚糖不溶于水和大多数有机溶剂,但可溶于稀酸中形成质子化的氨基变成多元阳离子,并能与各种各样的天然或合成的阴离子或聚合物形成离子复合物,例如DNA、蛋白质、脂类、聚丙烯酸等,其脱乙酰度决定了壳聚糖的溶解性,脱乙酰度越高,壳聚糖在有机酸等中的溶解性越好[1]。壳聚糖具有优异的生物学特性,包括良好的生物安全性、黏膜黏附性、血液相容性、生物降解性等,并具有抗肿瘤、抗氧化剂和抗菌特性。在生物医学领域,壳聚糖最初作为一种止血敷料进入临床研究中,近年来,基于壳聚糖出色的载药性能和优良的骨传导性,越来越多的研究人员将壳聚糖用于构建药物递送系统和组织工程支架[2-3]。此外,通过对壳聚糖进行化学修饰引入功能基团形成壳聚糖衍生物,可以进一步改善其某方面的特性以达到研究需求。常见的壳聚糖衍生物包括酰化壳聚糖、羧基化壳聚糖、烷基化壳聚糖、季铵化壳聚糖等。
在口腔疾病防治领域,以壳聚糖为基础的敷料已经被用作处理拔牙或口腔颌面部创伤,并且表现出了良好的伤口愈合性能[4];随着对壳聚糖及其衍生物的再矿化性能、载药性能以及骨传导性的探索,研究者开发了多种以壳聚糖及其衍生物为基础的材料,其在龋病、牙髓病、牙周病、口腔颌面部创伤治疗及口腔颌面部肿瘤方面都有很高的应用价值。它们可以直接添加在牙膏中以预防龋病,也可以直接注入感染性牙周袋治疗牙周病,同时壳聚糖复合支架材料还具有引导牙槽骨和颌骨再生的作用[5-6]。本文就壳聚糖及其衍生物的多种生物学性能在不同口腔疾病防治中的应用研究进行综述。
1 壳聚糖的生物学性能1.1 壳聚糖的抗菌性能壳聚糖对细菌和真菌具有广泛的抗菌活性,其抗菌作用主要在细胞膜表面实现,也可因微生物种类和壳聚糖分子量的不同引发细胞内的抗菌效应[7]。它的抗菌效果受到脱乙酰度、分子量、pH、浓度等多种因素的影响,此外,壳聚糖对不同菌株的抗菌效果也不尽相同,其对大肠杆菌的抗菌性能优于无害李斯特氏菌和金黄色葡萄球菌[8]。然而,由于壳聚糖机械强度低,水溶性差,目前壳聚糖的抗菌性能尚难以实现广泛应用,因此通过对壳聚糖进行化学修饰以改善壳聚糖的理化性质并提高其抗菌活性是目前的研究热点之一[9]。
1.2 壳聚糖的载药性能壳聚糖可以被加工为薄膜、水凝胶、纤维、微球、纳米颗粒等多种形式,并且具有独特的黏膜黏附和渗透增强性,这些特性使壳聚糖成为一种理想的药物递送物质[5]。基于壳聚糖的药物递送系统一直受到科研人员的广泛关注,近年来壳聚糖自组装纳米颗粒作为一种更为先进的递送系统备受青睐,壳聚糖具有自组装性能,并且在生物相容性、降解性、安全性等方面优于目前常见的纳米颗粒递送系统[10]。研究发现这种递送系统经口腔、黏膜、皮肤等多种给药途径均获得了较为理想的递送效果[11]。
1.3 壳聚糖的再矿化性能壳聚糖具有调节脱矿和再矿化平衡,减少钙磷等矿物质流失并抑制脱矿的功能。它不仅可以通过静电作用吸附在硬组织表面形成扩散屏障来减少矿物质流失,还能结合酸性环境中的氢离子,抑制pH值下降,减少其对硬组织的腐蚀[12];同时,壳聚糖分子中的氨基能与钙离子发生化学结合,聚集和携带无定型钙扩散进入深层脱矿病损中,并诱导无定型磷酸钙向羟基磷灰石转化。目前,基于壳聚糖的载体性能和再矿化作用,联合壳聚糖和再矿化药物开发新型的促矿化药物是再矿化领域的研究热点[13]。
1.4 壳聚糖的骨再生性能壳聚糖基于其良好的生物相容性和骨传导性,作为一种优良的支架材料被广泛应用于骨组织工程中[14]。一方面,壳聚糖可与其他材料联合制成壳聚糖复合支架材料,改善其机械性能,同时在复合支架中掺入生物活性分子可加速骨再生并增强体内新血管形成[2]。另一方面,壳聚糖及其复合材料可以作为处理骨种植体和合成支架的表面改性剂,以增强生物活性,提高成骨潜力[15]。除此之外,壳聚糖还能解聚释放壳聚糖单体,通过mRNA水平的信号转导激活丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK) 级联反应,活化成骨细胞[16]。
2 壳聚糖的常见衍生物2.1 酰化壳聚糖衍生物壳聚糖的氨基和羟基可与多种有机酸或酸酐、酰氯等发生反应生成酰化壳聚糖衍生物(图 1、图 2),引入的基团可削弱壳聚糖的分子内和分子间氢键,使衍生物的水溶性提高,衍生物的抗菌性能则在一定程度上受到取代度和分子量的影响[18-20]。酰化壳聚糖应用范围较广,高溶解度的酰化壳聚糖可作为药物递送载体,而高结晶度酰化壳聚糖则具有良好的加工性,可增强纤维的韧性[21-22]。
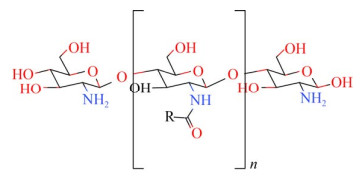 |
| 图 1 N-酰基化壳聚糖的结构式[17] Fig. 1 The structural formula of N-acylated chitosan[17]. |
| 图选项 |
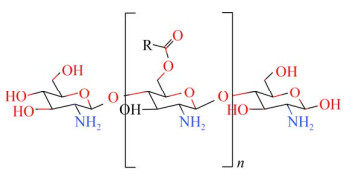 |
| 图 2 O-酰基化壳聚糖的结构式[17] Fig. 2 O-酰基化壳聚糖的结构式[17] |
| 图选项 |
2.2 羧基化壳聚糖衍生物壳聚糖的羧化主要通过乙醛酸与壳聚糖的-OH或-NH2基团反应实现,羧化壳聚糖衍生物有-COOH和-NH2两亲性基团(图 3),在酸性条件下中氨基质子化使羧甲基壳聚糖带正电荷;在碱性条件下中,羧基电离使羧甲基壳聚糖带负电荷,其水溶性主要受到取代度的影响[23-24]。羧基化壳聚糖衍生物的黏膜黏附性强,常被作为黏膜药物递送载体,在肠道、鼻黏膜和口腔递送方面均有广泛应用[11]。
 |
| 图 3 羧基化壳聚糖的结构式[17] Fig. 3 The structural formula of carboxylated chitosan[17]. |
| 图选项 |
2.3 烷基化壳聚糖衍生物壳聚糖主要通过氨基发生烷基化反应,生成N-烷基化衍生物(图 4),羟基也可参与烷基化,产生O-烷基化衍生物(图 5),与壳聚糖相比,烷基化的壳聚糖分子内氢键显著弱化,水溶性有所增加,但值得注意的是,引入的长链烷基具有疏水性,因此可以通过调整引入的烷基来控制烷基化壳聚糖衍生物的水溶性[25-26]。一系列凝血和溶血实验表明,烷基化壳聚糖衍生物与壳聚糖相比有更理想的凝血效果和生物相容性,其止血特性受到烷基链长度的影响,可作为理想的止血材料[27-28]。
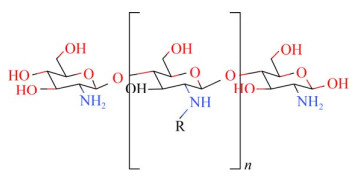 |
| 图 4 N-烷基化壳聚糖的结构式[17] Fig. 4 N-烷基化壳聚糖的结构式[17] |
| 图选项 |
 |
| 图 5 O-烷基化壳聚糖的结构式[17] Fig. 5 The structural formula of O-alkylated chitosan[17]. |
| 图选项 |
2.4 季铵化壳聚糖衍生物季铵化壳聚糖通常是由壳聚糖直接N取代或与季环氧化物反应产生的富有正电荷的阳离子聚合物(图 6),季环氧化物所携带的烷基基团可使形成的季铵化壳聚糖具有不同的亲水/疏水特性,常见的季铵化壳聚糖有N, N, N-三甲基壳聚糖(N, N, N-trimethyl chitosan,TMC)、N, N, N-三甲基O-(2-羟基-3-三甲基铵丙基) 壳聚糖(N, N, N- trimethyl O-(2-hydroxy-3-trimethylammonium propyl) chitosan,TMHTMAPC)、N-2-羟丙基二甲基乙基氯化铵壳聚糖(N-2-hydroxypropyl dimethyl ethyl ammonium chloride chitosan,N-2-HFCC) 等[29-30]。季铵化引入了大量正电荷增加了衍生物亲水性,使得季铵化壳聚糖在中性和碱性溶液中的溶解性大幅提升,因此季铵化壳聚糖具有比未修饰壳聚糖更广泛的应用范围和更有效的抗菌性能[31]。
 |
| 图 6 季铵化壳聚糖的结构式 Fig. 6 The structural formula of quaternized chitosan[17]. |
| 图选项 |
3 壳聚糖及其衍生物在不同口腔疾病防治中的应用研究3.1 壳聚糖及其衍生物在口腔预防中的应用自我口腔保健有赖于正确的口腔清洁方法和安全有效的口腔卫生用品,因此,改良现有的口腔卫生用品是口腔疾病预防的重要途径。目前市面上的漱口水主要分为非药用性和药用性漱口水,前者作用主要为清新口气,减少口腔异味,抗菌作用较弱;而药用性漱口水添加了洗必泰、复合碘剂等抗菌药物,具有更显著的抗菌效果,但长期使用可能增加牙齿及口腔黏膜着色的风险,还可能导致口腔菌群失调。基于壳聚糖的抗菌性能和生物安全性,有****尝试以壳聚糖作为抗菌活性物质,配制安全性与抗菌性兼具的漱口水。体外实验发现该漱口水可通过阻止常见口腔微生物的黏附,抑制生物膜的形成,从而实现抑菌功效,且抑菌效果明显优于两款市售漱口水[32]。体内实验和毒性分析结果表明该漱口水均未造成Ames、MTT和V79染色体畸变,并且有效抑制了志愿者口腔中的链球菌及肠球菌属,证明该壳聚糖漱口水兼顾生物安全性和抗菌性能,具有替代传统漱口水的巨大潜力[33]。
除漱口水外,壳聚糖在牙膏配方中也有广泛应用,一方面壳聚糖可与氟化物、氯化锡等一同被添加至牙膏中,用以促进牙体硬组织再矿化,预防因侵蚀和磨损导致的牙釉质物质流失[34];另一方面,壳聚糖可包裹CaCl2形成微球,通过促使刷牙过程中形成无定形磷酸钙达到控制龋齿的目的[35]。添加至牙膏中的壳聚糖除了发挥促矿化作用外仍具有一定的抗菌效果,与表面活性剂联合应用可抑制变异链球菌在生物膜中的活性,并且具有较高的生物安全性[36]。
3.2 壳聚糖及其衍生物在龋病治疗中的应用龋病是一种因细菌感染而引起的牙体硬组织进行性缺损的疾病,细菌感染和牙体硬组织脱矿的交替进行是龋病进展的主要原因,目前对壳聚糖的防龋应用主要集中于抑菌和促矿化两方面[37-38]。
一方面,壳聚糖具有良好的抗菌效果和生物相容性,有****将蜂胶及壳聚糖溶解于水-酒精载体,以制备一种基于蜂胶的壳聚糖清漆,这种清漆在牛牙上可迅速成膜,在体外表现出优于洗必泰清漆的抗菌效果[39]。研究发现添加了壳聚糖的漱口水具有良好的抑菌活性,可维持口腔微生态稳定,并且生物安全性大于商业漱口水[40]。然而由于漱口水、牙膏等制剂在牙面停留的时间短,且单一应用壳聚糖的抗菌效果较弱,防龋效果不够理想,因此有****尝试将其他抗菌制剂与壳聚糖及其衍生物联用,制成可长时间在牙面停留的凝胶或纳米纤维垫,以期获得更优良的抗菌效果,这类静电纺丝纳米纤维垫在体外和体内均表现出良好的黏膜黏附性和抗菌活性,且与联合抗菌剂表现出协同抗菌活性[41-42]。另一方面,壳聚糖具有良好的促矿化作用和载药性能,并且在药物缓释方面有较大的应用前景,部分****利用壳聚糖的这一特性,将具有促矿化效果的化合物与壳聚糖制成有抗菌和促矿化复合效果的制剂,如壳聚糖生物玻璃复合物、釉原蛋白-壳聚糖复合凝胶、羧甲基壳聚糖-磷酸钙复合物等[37, 43-44]。有多项体外研究证实这类制剂可抑制变异链球菌生长,促进胶原纤维的仿生矿化,提高经脱矿处理后离体牙的努氏硬度,表现出良好的抗菌和促矿化双效抗龋作用[45-46]。
基于壳聚糖良好的抗菌与载药性能,笔者课题组前期通过构建壳聚糖-釉原蛋白衍生多肽复合体,将其应用于早期釉质龋的体外防治研究。我们的研究发现该复合体兼具良好的抗致龋菌和促矿化性能,一方面能够显著抑制变异链球菌的黏附与生物膜形成,另一方面能够明显促进脱矿牙釉质显微硬度恢复至50.06%,并降低龋坏深度和矿物含量的丢失,在早期龋防治中展现出良好的抗龋性能和潜力,也为其体内综合防龋效力的深入研究奠定了基础[37, 47]。
此外,壳聚糖还可添加至树脂充填或粘接材料中,部分研究表明,壳聚糖或其衍生物(甲基丙烯酸壳聚糖、甲基丙烯酸酯壳聚糖、羧甲基壳聚糖) 被添加至实验树脂基质或粘接剂中,能够增强树脂基质或粘接剂的抗菌性和边缘密合性,预防充填治疗后产生继发龋,但壳聚糖及其衍生物含量的添加可能会影响材料的机械强度,导致硬度和抗弯强度下降[46-48]。
上述研究表明,壳聚糖不仅可作为安全的抗菌剂用于龋病防治的药物治疗,也可作为充填材料或粘接材料辅剂应用至继发龋的预防。
3.3 壳聚糖及其衍生物在牙髓病治疗中的应用牙髓疾病包括牙髓炎、牙髓变性和牙髓坏死,其中以牙髓炎最为常见,其主要致病因素为微生物感染,也会受到其他理化因素、生物学因素等的影响。壳聚糖在牙髓疾病方面的应用集中于对牙髓炎的治疗,在活髓保存术和根尖诱导成形术中有广泛的应用前景[49]。
长期以来,氢氧化钙被认为是活髓保存治疗的首选材料,但其存在细胞毒性,且诱导形成的牙本质桥不完全;与氢氧化钙相比,壳聚糖对牙髓无细胞毒性,可作为一种生物活性材料添加至盖髓剂中,在抗菌的同时可以极大程度地保存牙髓的活性[50]。Zhu等制备的壳聚糖-含银生物玻璃水凝胶,在炎症牙髓细胞模型中可下调IL-1β、IL-6、IL-8、TNF-α四种炎症因子的表达,表现出良好的抗炎效果,并在小鼠弥漫性牙髓炎活髓切断模型中形成良好的冠方封闭,且保留了根尖部牙髓细胞的活性[51]。此外,Chen等的研究发现,壳聚糖-无定形磷酸钙纳米复合支架可模仿牙本质基质蛋白1在牙体硬组织矿化中的作用,释放无定形磷酸钙,并使其渗透到胶原蛋白原纤维中,以完成胶原蛋白的原纤维内矿化;实验中完全脱矿的牙本质最终实现了部分矿化,说明了壳聚糖应用至新型盖髓材料的可能性[52]。
壳聚糖也可用于基于组织工程技术的根尖诱导成形术。通过组织工程技术治疗牙髓感染的年轻恒牙需要保留有活力的牙髓组织,并依赖干细胞、生长因子和支架材料促进牙髓-牙本质复合体的形成[53]。壳聚糖具有一定的孔隙率和机械强度,可作为组织工程技术中的支架材料,但是壳聚糖单一应用时的亲水性较差,因此常常与亲水性好但机械强度弱的纤连蛋白、血纤蛋白、RGD序列等生物材料固定,以提高壳聚糖支架的亲水性,这种复合支架材料能够成功诱导牙髓种子细胞黏附和增殖、分化的作用,并有利于修复性牙本质形成[54]。进一步研究发现,在制备壳聚糖支架过程中加入铝酸钙可使支架的孔隙率增加,并进一步提高细胞的增殖速率,获得更多的矿化基质沉积[55]。
3.4 壳聚糖及其衍生物在牙周治疗中的应用牙周病是一种由细菌菌斑引起的局部慢性炎症性疾病,菌斑生物膜刺激导致宿主免疫反应失调,造成支持组织破坏、附着丧失、病理性牙周袋形成以及牙槽骨吸收,甚至出现牙齿脱落,因此抑制牙周菌斑形成和局部炎症反应是治疗牙周病的理论基础[56]。
壳聚糖可以直接抑制牙周局部炎症和牙周病原菌,而且不会对牙周组织造成二次刺激[57]。在抗炎作用方面,壳聚糖具有改变组织炎症中巨噬细胞和成纤维细胞介导的反应的能力,单一的壳聚糖作用可以明显降低牙龈成纤维细胞中IL-β刺激诱导的前列腺素E2 (Prostaglandin E2,PGE2)的水平,非刺激情况下不会引起细胞中PGE2水平的变化[57];在抗菌作用方面,多项研究证实了壳聚糖对牙龈卟啉单胞菌(Porphyromonas gingivalis,Pg)、放线菌等牙周病原菌的固有抗菌性能,Arancibia等和Costa等发现壳聚糖浓度为5 mg/mL时能抑制牙龈卟啉单胞菌和伴放线聚集杆菌Aggregatibacter actinomycetemcomitans (Aa) 的生长,但值得注意的是,体外细胞活性实验发现5 mg/mL的壳聚糖可以产生一定的细胞毒性作用,可能会造成牙龈结缔组织的损伤,但还需要体内外研究进一步验证[57-58]。因此,单独使用壳聚糖仍存在很大的限制。目前临床对牙周病的治疗主要依赖于机械清创术,如龈下刮治和根面平整等;然而,器械清创不能完全清除菌斑,为了提高治疗效果,基于壳聚糖的牙周局部给药系统成为了一种新的手段。
目前,应用于牙周疾病治疗的壳聚糖局部给药系统包括壳聚糖凝胶、壳聚糖薄膜、壳聚糖微球、纳米粒子、复合材料以及壳聚糖囊泡系统等,它们在牙周炎的治疗应用中具有广阔的前景,可能成为牙膏配方的一部分,或直接注入牙周袋[5]。壳聚糖局部给药系统能缓释牙周药物的释放速率,维持局部药物浓度,增强药物疗效。例如,?zdo?an等开发的壳聚糖局部递送阿托伐他汀凝胶制剂在体外实验中表现出良好的缓释作用,保证了更持久的局部药物浓度[59]。但是,Gjoseva等发现壳聚糖微粒体系会出现快速的溶胀和凝胶形成,很难控制药物释放速率,尤其是搭载像多西环素这样的水溶性物质[60]。相比之下,壳聚糖纳米颗粒不仅能克服溶胀效应,还可以通过胞饮作用或内吞作用被细胞内化吸收,使搭载的药物进入牙周细胞内部减少炎症相关因子表达[61-62]。
另外,壳聚糖还能影响牙槽骨的愈合和附着损失的修复。壳聚糖不仅可以促进骨祖细胞的分化,促进牙周骨的形成;还能增强阿托伐他汀的作用,减少附着损失、促进牙槽骨愈合[59, 63]。在牙周纤维再生方面,有****在壳聚糖膜上成功培养出牙周膜细胞球体,与较传统单层培养的细胞相比,其自我更新能力和成骨能力更强,这表明壳聚糖在牙周纤维再生方面有一定应用潜力[64]。
3.5 壳聚糖及其衍生物在口腔颌面部创伤治疗中的应用口腔颌面部创伤治疗包括创伤愈合和神经感觉运动功能的恢复,与人体其他部位相比其在美观性上有很高的要求。创伤愈合过程可分为3个连续的阶段:炎症、增殖和瘢痕成熟,涉及细胞、细胞外基质和信号分子之间复杂的相互作用。
壳聚糖主要通过活化成纤维细胞、刺激Ⅳ型胶原蛋白合成、促进释放生长因子和巨噬细胞迁移,同时辅以抗菌性能,在组织创面的愈合中发挥作用,可运用于开放性创面的治疗[3]。研究发现,壳聚糖中加入碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF) 可加快组织损伤修复的愈合速度[65]。进一步研究表明,壳聚糖促颗粒化组织形成的特性对真皮-表皮损伤修复表现出更好的作用[3, 66]。在美容修复方面,壳聚糖也具有一定的潜力。壳聚糖解聚释放的单体能促进成纤维细胞增殖,有利于有序胶原蛋白沉积和刺激透明质酸合成,加速伤口愈合和预防疤痕;另外,壳聚糖和羧甲基壳聚糖能抑制人皮肤原代成纤维细胞中基质金属蛋白酶2 (Matrix metalloproteinase-2,MMP2) 的活化和表达,这为研究MMP2介导的伤口愈合问题和皱纹形成提供了新的思路[67-68]。
在止血方面,作为一种天然的带正电荷的多糖,壳聚糖的氨基与红细胞表面的各种带负电荷的蛋白质和糖脂发生静电作用,这种相互作用增加了血液的黏度,激活血小板的黏附和聚集,有利于伤口止血[69]。目前临床上以壳聚糖为基础的敷料和缝线在创伤及外科伤口的处理上表现出优良的性能,得到了广泛的研究应用,如Hemcon牙科敷料可以显著减少局部麻醉下的小型口腔手术出血,包括口服抗凝治疗的患者[4];季铵化壳聚糖包被的Vicryl可吸收缝线可以防止整形手术中缝线相关的手术部位感染[70]。壳聚糖敷料是一种优良的止血剂,但其仍然存在不足之处,相比于壳聚糖,富血小板纤维蛋白凝胶具有更好的创面愈合性能和术后疼痛控制[71]。在周围神经重建方面,壳聚糖及其复合材料也表现出很高的研究价值。壳聚糖的降解产物可以促进细胞增殖和防止细胞凋亡,在周围神经再生过程中具有神经保护作用[72];在外周神经吻合手术中,缝线引起的排斥反应可能会影响术后恢复,而生物相容性好的壳聚糖制备的复合导管材料,如壳聚糖增强的壳聚糖神经导管为神经组织提供机械引导和稳定性,显著改善了神经再生的功能和形态学结果[73]。此外,在骨组织工程中,联合其他材料和生物活性药物分子制备的复合材料改善了壳聚糖的生物活性和力学性能,在治疗骨缺损方面取得了令人瞩目的进展,如在多孔羟基磷灰石-壳聚糖基质中,间充质干细胞转变为成骨细胞,表现出优秀的成骨效应[74]。一些研究显示壳聚糖复合材料有望在牙槽骨和颌骨的再生中得到更具体的应用,甚至可以加速牙种植体骨整合和重建关键尺寸缺陷[49]。
综上所述,壳聚糖在口腔颌面部创伤治疗中有广泛的应用前景,不仅可以作为止血材料、伤口敷料直接促进伤口愈合,在美容修复方面也具有潜力,还能制备成复合支架材料用于引导神经纤维和骨组织再生。
3.6 壳聚糖及其衍生物在防治口腔颌面部肿瘤中的应用一直以来,肿瘤细胞的侵袭性和耐药性是临床治疗肿瘤的棘手问题,其转录因子和内外转运机制的异常表达以及异常的代谢途径都具有独特的潜能,包括激活DNA修复机制对抗药物诱导的DNA损伤、通过激活独特的代谢机制对抗药物毒性、逃避药物引起的细胞凋亡和规避免疫系统的监视等[75]。
研究发现,壳聚糖和羧甲基壳聚糖均可抑制肿瘤细胞生长、增强机体抗肿瘤活性,一方面,壳聚糖可通过抑制肿瘤细胞中基质金属蛋白酶-9 (Matrix metalloproteinase-9,MMP-9) 的表达,减少血管内皮生长因子(Vascular endothelial growth factor,VEGF) 的释放,抑制肿瘤微血管系统生成;另一方面,壳聚糖还可以通过刺激淋巴细胞产生淋巴因子,诱导体液免疫和细胞免疫应答,增强机体免疫作用,发挥抗肿瘤作用[76-77]。近年来,基于壳聚糖的纳米药物在肿瘤的靶向治疗中取得了重大的进展。基于壳聚糖的纳米系统(Nanosystem,NSs) 可以结合治疗药物、靶向分子和诊断成像等,设计出多功能NSs,在肿瘤特别是恶性肿瘤的诊断和治疗中有很好的应用前景[75, 78]。然而,壳聚糖的低水溶性限制了基因和药物传递的应用,为了提高水溶性,通常用聚乙二醇修饰壳聚糖或添加新的亲水基团,聚乙二醇的加入还延长药物分子的半衰期,降低了其生物清除率,表现出更好的治疗效果[79]。
此外,壳聚糖纳米材料还可以应用于光热疗法在体外抑制人口腔上皮癌KB细胞和体内治疗KB肿瘤[80]。纳米材料作为热发生器,可以吸收和转化近红外光(Near infrared,NIR),转化为热能杀伤肿瘤细胞,但存在一定侵袭性,有导致肿瘤复发的风险;而壳聚糖纳米材料不仅可以搭载靶向分子,在光热疗法作用下特异性杀伤癌细胞,还能在光热的作用下释放化疗药物,提高靶向癌区的药物浓度,协同破坏癌细胞,另外,壳聚糖作为化疗药物的缓释体系,持续杀伤残存的癌细胞,降低肿瘤复发的风险[80]。
4 展望壳聚糖及其衍生物所具备的抗菌性、载药性、再矿化性能和成骨性能使其在龋病、牙髓疾病、牙周病、口腔颌面部创伤、口腔肿瘤的防治方面具有广泛的应用前景,不仅可用于软、硬组织的缺损修复,还可与多种生物活性大分子、金属化合物等联合使用,发挥协同抗菌抗炎作用。随着对壳聚糖性能研究的深入,研究人员发现壳聚糖的亲水性不强、可塑性低、壳聚糖支架的孔隙率和孔隙直径不易控制等不足极大地限制了其广泛应用。未来的研究方向可能主要着眼于对壳聚糖进行物理改性或化学修饰,合成制备性能更加优越的聚合物、枝接化合物、复合材料及纳米材料。目前,壳聚糖及其衍生物在口腔疾病防治方面,尤其是药物递送和组织工程学方面有着良好的应用前景,以壳聚糖为基础的药物和组织工程支架可能会在未来应用至不同口腔疾病的临床治疗。
参考文献
| [1] | Babu A, Ramesh R. Multifaceted applications of chitosan in cancer drug delivery and therapy. Mar Drugs, 2017, 15(4): 96. DOI:10.3390/md15040096 |
| [2] | 丁鑫鑫, 周延民, 相星辰, 等. 壳聚糖复合材料在骨组织工程中的研究进展. 华西口腔医学杂志, 2018, 36(4): 441-446. Ding XX, Zhou YM, Xiang XC, et al. Research progress on chitosan composite scaffolds in bone tissue engineering. West Chin J Stomatol, 2018, 36(4): 441-446 (in Chinese). |
| [3] | Muzzarelli RAA. Chitins and chitosans for the repair of wounded skin, nerve, cartilage and bone. Carbohyd Polym, 2009, 76(2): 167-182. DOI:10.1016/j.carbpol.2008.11.002 |
| [4] | Kumar KRA, Kumar J, Sarvagna J, et al. Hemostasis and post-operative care of oral surgical wounds by hemcon dental dressing in patients on oral anticoagulant therapy: a split mouth randomized controlled clinical trial. J Clin Diagn Res, 2016, 10(9): ZC37-ZC40. |
| [5] | Sah AK, Dewangan M, Suresh PK. Potential of chitosan-based carrier for periodontal drug delivery. Colloids Surf B Biointerf, 2019, 178: 185-198. DOI:10.1016/j.colsurfb.2019.02.044 |
| [6] | Jabbari F, Hesaraki S, Houshmand B. The physical, mechanical, and biological properties of silk fibroin/chitosan/reduced graphene oxide composite membranes for guided bone regeneration. J Biomater Sci Polym Ed, 2019, 30(18): 1779-1802. DOI:10.1080/09205063.2019.1666235 |
| [7] | Verlee A, Mincke S, Stevens CV. Recent developments in antibacterial and antifungal chitosan and its derivatives. Carbohydr Polym, 2017, 164: 268-283. DOI:10.1016/j.carbpol.2017.02.001 |
| [8] | Ardila N, Daigle F, Heuzey MC, et al. Antibacterial activity of neat chitosan powder and flakes. Molecules, 2017, 22(1): 100. DOI:10.3390/molecules22010100 |
| [9] | Shao JL, Wang B, Li JM, et al. Antibacterial effect and wound healing ability of silver nanoparticles incorporation into chitosan-based nanofibrous membranes. Mater Sci Eng C, 2019, 98: 1053-1063. DOI:10.1016/j.msec.2019.01.073 |
| [10] | Qui?ones JP, Peniche H, Peniche C. Chitosan based self-assembled nanoparticles in drug delivery. Polymers (Basel), 2018, 10(3): 235. DOI:10.3390/polym10030235 |
| [11] | Chopra S, Mahdi S, Kaur J, et al. Advances and potential applications of chitosan derivatives as mucoadhesive biomaterials in modern drug delivery. J Pharm Pharmacol, 2006, 58(8): 1021-1032. |
| [12] | Arnaud TMS, De Barros Neto B, Diniz FB. Chitosan effect on dental enamel de-remineralization: an in vitro evaluation. J Dent, 2010, 38(11): 848-852. DOI:10.1016/j.jdent.2010.06.004 |
| [13] | Ruan QC, Zhang YZ, Yang XD, et al. An amelogenin-chitosan matrix promotes assembly of an enamel-like layer with a dense interface. Acta Biomater, 2013, 9(7): 7289-7297. DOI:10.1016/j.actbio.2013.04.004 |
| [14] | Oliveira JM, Rodrigues MT, Silva SS, et al. Novel hydroxyapatite/chitosan bilayered scaffold for osteochondral tissue-engineering applications: Scaffold design and its performance when seeded with goat bone marrow stromal cells. Biomaterials, 2006, 27(36): 6123-6137. DOI:10.1016/j.biomaterials.2006.07.034 |
| [15] | Abinaya B, Prasith TP, Ashwin B, et al. Chitosan in surface modification for bone tissue engineering applications. Biotechnol J, 2019, 14(12): e1900171. DOI:10.1002/biot.201900171 |
| [16] | Ganno T, Yamada S, Ohara N, et al. Early gene expression analyzed by cDNA microarray and real-time PCR in osteoblasts cultured with chitosan monomer. J Biomed Mater Res A, 2007, 82(1): 188-194. |
| [17] | Wang WQ, Meng QY, Li Q, et al. Chitosan derivatives and their application in biomedicine. Int J Mol Sci, 2020, 21(2): 487. DOI:10.3390/ijms21020487 |
| [18] | He GH, Chen X, Yin YH, et al. Synthesis, characterization and antibacterial activity of salicyloyl chitosan. Carbohyd Polym, 2011, 83(3): 1274-1278. DOI:10.1016/j.carbpol.2010.09.034 |
| [19] | Braz EMDA, Silva SCCCE, Da Silva DA, et al. Modified chitosan-based bioactive material for antimicrobial application: Synthesis and characterization. Int J Biol Macromol, 2018, 117: 640-647. DOI:10.1016/j.ijbiomac.2018.05.205 |
| [20] | Cai JP, Dang QF, Liu CS, et al. Preparation and characterization of N-benzoyl-O-acetyl-chitosan. Int J Biol Macromol, 2015, 77: 52-58. DOI:10.1016/j.ijbiomac.2015.03.007 |
| [21] | Sheik S, Sheik S, Nairy R, et al. Study on the morphological and biocompatible properties of chitosan grafted silk fibre reinforced PVA films for tissue engineering applications. Int J Biol Macromol, 2018, 116: 45-53. DOI:10.1016/j.ijbiomac.2018.05.019 |
| [22] | Liu CK, Wu YG, Zhao LY, et al. Preparation of acetylsalicylic acid-acylated chitosan as a novel polymeric drug for drug controlled release. Int J Biol Macromol, 2015, 78: 189-194. DOI:10.1016/j.ijbiomac.2015.03.063 |
| [23] | Shariatinia Z. Carboxymethyl chitosan: properties and biomedical applications. Int J Biol Macromol, 2018, 120: 1406-1419. DOI:10.1016/j.ijbiomac.2018.09.131 |
| [24] | Muzzarelli RAA. Carboxymethylated chitins and chitosans. Carbohydr Polym, 1988, 8(1): 1-21. DOI:10.1016/0144-8617(88)90032-X |
| [25] | Burr SJ, Williams PA, Ratcliffe I. Synthesis of cationic alkylated chitosans and an investigation of their rheological properties and interaction with anionic surfactant. Carbohydr Polym, 2018, 201: 615-623. DOI:10.1016/j.carbpol.2018.08.105 |
| [26] | Yang TC, Chou CC, Li CF. Antibacterial activity of N-alkylated disaccharide chitosan derivatives. Int J Food Microbiol, 2005, 97(3): 237-245. DOI:10.1016/S0168-1605(03)00083-7 |
| [27] | Wang XY, Guan J, Zhuang XP, et al. Exploration of blood coagulation of N-alkyl chitosan nanofiber membrane in vitro. Biomacromolecules, 2018, 19(3): 731-739. DOI:10.1021/acs.biomac.7b01492 |
| [28] | Chen ZH, Yao XP, Liu L, et al. Blood coagulation evaluation of N-alkylated chitosan. Carbohydr Polym, 2017, 173: 259-268. DOI:10.1016/j.carbpol.2017.05.085 |
| [29] | Kulkarni AD, Patel HM, Surana SJ, et al. N, N, N-trimethyl chitosan: an advanced polymer with myriad of opportunities in nanomedicine. Carbohydr Polym, 2017, 157: 875-902. DOI:10.1016/j.carbpol.2016.10.041 |
| [30] | Jin Z, Li D, Dai CX, et al. Response of live newcastle disease virus encapsulated in N-2-hydroxypropyl dimethylethyl ammonium chloride chitosan nanoparticles. Carbohydr Polym, 2017, 171: 267-280. DOI:10.1016/j.carbpol.2017.05.022 |
| [31] | Cai JP, Dang QF, Liu CS, et al. Preparation, characterization and antibacterial activity of O-acetyl-chitosan-N-2-hydroxypropyl trimethyl ammonium chloride. Int J Biol Macromol, 2015, 80: 8-15. DOI:10.1016/j.ijbiomac.2015.05.061 |
| [32] | Costa EM, Silva S, Madureira AR, et al. A comprehensive study into the impact of a chitosan mouthwash upon oral microorganism's biofilm formation in vitro. Carbohydr Polym, 2014, 101: 1081-1086. DOI:10.1016/j.carbpol.2013.09.041 |
| [33] | Costa EM, Silva S, Costa MR, et al. Chitosan mouthwash: toxicity and in vivo validation. Carbohydr Polym, 2014, 111: 385-392. DOI:10.1016/j.carbpol.2014.04.046 |
| [34] | Carvalho TS, Lussi A. Combined effect of a fluoride-, stannous- and chitosan-containing toothpaste and stannous-containing rinse on the prevention of initial enamel erosion-abrasion. J Dent, 2014, 42(4): 450-459. DOI:10.1016/j.jdent.2014.01.004 |
| [35] | Wu LF, Li F, Morrow BR, et al. A novel antimicrobial and remineralizing toothpaste containing CaCl2/chitosan microspheres. Am J Dent, 2018, 31(3): 149-154. |
| [36] | Resende AHM, Farias JM, Silva DDB, et al. Application of biosurfactants and chitosan in toothpaste formulation. Colloids Surf B Biointerf, 2019, 181: 77-84. DOI:10.1016/j.colsurfb.2019.05.032 |
| [37] | Ren Q, Ding LJ, Li ZC, et al. Chitosan hydrogel containing amelogenin-derived peptide: Inhibition of cariogenic bacteria and promotion of remineralization of initial caries lesions. Arch Oral Biol, 2019, 100: 42-48. DOI:10.1016/j.archoralbio.2019.02.004 |
| [38] | 樊明文. 牙体牙髓病学. 4版. 北京: 人民卫生出版社, 2012. Fan MW. Cariology, Endodontology and Operative Dentistry. 4th Edition. Beijing: People's Medical Publishing House, 2012 (in Chinese). |
| [39] | Franca JR, De Luca MP, Ribeiro TG, et al. Propolis-based chitosan varnish: drug delivery, controlled release and antimicrobial activity against oral pathogen bacteria. BMC Complement Altern Med, 2014, 14: 478. DOI:10.1186/1472-6882-14-478 |
| [40] | Farias JM, Stamford TCM, Resende AHM, et al. Mouthwash containing a biosurfactant and chitosan: an eco-sustainable option for the control of cariogenic microorganisms. Int J Biol Macromol, 2019, 129: 853-860. DOI:10.1016/j.ijbiomac.2019.02.090 |
| [41] | Ashrafi B, Rashidipour M, Marzban A, et al. Mentha piperita essential oils loaded in a chitosan nanogel with inhibitory effect on biofilm formation against S. mutans on the dental surface. Carbohydr Polym, 2019, 212: 142-149. DOI:10.1016/j.carbpol.2019.02.018 |
| [42] | Samprasit W, Kaomongkolgit R, Sukma M, et al. Mucoadhesive electrospun chitosan-based nanofibre mats for dental caries prevention. Carbohydr Polym, 2015, 117: 933-940. DOI:10.1016/j.carbpol.2014.10.026 |
| [43] | He JK, Bao YJ, Li J, et al. Nanocomplexes of carboxymethyl chitosan/amorphous calcium phosphate reduce oral bacteria adherence and biofilm formation on human enamel surface. J Dent, 2019, 80: 15-22. DOI:10.1016/j.jdent.2018.11.003 |
| [44] | Kim DA, Lee JH, Jun SK, et al. Sol-gel-derived bioactive glass nanoparticle-incorporated glass ionomer cement with or without chitosan for enhanced mechanical and biomineralization properties. Dent Mater, 2017, 33(7): 805-817. DOI:10.1016/j.dental.2017.04.017 |
| [45] | Zhang J, Lynch RJM, Watson TF, et al. Chitosan-bioglass complexes promote subsurface remineralisation of incipient human carious enamel lesions. J Dent, 2019, 84: 67-75. DOI:10.1016/j.jdent.2019.03.006 |
| [46] | Huang ZH, Qi YP, Zhang K, et al. Use of experimental-resin-based materials doped with carboxymethyl chitosan and calcium phosphate microfillers to induce biomimetic remineralization of caries-affected dentin. J Mech Behav Biomed Mater, 2019, 89: 81-88. DOI:10.1016/j.jmbbm.2018.09.008 |
| [47] | Ren Q, Li ZC, Ding LJ, et al. Anti-biofilm and remineralization effects of chitosan hydrogel containing amelogenin-derived peptide on initial caries lesions. Regen Biomater, 2018, 5(2): 69-76. DOI:10.1093/rb/rby005 |
| [48] | Stenhagen ISR, Rukke HV, Dragland IS, et al. Effect of methacrylated chitosan incorporated in experimental composite and adhesive on mechanical properties and biofilm formation. Eur J Oral Sci, 2019, 127(1): 81-88. DOI:10.1111/eos.12584 |
| [49] | Aguilar A, Zein N, Harmouch E, et al. Application of chitosan in bone and dental engineering. Molecules, 2019, 24(16): 3009. DOI:10.3390/molecules24163009 |
| [50] | 黄定明, 陆倩, 廖茜, 等. 活髓保存治疗之惑及解决之道. 华西口腔医学杂志, 2017, 35(3): 227-231. |
| [51] | Zhu NX, Chatzistavrou X, Ge LH, et al. Biological properties of modified bioactive glass on dental pulp cells. J Dent, 2019, 83: 18-26. DOI:10.1016/j.jdent.2019.01.017 |
| [52] | Chen Z, Cao SS, Wang HR, et al. Biomimetic remineralization of demineralized dentine using scaffold of CMC/ACP nanocomplexes in an in vitro tooth model of deep caries. PLoS ONE, 2015, 10(1): e0116553. DOI:10.1371/journal.pone.0116553 |
| [53] | Jazayeri HE, Lee SM, Kuhn L, et al. Polymeric scaffolds for dental pulp tissue engineering: a review. Dent Mater, 2020, 36(2): e47-e58. DOI:10.1016/j.dental.2019.11.005 |
| [54] | Sana FA, Yurtsever M?, Bayrak GK, et al. Spreading, proliferation and differentiation of human dental pulp stem cells on chitosan scaffolds immobilized with RGD or fibronectin. Cytotechnology, 2017, 69(4): 617-630. DOI:10.1007/s10616-017-0072-9 |
| [55] | Bordini EAF, Cassiano FB, Silva ISP, et al. Synergistic potential of 1α, 25-dihydroxyvitamin D3 and calcium-aluminate-chitosan scaffolds with dental pulp cells. Clin Oral Investig, 2020, 24(2): 663-674. DOI:10.1007/s00784-019-02906-z |
| [56] | Slots J. Periodontitis: facts, fallacies and the future. Periodontology 2000, 2017, 75(1): 7-23. DOI:10.1111/prd.12221 |
| [57] | Arancibia R, Maturana C, Silva D, et al. Effects of chitosan particles in periodontal pathogens and gingival fibroblasts. J Dent Res, 2013, 92(8): 740-745. DOI:10.1177/0022034513494816 |
| [58] | Costa EM, Silva S, Pina C, et al. Evaluation and insights into chitosan antimicrobial activity against anaerobic oral pathogens. Anaerobe, 2012, 18(3): 305-309. DOI:10.1016/j.anaerobe.2012.04.009 |
| [59] | ?zdo?an AI, ?larslan YD, K?semehmeto?lu K, 等. In vivo evaluation of chitosan based local delivery systems for atorvastatin in treatment of periodontitis. Int J Pharm, 2018, 550(1/2): 470-476. |
| [60] | Gjoseva S, Geskovski N, Sazdovska SD, et al. Design and biological response of doxycycline loaded chitosan microparticles for periodontal disease treatment. Carbohydr Polym, 2018, 186: 260-272. DOI:10.1016/j.carbpol.2018.01.043 |
| [61] | Martin V, Ribeiro IAC, Alves MM, et al. Understanding intracellular trafficking and anti-inflammatory effects of minocycline chitosan-nanoparticles in human gingival fibroblasts for periodontal disease treatment. Int J Pharm, 2019, 572: 118821. DOI:10.1016/j.ijpharm.2019.118821 |
| [62] | Kilicarslan M, Ilhan M, et al. Preparation and evaluation of clindamycin phosphate loaded chitosan/alginate polyelectrolyte complex film as mucoadhesive drug delivery system for periodontal therapy. Eur J Pharm Sci, 2018, 123: 441-451. DOI:10.1016/j.ejps.2018.08.007 |
| [63] | Lee YM, Park YJ, Lee SJ, et al. Tissue engineered bone formation using chitosan/tricalcium phosphate sponges. J Periodontol, 2000, 71(3): 410-417. DOI:10.1902/jop.2000.71.3.410 |
| [64] | Yan XZ, Van Den Beucken JJJP, Yuan C, et al. Spheroid formation and stemness preservation of human periodontal ligament cells on chitosan films. Oral Dis, 2018, 24(6): 1083-1092. DOI:10.1111/odi.12855 |
| [65] | Park CJ, Clark SG, Lichtensteiger CA, et al. Accelerated wound closure of pressure ulcers in aged mice by chitosan scaffolds with and without bFGF. Acta Biomater, 2009, 5(6): 1926-1936. DOI:10.1016/j.actbio.2009.03.002 |
| [66] | Singh R, Shitiz K, Singh A. Chitin and chitosan: biopolymers for wound management. Int Wound J, 2017, 14(6): 1276-1289. DOI:10.1111/iwj.12797 |
| [67] | Jiang ZW, Han BQ, Li H, et al. Preparation and anti-tumor metastasis of carboxymethyl chitosan. Carbohydr Polym, 2015, 125: 53-60. DOI:10.1016/j.carbpol.2015.02.039 |
| [68] | Gorzelanny C, P?ppelmann B, Strozyk E, et al. Specific interaction between chitosan and matrix metalloprotease 2 decreases the invasive activity of human melanoma cells. Biomacromolecules, 2007, 8(10): 3035-3040. DOI:10.1021/bm0703214 |
| [69] | Bano I, Arshad M, Yasin T, et al. Chitosan: a potential biopolymer for wound management. Int J Biol Macromol, 2017, 102: 380-383. DOI:10.1016/j.ijbiomac.2017.04.047 |
| [70] | Yang Y, Yang SB, Wang YG, et al. Bacterial inhibition potential of quaternised chitosan-coated VICRYL absorbable suture: An in vitro and in vivo study. J Orthop Translat, 2017, 8: 49-61. DOI:10.1016/j.jot.2016.10.001 |
| [71] | Sarkar S, Prashanth NT, Shobha ES, et al. Efficacy of platelet rich fibrin versus chitosan as a hemostatic agent following dental extraction in patients on antiplatelet therapy. J Oral Biol Craniofac Res, 2019, 9(4): 336-339. DOI:10.1016/j.jobcr.2019.07.003 |
| [72] | Boecker A, Daeschler SC, Kneser U, et al. Relevance and recent developments of chitosan in peripheral nerve surgery. Front Cell Neurosci, 2019, 13: 104. |
| [73] | Meyer C, Stenberg L, Gonzalez-Perez F, et al. Chitosan-film enhanced chitosan nerve guides for long-distance regeneration of peripheral nerves. Biomaterials, 2016, 76: 33-51. DOI:10.1016/j.biomaterials.2015.10.040 |
| [74] | Przekora A, Palka K, Ginalska G. Biomedical potential of chitosan/HA and chitosan/β-1, 3- glucan/HA biomaterials as scaffolds for bone regeneration—A comparative study. Mater Sci Eng C, 2016, 58: 891-899. DOI:10.1016/j.msec.2015.09.046 |
| [75] | Fathi M, Majidi S, Zangabad PS, et al. Chitosan-based multifunctional nanomedicines and theranostics for targeted therapy of cancer. Med Res Rev, 2018, 38(6): 2110-2136. DOI:10.1002/med.21506 |
| [76] | Muanprasat C, Chatsudthipong V. Chitosan oligosaccharide: biological activities and potential therapeutic applications. Pharmacol Ther, 2017, 170: 80-97. DOI:10.1016/j.pharmthera.2016.10.013 |
| [77] | Jiang ZW, Han BQ, Li H, et al. Carboxymethyl chitosan represses tumor angiogenesis in vitro and in vivo. Carbohydr Polym, 2015, 129: 1-8. DOI:10.1016/j.carbpol.2015.04.040 |
| [78] | Wang X, Tang H, Wang CZ, et al. phenylboronic acid-mediated tumor targeting of chitosan nanoparticles. Theranostics, 2016, 6(9): 1378-1392. DOI:10.7150/thno.15156 |
| [79] | Yang CX, Gao S, Dagn?s-Hansen F, Jakobsen M and Kjems J. Impact of PEG chain length on the physical properties and bioactivity of pegylated chitosan/sirna nanoparticles in vitro and in vivo. ACS Appl Mater Interfaces, 2017, 9(14): 12203-12216. DOI:10.1021/acsami.6b16556 |
| [80] | Lin M, Wang DD, Liu SW, et al. Cupreous complex-loaded chitosan nanoparticles for photothermal therapy and chemotherapy of oral epithelial carcinoma. ACS Appl Mater Interfaces, 2015, 7(37): 20801-20812. DOI:10.1021/acsami.5b05866 |
