
 , 仇华吉
, 仇华吉

中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069
收稿日期:2020-08-03;接收日期:2020-11-16
基金项目:国家自然科学基金(Nos. 32072855, U20A2060),黑龙江省自然科学基金(No. QC2018035) 资助
摘要:核内小体是定位于细胞核内的无膜结构,为多蛋白-RNA复合体,通过招募相关蛋白参与基因转录、RNA剪切、表观遗传调控、肿瘤发生与抑制及抗病毒防御等多种细胞活动。明确核内小体蛋白的形成过程、功能和调控机制对研究相关疾病与病毒-宿主作用机制均具有重要意义。以下以几种核内小体蛋白为例,对核内小体的形成方式、结构与功能进行综述,并重点阐述其在抗病毒感染中的重要作用,期望为宿主抗病毒免疫机制研究提供一个新的靶标
关键词:核内小体装配机制功能抗病毒应答
Complex structures and diverse functions of nuclear bodies: a review
Xinyuan Liu, Lian-Feng Li

 , Hua-Ji Qiu
, Hua-Ji Qiu

State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Science, Harbin 150069, Heilongjiang, China
Received: August 3, 2020; Accepted: November 16, 2020
Supported by: National Natural Science Foundation of China (Nos. 32072855, U20A2060), Natural Science Foundation of Heilongjiang Province of China (No. QC2018035)
Corresponding author: Lian-Feng Li. Tel: +86-451-51051711; E-mail: lilianfeng@caas.cn;
Hua-Ji Qiu. Tel: +86-451-51051708; E-mail: qiuhuaji@caas.cn.
Abstract: Nuclear bodies are membrane-free nuclear substructures that are localized in the mammalian nuclear matrix region. They are multiprotein complexes that recruit other proteins to participate in various cellular activities, such as transcription, RNA splicing, epigenetic regulation, tumorigenesis and antiviral defense. It is of great significance to clarify the functions and regulatory mechanisms of nuclear bodies to probe related diseases and virus-host interactions. This review takes several nuclear bodies associated proteins as examples, summarizes the formation process, structure and functions of nuclear bodies, and focuses on their important roles in antiviral infection. It is expected to provide new insight into host antiviral mechanisms.
Keywords: nuclear bodiesassemblyfunctionantiviral response
核内小体(Nuclear bodies,NBs) 是定位于哺乳动物细胞核基质区域的、无包膜的细胞核亚结构,在显微镜下可见,无固定形态。核内小体的形成是一个动态的过程,可利用荧光漂白恢复技术(Fluorescence recovery after photobleaching,FRAP) 证明其不断地与周围核质交换成分[1],利用这一特点可将核内小体与核质内其他蛋白聚集体进行区分[2]。细胞内主要的核内小体有核仁(Nucleolus)、早幼粒细胞白血病核内小体(Promyelocytic leukemia nuclear body,PML nuclear body)、卡哈尔小体(Cajal body)、核散斑体(Nuclear speckle)、旁斑(Paraspeckle)、多梳小体(Polycomb body)、核应激小体(Nuclear stress body,nSB) 及Gem小体等。
核内小体在空间上是细胞核内一个独立的区域,与细胞质内细胞器进行的代谢过程相似,核内小体形成的区域聚集着多种物质以促进某些生物反应更加高效地进行,在不同生物学过程和应激条件下动态地产生应答。核内小体可与非编码RNA (Non-coding RNA,ncRNA) 和染色质修饰因子等分子协同修饰多种蛋白质和RNA,参与装配核糖核蛋白(Ribonucleoprotein,RNP) 复合体以及调节基因表达。
核内小体成分众多、形成复杂、功能多样,目前已对部分核内小体的关键成分进行了研究,结果显示核内小体在细胞的基因表达调控及抗病毒感染等方面发挥着重要作用。本文主要介绍核内小体的形成过程、结构、功能及其最新的研究进展,并重点介绍了核内小体的抗病毒作用。
1 核内小体的形成核内小体的形成有两个重要元素,一是通过大分子相互作用形成液-液两相分离(犹如油跟水),二是形成高分辨率显微镜下可明确分辨形态的分子构造。尽管核内小体不具备膜,但它仍能稳定地保持完整结构,这表明核内小体具有与其他膜结构细胞器不同的组装和维持稳态的机制。厘清细胞装配、维持和调节核内小体的分子机制有助于明确核内小体在不同代谢环境中的生物学功能。
1.1 核内小体是一个稳定的动态结构核内小体是蛋白质-RNA复合体,不具备膜结构,且部分成分弥散地分布于染色质间,这为核内小体与周围核质进行成分交换提供了便利[2]。旁斑中心蛋白PSP1 (Paraspeckle component 1)、p54nrb (54-kDa nuclear RNA- and DNA-binding protein)和PSF (Polypyrimidine tract-binding protein-associated-splicing factor) 均具有可移动部分,这些可移动部分的荧光漂白恢复半衰期约为几秒,较周围核质成分的荧光漂白恢复半衰期长。旁斑蛋白较核质成分延迟移动的现象在核散斑体的SRSF1 (Serine/arginine-rich splicing factor 1) 蛋白和核仁的纤维蛋白中发生[3-4],这也体现了旁斑中复杂的蛋白-蛋白及蛋白-RNA相互作用关系,这种快速且自由的成分交换以及核内小体中复杂的相互作用关系使得核内小体动态地保持稳定结构。
目前,已提出3种核内小体装配机制[1-2]:一是随机装配(图 1A),在此机制中,核内小体成分的装配无严格顺序且可通过多种通路实现;二是顺序装配(图 1B),此装配机制遵照严格的顺序,其形成通路也相对固定;三是“播种”装配(图 1C),核内小体成分中的蛋白或RNA作为装配的“种子”诱发核内小体装配起始,通过调节不同环境刺激、代谢环境下“种子”蛋白水平以快速调节核内小体,为细胞提供了一种可快速调节核内小体定位、大小、数量及活性的途径,从而在多个水平上达到调节基因表达的目的。
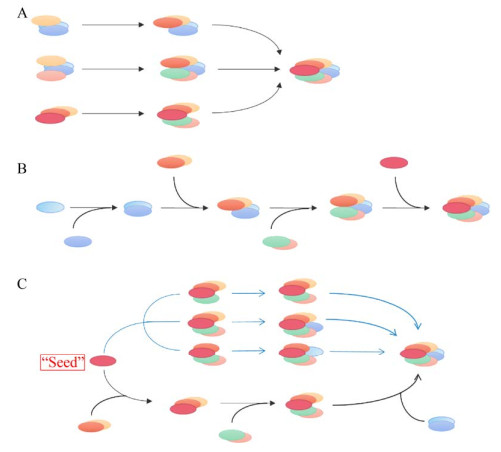 |
| 图 1 核内小体装配机制(改编自参考文献[6]) Fig. 1 Mechanisms of nuclear body assembly (adapted from reference [6]). (A) Stochastic assembly model. A nuclear body can take place via a stochastic assembly mechanism in which multiple pathways can be followed. (B) Ordered assembly model. A nuclear body can take place via a hierarchically ordered mechanism in which only one or limited number of pathways is followed. (C) Seeding assembly model. RNAs or proteins serve as seeds (shown in red) to nucleate the formation of a nuclear body. The subsequent steps after the initial seeding event could be either stochastic or ordered. |
| 图选项 |
另外,有研究表明,核内小体可通过液-液两相分离(Liquid-liquid phase separation,LLPS) 的形式产生。LLPS是由具有低复杂性结构域(LCDs) 的蛋白实现的,LCDs缺乏明确的三维结构,为多价分子间相互作用如静电作用、Pi堆积和疏水作用提供了基础[5]。
1.2 核内小体形成受到精细调节在RNA诱导装配机制中,转录出的RNA为调节核内小体定位、大小及数量的平台。旁斑的形成和定位均位于men ε/β基因位点附近,men ε/β转录的非编码RNA可作为成核剂,激活转录对于维持核内小体是必需的,且核内小体的大小与转录产物数量相关[7]。核应激小体是由热休克或其他细胞应激因素诱发形成的核内小体,热休克转录因子1 (Heat shock transcription factor 1,HSF1)重新分布引发CBP/p300聚集、染色质重塑、RNA聚合酶Ⅱ聚集以及转录激活,转录形成初期SatⅢ RNA诱发核应激小体装配[8-9]。
蛋白也可诱发核内小体装配。早幼粒细胞白血病蛋白(PML蛋白) 是PML核内小体形成的基础,处于抑制状态的pml基因不能表达蛋白,故不能形成PML核内小体[10-11]。SUMO (Small ubiquitin-related modifier) 化的PML蛋白才能招募Sp110 (Speckled 110 kDa) 和DAXX (Death domain-associated protein 6) 成分诱发核内小体形成[11]。另外,在病毒感染和细胞衰老条件下,pml基因表达上调且PML核内小体的数目增多、体积变大[12]。
综上所述,核内小体中的蛋白质和RNA成分决定了核内小体的完整性,然而核内小体与周围核质快速的成分交换及短暂的相互作用使得核内小体这一稳定的大分子复合体处于动态状态,并随时准备对某些应激因素和细胞信号进行应答。
2 核内小体的结构核内小体由多种核内小体蛋白组成,而这些核内小体蛋白又具有相似的结构域。PML蛋白有7种亚型[13],各亚型均具有相同的N端结构,即1个环形结构域(RING domain) (图 2A)、2个富含半胱氨酸-组氨酸的锌指结构域及1个α螺旋卷曲结构(α coiled-coil domain),以上几种结构域组成1个RBCC/TRIM (RING,B-box,coiled-coil/ tripartite motif) 结构域[14],另外,PML蛋白还具有1个核定位信号区域(Nuclear localization signal,NLS) (图 3A)。RBCC/TRIM结构域对于PML蛋白在核内小体中的定位十分重要,也影响着核内小体的生长、细胞凋亡及抗病毒防御特性。RING结构域呈四聚体结构(图 2B),可调节PML蛋白与其他蛋白间的相互作用,进而调节核内小体的功能,影响肿瘤发生、细胞凋亡等过程[15-16]。三氧化二砷可以靶向锌指结构域的B2盒,加速PML核内小体的形成。α螺旋卷曲结构则是与锌指结构域的B2盒相邻的结构域。PML蛋白可发生SUMO化(图 2C)、磷酸化和乙酰化等多种翻译后修饰,如SUMO化修饰可发生在65Lys和160Lys,SUMO分子与其发生共价结合,调节PML蛋白与其他蛋白的相互作用以及核内小体的形成。
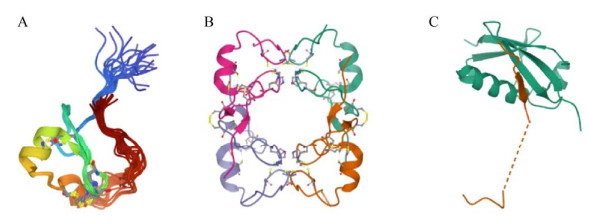 |
| 图 2 PML蛋白主要结构空间构象[24-26] Fig. 2 Main structures of PML protein. (A) The RING domain of PML. (B) Crystal structure of PML RING tetramer. (C) Crystal structure of SUMO1 in complex with PML. |
| 图选项 |
 |
| 图 3 PML核内小体主要蛋白结构域 Fig. 3 Main protein domains of PML nuclear body. (A) PML. (B) Sp100. (C) Sp110. (D) Sp140. (E) DAXX. B-box/RING/PHD: types of Zinc finger. NLS: Nuclear localization signal. HMG: DNA binding site. SAND: Sp-100-AIRE-NucP41/75-DEAF1 domain. BRD: Bromodomain. |
| 图选项 |
Sp家族蛋白通常具有NLS、Caspase激活及招募结构域(Caspase recruitment domain,CARD)、Sp-100-AIRE-NucP41/75-DEAF1结构域(SAND)、植物同源异型结构域(Plant homeodomain,PHD)及溴结构域(Bromodomain,BRD) (图 3B-D)。其中,PHD和BRD两个结构域位置接近,仅由不足30个氨基酸相连,因而形成了一个结构-功能单元,发挥多样的功能[17-19]。PHD-BRD盒可识别多种组蛋白翻译后修饰的组合,如赖氨酸的甲基化和乙酰化修饰。PHD-BRD盒同时也是SUMO化修饰位点,SUMO化是一种动态的翻译后修饰过程,参与多种核内生物学过程,如基因表达、基因组稳定[20]、DNA损伤修复[21]、蛋白转运[22]以及细胞周期调控[20]。在对Kap/TRIM28的研究中发现,BRD发生SUMO化修饰后也可促进Kap/TRIM28介导转录后沉默[23]。
3 核内小体的功能核内小体通过聚集细胞内一系列生物学过程所需的蛋白或RNA,并作为反应位点,以有效地促进某些生物学反应。核内小体由多种蛋白和RNA组成,这些蛋白或RNA在核内小体的形成和功能上发挥着重要作用,下面从转录调控、疾病诊断、抗凋亡及抗病毒等方面概述其功能。
3.1 转录调控作用在人类基因组中,只有不到2%的序列为蛋白质编码基因,且在大多数高等真核生物中,蛋白质编码基因的数量是相似的。显然,发育过程的差异由基因表达调控决定,这种调控可通过细胞核内分子的动态变化得以促进或抑制。
核仁是rDNA转录、前体rRNA加工和修饰以及前体核糖体组装和成熟的位点[27]。核仁内组蛋白赖氨酸去甲基化酶(Histone lysine demethylase,PHF8) 和赖氨酸特异性去甲基化酶2B (Lysine- specific demethylase 2B,KDM2B) 在调节rDNA的表观遗传状态方面发挥作用[28-29]。卡哈尔小体可以招募大量的短链非编码RNA,包括小核RNA (Small nuclear RNA,snRNA) 和小核仁RNA (Small nucleolar RNA,snoRNA),这两种RNA在核糖体RNA (Ribosomal RNA,rRNA) 的形成过程中发挥作用。卡哈尔小体的主要蛋白Coilin在体内、体外均可与初期snRNA结合,进而促进卡哈尔小体与snRNA的结合[30-31]。研究证实,卡哈尔小体与snRNA的加工修饰以及功能性snRNP的装配相关,抑制snRNP二聚体或三聚体形成,引起snRNP装配中间体在卡哈尔小体内聚集;而抑制snRNP装配的最后一步,使得原本不存在卡哈尔小体的细胞中形成了此核内小体,且这些新形成的核内小体会招募大量不完整的snRNP。因此,卡哈尔小体可作为一个调节和监测snRNP在胞核内形成过程的结构。
3.2 疾病的分子标志蛋白质组学的研究不仅为生命活动规律提供了物质基础,也为多种疾病的诊断和治疗提供理论依据。通过比较分析正常和病理个体间的蛋白质组,可以找到某些与疾病相关的特异性蛋白质作为疾病早期诊断的分子标志。目前,Gem小体的功能尚不清楚,仅知道其成分是运动神经元生存蛋白(Survival motor neuron protein,SMN) 和Gem相关蛋白(Gem-associated protein,Gemin),它们也是胞质SMN复合体的成分[32]。缺失SMN蛋白导致运动神经元退化以及脊髓性肌萎缩症(Spinal muscular atrophy,SMA),且SMA患者的细胞内也缺乏Gem小体,而在另外一种运动神经元退化疾病——肌萎缩性脊髓侧索硬化症(Amyotrophic lateral sclerosis,ALS) 中也发现了Gem小体受到破坏的现象[32]。基于这些发现,推测Gem小体与运动神经元退化的疾病相关联。
3.3 细胞内抗凋亡作用旁斑是一种由应激引起的核内小体,40多种RNA结合蛋白结合在支架长链非编码RNA (Long non-coding RNA,lncRNA)——核旁斑组装转录本1 (Nuclear paraspeckle assembly transcript 1,NEAT1) 上,形成了此核内小体[33]。NEAT1与多种癌症相关,它可以促进应激后的DNA修复过程,在早期前列腺癌中也作为基因调节因子调节细胞增殖,两项研究表明,核剪切因子SFPQ (Splicing factor,proline- and glutamine-rich) 与启动子结合,进而影响了一些重要的免疫应答基因的表达[34-35],这也表明,NEAT1/旁斑是一个潜在的治疗靶点。
3.4 核内小体在病毒感染中的作用核内小体相关蛋白,如PML蛋白、Sp家族蛋白和p53等,参与DNA修复、细胞衰老、应激以及抗病毒免疫应答等多种细胞过程[36],故核内小体也常成为病毒蛋白作用的靶标。研究证实,核内小体在宿主抗病毒天然免疫应答过程中发挥重要作用,可作为病毒基因表达的抑制因子,也是Ⅰ型干扰素信号通路的调节因子,核内小体中部分蛋白如PML蛋白、Sp家族蛋白、ISG20 (Interferon- stimulated gene 20-kDa protein) 及PA28 (Proteasome activator 28) 等在干扰素作用下表达上调[37]。
Ⅰ型干扰素(IFN-α和IFN-β)、Ⅱ型干扰素(IFN-γ) 均可以刺激核质内和核内小体内PML蛋白表达上调。在pml基因启动子中包含干扰素刺激应答元件(Interferon-stimulated response element,ISRE) 和IFN-γ活化序列(Interferon-gamma-activated sequence,GAS),与其他包含ISRE和GAS序列元件的基因不同,pml基因中这两个元件位于第一外显子的非翻译区[38]。缺失pml启动子中的ISRE序列阻断了Ⅰ型、Ⅱ型干扰素应答反应,也证明了pml基因是Ⅰ型和Ⅱ型干扰素的靶基因。同样地,Sp家族蛋白如Sp100、Sp110和Sp140等蛋白也是干扰素的靶基因。此外,PA28 (11S调节因子) 是一种IFN-γ诱导的蛋白酶体激活蛋白,参与MHC-Ⅰ类抗原的递呈。IFN-γ处理细胞后,PML核内小体中的PA28蛋白数量及大小均有所增加[39]。PA28在PML核内小体中的招募机制尚不明确,其在PML核内小体中的作用可能与装配或激活免疫蛋白酶体相关。isg20为干扰素刺激基因,ISG20蛋白主要定位于细胞核内且与PML核内小体有紧密的联系。另外,ISG20也是一种干扰素诱导的RNA酶,过表达ISG20可以拮抗某些RNA病毒的感染,这提示ISG20可能参与一种独特的干扰素抗病毒应答机制。
有研究表明,过表达PML蛋白可抑制水泡性口炎病毒(Vesicular stomatitis virus,VSV) 和流感病毒的感染[40]。PML蛋白对VSV的mRNA转录及蛋白合成均有抑制作用,VSV完全在细胞质中复制,流感病毒则是在细胞核进行复制和转录,其对VSV和流感病毒复制的抑制程度取决于PML蛋白表达水平以及病毒的感染复数(MOI),在MOI=0.1时其对病毒复制的抑制程度最大。在鼠源细胞中,PML蛋白在定位和抗病毒作用方面与Mx1蛋白十分相似,这些结果提示,PML蛋白可能通过修饰细胞内其他蛋白间接地发挥抗病毒防御作用。
此外,过表达PML蛋白对人类泡沫病毒(Human foamy virus,HFV) 的感染也有抵御作用。过表达PML蛋白对HFV复制的抑制程度与1 000 U/mL的IFN-α作用效果相当,HFV的DNA复制、mRNA转录、蛋白合成均受到抑制,且反转录酶活性降低。定位于核内的PML蛋白,利用其RING结构域抑制mRNA转录。PML蛋白还可以通过物理作用与HFV Tas蛋白N端结合以抑制Tas与HFV长末端重复序列(Long terminal repeat,LTR) 和内部启动子(Internal promoter,IP) 的相互作用,进而削弱了Tas刺激的病毒转录,证实PML蛋白是第一个通过物理作用抑制病毒转录激活因子功能的干扰素诱导蛋白[41]。
PML核内小体与其他分子共定位对于抑制病毒感染也具有重要意义。Smc5/6 (Structural maintenance of chromosomes protein 5/6) 是一种内在的抗病毒限制性因子,当其定位到PML核内小体时,会抑制乙型肝炎病毒(Hepatitis B virus,HBV) 基因组转录。缺失PML蛋白和Sp100蛋白会改变Smc6在核内的分布,在病毒X蛋白(HBx)不存在的情况下诱发HBV转录;而在HBx存在时,PML核内小体组分并不限制共价、闭合、环状DNA分子(Covalently closed circular DNA,cccDNA) 转录,仅作为促进Smc5/6定位和发挥功能的支架[42]。
然而,病毒为了在细胞内存活并增殖,也进化出了相当多的方法来对抗机体的抗病毒作用。寨卡病毒(Zika virus,ZIKV) 感染会激活宿主芳香烃受体(Aryl hydrocarbon receptor,AHR),AHR抑制NF-κB对pml基因启动子的激活,降低了PML蛋白的表达水平,进而抑制了PML蛋白驱动的机体抗病毒天然免疫应答[43]。有研究表明,Ⅰ型单纯疱疹病毒(Herpes simplex virus 1,HSV-1)、人巨细胞病毒(Human cytomegalovirus,HCMV)、猿猴空泡病毒40 (Simian vacuolating virus 40,SV40) 和腺病毒5型(Adenovirus type 5,AdV5) 等,在感染初期阶段将PML核内小体作为靶标,引起核内小体部分蛋白的重组和降解[44-45]。爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV) 的Z-反式激活因子调节蛋白Zta是病毒生产性裂解感染宿主的关键分子,它也是破坏PML核内小体的“充分必要条件”[46-47],但它并不介导PML核内小体的降解;EBV破坏PML核内小体依靠其核抗原(Epstein-Barr nuclear antigen 1,EBNA1),它将细胞酪蛋白激酶2 (Casein kinase 2,CK2) 招募至PML核内小体,PML蛋白发生磷酸化,进而加速了泛素化及通过蛋白酶体途径降解的进程[48]。登革病毒(Dengue virus,DENV) 的NS5蛋白诱导PML核内小体降解,进而抑制宿主抗病毒反应[49]。
在调节HSV-1感染激活的宿主天然免疫过程中,PML蛋白发挥着双重功能。当病毒基因组(vDNA) 入核后,PML核内小体即捕获vDNA,导致病毒复制受阻;而随着病毒即早期蛋白ICP0表达,PML核内小体逐渐被降解,释放vDNA,进而激活HSV-1的裂解性复制[50]。
目前,有待证实的是,PML核内小体蛋白的聚集是否为其发挥抗病毒功能的基础,PML核内小体抑制病毒的一种策略是通过PML核内小体变大,包裹病毒颗粒,这表明PML核内小体可通过物理途径抑制病毒。当然,病毒为逃逸PML核内小体介导的天然免疫,也进化出了许多策略破坏核内小体,病毒与核内小体的关系及相互作用也说明了核内小体在宿主抗病毒防御机制中起着重要作用。
4 结语近年来,越来越多的研究证实,核内小体是调节核内生物学过程的一种高度动态性结构,核内小体在核内生物学过程中扮演着多样且重要的角色,核内小体参与转录调控、肿瘤发生、细胞凋亡及病毒感染等过程。对核内小体生物发生过程的研究表明,核内小体的组成与功能在分子生物学层面具有重要的意义,在诸如转录、应激、干扰素作用及病毒感染等不同的生物学条件下,核内小体招募细胞内其他蛋白,通过重新共定位并发生相互作用以发挥功能。另外,某些核内小体蛋白如PML、Sp110和Sp140等,也可通过与细胞内非编码RNA如lncRNA、微RNA (MicroRNA,miRNA) 等结合,间接地参与细胞内的生物学反应。
核内小体种类众多、组成复杂,针对核内小体生物学功能的研究才刚刚开始。目前,基础医学研究结果表明,PML核内小体的异常改变与多种肿瘤,尤其是早幼粒细胞白血病的发生关系密切;核散斑体和Gem小体与神经退行性病变相关。但对于其他核内小体的特性以及核内小体其他功能的研究仍较少。目前,关于核内小体抗动物病毒作用的研究几乎处于空白状态。关于核内小体抗病毒作用的猜想是多角度、多方面的,而核内小体装配过程、核内小体成分间相互作用及核内小体发挥不同生物学功能的具体分子机制尚需使用创新性策略予以揭示。
参考文献
| [1] | Mao YS, Sunwoo H, Zhang B, et al. Direct visualization of the co-transcriptional assembly of a nuclear body by noncoding RNAs. Nat Cell Biol, 2011, 13(1): 95-101. DOI:10.1038/ncb2140 |
| [2] | Matera AG, Izaguire-Sierra M, Praveen K, et al. Nuclear bodies: random aggregates of sticky proteins or crucibles of macromolecular assembly. Dev Cell, 2009, 17(5): 639-647. DOI:10.1016/j.devcel.2009.10.017 |
| [3] | Phair RD, Misteli T. High mobility of proteins in the mammalian cell nucleus. Nature, 2000, 404(6778): 604-609. DOI:10.1038/35007077 |
| [4] | Chen D, Huang S. Nucleolar components involved in ribosome biogenesis cycle between the nucleolus and nucleoplasm in interphase cells. J Cell Biol, 2001, 153(1): 169-176. DOI:10.1083/jcb.153.1.169 |
| [5] | Sawyer IA, Sturgill D, Dund RM, et al. Membraneless nuclear organelles and the search for phases within phases. Wiley Interdiscip Rev RNA, 2019, 10(2): e1514. DOI:10.1002/wrna.1514 |
| [6] | Mao YS, Zhang B, Spector DL. Biogenesis and function of nuclear bodies. Trends Genet, 2011, 27(8): 295-306. DOI:10.1016/j.tig.2011.05.006 |
| [7] | Nizami Z, Deryusheva S, Gall JG. The Cajal body and histone locus body. Cold Spring Harb Perspect Biol, 2010, 2(7): a000653. |
| [8] | Biamonti G, Vourc'h C. Nuclear stress bodies. Cold Spring Harb Perspect Biol, 2010, 2(6): a000695. |
| [9] | Jolly C, Lakhotia SC. Human SatⅢ and drosophila Hsr omega transcripts: a common paradigm for regulation of nuclear RNA processing in stressed cells. Nucleic Acids Res, 2006, 34(19): 5508-5514. DOI:10.1093/nar/gkl711 |
| [10] | Ascoli CA, Maul GG. Identification of a novel nuclear domain. J Cell Biol, 1991, 112(5): 785-795. DOI:10.1083/jcb.112.5.785 |
| [11] | Bernardi R, Pandolfi PP. Structure, dynamics and functions of promyelocytic leukaemia nuclear bodies. Nat Rev Mol Cell Biol, 2007, 8(12): 1006-1016. DOI:10.1038/nrm2277 |
| [12] | Lallemand-Breitenbach V, De Thé H. PML nuclear bodies. Cold Spring Harb Perspect Biol, 2010, 2(5): a000661. |
| [13] | Jensen K, Shiels C, Freemont PS. PML protein isoforms and the RBCC/TRIM motif. Oncogene, 2001, 20(49): 7223-7233. DOI:10.1038/sj.onc.1204765 |
| [14] | Li C, Peng Q, Wan X, et al. C-terminal motifs in PML protein isoforms critically regulate PML-NB formation. J Cell Sci, 2017, 130(20): 3496-3506. |
| [15] | Wang P, Benhenda S, Wu H, et al. RING tetramerization is required for nuclear body biogenesis and PML SUMOylation. Nat Commun, 2018, 9(1): 1277. DOI:10.1038/s41467-018-03498-0 |
| [16] | Hsu KS, Kao HY. PML: regulation and multifaceted function beyond tumor suppression. Cell Biosci, 2018, 8(1): 5. DOI:10.1186/s13578-018-0204-8 |
| [17] | Musselman CA, Lalonde ME, C?té J, et al. Perceiving the epigenetic landscape through histone readers. Nat Struct Mol Biol, 2012, 19(12): 1218-1227. DOI:10.1038/nsmb.2436 |
| [18] | Filippakopoulos P, Picaud S, Mangos M, et al. Histone recognition and large-scale structural analysis of the human bromodomain family. Cell, 2012, 149(1): 214-231. DOI:10.1016/j.cell.2012.02.013 |
| [19] | Sanchez R, Zhou MM. The role of human bromodomains in chromatin biology and gene transcription. Curr Opin Drug Discov Devel, 2009, 12(5): 659-665. |
| [20] | Eifler K, Vertegaal ACO. SUMOylation-mediated regulation of cell cycle progression and cancer. Trends Biochem Sci, 2015, 40(12): 779-793. DOI:10.1016/j.tibs.2015.09.006 |
| [21] | Jackson S, Durocher D. Regulation of DNA damage responses by ubiquitin and SUMO. Mol Cell, 2013, 49(5): 795-807. DOI:10.1016/j.molcel.2013.01.017 |
| [22] | Melchior F, Schergaut M, Pichler A. SUMO: ligases, isopeptidases and nuclear pores. Trends Biochem Sci, 2003, 28(11): 612-618. DOI:10.1016/j.tibs.2003.09.002 |
| [23] | Chen Z, Zang J, Whetstine J, et al. Structural insights into histone demethylation by JMJD2 family members. Cell, 2006, 125(4): 691-702. DOI:10.1016/j.cell.2006.04.024 |
| [24] | Huang SY, Chang CF, Fang PJ, et al. The RING domain of human promyelocytic leukemia protein (PML). J Biomol NMR, 2015, 61(2): 173-180. DOI:10.1007/s10858-015-9901-3 |
| [25] | Wang P, Benhenda S, Wu H, et al. RING tetramerization is required for nuclear body biogenesis and PML SUMOylation. Nat Commun, 2018, 9(1): 1277. DOI:10.1038/s41467-018-03498-0 |
| [26] | Cappadocia L, Mascle XH, Bourdeau V, et al. Structural and functional characterization of the phosphorylation-dependent interaction between PML and SUMO1. Structure, 2015, 23(1): 126-138. DOI:10.1016/j.str.2014.10.015 |
| [27] | Pederson T. The nucleolus. Cold Spring Harb Perspect Biol, 2011, 3(3): a000638. |
| [28] | Feng W, Yonezawa M, Ye J, et al. PHF8 activates transcription of rRNA genes through H3K4me3 binding and H3K9me1/2 demethylation. Nat Struct Mol Biol, 2010, 17(4): 445-450. DOI:10.1038/nsmb.1778 |
| [29] | Frescas D, Guardavaccaro D, Bassermann F, et al. JHDM1B/FBXL10 is a nucleolar protein that represses transcription of ribosomal RNA genes. Nature, 2007, 450(7167): 309-313. DOI:10.1038/nature06255 |
| [30] | Walker MP, Tian L, Matera AG, et al. Reduced viability, fertility and fecundity in mice lacking the Cajal body marker protein, coilin. PLoS ONE, 2009, 4(7): e6171. DOI:10.1371/journal.pone.0006171 |
| [31] | Strzelecka M, Trowitzsch S, Weber G, et al. Coilin-dependent snRNP assembly is essential for zebrafish embryogenesis. Nat Struct Mol Biol, 2010, 17(4): 403-409. DOI:10.1038/nsmb.1783 |
| [32] | Raimer AC, Gray KM, Matera AG. SMN—a chaperone for nuclear RNP social occasions. RNA Biol, 2017, 14(6): 701-711. DOI:10.1080/15476286.2016.1236168 |
| [33] | Naganuma T, Nakagawa S, Tanigawa A, et al. Alternative 3'-end processing of long noncoding RNA initiates construction of nuclear paraspeckles. EMBO J, 2012, 31(20): 4020-4034. DOI:10.1038/emboj.2012.251 |
| [34] | Hirose T, Virnicchi G, Tanigawa A, et al. Neat1 long noncoding RNA regulates transcription via protein sequestration within subnuclear bodies. Mol Biol Cell, 2014, 25(1): 169-183. DOI:10.1091/mbc.e13-09-0558 |
| [35] | Imamura K, Imamachi N, Akizuki G, et al. Long noncoding RNA Neat1-dependent SFPQ relocation from promoter region to paraspeckle mediates IL8 expression upon immune stimuli. Mol Cell, 2014, 53(3): 393-406. DOI:10.1016/j.molcel.2014.01.009 |
| [36] | Sahin U, Ferhi O, Jeanne M, et al. Oxidative stress-induced assembly of PML nuclear bodies controls SUMOylation of partner proteins. J Cell Biol, 2014, 204(6): 931-945. DOI:10.1083/jcb.201305148 |
| [37] | Scherer M, Stamminger T. Emerging role of PML nuclear bodies in innate immune signaling. J Virol, 2016, 90(13): 5850-5854. DOI:10.1128/JVI.01979-15 |
| [38] | Stadler M, Chelbi-Alix MK, Koken MH, et al. Transcriptional induction of the PML growth suppressor gene by interferons is mediated through an ISRE and a GAS element. Oncogene, 1995, 11(12): 2565-2573. |
| [39] | Fabunmi RP, Wigley WC, Thomas PJ, et al. Interferon gamma regulates accumulation of the proteasome activator PA28 and immunoproteasomes at nuclear PML bodies. J Cell Sci, 2001, 114(1): 29-36. DOI:10.1242/jcs.114.1.29 |
| [40] | Chelbi-Alix MK, Quignon F, Pelicano L, et al. Resistance to virus infection conferred by the interferon-induced PML protein. J Virol, 1998, 72(2): 1043-1051. DOI:10.1128/JVI.72.2.1043-1051.1998 |
| [41] | Regad T, Saib A, Lallemand-Breitenbach V, et al. PML mediates the interferon-induced antiviral state against a complex retrovirus via its association with the viral transactivator. EMBO J, 2001, 20(13): 3495-3505. DOI:10.1093/emboj/20.13.3495 |
| [42] | Niu C, Livingston CM, Li L, et al. The Smc5/6 complex restricts HBV when localized to ND10 without inducing an innate immune response and is counteracted by the HBV X protein shortly after infection. PLoS ONE, 2017, 12(1): e0169648. DOI:10.1371/journal.pone.0169648 |
| [43] | Giovannoni F, Bosch I, Polonio CM, et al. AHR is a Zika virus host factor and a candidate target for antiviral therapy. Nat Neurosci, 2020, 23(8): 939-951. DOI:10.1038/s41593-020-0664-0 |
| [44] | Kim YE, Lee JH, Kim ET, et al. Human cytomegalovirus infection causes degradation of Sp100 proteins that suppress viral gene expression. J Virol, 2011, 85(22): 11928-11937. DOI:10.1128/JVI.00758-11 |
| [45] | Berscheminski J, Groitl P, Dobner T, et al. The adenoviral oncogene E1A-13S interacts with a specific isoform of the tumor suppressor PML to enhance viral transcription. J Virol, 2013, 87(2): 965-977. DOI:10.1128/JVI.02023-12 |
| [46] | Adamson AL, Kenney S. Epstein-Barr virus immediate-early protein BZLF1 is SUMO-1 modified and disrupts promyelocytic leukemia bodies. J Virol, 2001, 75(5): 2388-2399. DOI:10.1128/JVI.75.5.2388-2399.2001 |
| [47] | Bowling BL, Adamson AL. Functional interactions between the Epstein-Barr virus BZLF1 protein and the promyelocytic leukemia protein. Virus Res, 2006, 117(2): 244-253. DOI:10.1016/j.virusres.2005.10.018 |
| [48] | Full F, Hahn AS, Gro?kopf AK, et al. Gammaherpesviral tegument proteins, PML nuclear bodies and the ubiquitin-proteasome system. Viruses, 2017, 9(10): 308. DOI:10.3390/v9100308 |
| [49] | Giovannoni F, Ladelfa MF, Monte M, et al. Dengue non-structural protein 5 polymerase complexes with promyelocytic leukemia protein (PML) isoforms Ⅲand Ⅳ to disrupt PML-nuclear bodies in infected cells. Front Cell Infect Microbiol, 2019, 13(9): 284. |
| [50] | Alandijany T, Roberts APE, Conn KL, et al. Distinct temporal roles for the promyelocytic leukaemia (PML) protein in the sequential regulation of intracellular host immunity to HSV-1 infection. PLoS Pathog, 2018, 14(1): e1006769. DOI:10.1371/journal.ppat.1006769 |
