

1. 江苏省农业科学院 农业资源与环境研究所,江苏 南京 210014;
2. 农业农村部种养结合重点实验室,江苏 南京 210014;
3. 江苏省有机固体废弃物资源化协同创新中心,江苏 南京 210095;
4. 江苏省农业科学院 果树研究所,江苏 南京 210014
收稿日期:2020-09-10;接收日期:2020-12-02;网络出版时间:2021-01-06
基金项目:江苏省农业科技自主创新资金(No. CX(20)3078) 资助
摘要:生物方法合成纳米材料具有低能耗、高安全性以及环境友好等优良特点,因而备受人们关注。利用细菌将硒酸盐或亚硒酸盐还原为单质硒,不仅可以降低硒毒性,而且还能获得价值更高的生物纳米材料。文中选用可耐受高盐环境胁迫的枯草芽孢杆菌亚种Bacillus subtilis subspecies stercoris strain XP构建生物模型,分别以LB液体培养基和亚硒酸钠为介质和底物(电子受体),解析菌株XP合成纳米硒的基本规律。通过扫描电镜(Scanning electron microscope,SEM) 观察、X射线能谱分析(X-ray energy dispersive spectral analysis,EDAX)、X射线衍射(X-ray diffraction,XRD) 分析、傅里叶红外变换光谱(Fourier transform infrared spectroscopy,FTIR) 技术对合成的纳米硒进行物理化学表征分析,同时选用草莓枯萎、红叶、紫斑病病原真菌对其抗菌活性进行分析。结果表明,菌株XP介导合成的单质硒为球形纳米颗粒(Selenium nanoparticles,SeNPs),其生成量与反应时间呈正相关(0-48 h),且细胞形态未发生褶皱或破损等变化(耐受力强);SeNPs为非晶态,粒径范围在135-165 nm,表面元素组成以Se为主,同时存在C、O、N、S等有机元素;颗粒表面包裹生物大分子物质,-OH、C=O、N-H、C-H等官能团与SeNPs稳定性和生物活性密切相关;高浓度纳米硒对枯萎、红叶、紫斑病病原真菌均有显著抑制活性(P < 0.05),其中对草莓红叶病与枯萎病病原真菌的抑制活性明显优于对紫斑病病原真菌的抑制活性。总而言之,菌株XP不仅耐受高盐胁迫能力强,同时还可介导合成生物SeNPs,其合成的纳米硒颗粒具有良好的稳定性和生物活性,在草莓病害防治以及绿色富硒草莓种植等领域具有潜在的应用价值。
关键词:枯草芽孢杆菌生物纳米硒物理化学表征抑菌活性
Biosynthesis of spherical selenium nanoparticles with halophilic Bacillus subtilis subspecies stercoris strain XP for inhibition of strawberry pathogens
Yanyun Zhu1,2,3, Xiangping Kong1,2,3, Ejiao Wu4, Ning Zhu1,2,3, Dong Liang1,2,3, Menghan Lou1, Zhumeng Zhou1, Hongmei Jin1,2,3


1. Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China;
2. Key Laboratory of Crop and Livestock Integrated Farming, Ministry of Agriculture and Rural Affairs, Nanjing 210014, Jiangsu, China;
3. Jiangsu Collaborative Innovation Center for Solid Organic Waste Resource Utilization, Nanjing 210095, Jiangsu, China;
4. Institute of Pomology, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China
Received: September 10, 2020; Accepted: December 2, 2020; Published: January 6, 2021
Supported by: Jiangsu Agricultural Science and Technology Innovation Fund, China (No. CX(20)3078)
Corresponding author: Hongmei Jin. Tel: +86-25-84390238; E-mail: hmjin@jaas.ac.cn.
Abstract: Biosynthesis of nanomaterials has attracted much attention for its excellent characteristics such as low energy consumption, high safety, and environmental friendliness. As we all know, the toxic selenite can be transformed into higher-value nanomaterials by using bacteria. In this study, nano-selenium was synthesized by halophilic Bacillus subtilis subspecies stercoris strain XP in LB medium supplemented with selenite (electron acceptor). The physicochemical characteristics of nano-selenium were analyzed by scanning electron microscope (SEM), X-ray energy dispersive spectral analysis (EDAX), X-ray diffraction (XRD), and fourier transform infrared spectroscopy (FTIR). Meanwhile, the antifungal activity of nano-selenium to strawberry pathogens (fusarium wilt, erythema, and purple spot fungi) was determined. The products from reduction of selenite by strain XP was amorphous spherical selenium nanoparticles (SeNPs) with a diameter range of 135-165 nm. The production of SeNPs was positively correlated with time (0-48 h) and no changes were observed on cell morphology. Selenium was dominant in the surface of SeNPs where the organic elements (C, O, N, and S) existed at the same time. SeNPs were coated with biomolecules containing functional groups (such as -OH, C=O, N-H, and C-H) which were associated with the stability and bioactivity of particles. Although the highest concentration of SeNPs had significant (P < 0.05) inhibitory effects on three strains of strawberry pathogens, antifungal activity to erythema and fusarium wilt pathogenic fungi was higher than that to purple spot pathogenic fungi from strawberry. In conclusion, strain XP not only has strong tolerance to high salt stress, but can be also used to synthesize biological SeNPs with good stability and biological activity. Thus, the strain XP has bright perspectives and great potential advantage in pathogens control and green selenium-rich strawberry planting as well as other fields.
Keywords: Bacillus subtilis subsp.biological nano-seleniumphysicochemical characteristicsantifungal activity
硒元素(Se) 虽然是人体和动物体生长发育必需的微量元素之一,但过量摄入则会引起人和动物体的生理功能障碍甚至中毒死亡[1]。纳米硒(SeNPs) 作为一种新型单质态硒(Se0),比普通单质硒更易被人体吸收,相对于亚硒酸盐(SeO32-)、硒酸盐(SeO42-)、有机硒化合物(Se2-),其生物安全性更高[2],因其良好的物理、化学特性与生物活性,在食品、医药、材料以及农业生产等方面具有广泛的应用价值[3]。因此,近些年关于SeNPs的人工制备方法及其合成机制的研究日益成为人们关注的焦点。在农业生产领域,利用SeNPs作为肥料添加剂,可有效增强植株抵抗重金属胁迫的能力以及抵御病害的能力,达到提升农作物及其产品品质的目的。
利用微生物转化无机硒(亚硒酸盐、硒酸盐)为SeNPs是一种环境友好的绿色合成途径,相对于化学或物理合成更受人们青睐[4-5]。目前,可用于合成SeNPs的微生物包括了细菌和真菌,前者相对于后者具有更大的优势,这是因为细菌具有良好的环境适应能力,能够有效抵抗重金属等有害物质的胁迫[4]。现已报道的能够将无机硒转化为SeNPs的细菌包括:芽孢杆菌属Bacillus sp.[6]、克雷伯氏菌属Klebsiella sp.[7]、链霉菌属Streptomyces sp.[8]、肠杆菌属Enterobacter sp.[9]、乳酸杆菌属Lactobacillus sp.[10]、固氮螺菌属Azospirillum sp.[11]、草螺菌属Herbaspirillum sp.[12]以及拉恩氏菌属Rahnella sp.等[13]。其中,芽孢杆菌作为生防菌,不仅代谢旺盛、繁殖能力强、环境适应性强,而且在合成纳米硒方面具有潜在的优势。因此,不断挖掘具有强耐受胁迫能力且高效产纳米硒的生防类菌株,可为我国富硒农业的发展提供源源不断的驱动力。人们通过研究进一步发现,细菌合成纳米硒的途径与菌株种类及其代谢底物密切相关[7-13]。当以硒酸盐为底物时,细菌细胞中参与纳米硒合成的酶类主要包括:硒酸盐还原酶(SerABC或SrdABC) 与硝酸盐还原酶(NarGHIJ或NarZUWV)[6, 8];当以亚硒酸盐为底物时,参与纳米硒合成的酶类主要包括:亚硫酸盐还原酶、亚硝酸盐还原酶与谷胱甘肽还原酶;同时,NADH脱氢酶、醌池(Q-pool) 以及细胞色素也参与了纳米硒的生物合成过程[8-9]。目前针对硒酸盐还原生成纳米硒的机制已较为清楚,而针对亚硒酸盐还原生成纳米硒的机制尚需进一步探究。
本团队在前期的研究过程中,新发现一株具有耐受高浓度盐离子(7% NaCl) 能力的枯草芽孢杆菌亚种菌株XP Bacillus subtilis subspecies stercoris strain XP能够在含5 mmol/L Na2SeO3的LB培养基中正常生长,同时还可产生新的红色物质——纳米级球形颗粒,其基本特征与已有报道中其他细菌合成的纳米硒基本特征类似[6-13]。然而,目前关于菌株XP代谢硒的研究尚为空白,若能进一步明确菌株XP合成纳米硒的基本规律及纳米硒物理化学与生物活性特征,这对菌株XP在硒的生物转化应用方面具有重要意义。基于此,本研究以菌株XP作为研究对象,针对其合成纳米硒的动态规律、细胞形态的变化特征、纳米硒的物理化学特征(空间分布、粒径范围、晶型、元素组成、有机官能团结构等) 及生物活性作进一步分析,以期为纳米硒生物合成提供新的菌株资源,同时为后续菌株XP在农业生产中的应用提供有价值的参考。
1 材料与方法1.1 材料1.1.1 试验菌株枯草芽孢杆菌Bacillus subtilis subspecies stercoris strain XP作为供试菌株之一,由本课题组研究人员孔祥平从餐厨垃圾厌氧发酵产物中分离并鉴定。菌株XP的具体鉴定方法参考Adelskov等的研究[14],后续主要用于SeNPs的生物合成。其他3株供试菌株分别为草莓枯萎病菌Fusarium oxysporium Schl.、草莓紫斑病菌Mycosphaerella fragariae、草莓红叶病菌Pestalotiopsis clavispora,于2020年4月采集于四川省凉山彝族自治州德昌县巴洞镇,由江苏省农业科学院果树研究所提供,用于纳米硒生物活性分析。
1.1.2 培养基试验所用培养基共两种,其中Luria-Bertani (LB) 液体培养基(胰蛋白胨10 g、NaCl 10 g、酵母提取物5 g、去离子水1 L,pH 7.2) 用于XP的活化和纳米硒的生物合成制备,PDA培养基(马铃薯浸提粉3 g、葡萄糖20 g、琼脂14 g、去离子水1 L),用于病原真菌的孵育以及纳米硒生物活性分析。使用前,在121 ℃条件下高压蒸汽灭菌20 min,晾至室温备用。
1.1.3 主要试剂与仪器药品及试剂:Na2SeO3 (≥98%,Sigma-Aldrich),无水乙醇(99.5%,沪试),戊二醛(25%,国药),磷酸缓冲液(PBS,0.01 mol/L,pH 7.2-7.4)。
仪器:细胞密度仪(GE Ultrospec10,美国),扫描电镜(EVO-LS10,蔡司,德国),傅里叶红外变换光谱仪(Nicolet iS50,Thermo,美国),X射线衍射仪(D8 Advance,Bruker,德国),能谱分析仪(HT7700,Hitachi,日本),微型旋涡混合仪(WH-2,泸西,中国),小型高速离心机(AG 22331,Eppendorf,德国),喷金仪(108 Auto,CRESSINGTON,英国),真空冷冻干燥仪(Scientz-10N,新芝生物,中国)。
1.2 方法1.2.1 细菌和病原真菌的活化芽孢杆菌:从LB固体培养基平板上挑取菌株XP单菌落,转移至含有5 mL无菌LB培养基的试管中,置于35 ℃恒温摇床上连续摇培(150 r/min)至对数生长期(OD600约0.8) 备用。
草莓病原真菌:用无菌接种环挑取草莓枯萎病、草莓紫斑病、草莓红叶病的菌饼,接种至PDA平皿中央;用封口膜封住平皿边缘以防止交叉污染,之后正置于26 ℃恒温培养箱中静置培养;1 d后待新菌丝长出,再将平皿倒置过来继续培养,待菌丝长满平皿后放置于4 ℃冰箱中暂存备用。
1.2.2 利用菌株XP合成生物纳米硒首先,按照上述1.1.2中配方配制好LB液体培养基,将其分装至250 mL三角锥瓶中(100 mL/瓶),用PE膜封住瓶口,121 ℃高压灭菌20 min后晾至室温并置于超净工作台中;然后,在无菌环境下,用移液枪吸取过无菌滤膜(孔径0.21 μm) 的亚硒酸钠溶液(1 mol/L) 500 μL,加至培养基中混匀,使LB中Se (Ⅳ) 的浓度达到5 mmol/L;最后,取活化好的XP菌液,按照1% (V/V) 的接种量接种至含有5 mmol/L Se (Ⅳ) 的LB培养基中。其中,对照组不添加亚硒酸钠,每个处理设置3个重复,在同等条件下(150 r/min,35 ℃) 恒温连续培养48 h。
1.2.3 纳米硒的分离纯化与定量分析纳米硒的分离纯化:具体方法参考Dobias等[15]的研究,对XP合成的纳米硒进行分离和纯化。首先,通过离心收集菌体与纳米硒的混合物,连续用无菌水清洗3遍,将收集的混合物置于预冷研钵中;然后,加入液氮进行研磨,收集研磨液至烧杯中,在冰敷条件下超声6 min (不宜超过10 min),加入无菌水调节总体积,使其不低于原始样品体积的1/2;最后,通过真空抽滤和连续萃取去除有机相,获得的水相在1 200 r/min条件下离心10 min,所得沉淀即为纳米硒。
纳米硒浓度的测定:采用改进的Biswas法测定[16]。首先,将上述分离纯化好的纳米硒转移到含有25 mL无菌水的离心管中,并置于振荡器上充分混匀;然后,从中吸取2 mL转移至新的离心管中,8 000 r/min离心10 min,去除上清,向管内加入1 mol/L Na2S溶液1 mL,轻轻振荡使纳米硒充分溶解,室温静置1 h;用紫外可见分光光度计(UV-2800,尤尼克,美国) 测定溶液在500 nm处的吸光值,每个样品测定3次。标准曲线的绘制如文献[16]所述。最终,基于标准曲线方程及样品测定的吸光值,计算出原溶液中纳米硒的含量。
1.2.4 菌株XP细胞形态观察与分离纯化后的纳米硒基本物理化学特性表征利用扫描电镜(SEM) 对培养过程不同阶段菌株XP的细胞形态进行表征分析。如上所述,培养期间分别在0、12、24、48 h时取适量培养液于2 mL离心管中,置于小型高速离心机中,4 ℃条件下10 000 r/min离心10 min,去除上清液后获得菌体沉淀;加入1 mL的PBS缓冲液,充分振荡悬浮细胞,同等条件下离心去除上清,重复清洗3次;向最终获得的菌体沉淀中加入1 mL 2.5%的戊二醛溶液并振荡充分(切勿有细胞团聚体),4 ℃条件下固定24 h后进行后续处理。电镜观察之前,先对样品进行离心、脱水、干燥、喷金等一系列处理,再通过环境扫描电镜观察菌株XP的细胞形态。
分离纯化后的纳米硒,首先通过真空冷冻干燥,然后喷金处理,最后利用扫描电镜进行观察。通过X射线衍射(XRD) 与傅里叶红外变换光谱(FTIR),对纳米硒的结构及其官能团组成进行表征分析。取48 h离心收集的样品,清洗3次后置于-80 ℃冷藏过夜;次日,置于真空冷冻干燥仪中进行干燥,干燥完毕后,取适量样品粉末分别进行XRD和FTIR分析。X射线衍射分析用Bruker D8 Advance进行测定,电压为20 kV,电流5 mA,Kα (λ=1.541 8 ?),扫描速率4°/min,步长0.02°,扫描范围5°-85°。
1.2.5 纳米硒抑制病原真菌活性分析分离纯化获得的纳米硒先用无菌水稀释成不同浓度的溶液(40、120、360 μmol/mL),然后取100 μL涂布在PDA平板上,制备出纳米硒含量为4 μmol、12 μmol、36 μmol的PDA平板[17],用于抗菌活性分析。选用的3株病原真菌株:枯萎病菌、紫斑病菌、红叶病菌均来自草莓植株病原菌。具体操作如下:1) 将冷冻干燥后的纳米硒固体粉末配制为水溶液,浓度梯度如上所述;2) 分别吸取不同浓度的纳米硒水溶液100 μL,加到PDA培养基平板中央,并立即用玻璃涂布器涂布均匀,同时设置对照组(加入等体积的无菌水并涂布),每个处理3个重复;3) 用内径为5 mm的打孔器在事先活化好的病原真菌培养基上均匀打孔,利用接种环转移菌饼至含有纳米硒的平板中央,使长有菌丝的一面贴紧培养基表面;4) 盖上皿盖,封口膜密封平皿边缘,静置于26 ℃恒温生化箱中进行培养。培养过程中每天定时测量菌落直径大小,记录菌株生长情况,待对照组中的菌落长至平板的2/3时,停止培养,并分析不同浓度纳米硒的抑菌效果。抑菌率(R) 计算方式为:R=(DControl-DTreatment)/(DControl-0.5),其中0.5为接种菌饼的直径(cm)。
1.2.6 数据分析本研究中所有实验均设置3个重复,测定所得数据利用Sigmaplot 12.3和Origin 9.1分析作图,利用软件SAS 9.4进行统计学分析,利用Search-Match进行晶型分析。
2 结果与分析2.1 菌株XP合成生物纳米硒的动态过程监测将菌株XP接入到含有5 mmol/L Se (Ⅳ) 的LB培养基中,恒温(37 ℃) 匀速(150 r/min) 振荡培养。随着培养时间的延长,观察到溶液颜色逐渐变红(如图 1所示),这说明单质硒逐渐生成[6, 13, 18-19]。为了进一步确定此判断结果,取不同时间点的培养液进行扫描电镜观察。从图 2所展示的SEM电子照片可以看出,不含硒的对照组(Control) 并未产生单质球形颗粒状物质。利用能谱仪(EDAX)对球形颗粒表面元素组成进行分析,结果如图 3所示,分别在1.4、11.2、12.5 keV出现了Se元素的特征峰,颗粒表面Se元素的相对含量最高(34%),Cu元素(29%) 来自载样铜网,此外含有少量来自生物大分子的有机元素,从而更加确定菌株XP所产生的球形颗粒为生物纳米硒颗粒(SeNPs)[9, 11, 13]。对比图 2中各个时间点的SEM观察结果,发现培养至12 h时菌株XP的细胞周围有少量球形SeNPs形成,粒径范围在135-165 nm之间;随着培养时间的延长,这种球形SeNPs累积量越来越多,且生成的全部纳米硒颗粒均分散在细胞外。此外,通过电镜照片还可知晓,在SeNPs的生成过程中,菌株XP细胞的形态并未受到影响,这说明5 mmol/L Se (Ⅳ) 对XP生长并未产生抑制,所选的Se (Ⅳ) 处理浓度合适。
 |
| 图 1 连续培养过程中对照组(Control) 和加硒(Se (Ⅳ)) 组菌液颜色变化情况 Fig. 1 Changes in color of medium supplemented with or without Se (Ⅳ) after 12, 24, and 48 h cultivation. |
| 图选项 |
 |
| 图 2 不同培养时间菌株XP细胞形态及其合成纳米硒的扫描电镜照片 Fig. 2 SEM of cellular morphology and SeNPs synthesized by strain XP after 0, 12, 24, and 48 h cultivation. |
| 图选项 |
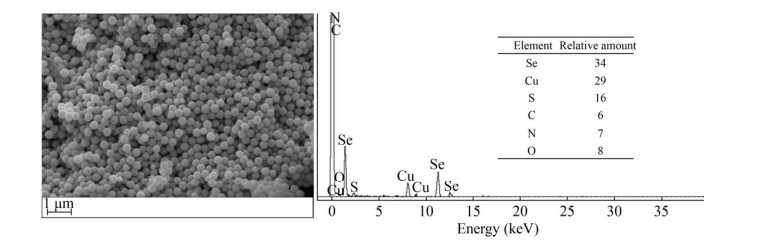 |
| 图 3 纯化后的SeNPs扫描电镜图像及其X射线能谱分析 Fig. 3 SEM images and X-ray energy dispersive spectral analysis (EDAX) of purified SeNPs. |
| 图选项 |
2.2 生物纳米硒的物理化学特性表征基于上述实验结果,为进一步明确菌株XP生物合成的SeNPs的物理结构特征,利用X射线衍射仪(XRD) 对分离纯化后的SeNPs晶型结构进行表征,所得样品衍射峰如图 4A所示,亚硒酸钠作为对照(图 4B)。同时,结合软件Crystallographica Search-Match (CSM) 对测定结果进一步分析。
图 4A为SeNPs的衍射谱,在2θ约为17.56°、29.19°、40.47°三个位置出现了较为宽泛的峰,无明显的晶体衍射峰,这表明芽孢杆菌XP生物合成的SeNPs为非晶态。此外,SeNPs的与图 4B中Na2SeO3的X射线衍射结果(软件CSM中Na2SeO3标准卡片编号32-1153) 相比较,发现经过微生物转化之后,在21.98°、37.60°等位置多个尖锐的峰已全部消失,这说明在纳米硒的合成过程中,底物Na2SeO3的晶体结构在微生物的作用下被改变,最终转化为非晶态的纳米硒。
 |
| 图 4 生物纳米硒SeNPs (A) 与亚硒酸钠Na2SeO3 (B) 的X射线衍射图谱(XRD) Fig. 4 X-ray diffraction pattern of biosynthetic SeNPs (A) and Na2SeO3 (B). |
| 图选项 |
为进一步明确合成的生物SeNPs表面是否包被有蛋白质类等生物大分子,采用傅里叶红外变换光谱对其表面官能团结构进行表征分析。由图 5中的FTIR谱图结果可以看到,位于3 279 cm-1处存在一个较强的吸收峰,为-OH的伸缩振动,源于多糖或纤维素类物质[20];在2 926 cm-1处存在的吸收峰,为-CH2-的伸缩振动,源于脂肪类物质[21];在1 635 cm-1和1 539 cm-1处各存在一个吸收峰,分别为C=O和N-H的伸缩振动,源于蛋白类物质[22];在1 454-1322 cm-1的吸收峰归属于脂肪族的C-H伸缩振动;此外,在1 229 cm-1和1 036 cm-1处的吸收峰分别对应-OH的弯曲振动和C-O的伸缩振动,多源自多糖类物质[21, 23]。根据FTIR分析结果可知,菌株XP在转化亚硒酸盐的过程中,可以分泌出胞外多糖类物质,这些物质进一步为纳米硒颗粒的形成提供了结合位点,同时由于所含-OH的负电荷特性可使生成的SeNPs在水溶液中具有良好的稳定性[24-25]。此外,菌株XP合成的SeNPs中,含有脂类和蛋白类等多种有机成分,这些物质及功能基团的存在,能够有效提高纳米硒颗粒的稳定性及生物活性[23]。已有研究表明,氨基酸残基中的羰基(C=O) 和肽键(-CO-NH-) 能够结合重金属或类金属,最终使得蛋白质包裹在纳米颗粒产物上,从而防止纳米颗粒发生团聚[26]。
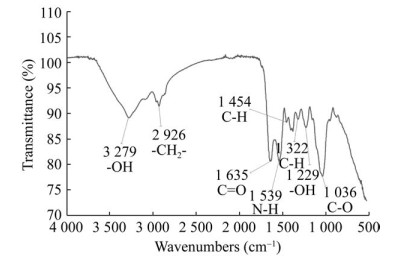 |
| 图 5 生物纳米硒SeNPs的傅里叶红外变换谱图 Fig. 5 Fourier transform infrared spectrum of biosynthetic SeNPs. |
| 图选项 |
2.3 生物纳米硒对草莓病原真菌的抑制为初步探明菌株XP合成的生物SeNPs在草莓种植方面可发挥的生防作用潜力,本研究选用了3株典型的草莓病原真菌(草莓枯萎病菌、草莓紫斑病菌、草莓红叶病菌),采用平板抑制法来检测SeNPs对这3种病原菌的生物抑制活性。图 6A展示的是3种浓度水平的SeNPs处理条件下(具体浓度设置见1.2.4) 3株病原真菌在PDA平板上的生长状态,Control为对照组;图 6B展示的是3种水平的SeNPs处理对各个菌株的抑制率。结合图 6A中菌丝的生长状况以及图 6B的分析结果可知,不同水平SeNPs处理条件对3种典型草莓病原真菌的抑制作用均表现出浓度梯度效应。
 |
| 图 6 不同水平SeNPs处理下草莓病原真菌生长状态(A) 和不同水平SeNPs处理对草莓病原真菌的抑制率(B) Fig. 6 Colony of strawberry pathogens treated with different concentrations of SeNPs (A) and the corresponding inhibitory rate (B). (Note: KW, ZB, and HY was used to represent the strain Fusarium oxysporium Schl., Mycosphaerella fragariae, and Pestalotiopsis clavispora, respectively.) |
| 图选项 |
其中,高水平SeNPs处理(36 μmol,Chigh)对草莓枯萎病菌的抑制率显著高于同水平处理下草莓紫斑病菌(P < 0.01) 与草莓红叶病菌(P < 0.05)的抑制率;培养5 d后,Chigh对枯萎病菌的抑制率达到99%以上,Chigh对红叶病菌的抑制率高达67.9%,而对于紫斑病菌的抑制率最低(15.7%)。低水平SeNPs处理(4 μmol,Clow) 对3株病原真菌的抑制率为R红叶病菌 > R枯萎病菌 > R紫斑病菌,即Clow对红叶病菌的抑制作用最强。中水平SeNPs处理(12 μmol,Cmedium) 对红叶、枯萎、紫斑病菌的抑制率依次为60.4%、57.6%、10.5%,对红叶和枯萎病菌的抑制效果十分接近,二者之间无显著性差异(P > 0.05),对紫斑病菌抑制率最低。此外,SeNPs在抑制枯萎与红叶病菌上,Clow与Cmedium处理之间对比均表现出显著性差异(P < 0.05),但在紫斑病菌抑制上Clow与Cmedium处理之间并未表现出显著性差异。因此,综合菌丝生长状况与抑制率分析可知,SeNPs对红叶与枯萎病菌的抑制活性明显优于对紫斑病菌的抑制活性,高水平处理下可完全抑制草莓枯萎病菌丝的生长。
3 讨论目前已报道的具有纳米硒合成能力的细菌菌株种类丰富[6-13],合成的纳米硒大多为球形或者类球形,发生位置有三大类即“细胞内部” “细胞外部” “细胞内外均有”,原因在于参与含氧硒酸根或亚硒酸根生物还原过程的酶类等物质不同。本研究发现菌株XP合成球形纳米硒(135-165 nm) 的发生位置主要在细胞外部,FTIR结果则进一步证明XP具有外泌有机生物分子(如胞外多糖、蛋白、脂类等) 的能力,这些生物分子能够有效参与纳米硒的合成,对维持SeNPs的稳定性和生物活性至关重要。近期杨颖等[27]利用贪铜杆菌Cupriavidus sp. SHE细胞上清液成功合成粒径约为196 nm的球形纳米硒颗粒,说明菌株Cupriavidus sp. SHE合成纳米硒的主要场所在细胞外,这与本研究的结果类似。早先有研究报道,陶厄氏菌Thauera selenatis能够以硒酸盐作为呼吸底物进行生长代谢,硒酸盐被还原为单质硒后与细胞外泌蛋白SefA结合并一起被释放到细胞外,蛋白SefA能够有效防止纳米硒颗粒聚集,在维持颗粒稳定性方面发挥重要作用[28]。随后Gonzalezgil等[29]和Zhang等[23]也报道了类似结果,利用生物聚集体合成的纳米硒颗粒表面存在多糖、脂类、胺类等,这些有机大分子与颗粒的稳定性密切相关。因此,后续还应利用蛋白组学技术,对菌株XP合成的SeNPs中的生物组分进行解析,为明确菌株XP合成纳米硒的分子机制做好铺垫。此外,人们通过分析还发现生物合成的纳米硒多为非晶态。Ye等[18]以生物质茶多酚等为模板,亚硒酸盐和抗坏血酸为底物,通过生物还原方式合成的纳米硒也呈非晶态;王丽红等[19]的研究也报道了类似结果,利用细菌还原亚硒酸盐可以获得非晶态的纳米级单质硒,且非晶态纳米硒的反应活性优于晶体形态的活性。据此可知,相较于化学合成的晶态纳米硒,菌株XP合成的非晶态纳米硒具有潜在的生物活性优势。
目前,抗生素耐药性和食品安全已成为公众、政府以及相关监管机构迫切需要解决的两大问题。据联合国粮农组织估计,真菌感染造成全球25%的农产品损失,被视为对农业和食品工业的主要威胁,而纳米技术的蓬勃发展则为人们在绿色农业发展和食品安全方面提供了有效的途径[30-31]。相对于常规的金属(银、金、钛、锌、镉、铜等)纳米材料,利用微生物合成的纳米硒成本低、安全性高,并且具有良好的抗氧化、抗菌和生物相容性,因此具有较高的生物潜在应用价值[32]。本研究通过抑菌实验发现,菌株XP合成的球形生物纳米硒针对草莓病原真菌具有潜在的生防功能,并表现出剂量依赖效应,即纳米硒的处理浓度越高其抑制活性越好。周驰[33]研究了不同浓度纳米硒对稻瘟病病原菌的抑制作用,也发现了类似的规律,随着纳米硒处理浓度的增加,病原真菌菌落生长受到的抑制作用也越强。Mosallam等[34]的研究结果则表明,纳米硒对醋酸钙不动杆菌Acinetobacter calcoaceticus和金黄色葡萄球菌Staphylococcus aureus的抑制活性不仅和剂量有关,同时也和纳米硒的颗粒粒径、形状密切相关。这是因为颗粒粒径及形状与其比表面积大小密切相关,一般高比表面积更有利于纳米硒与微生物细胞接触,从而大大提高其抑菌活性。另外,本研究还发现高浓度SeNPs处理对草莓枯萎病病原菌、紫斑病病原菌、红叶病病原菌均有显著的抑制效果,但对红叶与枯萎病病原菌的抑制活性明显优于对紫斑病病原菌的抑制活性。出现这种差异的原因在于,不同种类真菌代谢硒的途径各异,部分真菌可以将纳米硒中的Se作为营养物质,通过自身代谢过程降低纳米硒对自身的毒害作用[35-36]。至今关于纳米硒对大肠杆菌、葡萄球菌、白色念珠菌、绿脓杆菌以及水稻病原真菌等的抑制活性研究报道较多[33, 37-40],但针对草莓病原真菌的研究鲜有报道。文中菌株XP合成的纳米硒,虽然在PDA平板上对以上3种草莓病病原真菌有显著抑制作用,但是在植株上的抑病效果尚未可知,今后还应该设计植物实验进一步分析。综上所述,本研究能够为草莓种植过程中有害病原真菌的防控提供宝贵的参考信息,同时菌株XP合成的生物纳米硒也有望在提高草莓品质方面发挥积极效用。
参考文献
| [1] | Dinh QT, Cui Z, Huang J, et al. Selenium distribution in the Chinese environment and its relationship with human health: a review. Environ Int, 2018, 112: 294-309. DOI:10.1016/j.envint.2017.12.035 |
| [2] | Wang H, Zhang J, Yu H. Elemental selenium at nano size possesses lower toxicity without compromising the fundamental effect on selenoenzymes: comparison with selenomethionine in mice. Free Radical Bio Med, 2007, 42(10): 1524-1533. DOI:10.1016/j.freeradbiomed.2007.02.013 |
| [3] | Banach M, Pulit-Prociak J. Proecological method for the preparation of metal nanoparticles. J Clean Prod, 2017, 141: 1030-1039. DOI:10.1016/j.jclepro.2016.09.180 |
| [4] | Wadhwani SA, Shedbalkar UU, Singh R, Chopade BA. Biogenic selenium nanoparticles: current status and future prospects. Appl Microbiol Biot, 2016, 100(6): 2555-2566. DOI:10.1007/s00253-016-7300-7 |
| [5] | Lampis S, Zonaro E, Bertolini C, et al. Selenite biotransformation and detoxification by Stenotrophomonas maltophilia SeITE02: novel clues on the route to bacterial biogenesis of selenium nanoparticles. J Hazard Mater, 2017, 324: 3-14. DOI:10.1016/j.jhazmat.2016.02.035 |
| [6] | Kuroda M, Yamashita M, Miwa E, et al. Molecular cloning and characterization of the srdBCA operon, encoding the respiratory selenate reductase complex, from the selenate-reducing bacterium Bacillus selenatarsenatis SF-1. J Bacteriol, 2011, 193(9): 2141-2148. DOI:10.1128/JB.01197-10 |
| [7] | Fesharaki PJ, Nazari P, Shakibaie M, et al. Biosynthesis of selenium nanoparticles using Klebsiella pneumoniae and their recovery by a simple sterilization process. Braz J Microbiol, 2010, 41(2): 461-466. DOI:10.1590/S1517-83822010000200028 |
| [8] | Tan Y, Yao R, Wang R, et al. Reduction of selenite to Se(0) nanoparticles by filamentous bacterium Streptomyces sp. ES2-5 isolated from a selenium mining soil. Microb Cell Fact, 2016, 15(1): 157-157. DOI:10.1186/s12934-016-0554-z |
| [9] | Song D, Li X, Cheng Y, et al. Aerobic biogenesis of selenium nanoparticles by Enterobacter cloacae Z0206 as a consequence of fumarate reductase mediated selenite reduction. Sci Rep-UK, 2017, 7(1): 3239-3239. DOI:10.1038/s41598-017-03558-3 |
| [10] | Qiao L, Dou X, Yan S, et al. Biogenic selenium nanoparticles synthesized by Lactobacillus casei ATCC 393 alleviate diquat-induced intestinal barrier dysfunction in C57BL/6 mice through their antioxidant activity. Food Funct, 2020, 11(4): 3020-3031. DOI:10.1039/D0FO00132E |
| [11] | Tugarova AV, Mamchenkova PV, Khanadeev VA, et al. Selenite reduction by the rhizobacterium Azospirillum brasilense, synthesis of extracellular selenium nanoparticles and their characterisation. New Biotechnol, 2020, 58: 17-24. DOI:10.1016/j.nbt.2020.02.003 |
| [12] | Xu X, Cheng W, Liu X, et al. Selenate reduction and selenium enrichment of tea by the endophytic Herbaspirillum sp. strain WT00C. Curr Microbiol, 2020, 77(4): 588-601. DOI:10.1007/s00284-019-01682-z |
| [13] | Zhu YY, Ren BY, Li HF, et al. Biosynthesis of selenium nanoparticles and effects of selenite, selenate, and selenomethionine on cell growth and morphology in Rahnella aquatilis HX2. Appl Microbiol Biot, 2018, 102(14): 6191-6205. DOI:10.1007/s00253-018-9060-z |
| [14] | Adelskov J, Patel BKC. A molecular phylogenetic framework for Bacillus subtilis using genome sequences and its application to Bacillus subtilis subspecies stecoris strain D7XPN1, an isolate from a commercial food-waste degrading bioreactor. 3 Biotech, 2016, 6: 96. |
| [15] | Dobias J, Suvorova EI, Bernier-Latmani R. Role of proteins in controlling selenium nanoparticle size. Nanotechnology, 2011, 22(19): 195605. DOI:10.1088/0957-4484/22/19/195605 |
| [16] | Biswas KC, Barton LL, Tsui WL, et al. A novel method for the measurement of elemental selenium produced by bacterial reduction of selenite. J Microbiol Meth, 2011, 86(2): 140-144. DOI:10.1016/j.mimet.2011.04.009 |
| [17] | Zhou JY, Zhao XY, Dai CC. Antagonistic mechanisms of endophytic Pseudomonas fluorescens against Athelia rolfsii. J Appl Microbiol, 2014, 117(4): 1144-1158. DOI:10.1111/jam.12586 |
| [18] | Ye X, Chen Z, Zhang Y, et al. Construction, characterization, and bioactive evaluation of nano-selenium stabilized by green tea nano-aggregates. Lwt, 2020, 129: 109475. DOI:10.1016/j.lwt.2020.109475 |
| [19] | 王丽红, 杨辉, 毛建丽, 等. 微生物还原法合成纳米硒益生菌的筛选及其培养条件优化. 陕西科技大学学报, 2019, 37(4): 29-34. Wang LH, Yang H, Mao JL, et al. Screening of probiotics strain for nano-selenium synthesis by microbial reduction and optimization of the culture conditions. J Shaanxi Uni Sci Technol, 2019, 37(4): 29-34 (in Chinese). DOI:10.3969/j.issn.1000-5811.2019.04.006 |
| [20] | Hinterstoisser B, Salmen L. Application of dynamic 2D FTIR to cellulose. Vib Spectrosc, 2000, 22(1): 111-118. |
| [21] | 李磊, 李忠佩, 刘明, 等. 基于FTIR分析猪场废水有机物分解过程中组成结构变化. 光谱学与光谱分析, 2016, 36(11): 3517-3522. Li L, Li ZP, Liu M, et al. Structural analysis of organic matter composition in piggery wastewater during the process of organic degradation based on FTIR spectroscopy. Spectrosc Spect Anal, 2016, 36(11): 3517-3522 (in Chinese). |
| [22] | Akcay FA, Avci A. Effects of process conditions and yeast extract on the synthesis of selenium nanoparticles by a novel indigenous isolate Bacillus sp. EKT1 and characterization of nanoparticles. Arch Microbiol, 2020. DOI:10.1007/s00203-020-01942-8 |
| [23] | Zhang X, Yan H, Ma L, et al. Preparation and characterization of selenium nanoparticles decorated by Spirulina platensis polysaccharide. J Food Biochem, 2020. |
| [24] | Zhang J, Gao X, Zhang L, et al. Biological effects of a nano red elemental selenium. Biofactors, 2001, 15(1): 27-38. DOI:10.1002/biof.5520150103 |
| [25] | Yang F, Tang Q, Zhong X, et al. Surface decoration by Spirulina polysaccharide enhances the cellular uptake and anticancer efficacy of selenium nanoparticles. Int J Nanomed, 2012, 7: 835-844. DOI:10.2217/nnm.11.154 |
| [26] | Radhika S R Rajasree SG. Extracellular biosynthesis of selenium nanoparticles using some species of Lactobacillus. Indian Journal of Geo-Marine Sciences, 2015, 43(5): 766-775. |
| [27] | 杨颖, 厉舒祯, 范书伶, 等. 贪铜杆菌Cupriavidus sp. SHE细胞上清液合成纳米硒特性考. 生物工程学报, 2020, 36(6): 1162-1169. Yang Y, Li SZ, Fan SL, et al. Characteristics of selenium nanoparticles synthesized by cell-free supernatant Cupriavidus sp. SHE. Chin J Biotech, 2020, 36(6): 1162-1169 (in Chinese). |
| [28] | Debieux CM, Dridge EJ, Mueller CM, et al. A bacterial process for selenium nanosphere assembly. P Natl Acad Sci USA, 2011, 108(33): 13480-13485. DOI:10.1073/pnas.1105959108 |
| [29] | Gonzalezgil G, Lens PNL, Saikaly PE. Selenite reduction by anaerobic microbial aggregates: microbial community structure, and proteins associated to the produced selenium spheres. Front Microbiol, 2016, 7: 571-571. |
| [30] | Bryden WL. Mycotoxins in the food chain: human health implications. Asia Pac J Clin Nutr, 2007, 16(1): 95-101. |
| [31] | Kalagatur NK, Ghosh OSN, Sundararaj N, et al. Antifungal activity of chitosan nanoparticles encapsulated with cymbopogon martinii essential oil on plant pathogenic fungi Fusarium graminearum. Front Pharmacol, 2018, 9: 610. DOI:10.3389/fphar.2018.00610 |
| [32] | Sohal IS, Ofallon KS, Gaines P, et al. Ingested engineered nanomaterials: state of science in nanotoxicity testing and future research needs. Part Fibre Toxicol, 2018, 15(1): 1-31. DOI:10.1186/s12989-017-0237-x |
| [33] | 周驰. 纳米硒的生物合成及其抑菌活性的研究[D]. 合肥: 安徽农业大学, 2018. Zhou C. Study on biosynthesis and antifungal activity of nano-selenium[D]. Hefei: Anhui Agricultural University, 2018 (in Chinese). |
| [34] | Mosallam FM, Elsayyad GS, Fathy RM, et al. Biomolecules-mediated synthesis of selenium nanoparticles using Aspergillus oryzae fermented Lupin extract and gamma radiation for hindering the growth of some multidrug-resistant bacteria and pathogenic fungi. Microb Pathogenesis, 2018, 122: 108-116. DOI:10.1016/j.micpath.2018.06.013 |
| [35] | Alghuthaymi MA, Almoammar H, Rai M, et al. Myconanoparticles: synthesis and their role in phytopathogens management. Biotechnol Biotec Eq, 2015, 29(2): 221-236. DOI:10.1080/13102818.2015.1008194 |
| [36] | Shoeibi S, Mozdziak P, Golkar-Narenji A. Biogenesis of selenium nanoparticles using green chemistry. Topics Curr Chem, 2017, 375(6): 88. DOI:10.1007/s41061-017-0176-x |
| [37] | Gunti L, Dass RS, Kalagatur NK. Phytofabrication of selenium nanoparticles from emblica officinalis fruit extract and exploring its biopotential applications: antioxidant, antimicrobial, and biocompatibility. Front Microbiol, 2019, 10: 931. DOI:10.3389/fmicb.2019.00931 |
| [38] | Kokila K, Elavarasan N, Sujatha V. Diospyros montana leaf extract-mediated synthesis of selenium nanoparticles and their biological applications. New J Chem, 2017, 41(15): 7481-7490. DOI:10.1039/C7NJ01124E |
| [39] | Kheradmand E, Rafii F, Yazdi MH, et al. The antimicrobial effects of selenium nanoparticle- enriched probiotics and their fermented broth against Candida albicans. DARU, 2014, 22(1): 48-48. DOI:10.1186/2008-2231-22-48 |
| [40] | Shakibaie M, Forootanfar H, Golkari Y, et al. Anti-biofilm activity of biogenic selenium nanoparticles and selenium dioxide against clinical isolates of Staphylococcus aureus, Pseudomonas aeruginosa, and Proteus mirabilis. J Trace Elem Med Biol, 2015, 29: 235-241. DOI:10.1016/j.jtemb.2014.07.020 |
