

山西农业大学 分子农业与生物能源研究所,山西 太谷 030801
收稿日期:2021-02-20;接收日期:2021-04-23;网络出版时间:2021-05-26
基金项目:国家自然科学基金(Nos. 31401430,31201266,30971806),国家农业部“948”项目(No. 2014-Z39),山西省煤基重点科技攻关项目(No. FT-2014-01),山西省重点科技项目(No. 201603D312005),山西省重点研发计划(No. 201703D221002-3),山西省留学归国人员科研基金(No. 2015-064) 资助
摘要:发展以非粮食作物为原料制备乙醇等生物燃料既可缓解全球能源危机,又能减低粮食作物用于生物燃料对粮食安全的威胁。烟草Nicotiana tabacum是一种生物量较高的经济作物,培育富含淀粉的新型烟草,可专用于燃料乙醇生产。文中克隆了烟草控制淀粉生物合成的ADP-葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase,NtAGPase) 小亚基基因NtSSU,并构建了NtSSU基因植物表达载体。通过农杆菌介导叶盘转化法在烟草中超表达NtSSU基因。转基因烟草植株表型鉴定显示,过表达NtSSU基因促进烟叶淀粉富集,烟叶淀粉含量从野生型17.5%升高到41.7%。转基因烟草的生长速率和生物量也显著增加。研究结果揭示,过表达NtSSU基因能有效调动光合产物碳通量更多地进入淀粉合成途径,提高生物质产量,且未对其他农艺性状产生负效应。因此,NtSSU基因可作为优异靶标基因应用于植物代谢工程以促进营养器官中淀粉的合成积累,从而开发专用于生产燃料乙醇的新种质。
关键词:烟草NtAGPase小亚基基因NtSSU淀粉合成生物量非粮燃料乙醇
Overexpression of NtAGPase small subunit gene increases leaf starch content and tobacco biomass
Ying Chen, Yu Gao, Teng Li, Zhi Xing, Guiping Cai, Jin'ai Xue, Runzhi Li


Institute of Molecular Agriculture and Bioenergy, Shanxi Agricultural University, Taigu 030801, Shanxi, China
Received: February 20, 2021; Accepted: April 23, 2021; Published: May 26, 2021
Supported by: National Natural Science Foundation of China (Nos. 31401430, 31201266, 30971806), National Department of Agriculture "948" Program (No. 2014-Z39), Coal-based Key Sci-Tech Project of Shanxi Province, China (No. FT-2014-01), Key Science and Technology Program of Shanxi Province, China (No. 201603D312005), Key Research and Development Project of Shanxi Province, China (No. 201703D221002-3), Research Project Supported by Shanxi Scholarship Council of China (No. 2015-064)
Corresponding author: Runzhi Li. Tel: +86-354-6288344; E-mail: rli2001@126.com.
Abstract: Production of biofuels such as ethanol from non-grain crops may contribute to alleviating the global energy crisis and reducing the potential threat to food security. Tobacco (Nicotiana tabacum) is a commercial crop with high biomass yield. Breeding of starch-rich tobacco plants may provide alternative raw materials for the production of fuel ethanol. We cloned the small subunit gene NtSSU of ADP-glucose pyrophosphorylase (NtAGPase), which controls starch biosynthesis in tobacco, and constructed a plant expression vector pCAMBIA1303-NtSSU. The NtSSU gene was overexpressed in tobacco upon Agrobacterium-mediated leaf disc transformation. Phenotypic analysis showed that overexpression of NtSSU gene promoted the accumulation of starch in tobacco leaves, and the content of starch in tobacco leaves increased from 17.5% to 41.7%. The growth rate and biomass yield of the transgenic tobacco with NtSSU gene were also significantly increased. The results revealed that overexpression of NtSSU gene could effectively redirect more photosynthesis carbon flux into starch biosynthesis pathway, which led to an increased biomass yield but did not generate negative effects on other agronomic traits. Therefore, NtSSU gene can be used as an excellent target gene in plant breeding to enrich starch accumulation in vegetative organs to develop new germplasm dedicated to fuel ethanol production.
Keywords: tobacco (Nicotiana tabacum)NtAGPase small subunit gene NtSSUstarch biosynthesisbiomassnon-grain fuel ethanol
作为可再生能源,生物燃料乙醇是目前发展最迅速的新型产业之一[1]。生物燃料乙醇不仅可作为石油的替代品,缓解传统石油资源紧缺的压力,满足全球能源可持续发展的要求,而且可显著减少温室气体的排放量,是一种环境友好型清洁能源[2]。生物燃料乙醇生产主要包括:以玉米、小麦和水稻等粮食作物和非粮作物为原料,通过生物发酵等技术将淀粉质或糖质转化为乙醇,以及以秸秆等农业废弃物为原料生产纤维素乙醇[3]。尽管燃料乙醇生产可有效消化“陈化粮”,但长期使用粮食作物制备燃料乙醇不利于国家粮食安全[4]。以农业废弃物制备燃料乙醇的技术工艺尚不成熟,规模化应用受限。因此,开发廉价且原料充足的非粮作物、增加优质生产原料的供应是推进燃料乙醇发展的重要突破口[5-7],应用前景广阔。
烟草Nicotiana tabacum L.是一年生或有限多年生草本植物,广泛种植于全球热带和温带地区。中国被称为“烟草大国”,其烟草的种植面积和产量一直位居世界之首[8]。作为一种非粮作物,烟草具有易于种植、生长周期短、生物量较大等优点,被认为是一种良好的工业原料[9]。一些研究显示,对烟草进行基因工程改造可使烟叶显著富集油脂和高附加值脂肪酸,以期用于生物燃油生产[10-11]。在烟叶中,淀粉是最主要的碳水化合物之一[12-13]。深入研究烟叶淀粉合成与代谢的分子机制,有助于对烟草进行遗传改良,培育富含淀粉的新型烟草以专用于生物燃料乙醇生产。这可极大地提高烟草的经济价值,促进生物能源可持续发展。
植物淀粉的生物合成是一个极其复杂的生物化学过程,涉及多种酶的参与及调控[14-15]。ADP-葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase,AGPase) 作为第一个关键的调节和限速酶,催化葡萄糖-1-磷酸(Glucose 1-phosphate,Glu-1-P) 与三磷酸腺苷(Adenosine triphosphate,ATP) 生成腺苷二磷酸葡萄糖(Adenosine diphosphate glucose,ADPG) (淀粉合成前体) 和焦磷酸(Pyrophosphate,PPi),不仅决定淀粉的累积水平,还影响着生物量以及器官发育等[16]。在植物中,AGPase全酶是由2个大亚基和2个小亚基组成的异源四聚体[17]。大亚基(54-60 kDa) 为多基因编码,小亚基(51-54 kDa) 为单基因编码。相较于大亚基,AGPase小亚基更加保守,可形成有活性的同源四聚体(α4)[18-19]。大亚基位于调节中心,起调控作用。小亚基位于催化中心,可与底物(Glu-1-P、ATP) 结合,发挥催化作用[20]。迄今为止,已从水稻、玉米、拟南芥、大麦和莲藕等多种植物鉴定到AGPase,尽管蛋白结构、催化效率和变构调节有差异,但其催化功能高度保守。已有研究显示,AGPase突变导致淀粉含量减低。例如,在玉米AGPase大亚基Shrunken-2 (Sh2) 突变体种子胚乳中,AGPase酶活性较低,淀粉含量显著降低[21]。然而,在玉米Sh2突变体中恢复AGPase酶活性,淀粉含量增加了15%[22]。胚胎特异性抑制甘蓝型油菜BnAGPase基因,不仅减少了淀粉的合成,还延迟了油菜种子的油分积累[23]。在小麦中过表达AGPase,提高了小麦籽粒胚乳中淀粉合成量,增加了每穗粒数和单粒重,促进了小麦的生长发育[24]。这些研究均证明了AGPase在植物淀粉合成及相关生命活动中行使重要功能。Kwak等发现烟草NtAGPase在花瓣展开和生长中起着至关重要的作用[25]。然而,有关烟草NtAGPase基因组学和遗传工程应用等亟待深入解析和论证。
本文以烟草N. tabacum Sumsun NN (SNN) 品种为试材,克隆了NtAGPase小亚基基因NtSSU,检测其时空表达谱,解析其基因结构和编码蛋白酶的理化性质及进化特征。构建了pCAMBIA1303-NtSSU植物过表达载体,并采用农杆菌介导的侵染法将其转入烟草。通过PCR和qRT-PCR筛选出阳性转化烟草植株。系统分析了纯合转基因株系烟叶中淀粉、蛋白和可溶性糖累积,以及NtSSU过表达株系的生长速率和生物量等农艺性状。本研究不仅为探索光合产物碳通量的分配、调控机制以及NtAGPase基因遗传工程提供了科学参考,而且培育获得富含淀粉烟草新种质,经进一步优化可应用于生物燃料乙醇生产。
1 材料与方法1.1 植物材料与试剂本试验所用材料为烟草N. tabacum,品种为Sumsun NN (SNN)。烟草无菌苗接种于MS培养基(含30 g/L蔗糖,7 g/L琼脂,pH 5.8)。转基因烟草植株种植于营养土中,置于光照培养箱。烟草的生长条件均为:光照130 μmol/(m2·s)、湿度50%-60%、温度(25±2) ℃,光暗交替培养(光照︰黑暗=12 h︰12 h)。
EASY spin植物RNA快速提取试剂盒购自Aidlab生物科技有限公司;5×All-In-One MasterMix反转录试剂盒购自ABM生物科技有限公司;2×RealStar Green Power Mixture购自GenStar公司;琼脂糖凝胶DNA回收试剂盒购自TIANGEN公司;KOD-Plus-Neo高保真PCR酶购于TOYOBO公司;淀粉含量检测试剂盒、可溶性糖含量检测试剂盒购自Solarbio公司;XbaⅠ、KpnⅠ购自NEB公司;T4 DNA连接酶购自TaKaRa公司;引物合成和基因测序均由生工生物工程(上海) 股份有限公司完成。
1.2 方法1.2.1 NtSSU基因的克隆利用EASY spin植物RNA快速提取试剂盒提取烟草幼苗总RNA。通过5×All-In-One RT MasterMix反转录试剂盒合成cDNA第一链。以cDNA为模板,使用KOD-Plus-Neo高保真PCR酶进行扩增。凝胶回收纯化后将产物连接到pMD18-T载体,并转入大肠杆菌Escherichia coli DH5α感受态细胞。使用特异性引物(F:5′-ATGG TGGTCACTGCTGCTA-3′;R:5′-GATGCTCCCAA TTCCATTGATGGCA-3′) 进行菌液PCR,筛选出的阳性重组子送往生工生物工程(上海) 股份有限公司测序。
1.2.2 NtSSU基因的生物信息学分析通过CDD数据库(https://www.ncbi.nlm.nih. gov/Structure/cdd/wrpsb.cgi) 和SMART在线软件(http://smart.emblheidelberg.de/) 分析鉴定NtSSU蛋白序列的保守功能结构域。利用ExPASy数据库(https://www.expasy.org/)预测NtSSU蛋白的分子量、等电点及亲水值等理化性质。运用MEGA7.0软件对烟草NtSSU蛋白序列及其他已知物种的SSUs蛋白序列进行比对(表 1),并采用邻接法(Neighbor-Joining method,NJ) 构建系统发育树,自举检验值设置为1 000个循环。
表 1 十种植物SSU蛋白序列信息Table 1 The accession number of protein sequence of SSU from 10 plant species
| Species | Proteins | Accession Nos. |
| Arabidopsis thaliana L. | AtSSU | NP_197423.1 |
| Brassica napus L. | BnSSU | XP_013681451.1 |
| Capsicum baccatum Jacq. | CbSSU | PHT44165.1 |
| Glycine soja Sieb. et Zucc. | GsSSU | KHN23805.1 |
| Oryza sativa L. | OsSSU | ACJ86329.1 |
| Ricinus communis L. | RcSSU | XP_002524583.1 |
| Solanum lycopersicum L. | SlSSU | NP_001234696.2 |
| Solanum tuberosum L. | StSSU | ABA81851.1 |
| Triticum aestivum L. | TaSSU | ASV64067.1 |
| Zea mays L. | ZmSSU | NP_001105717.2 |
表选项
1.2.3 烟草内源NtSSU基因的表达特性分析为分析内源NtSSU基因的时空表达特征,采用qRT-PCR检测该基因在烟草根、茎、叶、花及种子的表达情况。选用烟草NtActin基因为内参基因,通过Primer Premier 6设计qRT-PCR特异性引物(表 2)。qRT-PCR反应体系为:cDNA 1.0 μL,2×RealStar Green Power Mixture 10.0 μL,浓度为10 μmoL/L的正向、反向引物各0.5 μL,RNase-free H2O 8.0 μL。反应程序为:94 ℃ 10 min,95 ℃ 15 s,59 ℃ 1 min,40个循环。设置3次生物学重复。采用2-ΔΔCq法计算烟草内源NtSSU基因的相对表达量,用SPSS 25.0软件分析显著性差异。
表 2 qRT-PCR所用特异性引物Table 2 Primers used for qRT-PCR analysis
| Primer names | Primer sequences (5′-3′) | Size (bp) |
| NtActin-F | CAGTGGCCGTACAACAGGTA | 20 |
| NtActin-R | AACCGAAGAATTGCATGAGG | 20 |
| qNtSSU-F | AAGAGCAAAGCCAGCAGTTCCT | 22 |
| qNtSSU-R | TGAGCAGCAAGAACCTCCACAA | 22 |
表选项
1.2.4 pCAMBIA1303-NtSSU植物过表达载体的构建植物表达载体pCAMBIA1303和pMD18-T- NtSSU分别用XbaⅠ和KpnⅠ进行双酶切反应,酶切产物经回收纯化后,用T4 DNA连接酶连接,得到重组表达载体pCAMBIA1303-NtSSU。将所构建的重组表达载体转入大肠杆菌DH5α感受态细胞后,通过菌液PCR和双酶切试验鉴定阳性重组子。
1.2.5 烟草遗传转化通过冻融法将所构建植物表达载体转入农杆菌GV3101菌株,并置于LB液体培养基(含50 mg/L利福平和50 mg/L卡那霉素) 培养至OD600约0.4,用于侵染烟叶。取6周龄的无菌烟草叶片,切成0.5 cm2的块状,于农杆菌菌液中浸泡8 min,无菌水冲洗1 min,并用滤纸吸去多余的水分。将侵染后的叶片置于共培养培养基(MS+1.0 mg/L 6-苄氨基嘌呤+0.1 mg/L萘乙酸,pH 5.8),于黑暗条件下培养48 h。随后,将叶片转移至筛选培养基(MS+1.0 mg/L 6-苄氨基嘌呤+0.1 mg/L萘乙酸+50 mg/L潮霉素+500 mg/L噻孢霉素,pH 5.8)诱导出愈伤组织。愈伤组织长出分化芽后,将分化芽接至生根培养基(1/2 MS+500 mg/L噻孢霉素,pH 5.8) 进行生根培养,待根系长出后,对其进行炼苗移栽。
1.2.6 阳性转化烟草的分子筛选利用CTAB法提取筛选出的具有潮霉素抗性的T0代烟草植株基因组DNA。根据NtSSU基因序列及载体序列设计检测引物(F:5′-GTAAAAC GACGGCCAG-3′;R:5′-CAGGAAACAGCTAT GAC-3′)。通过PCR反应筛选阳性转基因烟草植株。取阳性转化烟草叶片提取RNA,通过qRT-PCR检测目的基因的表达量。连续继代繁殖,并对T1-T3代转基因烟草植株连续筛选鉴定,得到阳性纯合转基因烟草株系以用于后续分析。
1.2.7 淀粉、可溶性糖及蛋白质含量测定取开花期长势基本一致、位于相同叶位的野生型烟草和转基因烟草叶片置于冷冻干燥机中真空干燥后研磨成粉末状。利用淀粉含量检测试剂盒和可溶性糖含量检测试剂盒提取烟叶中的淀粉和可溶性糖,具体操作严格按照说明书进行。调节分光光度计波长为620 nm,分别测定淀粉和可溶性糖反应液的吸光度值。采用考马斯亮蓝法测定烟叶蛋白质的含量,于595 nm波长下测定吸光度值。根据各自标准曲线计算出样品中淀粉、可溶性糖及蛋白质的含量。对于不同化合物的测定均设置3次重复。
1.2.8 叶绿素含量的测定采用95%丙酮-乙醇提取法测定烟叶叶绿素含量。将烟叶去除叶脉后剪碎,准确称取0.5 g,重复3次,加入25 mL 95%丙酮-乙醇提取液(将体积比为1︰1的丙酮与无水乙醇混合液配制成95%的水溶液),置于25 ℃培养箱中黑暗处理24 h。以提取剂为对照,分别测定645 nm和663 nm处吸光值,利用Arnon公式计算烟叶叶绿素浓度。
1.2.9 地上部生物量和相对生长率的测定当烟草植株长至4叶期时,选择长势一致的幼苗进行移栽。移栽后15 d、30 d、45 d、60 d进行整株取样。设置3次重复,每次重复检测3株烟草植株。将采集的样品经105 ℃杀青30 min,然后置于60 ℃烘箱烘干至恒重,用分析天平称取地上干重,并以地上干重来测定相对生长速率。采用下列公式计算相对生长速率:RGR=(lnW2-1nW1)/(D2-D1),其中W1指的是第15天烟草地上部干重的平均值(g),W2指的是第60天烟草地上部干重的平均值(g),D2-D1表示两次测定的时间间隔(d)。
2 结果与分析2.1 NtSSU基因编码蛋白功能域及进化分析为解析NtSSU编码酶蛋白是否具有酶活性,我们克隆了NtSSU基因,并对NtSSU基因编码的蛋白进行功能保守结构域分析。结果显示,NtSSU基因编码蛋白属于PLNO2241超家族,具有典型的NTP-transferase和PbH1结构域。蛋白理化性质检测发现,该编码蛋白长度为520个氨基酸(aa),无跨膜结构和磷酸化位点,属于不稳定的水溶性蛋白。利用MEGA7.0软件对烟草NtSSU和其他植物SSUs进行多序列比对及进化分析(图 1) 显示,烟草NtSSU与茄科植物如马铃薯StSSU、番茄SlSSU、辣椒CbSSU等聚为紧密的一支,表明烟草NtSSU可能与其他茄科植物有共同的进化祖先。
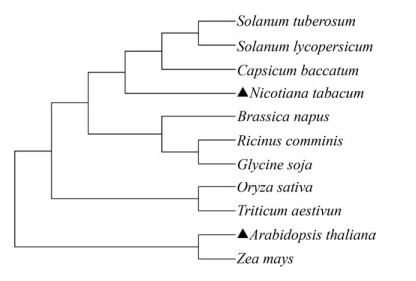 |
| 图 1 不同物种SSU蛋白的系统进化树 Fig. 1 Phylogenetic tree of SSU proteins from different plant species. |
| 图选项 |
2.2 烟草内源NtSSU基因在不同组织中的表达分析为鉴定烟草内源NtSSU基因在烟草生长发育过程中行使的功能,我们采用qRT-PCR分析了内源NtSSU基因在烟草根、茎、叶、花及种子中的表达模式。结果表明,内源NtSSU基因在烟草的各个组织中均有表达,但表达水平差异较大。如图 2所示,内源NtSSU在烟草的根、茎、叶、花中均有表达,且在叶片中表达量最高,而在种子中几乎不表达。因而,推测烟草内源NtSSU基因可能主要参与调控烟叶淀粉合成与积累等重要生理过程。
 |
| 图 2 烟草内源NtSSU基因在烟草不同组织表达的定量分析 Fig. 2 Quantitative analysis on the expression of endogenous NtSSU gene in different tissues of tobacco. The significance of difference was assessed by Duncan's new multiple range test. * and ** indicate statistically significant differences between samples at P < 0.05 and P < 0.01, respectively. |
| 图选项 |
2.3 阳性转基因烟草的筛选鉴定利用农杆菌介导的叶盘转化法将所构建的pCAMBIA1303-NtSSU植物表达载体转入烟草中。通过抗生素筛选,获得了具有潮霉素抗性的转化苗。提取转化苗基因组DNA,通过PCR反应扩增NtSSU基因。电泳结果显示,阳性pCAMBIA1303-NtSSU转基因烟草中含有1 623 bp的单一条带,然而在野生型烟草和转pCAMBIA1303空载体的烟草中并未检测到目的基因(图 3)。
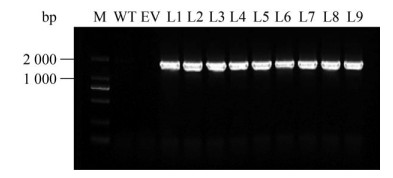 |
| 图 3 转基因烟草中目的基因NtSSU的PCR扩增 Fig. 3 PCR amplification of the target gene NtSSU in the transgenic tobacco. M: marker; WT: wild type tobacco; EV: tobacco transformed with pCAMBIA1303; L1-L9: transgenic tobacco with the target gene NtSSU. |
| 图选项 |
以NtActin基因为内参,应用qRT-PCR分析阳性转化烟草叶片中NtSSU基因的表达水平。如图 4所示,与野生型烟草相比,在转基因烟草株系中NtSSU的表达量均显著提高。尤其是在L1、L3和L6株系中,NtSSU的表达水平是野生型的2.04-2.26倍。
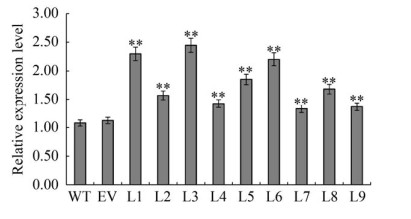 |
| 图 4 转基因烟草叶片中目的基因NtSSU的表达分析 Fig. 4 Analysis on the expression of the target gene NtSSU in transgenic tobacco leaves. WT: Wild type tobacco; EV: Tobacco transformed with pCAMBIA1303; L1-L9: Transgenic tobacco with the target gene NtSSU. The significance of difference was assessed by Duncan's new multiple range test. * and ** indicate statistically significant differences between samples at P < 0.05 and P < 0.01, respectively. |
| 图选项 |
2.4 转基因烟草淀粉、可溶性糖及蛋白质含量分析为阐述NtSSU基因在烟草中过表达是否会引起烟叶组织中淀粉及其他化合物含量的改变,我们选择NtSSU表达相对较高的转基因烟草株系用于淀粉、可溶性糖及蛋白质含量测定。结果显示,转基因烟叶中淀粉含量显著升高,从野生型烟草的17.5%升高到了32.8%-42.7% (图 5A)。可溶性糖含量有小幅度的提高,与淀粉含量的变化呈现正相关关系(图 5B)。此外,转基因烟叶中蛋白质含量也有轻微变化,但与野生型相比未达显著水平(图 5C)。
 |
| 图 5 转基因烟草叶片淀粉、可溶性糖、蛋白质含量 Fig. 5 Contents of starch (A), soluble sugar (B) and protein (C) in transgenic tobacco leaves. WT: wild type tobacco; EV: tobacco transformed with pCAMBIA1303; L1, L3, and L6: transgenic tobacco with the target gene NtSSU. The significance of difference was assessed by Duncan's new multiple range test. * and ** indicate statistically significant differences between samples at P < 0.05 and P < 0.01, respectively. |
| 图选项 |
2.5 转基因烟草叶绿素含量分析叶绿素是植物进行光合作用的主要色素,其含量影响植物光合速率。如表 3所示,在转基因烟叶中,叶绿素a、叶绿素b和总叶绿素含量均有所增加。此外,转基因烟叶中叶绿素a/b的值略有下降,推测过表达NtSSU有利于提高烟叶光能利用效率。
表 3 转基因烟草叶片中叶绿素含量Table 3 Chlorophyll content in the transgenic tobacco leaves
| Strains | Chl a (mg/g) | Chl b (mg/g) | Chl a+Chl b (mg/g) | Chl a/Chl b |
| WT | 1.11 | 0.42 | 1.53 | 2.64 |
| EV | 1.14 | 0.46 | 1.60 | 2.48 |
| L1 | 1.57** | 0.64* | 2.21 | 2.45 |
| L3 | 1.60** | 0.68** | 2.28 | 2.35 |
| L6 | 1.53** | 0.63* | 2.16 | 2.43 |
| WT: Wild type tobacco; EV: tobacco transformed with pCAMBIA1303; L1, L3, and L6: transgenic tobacco lines of the target gene NtSSU. The significance of difference was assessed by Duncan’s new multiple range test. * and ** indicate statistically significant differences between samples at P < 0.05 and P < 0.01, respectively. | ||||
表选项
2.6 转基因烟草生物量和相对生长速率分析为了比较野生型烟草和转基因烟草的生长差异,我们测定了不同发育时期的烟草地上部干重,从而计算出其相对生长率。在移栽后30 d左右,转基因烟草地上部干重明显高于野生烟草。随着植株的生长,野生型烟草和转基因烟草地上部干重的差异也越来越明显(图 6)。相对生长率的分析(图 7) 显示,转基因烟草的相对生长率均显著高于野生型烟草,说明NtSSU的高表达可促进烟草的生长发育和提高烟草的生物质产量。
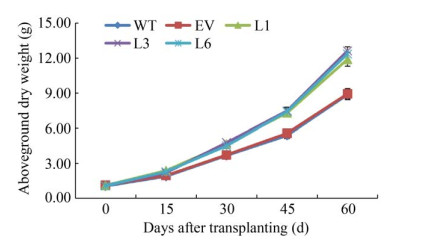 |
| 图 6 发育过程中转基因烟草地上部的干重 Fig. 6 The dry weight of transgenic tobacco aboveground during development. WT: wild type tobacco; EV: tobacco transformed with pCAMBIA1303; L1, L3, and L6: transgenic tobacco with the target gene NtSSU. |
| 图选项 |
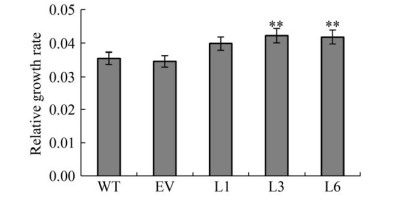 |
| 图 7 发育过程中转基因烟草的相对生长率 Fig. 7 Relative growth rate of the transgenic tobacco plants during development. WT: wild type tobacco; EV: tobacco transformed with pCAMBIA1303; L1, L3, and L6: transgenic tobacco with the target gene NtSSU. The significance of difference was assessed by Duncan's new multiple range test. * and ** indicate statistically significant differences between samples at P < 0.05 and P < 0.01, respectively. |
| 图选项 |
3 讨论开发新的非粮作物为原料以用于生产燃料乙醇,已成为发展生物能源产业的一条可行途径[6-7]。烟草是一种重要的经济作物,随着全球控烟行动和人们健康意识的增强,以烟草为原料生产香烟制品愈加受限。对高生物量烟草进行遗传改造以用于生产其他高值产品可实现烟草“变废为宝”,市场潜力巨大,倍受国内外科技界和工业界广泛重视[26-29]。培育烟叶富集淀粉的新型烟草种质以专用于生产燃料乙醇,不仅利于生物能源可持续发展,又能显著减少粮食作物用于乙醇生产而对粮食安全的威胁。因此,本文从调控烟叶淀粉合成途径入手,通过超表达淀粉合成关键酶基因,以期培育烟叶富含淀粉的烟草新种质,专用于燃料乙醇的生产。
已有研究揭示AGPase是淀粉合成过程中的一个重要限速酶,对淀粉合成的一般控制系数在0.3-0.6,决定着作物种子淀粉合成及积累量[16]。提高AGPase酶活性不仅可显著提高作物淀粉含量,而且有益于作物生长发育。例如,在小麦胚乳中增强AGPase酶活性可增加种子产量和植物总生物量[30]。类似地,过表达AGPase的转基因玉米植株,籽粒性状优异,且淀粉含量和种子重量明显增加[31]。然而,AGPase基因及编码酶蛋白在植物营养器官淀粉合成积累过程的具体作用还不清楚,尽管有研究显示过表达编码细菌AGPase的基因glgC可提高木薯淀粉积累和块根生物量[32]。我们通过检测烟草NtAGPase小亚基基因NtSSU的时空表达谱发现,内源NtSSU基因在烟叶中表达最高(图 2),而在种子中几乎不表达,这预示着内源NtSSU基因主要在烟叶中行使功能,可能在烟叶淀粉合成累积中起重要作用。接着,我们克隆了烟草NtAGPase小亚基基因NtSSU,并构建CaMV 35S启动子驱动烟草NtAGPase小亚基基因NtSSU表达的载体。过表达NtSSU的转基因烟叶淀粉含量显著高于野生型烟叶(图 5A),这提供了直接实验证据说明NtSSU基因及其编码酶蛋白是控制植物叶片组织淀粉合成积累的一个关键因素。
为进一步揭示超表达NtSSU的转基因烟叶淀粉含量提高是否对其他生理生化代谢、光合作用及植株生长发育产生显著影响,我们对转基因烟草植株表型系统检测显示,可溶性糖(图 5B) 含量显著增加,而蛋白含量略有减少(图 5C)。这可能是由于NtSSU酶蛋白活性提高,拉动光合碳同化产物大量流向碳水化合物合成途径,促进淀粉及可溶性糖的高量合成积累,而相对减少了与之竞争碳源的其他化合物合成途径的碳源供给。叶绿素含量与光合作用强弱密切相关,尽管本研究没有检测转基因烟叶和野生型烟叶光合作用的差异,但转基因烟叶的叶绿素含量显著升高(表 3),推测NtSSU基因的高表达有利于提高烟叶的光合作用。而光合作用的增强又为淀粉合成提供更多的碳同化物,进一步促进烟叶中淀粉合成与积累。类似地,有研究发现植物叶片组织中淀粉生物合成速率高通常意味着其具有更强的光合作用能力[33]。例如,超表达玉米AGPase小亚基Sh2r6hs基因导致转基因小麦植株叶片光合增加[30]。过表达马铃薯AGPase大亚基UpReg1基因显著促进水稻叶片光合作用和淀粉富集,同时提高了种子产量[34]。
值得注意的是,我们的研究还发现,在相同的生长条件下,超表达NtSSU的转基因烟草生物量(图 6) 和生长速率明显优于野生型烟草植株(图 7)。这显然得益于NtSSU的转基因烟叶淀粉高量富集和光合作用的提高。我们推测增加AGPase酶活性可增强发育中的营养器官库容量[32]。库容量的增加可减少反馈抑制,有利于光合作用持续有效的运行,进而促进植物生长发育和生物量积累。另一种可能是可溶性糖含量升高所致,因为糖是调节植物生长发育及多种生理生化代谢的信号分子[35-36],可溶性糖增多可激活相关生命活动协同反应,最终促进生物量增加和植株生长速率的提高。这些结果表明,NtSSU基因不仅参与烟叶淀粉合成等生理生化途径,而且与烟草的生长发育过程密切相关。
总之,本研究发现NtSSU基因是修饰烟叶淀粉合成途径的优异靶标,通过基因工程超表达NtSSU基因有利于培育富含淀粉的优质烟草种质,从而提高烟叶作为生物燃料原料的可用性,以专用于非粮燃料乙醇的生产。
4 结论本文克隆了烟草NtAGPase小亚基基因NtSSU,其编码蛋白具有典型的NTP-transferase和PbH1结构域。内源NtSSU基因在烟叶中高量表达,在种子中表达极低。采用农杆菌介导的叶盘转化法将NtSSU基因转入烟草,连续筛选获得9株独立的阳性转基因烟草。过表达NtSSU基因不仅能够显著增加烟叶淀粉富集量,而且还能促进烟草植株的生长发育。本研究为非粮燃料乙醇可持续生产提供了富含淀粉的优质烟草新种质。
参考文献
| [1] | 杜风光, 冯文生. 燃料乙醇发展现状和前景展望. 现代化工, 2006, 26(1): 6-9. Du FG, Feng WS. Current development situation of fuel ethanol and its future prospect. Mod Chem Ind, 2006, 26(1): 6-9 (in Chinese). DOI:10.3321/j.issn:0253-4320.2006.01.003 |
| [2] | 王鹏翔, 廖莎, 师文静, 等. 微藻生物质生产燃料乙醇技术进展. 当代化工, 2019, 48(8): 1842-1845. Wang PX, Liao S, Shi WJ, et al. Research progress of production technology of fuel ethanol by microalgae biomass. Contemp Chem Ind, 2019, 48(8): 1842-1845 (in Chinese). DOI:10.3969/j.issn.1671-0460.2019.08.051 |
| [3] | 王梦, 田晓俊, 陈必强, 等. 生物燃料乙醇产业未来发展的新模式. 中国工程科学, 2020, 22(2): 47-54. Wang M, Tian XJ, Chen BQ, et al. Future modes of fuel bioethanol industry. Strateg Study CAE, 2020, 22(2): 47-54 (in Chinese). |
| [4] | 仇焕广, 杨军, 黄季焜. 生物燃料乙醇发展及其对近期粮食价格上涨的影响分析. 农业经济问题, 2009, 30(1): 80-85. Qiu HG, Yang J, Huang JK. Biofuel ethanol development and its impact on the recent rise in food prices. Issues Agric Econ, 2009, 30(1): 80-85 (in Chinese). |
| [5] | 毛开云, 范月蕾, 王跃, 等. 国内外燃料乙醇产业现状+深度解析. 高科技与产业化, 2018(6): 6-13. Mao KY, Fan YL, Wang Y, et al. Domestic and foreign fuel ethanol industry status + in-depth analysis. High-Technol Commer, 2018(6): 6-13 (in Chinese). |
| [6] | 黄诗铿. 我国燃料乙醇原料应走多元化道路. 中国科技论坛, 2005(6): 52-55. Huang SK. The way for raw materials of producing alcohol as fuel must be diverse. Forum Sci Technol China, 2005(6): 52-55 (in Chinese). DOI:10.3969/j.issn.1002-6711.2005.06.011 |
| [7] | 岳国君, 武国庆, 郝小明. 我国燃料乙醇生产技术的现状与展望. 化学进展, 2007, 19(Z2): 1084-1090. Yue GJ, Wu GQ, Hao XM. The status quo and prospects of fuel ethanol process technology in China. Prog Chem, 2007, 19(Z2): 1084-1090 (in Chinese). |
| [8] | 李长双. 中国烟草产品国际竞争力研究[D]. 哈尔滨: 东北农业大学, 2017. Li CS. Research on the international competitiveness of Chinese tobacco product[D]. Harbin: Northeast Agricultural University, 2017 (in Chinese). |
| [9] | Andrianov V, Borisjuk N, Pogrebnyak N, et al. Tobacco as a production platform for biofuel: overexpression of Arabidopsis DGAT and LEC2 genes increases accumulation and shifts the composition of lipids in green biomass. Plant Biotechnol J, 2010, 8(3): 277-287. DOI:10.1111/j.1467-7652.2009.00458.x |
| [10] | 薛金爱, 毛雪, 吴永美, 等. 酿酒酵母脂酰-Δ9脱氢酶亚细胞定位表达及其对烟草脂肪酸合成的影响. 生物工程学报, 2013, 29(5): 630-645. Xue JA, Mao X, Wu YM, et al. Expression of yeast acyl-Δ9 desaturase for fatty acid biosynthesis in tobacco. Chin J Biotech, 2013, 29(5): 630-645 (in Chinese). |
| [11] | 高昌勇, 毛雪, 尚宏芹, 等. 超表达MucACP-Δ9脱氢酶对烟草叶组织油脂合成的影响. 植物生理学报, 2016, 52(9): 1333-1340. Gao CY, Mao X, Shang HQ, et al. Effect of overexpression of MucACP-Δ9 desaturase on lipid synthesis in tobacco leaves tissuse. Plant Physiol J, 2016, 52(9): 1333-1340 (in Chinese). |
| [12] | 宗会, 邓云龙, 张燕, 等. 烟叶中的淀粉累积与调控. 烟草科学研究, 2001(S): 196-197. Zong H, Deng YL, Zhang Y, et al. Starch accumulation and regulation in tobacco leaves. Tob Sci Res, 2001(S): 196-197 (in Chinese). |
| [13] | 尹启生, 蔡宪杰, 王信民, 等. 大田中后期烤烟淀粉酶活性及淀粉含量的变化. 烟草科技, 2006, 39(9): 55-57, 64. Yin QS, Cai XJ, Wang XM, et al. Changes of amylase activity and starch content in flue-cured tobacco during middle to late growing stage. Tob Sci Technol, 2006, 39(9): 55-57, 64 (in Chinese). DOI:10.3969/j.issn.1002-0861.2006.09.015 |
| [14] | Smith AM, Denyer K, Martin C. The synthesis of the starch granule. Annu Rev Plant Physiol Plant Mol Biol, 1997, 48: 67-87. DOI:10.1146/annurev.arplant.48.1.67 |
| [15] | Batra R, Saripalli G, Mohan A, et al. Comparative analysis of AGPase genes and encoded proteins in eight monocots and three dicots with emphasis on wheat. Front Plant Sci, 2017, 8: 19. |
| [16] | Saripalli G, Gupta PK. AGPase: its role in crop productivity with emphasis on heat tolerance in cereals. Theor Appl Genet, 2015, 128(10): 1893-1916. DOI:10.1007/s00122-015-2565-2 |
| [17] | Burton RA, Johnson PE, Beckles DM, et al. Characterization of the genes encoding the cytosolic and plastidial forms of ADP-glucose pyrophosphorylase in wheat endosperm. Plant Physiol, 2002, 130(3): 1464-1475. DOI:10.1104/pp.010363 |
| [18] | Ballicora MA, Laughlin MJ, Fu Y, et al. Adenosine 5'-diphosphate-glucose pyrophosphorylase from potato Tuber (significance of the N terminus of the small subunit for catalytic properties and heat stability). Plant Physiol, 1995, 109(1): 245-251. DOI:10.1104/pp.109.1.245 |
| [19] | Salamone PR, Greene TW, Kavakli IH, et al. Isolation and characterization of a higher plant ADP-glucose pyrophosphorylase small subunit homotetramer. FEBS Lett, 2000, 482(1/2): 113-118. |
| [20] | Ballicora MA, Iglesias AA, Preiss J. ADP-glucose pyrophosphorylase: a regulatory enzyme for plant starch synthesis. Photosynth Res, 2004, 79(1): 1-24. DOI:10.1023/B:PRES.0000011916.67519.58 |
| [21] | Bhave MR, Lawrence S, Barton C, et al. Identification and molecular characterization of shrunken-2 cDNA clones of maize. Plant Cell, 1990, 2(6): 581-588. |
| [22] | Singletary GW, Banisadr R, Keeling PL. Influence of gene dosage on carbohydrate synthesis and enzymatic activities in endosperm of starch-deficient mutants of maize. Plant Physiol, 1997, 113(1): 293-304. DOI:10.1104/pp.113.1.293 |
| [23] | Vigeolas H, M?hlmann T, Martini N, et al. Embryo-specific reduction of ADP-Glc pyrophosphorylase leads to an inhibition of starch synthesis and a delay in oil accumulation in developing seeds of oilseed rape. Plant Physiol, 2004, 136(1): 2676-2686. DOI:10.1104/pp.104.046854 |
| [24] | Kang G, Liu G, Peng X, et al. Increasing the starch content and grain weight of common wheat by overexpression of the cytosolic AGPase large subunit gene. Plant Physiol Biochem, 2013, 73: 93-98. DOI:10.1016/j.plaphy.2013.09.003 |
| [25] | Kwak MS, Min SR, Lee SM, et al. A sepal-expressed ADP-glucose pyrophosphorylase gene (NtAGP) is required for petal expansion growth in 'xanthi' tobacco. Plant Physiol, 2007, 145(1): 277-289. DOI:10.1104/pp.107.102095 |
| [26] | 杨洋, 杨雨波, 吴昊, 等. 烟草加工中打叶复烤工艺参数优化. 农业工程, 2018, 8(8): 83-85. Yang Y, Yang YB, Wu H, et al. Parameter optimization of threshing and redrying process in tobacco processing. Agric Eng, 2018, 8(8): 83-85 (in Chinese). DOI:10.3969/j.issn.2095-1795.2018.08.022 |
| [27] | 凌军, 杜宇, 张天栋, 等. 烟叶加工工艺过程中的降焦减害技术研究. 湖北农业科学, 2018, 57(5): 5-8. Ling J, Du Y, Zhang TD, et al. Research advancement of tobacco leaf decreasing harm technology for in processing. Hubei Agric Sci, 2018, 57(5): 5-8 (in Chinese). |
| [28] | 林跃平, 周清明, 王业建. 影响烟草生长、产量和品质的因子的研究进展. 作物研究, 2006, 20(5): 490-493. Lin YP, Zhou QM, Wang YJ. Research progress on factors affecting tobacco growth, yield and quality. Crop Res, 2006, 20(5): 490-493 (in Chinese). |
| [29] | 朱浩, 张强, 孙渭, 等. 烟草品质性状影响因子的研究进展. 中国农学通报, 2018, 34(34): 25-29. Zhu H, Zhang Q, Sun W, et al. Impact of tobacco quality traits: research progress. Chin Agric Sci Bull, 2018, 34(34): 25-29 (in Chinese). DOI:10.11924/j.issn.1000-6850.casb17090099 |
| [30] | Smidansky ED, Clancy M, Meyer FD, et al. Enhanced ADP-glucose pyrophosphorylase activity in wheat endosperm increases seed yield. Proc Natl Acad Sci USA, 2002, 99(3): 1724-1729. DOI:10.1073/pnas.022635299 |
| [31] | Li N, Zhang S, Zhao Y, et al. Over-expression of AGPase genes enhances seed weight and starch content in transgenic maize. Planta, 2011, 233(2): 241-250. DOI:10.1007/s00425-010-1296-5 |
| [32] | Ihemere U, Arias-Garzon D, Lawrence S, et al. Genetic modification of cassava for enhanced starch production. Plant Biotechnol J, 2006, 4(4): 453-465. DOI:10.1111/j.1467-7652.2006.00195.x |
| [33] | Sun J, Gibson KM, Kiirats O, et al. Interactions of nitrate and CO2 enrichment on growth, carbohydrates, and rubisco in Arabidopsis starch mutants. Significance of starch and hexose. Plant Physiol, 2002, 130(3): 1573-1583. DOI:10.1104/pp.010058 |
| [34] | Smidansky ED, Martin JM, Hannah LC, et al. Seed yield and plant biomass increases in rice are conferred by deregulation of endosperm ADP-glucose pyrophosphorylase. Planta, 2003, 216(4): 656-664. DOI:10.1007/s00425-002-0897-z |
| [35] | 李慧敏, 梁永书, 南文斌, 等. 糖调控植物根系生长发育的研究进展. 中国农学通报, 2015, 31(14): 108-113. Li HM, Liang YS, Nan WB, et al. Regulation of sugar on the growth and development of plant root system. Chin Agric Sci Bull, 2015, 31(14): 108-113 (in Chinese). DOI:10.11924/j.issn.1000-6850.casb15010181 |
| [36] | 石永春, 王旭, 王潇然, 等. 蔗糖信号调控植物生长和发育的研究进展. 植物生理学报, 2019, 55(11): 1579-1586. Shi YC, Wang X, Wang XR, et al. The regulatory role of sucrose as a signal in plant growth and development. Plant Physiol J, 2019, 55(11): 1579-1586 (in Chinese). |
