

1. 复旦大学 基础医学院细胞与遗传医学系,上海 200300;
2. 上海南方模式生物科技股份有限公司,上海 201318
收稿日期:2020-10-02;接收日期:2021-03-25
摘要:β2m (Beta-2-microglobulin)基因编码一个非糖基化蛋白,作为主要组织相容性复合体1类(MHCⅠ) 的重要组分,发挥抗原递呈的作用。为了避免免疫介导的清除,人类肿瘤和病原体采取了不同的策略,其中包括MHCⅠ表达的丢失。合适的动物模型对于评估和开发肿瘤及其他疾病的临床治疗新方法,以及阐明目前临床有效治疗方法的机制至关重要。利用CRISPR/Cas9基因编辑、显微注射等方法构建了β2m基因敲除小鼠。随后,通过PCR鉴定、qPCR、流式分析等实验技术进行基因型和表型鉴定。基因型鉴定结果显示在该品系小鼠中,目的基因编码区目标区域缺失。qPCR检测发现,β2m的mRNA水平发生显著的下调。流式结果显示,在不同的免疫组织和器官中,CD8+杀伤性T细胞显著减少。综上,成功构建β2m基因敲除小鼠,为后续体内研究β2m基因的功能奠定了基础。
关键词:主要组织相容性复合物β2m基因敲除小鼠CRISPR/Cas9
Construction of β2m knockout mice
Zhen Li1, Ruilin Sun2, Wen Liu1


1. Department of Cell and Genetic Medicine, School of Basic Medical Sciences, Fudan University, Shanghai 200300, China;
2. Shanghai Model Organisms Center, Shanghai 201318, China
Received: October 2, 2020; Accepted: March 25, 2021
Corresponding author: Wen Liu. Tel: +86-21-54237311-601; E-mail: liuwen@shmu.edu.cn.
Abstract: The β2m (Beta-2-microglobin) gene encodes a non-glycosylated protein that functions as an important component of major histocompatibility complexⅠ(MHCⅠ) for antigen presentation. To evade immune mediated clearance, human tumors and pathogens have adopted different strategies, including loss of MHCⅠexpression. Appropriate animal models are essential for understanding the mechanisms underpinning the clinical treatment of tumor and other human diseases. We constructed β2m knockout mice using CRISPR/Cas9 gene editing tool through embryo microinjection. Subsequently, genotyping and phenotyping of knockout mice were performed by PCR, qPCR, and flow cytometry. Mice genotyping showed that the coding region of the target gene was absent in the knockout mice. Real time PCR showed that mRNA level of β2m was significantly downregulated. Flow cytometry showed that the proportions of CD8+ killer T cells was significantly reduced in a variety of tissues and organs of the immune system. Taken together, we have successfully constructed a strain of β2m knockout mice, which will facilitate subsequent in vivo study on the function and mechanism of the β2m gene.
Keywords: major histocompatibility complexβ2mknockout miceCRISPR/Cas9
主要组织相容性复合物Ⅰ (Major histocompatibility complex Ⅰ,MHC Ⅰ) 是MHC的主要类型之一,另外一种类型是MHC Ⅱ。MHC Ⅰ存在于除红细胞之外几乎所有的脊椎动物的体细胞表面,主要功能是反映细胞的状态、递呈抗原。例如,细胞被病毒感染,病毒包膜蛋白破碎形成的多态链呈递给细胞表面的MHC Ⅰ。细胞毒性T淋巴细胞不断监测细胞表面的MHC Ⅰ类复合物,最终,清除表达异常蛋白来源多肽的转化和病毒感染的细胞。MHC Ⅱ位于抗原递呈细胞表面,如巨噬细胞等,通过主动识别细胞外抗原,发挥抗原递呈和起始免疫的作用。人类的MHC也叫作HLA(Human leukocyte antigen,HLA),小鼠的MHC被称为H-2。
β2m是β2m基因编码的,由119个氨基酸残基组成分子量大小为12 kDa的一个非糖基化蛋白。作为主要组织相容性复合体1类(MHC Ⅰ) 的组分,主要位于除红细胞之外几乎所有的脊椎动物的体细胞表面。另外,β2m还存在于多种细胞外液当中,包括血液、尿液和关节液等[1-2]。β2m从细胞表面脱落或由细胞分泌,进入血液循环,大多数β2m通过肾小球滤过和随后的肾小管分解代谢被肾脏清除,极少数的通过其他途径清除。早在1972年,已经有研究报道了β2m的结构[3],该研究发现,β2m与免疫球蛋白有类似的结构,该蛋白在序列上与免疫球蛋白轻链(CL) 的恒定部分和免疫球蛋白G的重链恒定部分区域(CH1、CH2和CH3) 同源并且两者具有相似的三级结构[4]。β2m含有一个57个氨基酸残基的链内二硫键环,其大小与免疫球蛋白G恒定区中的二硫键环相似[3]。另外,与免疫球蛋白的恒定区域一致的是,β2m结构也是非常保守的[5]。这些发现表明,β2m可能具有类似的免疫调控的功能。
β2m与多种疾病的发生发展密切相关,例如慢性肾病、透析相关的淀粉样病变和癌症等。随着慢性肾病的进展,血清中β2m的水平持续升高,与肾小球滤过率(Glomerular filtration rate,GFR) 呈负相关[1]。与其他的血清标记物相比,β2m作为一个新的肾功能的标记物拥有多种优势,例如,与代谢产物肌酐相比,β2m受到年龄、性别和种族的影响较小,并且β2m与疾病的不良预后更相关[6-8]。正常状态下,从MHC Ⅰ上解离后,β2m从细胞表面持续释放进入血液循环。β2m的产生速率是恒定的,为2–4 mg/(kg·d),正常人血浆浓度为1–3 μg/mL,然而,在终末期肾病患者的血清β2m水平通常在20–50 mg/L范围内,在特殊情况下可观察到高于100 mg/L的水平[9-10]。近年来,越来越多的证据表明β2m的表达受多种因素的影响,包括炎症、酸中毒、钙三醇治疗和透析技术等[1, 11-12]。透析相关的淀粉样病变(Dialysis-related amyloidosis,DRA) 是晚期肾病的一个并发症,常常与患者血液透析治疗有关,也可能发生在血液透析治疗之前。1980年,在法国塔辛,从腕管综合征(Carpal tunnel syndrome,CTS) 手术时获得的滑膜活检结果显示,7名长期血液透析(Haemodialysis,HD) 患者中存在不明性质的淀粉样沉积[13]。随后的几年里,这种疾病的临床特征和分子机制被逐步阐明。这种疾病又被称为透析相关的淀粉样病变,其临床表现为腕管综合征、多关节痛、破坏性脊柱关节炎和骨囊肿,显然,淀粉样蛋白对关节组织具有明显的亲和力。1985年,Gejyo等和Gorevic等发现淀粉样沉积的主要成分是β2m原纤维[14-15],因此,DRA又可以称为β2m淀粉样病变(Aβ2m)。有研究报道,在血液透析过程中,使用高通量膜可以有效去除Aβ2m患者血清中的β2m[16-18],然而使用低通量膜则不能达到同样的效果[19]。使用高通量膜去除血液中的β2m之后,可以显著改善Aβ2m引起的临床症状,例如CTS和破坏性关节炎[20-22]。β2m与肿瘤之间的关系也是一个长久以来被广泛关注的课题[23-24]。研究人员发现,尽管不同的年龄和性别的人群血清中β2m的含量可能存在差异[23],然而经过校正,晚期癌症患者血清β2m的含量要明显高于对照组,包括正常人群和早期癌症患者[23]。并且,血清β2m的含量与肿瘤的临床分期、格里森分级、远距离转移及治疗效果等均有明显的相关性[24]。在机制上,β2m可能通过诱导上皮间质转化的过程,进而促进肿瘤细胞的转移[24-26],最终导致肿瘤进展。例如,在前列腺癌的研究中发现,前列腺癌细胞中,β2m的表达量升高会刺激下游肿瘤细胞生长和骨迁移相关因子的表达,例如骨钙素、骨唾液蛋白、细胞周期素A、细胞周期素D1和血管内皮生长因子[26]。该研究还发现,利用小干扰RNA下调β2m的mRNA,能够增加细胞凋亡,有效抑制前列腺癌细胞的生长和骨转移[26]。
CRISPR/Cas9来源于细菌获得性免疫系统,从被发现以来,被广大实验者应用于细胞、植物和动物的基因编辑。目前,大多数模式动物模型的构建都采用CRISPR/Cas9技术,例如,亨廷顿舞蹈病小鼠模型[27]、杜兴氏肌肉萎缩症小鼠模型[28]和其他多种基因敲除小鼠[29]等。
合适的动物模型对于评估和开发肿瘤及其他疾病的临床治疗新方法,对阐明目前临床有效治疗方法的机制至关重要。本研究结合CRISPR/ Cas9、显微注射、胚胎移植等技术,在C57BL/6品系小鼠的背景下,构建β2m基因敲除的小鼠模型。基因型鉴定和表型鉴定结果表明,β2m基因敲除的小鼠模型构建成功。为后续进一步探究β2m在疾病发生发展过程中的功能及作用机制奠定了基础。
1 材料与方法1.1 实验动物伦理实验方案经由上海南方模式生物科技股份有限公司实验动物福利和伦理委员会批准(IACUC号2017-0003)。
1.2 试剂、耗材和仪器体外转录试剂盒(mMESSAGE mMACHINETM T7 ULTRA Transcription Kit,Thermo Fisher Scientific,American,Cat. No. AM1345)、RNA合成试剂盒(HiScribeTM T7 High Yield RNA Synthesis Kit,New England Biolabs,American,Cat. No. E2040S)、TRNzol Universal总RNA提取试剂(Tiangen,China,Cat. No. DP424)、RNA反转录试剂(QuantScript RT Kit,Tiangen,China,Cat. No. KR103)、实时荧光定量PCR试剂SuperReal PreMix Plus (SYBR Green) (Tiangen,China,Cat. No. FP205)、鼠尾裂解液、普通PCR试剂(TaKaRa LA Taq?,TaKaRa,China,Cat. No. RR02MA)、质粒小量提取试剂盒(Plasmid Mini Kit Ⅱ,Omega biotek,American,Cat. No. D6945)、琼脂糖凝胶回收试剂盒、Bsa Ⅰ (New England Biolabs,American,Cat. No. R0535)、Xba Ⅰ (New England Biolabs,American,Cat. No. R0145)、Not Ⅰ (New England Biolabs,American,Cat. No. R0189)、T4 DNA连接酶(TaKaRa,China,Cat. No. 2011)、T4 DNA聚合酶(TaKaRa,China,Cat. No. 2040)、大肠杆菌DH5a感受态细胞(Escherichia coli DH5α competent cells, TaKaRa, China, Cat. No. 9057)、电泳液(MES running buffer,biofurawTM,Cat. No. BT8100-2001)、转膜液(Fast transfer buffer stock solution (10×),biofurawTM,Cat. No. 8006-6006)、β2m抗体(β-2-microglobulin (G-10),Santa cruz,American,Cat. No. sc-46697)、β-actin抗体(β-actin antibody (C4) Alexa Fluor? 790,Cat. No. Santa cruz,American,sc-47778)、抗鼠的荧光二抗(IRDye 800CW goat anti-mouse IgG (H+L),odyssey,American,Cat. No. 926-32212)、BCA蛋白浓度测定试剂盒(增强型) (上海碧云天生物技术有限公司Beyotime,China,Cat. No. P0009)、PCR仪(Eppendorf,type. Pro S)、移液枪(GILSON)、实时荧光定量PCR仪(Analytikjena,type. QTOWER22)、琼脂糖凝胶电泳仪(上海天能科技有限公司TIANNENG,EPS-600)、恒温振荡仪(上海智诚投资有限公司ZHICHENG,type. ZHWY-211C)、流式细胞仪(Beckman Coulter,type. CytoFLEX)。
1.3 质粒构建及体外转录1.3.1 sgRNA设计参考NCBI数据库中β2m基因序列(ID: 12010),通过靶向β2m唯一个转录本的2号和3号外显子。利用在线软件CRISPR (http://crispor.tefor.net/) 进行sgRNA的设计,分别选取效率高、特异性好的上游和下游的sgRNA序列(表 1)。在2号外显子的上游190 bp位置和3号外显子的下游138 bp位置分别获得了一段sgRNA靶向核苷酸序列(表 1)。
表 1 靶向β2m基因靶位点的guideRNA位点和寡核苷酸序列Table 1 GuideRNA and oligonucleotide sequences targeting the target site of β2m gene
| Primers | Sequence (5′–3′) |
| Upstream sgRNA-1 | GGAAAACAGAAGGTACTCGTAGG |
| Downstream sgRNA-2 | ATTGTTTGATTCACTATCCTAGG |
| sgβ2m-1 sense sequence | CACCGGGAAAACAGAAGGTACTCGT |
| sgβ2m-1 antisense sequence | AAACACGAGTACCTTCTGTTTTCC |
| sgβ2m-2 sense sequence | CACCGATTGTTTGATTCACTATCCT |
| sgβ2m-2 antisense sequence | CACCGAGGATAGTGAATCAAACAAT |
表选项
1.3.2 pX-T7-sgβ2m质粒构建上述sgβ2m寡核苷酸序列设计完成后送至生工生物工程(上海) 股份有限公司合成sgβ2m寡核苷酸单链。由生工生物工程(上海) 股份有限公司合成的sgβ2m寡聚核苷酸单链采用以逐步降温的方式退火形成双链寡核苷酸,首先,预混1 μL (100 μmol/L) sgβ2m正义链、1 μL (100 μmol/L) sgβ2m反义链,补加双蒸水ddH2O至20 μL。其次,将预混液放置于95 ℃沸水,逐步冷却至室温,即获得退火产物双链寡核苷酸。空载质粒pX-T7-sgRNA经限制性内切酶Bsa Ⅰ酶切,再经过琼脂糖凝胶电泳,切胶回收获得纯化的线性化载体,用ddH2O稀释到20 ng/μL。然后将双链寡核苷酸与稀释后的线性化载体在T4 DNA连接酶的作用下进行连接。连接体系和程序如下:2 μL 10×T4 DNA连接酶缓冲液,1 μL T4 DNA连接酶,1 μL稀释后的线性化载体,2 μL双链寡核苷酸,14 μL ddH2O。室温过夜连接,获得连接产物。将连接产物转化大肠杆菌感受态细胞DH5α,转化过程参照TaKaRa的E. coli DH5α感受态细胞转化流程,转化产物涂布于含有氨苄青霉素的LB琼脂板,第2天在LB琼脂板上挑取多个单克隆菌落,接种于6 mL LB液体培养基,37 ℃振荡培养12–16 h。参照美国Omega biotek公司质粒小量提取试剂盒Plasmid Mini Kit的提取步骤提取质粒。送往生工生物工程(上海)股份有限公司测序,进行序列比对,测序结果匹配的阳性克隆保存备用。
1.3.3 表达载体pX-T7-sgβ2m和Cas9体外转录首先,表达载体分别用限制性内切酶Not Ⅰ和Xba Ⅰ进行酶切,经过琼脂糖凝胶电泳,切胶回收获得纯化的线性化转录模板pX-T7-sgβ2m- Not Ⅰ和Cas9-Xba Ⅰ。sgβ2m的体外合成参照美国NEB公司的RNA合成试剂盒HiScribeTM T7 High Yield RNA Synthesis Kit操作说明。Cas9的体外转录参照美国Thermo Fisher Scientific公司的体外转录试剂盒mMESSAGE mMACHINETM T7 ULTRA Transcription Kit操作说明,获得Cas9 mRNA。
1.4 动物及动物模型构建本实验小鼠饲养环境为SPF级,符合国家标准[SYXK(沪)2014-0002]。C57BL/6品系小鼠由上海南方模式生物有限公司提供。
利用显微注射的方法,使体外转录获得的Cas9 mRNA和sgβ2m转染进入C57BL/6小鼠受精卵,随后,将此受精卵移植到假孕母鼠的卵巢内,经胚胎发育,分娩获得子代小鼠。在这一批子代小鼠中,经鉴定存在β2m基因敲除的小鼠称作F0代小鼠,将F0代小鼠与野生型小鼠杂交,即可获得杂合子的F1代小鼠。将F1代杂合子小鼠自交,有1/4的机率可获得β2m基因敲除的纯合子小鼠。
1.5 小鼠基因组DNA提取剪取小鼠鼠尾(长度0.5 cm左右),放入已编号的1.5 mL离心管中并盖好盖子。每管加0.5 mL裂解液和50 μL蛋白酶K贮存液并将盖盖紧。将离心管置杂交炉中,56 ℃转动过夜。次日将样本于室温、12 000 r/min离心10 min。上清倒入1.5 mL离心管中,加1 mL无水乙醇(约2倍上清体积),盖紧盖子后轻摇,可见絮状沉淀。13 000 r/min离心15 min,弃上清。加70%乙醇1 mL,洗涤,13 000 r/min离心10–15 min,弃上清,收集沉淀,室温晾置15 min。每管加80–100 μL灭菌水,盖好后置室温或37 ℃孵育1 h充分溶解。在室温中放置数小时,待DNA全部溶解后–20 ℃保存,或直接进行PCR等实验。如DNA溶解不完全,可在37 ℃水浴中放置30–60 min,但不可过夜。DNA浓度控制在50–100 ng/μL,OD260/280在1.8–2.0之间。
1.6 PCR鉴定小鼠基因型经杂交和自交获得的子代小鼠,需要通过PCR的方法进行基因型鉴定,判断是否发生目的基因突变。PCR模板为鼠尾裂解液中提取获得的基因组DNA (Tail genomic DNA)。本实验中F0代小鼠、F1代杂合子小鼠以及纯合子小鼠进行基因型鉴定的引物如表 2。
表 2 基因型鉴定和qPCR引物Table 2 Genotyping and qPCR primers
| Primers | Sequence (5′–3′) | Application |
| P2 | CTGCGGGCTTTGATGTGGATACT | Genotyping |
| P1 | CCGGTGGGTGGCGTGAGT | Genotyping |
| P3 | TGGCAGGGTTAAAACAGAAGG | Genotyping |
| F | TCTCACTGACCGGCCTGTAT | qPCR |
| R | GATTTCAATGTGAGGCGGGTG | qPCR |
表选项
20 μL PCR反应体系:2 μL PCR缓冲液La Taq PCR Buffer,2 μL核苷酸混合物(2.5 mmol/L) dNTPs,0.5 μL引物1 (10 pmol/μL),0.5 μL引物2 (10 pmol/μL),0.8 μL DNA聚合酶La Taq DNA Polymerase,1 μL Tail genomic DNA,补加ddH2O到20 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性20 s,60 ℃退火20 s,72 ℃延伸2 min,35个循环;72 ℃延伸2 min。
1.7 实时荧光定量PCRqPCR实验用以检测不同样本间的同种基因表达量的差异。首先将反转录得到的cDNA以一定的比例稀释,在StepOne Plus实时定量PCR仪(Applied Biosystem,USA) 中,用特异性的引物(表 2) 和qPCR SYBR Green Master Mix试剂进行扩增,同时采集荧光数据。最终用于统计检验的结果来自至少3次生物重复实验。通过细胞骨架蛋白β-actin进行校正样本间目的基因表达水平的差异,校正后即为:ΔCt(目的基因)=Ct(β-actin)–Ct(目的基因)。为了计算得出基因相对表达量,还需要将ΔCt值转化为线性分度,再将实验组的数值除以对照组,最终得到标准化后的目的基因的相对表达量。
1.8 Western blottingWestern blotting实验测定野生小鼠和β2m-KO小鼠不同免疫器官中目标基因的蛋白水平。实验步骤如下所述,首先进行蛋白的提取和蛋白定量,将取出的组织块放入离心管中,加入适量磁珠和RIPA裂解液,6 000 r/min振荡30 s破碎2次,冰浴10 min。随后进行离心,4 ℃、12 000 r/min离心15 min,去除沉淀,得到的上清即为该组织蛋白。其次测定蛋白浓度,根据上海碧云天生物技术公司产品BCA蛋白浓度测定试剂盒(增强型) 的使用说明书进行蛋白定量,测得不同组织蛋白样品的浓度。然后取20 μg的蛋白加入等体积的上样缓冲液,在100 ℃的水浴锅中煮沸10 min,使蛋白变性。最后进行Western blotting实验。此实验具体过程如下,首先将上述变性后的20 μg蛋白样品进行电泳、转膜、封闭的过程,使蛋白吸附于硝酸纤维素膜(Nitrocellulose filter membrane,简称NC膜),然后将NC膜放置于4 ℃冰箱孵育一抗过夜。第2天,取出该膜用PBST清洗3次,每次5 min,去除多余的一抗。然后孵育荧光二抗,孵育条件为室温避光1 h。再次取出该膜用PBST清洗3次,每次5 min,去除多余的二抗。最后用Odyssey的双色红外激光成像仪进行成像。
1.9 流式细胞分析各免疫器官的细胞表型野生型小鼠及β2m基因敲除小鼠分别取抗凝血、脾脏和胸腺。外周血取100 μL,加入抗体PE anti-mouse CD3 antibody hh-200 μg (100206,Biolegend)、抗体APC anti-mouse CD8a antibody (100712, Biolegend) 和PE/Cy7 anti-mouse CD4 antibody (100422,Biolegend) 各1.5 μL。室温避光标记30 min,标记结束后加入1 mL红细胞裂解液,裂红5 min。裂解完成后,4 ℃、300×g离心5 min,弃上清。加入1 mL PBS,洗涤细胞沉淀,随后4 ℃、300×g离心5 min,弃上清。200 μL PBS重悬细胞沉淀,上机检测。对于脾脏和胸腺,先在100 μm滤网研磨,研磨后用1 mL红细胞裂解液反复冲洗滤网,将细胞冲洗下来,静置5 min,裂解红细胞。裂解完成后,4 ℃、300×g离心5 min,弃上清,加入1 mL PBS洗涤细胞沉淀。随后,4 ℃、300×g离心5 min,弃上清,加入PBS,调节细胞浓度至107个/mL,取100 μL用于标记。加入抗体PE anti-mouse CD3 antibody hh-200 μg (100206,Biolegend)、抗体APC anti-mouse CD8a antibody (100712,Biolegend) 和PE/Cy7 anti-mouse CD4 antibody (100422,Biolegend) 各1.5 μL,室温避光标记30 min,加入1 mL PBS洗涤细胞沉淀。4 ℃、300×g离心5 min,弃上清,200 μL PBS重悬细胞沉淀,上机检测。
1.10 统计学方法所有实验结果都是使用GraphPad Prism 6软件进行统计学检验的,两组之间的比较使用t检验(Student’s t-test),只有一个影响因素的3组及3组以上的比较首先进行方差齐性分析检验,若方差是齐的则可进行单因素方差分析(One-way ANOVA)。本论文所有的实验结果都是采用平均值±标准误(x±s) 形式,样本量“n”代表本实验的重复次数。P < 0.05用*表示;P < 0.01用**表示;P < 0.001用***表示;P > 0.05用NS (Not significant)表示。
2 结果与分析2.1 获得β2m基因敲除小鼠策略β2m基因编码蛋白β2m,全长119 aa,包含一个信号肽和一个免疫球蛋白样的结构域(图 1A)。为了获得β2m基因敲除小鼠,我们利用CRISPR/ Cas9技术进行构建。首先,我们将Cas9 mRNA和靶向2个不同位点的sgRNA利用显微注射的方式,使之进入C57BL/6小鼠受精卵细胞中(图 1C)。CRISPR/Cas9-sgRNA复合物可以通过对小鼠受精卵细胞进行基因修饰,靶向β2m的外显子1和3?非翻译区(3?UTR) (图 1B),去除小鼠基因组β2m基因的外显子2和外显子3,破坏β2m蛋白的结构和功能。将基因编辑后小鼠受精卵体外培养到囊胚期,然后移植到假孕母鼠的子宫,待其妊娠并产下子代小鼠(图 1C)。
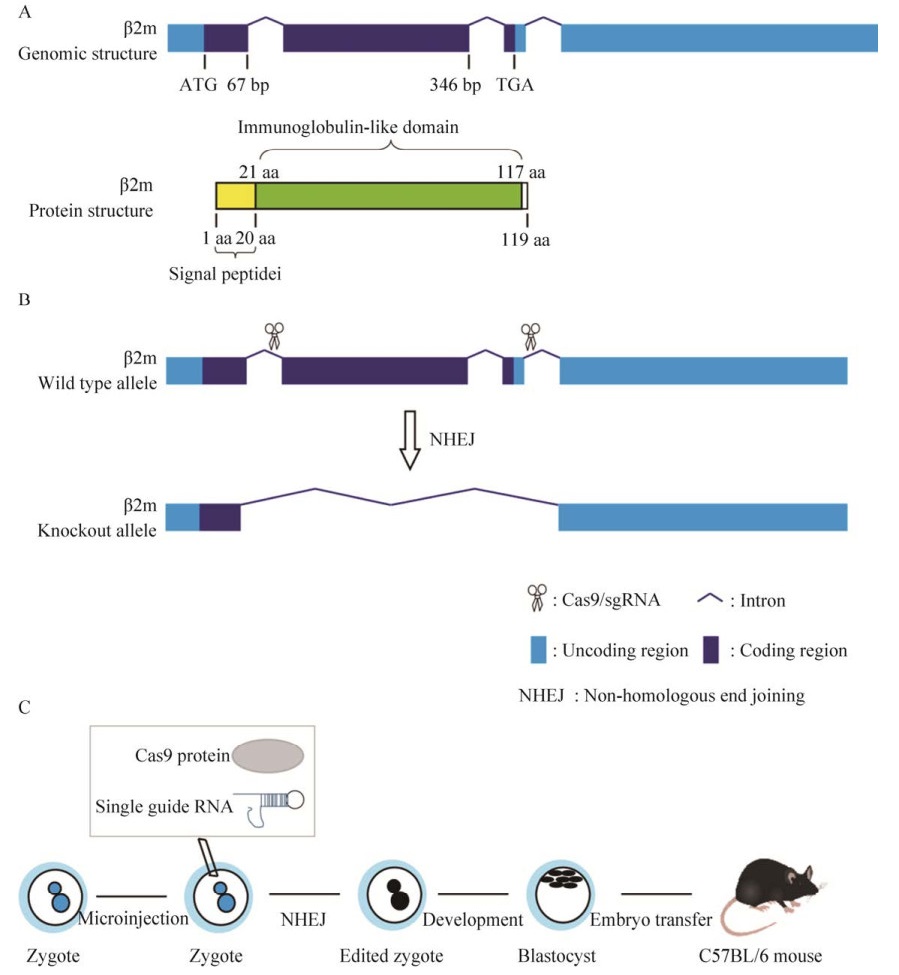 |
| 图 1 β2m基因敲除小鼠构建策略 Fig. 1 Strategy for constructing β2m knockout mice. Schematic representation of the genomic and protein structure of β2m (A), the strategy for knocking out β2m (B), and the procedure for generating β2m knockout mice (C). |
| 图选项 |
2.2 β2m基因敲除小鼠基因型鉴定我们总共将330个受精卵移植到10个假孕母鼠的子宫内,最后获得9只F0代小鼠,利用特异性引物进行基因型鉴定(图 2A),结果显示得到了7只阳性的F0代小鼠(图 2B),编号为2、3、4、5、7、8、9。然后通过回交和自交分别获得F1代的杂合敲除小鼠和F2代的纯合敲除小鼠,基因型鉴定,结果如图 2C所示,基因测序结果显示目标区域发生缺失(图 2D)。基因型鉴定结果表明,我们获得了带有纯合基因型的β2m基因敲除小鼠。
 |
| 图 2 β2m基因敲除小鼠基因型鉴定及序列测定 Fig. 2 Genotyping and sequencing of β2m knockout mice. (A) Strategy of β2m genotyping. (B) Genotyping results of F1 with primers (P2/P3) amplifying a band of 397 bp. (C) Genotyping results of F2 with primers (P2/P3) amplifying bands of 449 bp and 1 575 bp for heterozygous mice, and only a band of 449 bp for homozygous mice, and only a band of 1 575 bp for wild type mice. M, DL2000 DNA marker. (D) Genome sequence of C57BL/6 and homozygous mice. The red text is labeled as the guide RNA sequence. WT: wild type mice. KO: knockout mice, HE, heterozygous mice. HO: homozygous mice. |
| 图选项 |
2.3 β2m基因表达水平检测为了进一步鉴定β2m基因敲除后该基因的表达水平,我们设计了针对β2m基因敲除区的特异性引物(图 3A),每种基因型的小鼠分别选择2只,分别提取其脾脏、胸腺和血液中的RNA。利用靶向敲除区域的特异性引物,通过qPCR实验,比较了野生型C57BL/6小鼠和C57BL/6敲除小鼠不同免疫器官中β2m基因的表达水平。qPCR结果显示,β2m基因表达在不同免疫器官中均有下降。相对于野生型小鼠,杂合小鼠β2m基因表达显著下降,在纯合小鼠的不同免疫器官中β2m基因则完全没有表达(图 3B、3C、3D)。琼脂糖凝胶电泳结果进一步证实了这一现象(图 3E)。结果表明,我们构建的β2m基因敲除小鼠成功实现β2m基因表达下调。
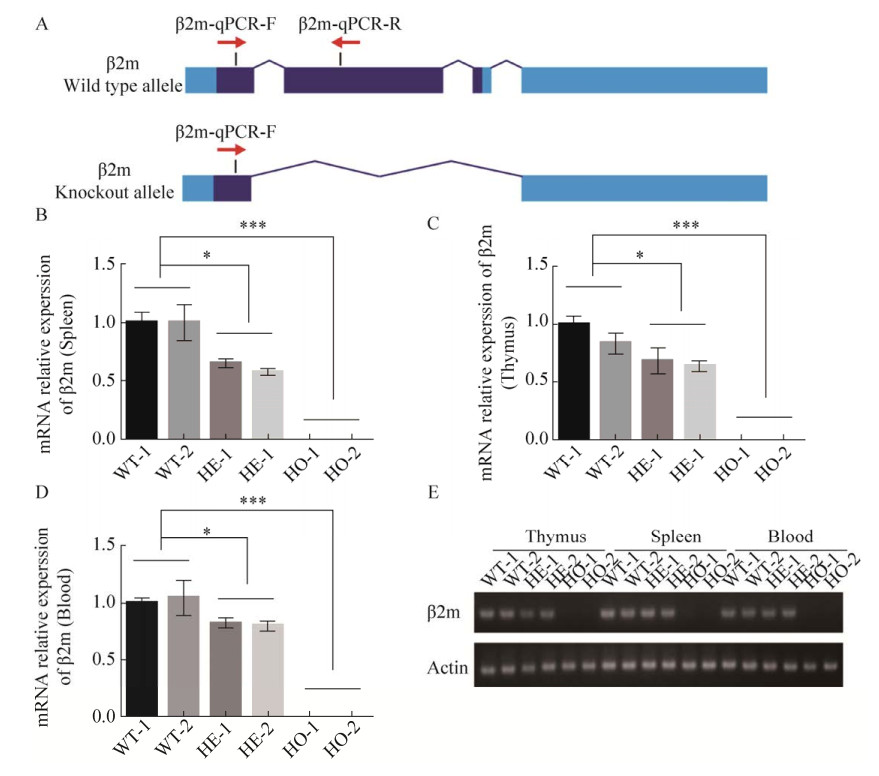 |
| 图 3 KO小鼠β2m基因表达水平检测 Fig. 3 Detection of β2m gene expression. (A) Strategy for identification of β2m knockout mice. (B) Detection of relative expression of β2m mRNA in spleen. (C) Detection of relative expression of β2m mRNA in thymus. (D) Detection of relative expression of β2m mRNA in blood. Error bars: s; n=3; *, P < 0.05; **, P < 0.01, ***: P < 0.001; NS: not significant, P > 0.05; one-way ANOVA followed by Dunnett's multiple comparisons test. (E) Electrophoresis identification results. WT: wild type mice; HE: heterozygous mice; HO: homozygous mice. |
| 图选项 |
2.4 β2m基因敲除小鼠表型鉴定为了鉴定β2m基因敲除小鼠的表型,我们通过流式细胞分析,对比了敲除小鼠与野生小鼠的不同免疫器官中CD4+ T和CD8+ T细胞的数量。首先,我们进一步证实敲除小鼠的不同免疫器官中β2m的表达水平发生显著下调(图 4A、4B)。FACS结果(图 4C)显示,在血液、脾脏和胸腺当中,CD8+杀伤性T细胞的数量显著减少,仅有极少量的CD8+杀伤性T细胞的存在(图 4D)。另外,CD4+ T细胞量有少量增加(图 4E),此结果与先前的研究相一致。综上所述,我们成功构建了β2m基因敲除小鼠。
 |
| 图 4 流式细胞分选鉴定β2m基因敲除小鼠表型 Fig. 4 Phenotype identification of knockout mice by flow cytometry. (A) Detection of relative expression of β2m protein in spleen of each genotype mouse. (B) Detection of relative expression of β2m protein in thymus of each genotype mouse. (C) Comparison of the number of different types of T cells in different immune organs between wild type mice and mutant mice by flow cytometry analysis. (D) Statistical analysis of CD4+ T cell count in different immune organs of C57BL/6 mice with or without β2m knockout. (E) Statistical analysis of CD8+ T cell count in different immune organs of C57BL/6 mice with or without β2m knockout. WT: wild type mice; β2m-KO: β2m knockout mice. |
| 图选项 |
3 讨论器官移植作为晚期器官衰竭的主要治疗选择,在近几十年里受到广泛的关注和应用。在2015年,有接近8000例的肝移植治疗。移植供体不足和移植后的免疫排斥反应仍然是两个主要问题。移植后的免疫排斥反应是由供体组织或器官细胞表面的主要组织相容性复合体(MHC) 介导,激活受体免疫系统产生的免疫反应,最终导致移植器官被破坏无法发挥正常的功能。免疫反应包括免疫细胞直接产生的细胞毒性作用,例如杀伤性T细胞介导的靶细胞的程序性细胞死亡。β2m作为MHC Ⅰ的主要组成成分,曾经被认为在移植后的排斥反应中发挥着重要的作用。与之前的研究相一致的是,我们的实验结果表明,β2m敲除的小鼠CD8+杀伤性T细胞的数量极大减少,仅有少量的CD8+杀伤性T细胞产生,虽然这少量的细胞可能在机体的免疫反应中发挥着重要的作用[30]。另外,CD4+CD8–的杀伤性T细胞发生代偿性的增加。由此,导致CD4+ T细胞/CD8+ T细胞比率增加。有文献报道,在早期感染阶段,旋毛虫会引起机体的免疫抑制,表现为在感染后的第11天,机体免疫细胞CD4+ T细胞/CD8+ T细胞比率发生显著的降低。在机体被病原菌感染时,CD4+ T细胞被激活,进而扩增及分化形成多种不同的辅助性T细胞。然而当CD4+ T细胞被过度激活时,可能会引发自身免疫性疾病。所以,CD4+ T细胞/ CD8+ T细胞比率增加可能会导致机体的炎症反应。β2m敲除的小鼠可以正常生存和增殖,CD8+ T细胞在免疫系统中显著降低。因此,β2m敲除的小鼠动物模型常常被用来研究CD8+杀伤性T细胞在器官移植后的免疫排斥反应中的作用。
近年来,β2m的研究主要集中在其他方面。慢性胃病患者血清中高水平的β2m与慢性胃病的进展呈正相关,与肾小球滤过率呈负相关。透析相关的淀粉样沉积导致机体各关节部位的β淀粉样沉积,沉积的主要成分是β2m。另外,β2m与不同的癌症之间存在着或促进或抑制的关系,可能取决于癌症的类型和肿瘤的进展,但是目前尚无靶向β2m用于治疗这些疾病的药物问世,因此,β2m在这些疾病中作用机制仍需进一步的研究探讨。本研究以基因编辑技术CRISPR/Cas9为基础,构建了β2m基因敲除C75BL/6小鼠,为后续进一步体内实验探究β2m在不同疾病中的功能及作用机制奠定了基础。然而由于人和鼠的免疫系统存在巨大的差异,所以本文的实验结果需慎重看待。
4 致谢感谢复旦大学基础医学院细胞与遗传医学系提供的实验平台,感谢细胞与遗传医学系副主任刘雯老师对本实验的指导,同时,感谢上海南方模式生物有限公司提供的实验用鼠。
参考文献
| [1] | Winchester JF, Salsberg JA, Levin NW. Beta-2 microglobulin in ESRD: an in-depth review. Adv Ren Replace Ther, 2003, 10(4): 279-309. DOI:10.1053/j.arrt.2003.11.003 |
| [2] | Vincent C, Revillard JP. Beta-2-microglobulin and HLA-related glycoproteins in human urine and serum. Contrib Nephrol, 1981, 26: 66-88. |
| [3] | Peterson PA, Cunningham BA, Bergg?rd I, et al. 2-microglobulin——a free immunoglobulin domain. Proc Natl Acad Sci USA, 1972, 69(7): 1697-1701. DOI:10.1073/pnas.69.7.1697 |
| [4] | Scarpioni R, Ricardi M, Albertazzi V, et al. Dialysisrelated amyloidosis: challenges and solutions. Int J Nephrol Renovasc Dis, 2016, 9: 319-328. DOI:10.2147/IJNRD.S84784 |
| [5] | Nakajima Y, Hoshi F, Higuchi S, et al. The complete amino acid sequence of dog beta 2-microglobulin. J Vet Med Sci, 1999, 61(5): 517-521. DOI:10.1292/jvms.61.517 |
| [6] | Filler G, Lepage N, Delisle B, et al. Effect of cyclosporine on mycophenolic acid area under the concentration-time curve in pediatric kidney transplant recipients. Ther Drug Monit, 2001, 23(5): 514-519. DOI:10.1097/00007691-200110000-00003 |
| [7] | Inker LA, Tighiouart H, Coresh J, et al. GFR estimation using β-trace protein and β2-microglobulin in CKD. Am J Kidney Dis, 2016, 67(1): 40-48. DOI:10.1053/j.ajkd.2015.07.025 |
| [8] | Juraschek SP, Coresh J, Inker LA, et al. Comparison of serum concentrations of β-trace protein, β2- microglobulin, cystatin C, and creatinine in the US population. Clin J Am Soc Nephrol, 2013, 8(4): 584-592. DOI:10.2215/CJN.08700812 |
| [9] | Wadhwa R, Yaguchi T, Hasan MK, et al. Hsp70 family member, mot-2/mthsp70/GRP75, binds to the cytoplasmic sequestration domain of the p53 protein. Exp Cell Res, 2002, 274(2): 246-253. DOI:10.1006/excr.2002.5468 |
| [10] | Floege J, Bartsch A, Schulze M, et al. Clearance and synthesis rates of beta 2-microglobulin in patients undergoing hemodialysis and in normal subjects. J Lab Clin Med, 1991, 118(2): 153-165. |
| [11] | Drüeke TB. Cell biology of parathyroid gland hyperplasia in chronic renal failure. J Am Soc Nephrol, 2000, 11(6): 1141-1152. DOI:10.1681/ASN.V1161141 |
| [12] | Drüeke TB. Β 2-microglobulin and amyloidosis. Nephrol Dial Transplant, 2000, 15(suppl_1): 17-24. DOI:10.1093/oxfordjournals.ndt.a027958 |
| [13] | Assenat H, Calemard E, Charra B, et al. Hemodialysis: carpal tunnel syndrome and amyloid substance. La Nouvelle Press Med, 1980, 9(24): 1715. |
| [14] | Gejyo F, Yamada T, Odani S, et al. A new form of amyloid protein associated with chronic hemodialysis was identified as beta 2-microglobulin. Biochem Biophys Res Commun, 1985, 129(3): 701-706. DOI:10.1016/0006-291X(85)91948-5 |
| [15] | Gorevic PD, Casey TT, Stone WJ, et al. Beta-2 microglobulin is an amyloidogenic protein in man. J Clin Invest, 1985, 76(6): 2425-2429. DOI:10.1172/JCI112257 |
| [16] | Aoike I, Fumitake G, Arakawa M, et al. Learning from the Japanese registry: how will we prevent long-term complications?. Nephrol Dial Transplant, 1995, 10(supp7): 7-15. DOI:10.1093/ndt/10.supp7.7 |
| [17] | Hakim RM, Wingard RL, Husni L, et al. The effect of membrane biocompatibility on plasma beta 2-microglobulin levels in chronic hemodialysis patients. J Am Soc Nephrol, 1996, 7(3): 472-478. DOI:10.1681/ASN.V73472 |
| [18] | Pickett TM, Cruickshank A, Greenwood RN, et al. Membrane flux not biocompatibility determines beta-2-microglobulin levels in hemodialysis patients. Blood Purif, 2002, 20(2): 161-166. DOI:10.1159/000047003 |
| [19] | Hartmann J, Fricke H, Schiffl H. Biocompatible membranes preserve residual renal function in patients undergoing regular hemodialysis. Am J Kidney Dis, 1997, 30(3): 366-373. DOI:10.1016/S0272-6386(97)90281-X |
| [20] | Schiffl H, Fischer R, Lang SM, et al. Clinical manifestations of AB-amyloidosis: effects of biocompatibility and flux. Nephrol Dial Transplant, 2000, 15(6): 840-845. DOI:10.1093/ndt/15.6.840 |
| [21] | Koda Y, Nishi S, Miyazaki S, et al. Switch from conventional to high-flux membrane reduces the risk of carpal tunnel syndrome and mortality of hemodialysis patients. Kidney Int, 1997, 52(4): 1096-1101. DOI:10.1038/ki.1997.434 |
| [22] | Miura Y, Ishiyama T, Inomata A, et al. Radiolucent bone cysts and the type of dialysis membrane used in patients undergoing long-term hemodialysis. Nephron, 1992, 60(3): 268-273. DOI:10.1159/000186764 |
| [23] | Teasdale C, Mander AM, Fifield R, et al. Serum β2-microglobulin in controls and cancer patients. Clin Chimica Acta, 1977, 78(1): 135-143. DOI:10.1016/0009-8981(77)90346-1 |
| [24] | Zhang YX, Wang L, Ji PY, et al. Correlation of serum β2-microglobulin levels with prostate-specific antigen, gleason score, clinical stage, tumor metastasis and therapy efficacy in prostate cancer. Arch Med Res, 2013, 44(4): 259-265. DOI:10.1016/j.arcmed.2013.03.008 |
| [25] | Josson S, Nomura T, Lin JT, et al. β2-microglobulin induces epithelial to mesenchymal transition and confers cancer lethality and bone metastasis in human cancer cells. Cancer Res, 2011, 71(7): 2600-2610. DOI:10.1158/0008-5472.CAN-10-3382 |
| [26] | Huang WC, Wu DQ, Xie ZH, et al. β2-microglobulin is a signaling and growth-promoting factor for human prostate cancer bone metastasis. Cancer Res, 2006, 66(18): 9108-9116. DOI:10.1158/0008-5472.CAN-06-1996 |
| [27] | Yang S, Chang R, Yang H, et al. CRISPR/ Cas9-mediated gene editing ameliorates neurotoxicity in mouse model of Huntington's disease. J Clin Invest, 2017, 127(7): 2719-2724. DOI:10.1172/JCI92087 |
| [28] | Bengtsson NE, Hall JK, Odom GL, et al. Muscle-specific CRISPR/Cas9 dystrophin gene editing ameliorates pathophysiology in a mouse model for Duchenne muscular dystrophy. Nat Commun, 2017, 8: 14454. DOI:10.1038/ncomms14454 |
| [29] | Liu C, Chen CY, Shang QH, et al. Establishment of Ace2 knockout mouse model with CRISPR/Cas9 gene targeting technology. Sheng Li Xue Bao, 2019, 71(4): 588-596. |
| [30] | Freland S, Ljunggren HG. Beta 2-microglobulin/CD8-/- mice reveal significant role for CD8+ T cells in graft rejection responses in beta 2-microglobulin-/- mice. Scand J Immunol, 2000, 51(3): 219-223. DOI:10.1046/j.1365-3083.2000.00712.x |
