

山西农业大学 动物医学学院,山西 太谷 030801
收稿日期:2021-03-04;接收日期:2021-04-30;网络出版时间:2021-05-18
基金项目:山西省青年基金(No. 201801D221301),山西农业大学创新团队项目(No. CXTD201201) 资助
摘要:目前,我国饲料中全面禁止添加抗生素,寻找新型的抗生素替代物成为科学研究的热点之一。为获得新的细菌素,本研究以大肠杆菌、沙门氏菌、金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和单增李斯特氏菌为指示菌,通过牛津杯扩散法从羊驼粪便中筛选到高产抑菌物质的芽孢杆菌。基于菌落特征、革兰氏染色和16S rRNA的鉴定结果,将分离到的产抑菌物质菌株命名为地衣芽孢杆菌SXAU06株。采用硫酸铵沉淀、氯仿抽提、分子截留和SDS-PAGE等技术对所产抑菌物质进行分离纯化,经LC-MS/MS和生物信息学分析发现,抑菌物质为分子量约14 kDa的类细菌素,将其命名为BLIS_SXAU06。耐受性试验结果显示,BLIS_SXAU06具有耐高温、耐酸碱和耐蛋白酶K的特性。利用大肠杆菌表达系统对BLIS_SXAU06进行重组表达,所获得的重组BLIS_SXAU06具有抑制金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和单增李斯特氏菌生长的活性。综上所述,BLIS_SXAU06具有优良的特性,可进一步在农业生产、生物医药和食品加工领域开展研究。
关键词:地衣芽孢杆菌类细菌素抑菌活性热稳定pH稳定
Isolation, identification and prokaryotic expression of a bacteriocin-like substance from Bacillus licheniformis
Xiuju Yu, Xiaotao Han, Yuyu Li, Zheng Sun, Changsheng Dong


College of Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, Shanxi, China
Received: March 4, 2021; Accepted: April 30, 2021; Published: May 18, 2021
Supported by: Youth Foundation of Shanxi Province, China (No. 201801D221301), Innovation Team of Shanxi Agricultural University (No. CXTD201201)
Corresponding author: Changsheng Dong. Tel: +86-354-6289208; E-mail: dongchangsheng@126.com.
Abstract: The ban on addition of antibiotics in animal feed in China has made the search for new antibiotics substitutes, e.g. bacteriocin, a hot topic in research. The present study successfully isolated an antibacterial substance producing strain of Bacillus sp. from alpaca feces by agar diffusion method, using Escherichia coli, Salmonella enterica, Staphylococcus aureus, Staphylococcus epidermidis, Micrococcus luteus and Listeria monocytogenes as indicator bacteria. The isolated strain was named as B. licheniformis SXAU06 based on colony morphology, Gram staining and 16S rRNA gene sequence. The antibacterial substance was isolated and purified through a series of procedures including (NH4)2SO4 precipitation, chloroform extraction, molecular interception and SDS-PAGE analysis. Bioinformatics analysis of the LC-MS/MS data indicated that the antibacterial substance was a bacteriocin-like substance (BLIS) with an approximate molecular weight of 14 kDa, and it was designated as BLIS_SXAU06. BLIS_SXAU06 exhibited high resistance to treatment of proteinase K, high temperature, high acidity and alkalinity. BLIS_SXAU06 was heterologously expressed in E. coli and the recombinant BLIS_SXAU06 exhibited effective antibacterial activity against S. aureus, S. epidermidis, M. luteus, and L. monocytogenes, showing potential to be investigated further.
Keywords: Bacillus licheniformisbacteriocin-likeantibacterial activitythermal stabilitypH stability
细菌素是一类通过某些细菌的核糖体合成产生的具有抑制亲缘微生物生长的多肽、蛋白类抗菌物质。通过细菌素数据库BACTIBASE (http://bactibase.pfba-lab.org)和蛋白质结构数据库PDB (http://www.rcsb.org/)对已知细菌素的比较,结果显示,不同细菌素的氨基酸组成、电荷数、疏水性和极性、空间排列和构象存在很大的差异[1]。细菌素的多样性特征为其在抗菌领域的应用提供了丰富的选择材料[2]。近年来,随着抗生素残留和耐药菌在卫生、食品、养殖等领域的不断出现,新型抗生素替代品的研究备受关注[3],细菌素因其有别于抗生素的抑菌作用机制、不易产生耐药性和无毒无害的特点,成为最有可能替代抗生素的物质之一[4]。
芽孢杆菌产生的细菌素是继乳酸菌细菌素之后的又一类重要的细菌素,与乳酸菌细菌素相比,芽孢杆菌细菌素抗菌谱更广,并具有较强的耐高温、耐酸碱等特性[5-6],这些优良特性提示芽孢杆菌产生的(类) 细菌素具有广泛的应用前景[7-8]。截至目前,已分离到的芽孢杆菌细菌素有80余种,类细菌素20余种,分别是由地衣芽孢杆菌Bacillus licheniformis、枯草芽孢杆菌Bacillus subtilis、解淀粉芽孢杆菌Bacillus amyloliquefaciens、苏云金芽孢杆菌Bacillus thuringiensis、蜡样芽孢杆菌Bacillus cereus和凝结芽孢杆菌Bacillus coagulans等属的菌株产生。研究过程中发现,(类) 细菌素是细菌产生的天然成分,其分子量虽小,但伴随其合成往往需要一簇基因的共同表达才可以完成[9-11],且与众多物质混合,存在产量低、分离纯化难度大等问题。利用基因工程技术合成细菌素是一条高效、低成本的生产途径[12]。据现有文献报道,鲜有从获取细菌素的基因序列入手,通过体外表达系统获取细菌素的研究。本文旨在从羊驼粪便中筛选具有高产细菌素的芽孢杆菌,通过细菌素的分离纯化和质谱分析获得(类) 细菌素的氨基酸序列,利用大肠杆菌表达系统对细菌素进行体外表达并检测其抑菌活性,同时对该类细菌素的生物学特性进行鉴定,为细菌素的获取和应用奠定理论基础。
1 材料与方法1.1 指示菌与试剂指示菌:大肠杆菌Escherichia coli CMCC44102、甲型副伤寒沙门氏菌Salmonella paratyphi A CMCC(B)50001、金黄色葡萄球菌Staphylococcus aureus CMCC26003、表皮葡萄球菌Staphylococcus epidermidis CMCC(B)26069、藤黄微球菌Micrococcus luteus CMCC(B)28001、单增李斯特氏菌Listeria monocytogenes ATCC19111,保存于山西农业大学羊驼生物工程实验室。
牛津杯扩散法所用双层培养基:下层板为2%琼脂培养基,上层板为15 mL含107 CFU/mL指示菌的0.75% TSA培养基(胰蛋白胨15.0 g,大豆蛋白胨5.0 g,氯化钠30.0 g,琼脂7.5 g,加蒸馏水至1 L) 或者0.75% BHI培养基(38.5 g脑心浸液肉汤颗粒,琼脂7.5 g,加蒸馏水至1 L)。氯化钠、氯仿等生化试剂购自中国医药集团有限公司;硫酸铵、革兰氏染色试剂盒和SDS-PAGE凝胶制备试剂盒等购自北京索莱宝科技有限公司;3 kDa、10 kDa超滤离心管和0.22 μm无菌滤器购自Millipore公司。
1.2 产细菌素芽孢杆菌的筛选和鉴定在山西农业大学羊驼养殖基地,随机采取10头羊驼的粪便,参照研究报道的方法[4]进行分离,按照0.2 g/头用PBS将羊驼粪便制成均匀的悬液,37 ℃孵育1 h后,进行10倍梯度稀释,涂布于LB平板,37 ℃培养12 h,观察菌落形态、大小和颜色等特征,结合革兰氏染色情况,挑选菌落并进行编号。划线纯化4次后,牛津杯扩散法测定挑选菌株发酵上清液的抑菌活性。
通过抑菌效果的比较,获得一株抑菌活性最佳的菌株,对其进行16S rRNA菌种鉴定,步骤如下:以提取的菌体DNA作为模板,利用通用引物进行16S rRNA全长序列的PCR扩增。所用的引物序列如表 1所示。1%琼脂糖凝胶电泳鉴定PCR产物大小。将扩增产物送至北京六合华大基因科技有限公司进行16S rRNA分子鉴定。运用NCBI的BLAST进行核苷酸序列的比对,使用Cluster Omega在线分析软件,构建系统发育树,分析分离菌株的同源性和菌种归属。
表 1 16S rRNA鉴定所用引物Table 1 Primers used for 16S rRNA identification
| Primer name | Sequence (5′?3′) |
| 27f | AGAGTTTGATCMTGGCTCAG |
| 1492R | TACGGYTACCTTGTTACGACTT |
表选项
1.3 细菌素的分离纯化硫酸铵沉淀:用饱和度为60%的硫酸铵对1 L无细胞上清液进行盐析,室温下磁力搅拌器低速搅拌6 h后,10 000×g、4 ℃离心20 min,1/40体积的PBS重悬沉淀;氯仿抽提:硫酸铵沉淀所获溶液与氯仿按照1︰1体积比混合,振荡15 min后静置10 min,4 500×g、4 ℃离心10 min,收集中间相,真空浓缩仪进行干燥,PBS重悬沉淀物;分子截留:利用3 kDa和10 kDa超滤离心管进行分子截留,获得>10 kDa、3–10 kDa和<3 kDa的蛋白液;SDS-PAGE分析:一个泳道进行考马斯亮蓝染色,另两个泳道用0.1% Tween 80清洗3次,30 min/次,之后MilliQ水清洗30 min除去SDS,一个泳道的整条胶、另一泳道的分段胶移至LB平板,在其上倾倒含有107 CFU/mL金黄色葡萄球菌的0.75% TSA培养基,37 ℃培养过夜,测定其抑菌效果。分离纯化的每一步后均进行抑菌活性检测。
1.4 细菌素对温度、pH、人工胃液和人工肠液的耐受性测定将纯化后的细菌素溶液,分别在70 ℃、80 ℃、90 ℃、100 ℃条件下处理30 min,121 ℃高压处理30 min,4 ℃放置6个月。待处理溶液冷却后采用牛津杯扩散法测定其抑菌活性,以未处理的类细菌素溶液作为对照。
将纯化后的细菌素溶液分别调pH值至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,37 ℃下孵育6 h后将pH值调至7.0,检测其抑菌活性,以pH 7.0的类细菌素溶液作为对照。
纯化后的细菌素溶液用1 mg/mL的蛋白酶K、胰蛋白酶、DNase、RNase和链霉蛋白酶E,37 ℃处理1 h,测定不同酶处理后的细菌素的抑菌活性,以未处理的类细菌素溶液作为对照。
参考中华人民共和国兽药典的方法[13],配置人工胃液(Simulated gastric fluid,SGF) (配置pH值为2.0、3.0、4.0的稀盐酸溶液,高压灭菌。在无菌条件下,1 g/100 mL比例加胃蛋白酶) 和人工肠液(Simulated intestinal fluid,SIG) (磷酸二氢钾6.8 g加入500 mL水摇匀后用NaOH调pH至6.8,另加水溶解胰酶10 g,将两液混合后定容至1 000 mL。在制好的溶液中加入猪胆盐,配置含有0.1%、0.3%、0.9%猪胆盐的肠液)。取10 mL的细菌素溶液分别与90 mL的不同pH的人工胃液或不同浓度胆盐的人工肠液混合,37 ℃条件下作用6 h,采用牛津杯扩散法测定其抑菌活性,细菌素溶液与PBS按照体积比1︰9混合作为对照。
1.5 质谱及生物信息学分析将具有抑菌活性的SDS电泳胶条送至北京六合华大基因科技有限公司,进行质谱分析。通过UltiMate3000 (Dionex)和Q Exactive (Thermo Fisher Scientific) LC-MS/MS质谱仪系统进行蛋白分析。运用Mascot软件(Matrix Science)、NCBI和ExPASy-ProtParam tool进行UniProt、比对、覆盖率等生物信息学分析,预测分离菌SXAU06所产细菌素的氨基酸序列。根据大肠杆菌密码子偏好性,优化合成预测抗菌蛋白的基因序列。
1.6 类细菌素的原核表达与纯化重组质粒的构建:根据优化后的类细菌素基因序列,设计构建表达载体的特异性引物,上、下游引物分别引入BamHⅠ和SalⅠ酶切位点。所设计的引物序如表 2所示。以优化序列为模板,PCR扩增基因序列。PCR产物进行琼脂糖凝胶电泳检测和回收纯化后,用限制性内切酶BamHⅠ和SalⅠ进行双酶切,与同样经过双酶切的pCold-Ⅰ表达质粒进行连接构建重组质粒,通过测序和酶切鉴定重组质粒的正确性。
表 2 表达的类细菌素基因引物序列Table 2 Primers of BLIS gene to be expressed
| Primer name | Sequence (5′?3′) |
| F | TAACGGGATCCAAAAAGATCTTCGTGAGCCT |
| R | TTGATGTCGACTTAATTACTAAATTCCGAAA |
表选项
原核表达:将重组质粒转化至E. coli感受态细胞,次日挑单菌落,37 ℃培养12 h,按1% (V/V)转接入含氨苄青霉素(Ampicillin,Amp)的LB培养基中,在37 ℃培养至OD600为0.6时,加入诱导剂IPTG,同时设定不加诱导剂的对照组,15 ℃、150 r/min诱导12 h。离心收集菌体,用PBS重悬菌体,吹打均匀,超声破碎,离心收集超声后的上清和沉淀,进行SDS-PAGE检测。
蛋白纯化:利用NI-IDA-Sepharose Cl-6B镍亲和层析柱在AKTA Pure进行纯化。条件为:波长280 nm,流速1 mL/min;平衡缓冲液为20 mmol/L Tris-HCl,20 mmol/L咪唑,0.15 mmol/L NaCl,pH 8.0;洗脱缓冲液为20 mmol/L Tris-HCl,250 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0。收集洗脱峰蛋白溶液至透析袋中,PBS透析过夜。样品进行SDS-PAGE和Western blotting分析。
1.7 重组蛋白的抑菌活性检测以金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和单增李斯特氏菌为指示菌,采用牛津杯扩散法对重组蛋白的抑菌活性进行检测。同时设定Amp为阳性对照,PBS为阴性对照。分别在孔中加入180 μL的待测样品,将抑菌平板放置到培养箱中37 ℃条件下培养12 h,观察并记录抑菌效果。
2 结果与分析2.1 分离株发酵上清的抑菌作用通过菌落形态观察和革兰氏染色镜检初步筛选到20株疑似芽孢杆菌(编号为SXAU01-20)。分离株发酵上清的抑菌结果显示:分离株SXAU06的无细胞上清液的浓度为1.568 μg/μL,对金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和单增李斯特氏菌具有较好的抑菌活性(表 3)。
表 3 分离株SXAU06发酵上清的抑菌活性检测Table 3 Antibacterial activity assay using the cell-free supernatant of strain SXAU06
| The diameter of the inhibition zones (mm) | ||||||
| Strain | E. coli | Salmonella | S. aureus | S. epidermidis | M. luteus | L. monocytogenes |
| SXAU06 | 0 | 0 | 22.38±0.08 | 21.40±0.15 | 20.08±0.13 | 17.51±0.10 |
表选项
2.2 分离株的鉴定分离株SXAU06菌落呈灰白色,菌落边缘不整齐呈不规则,菌落表面不光滑不透明,中等大小,形成“粘液状的花形”菌落(图 1A);经革兰氏染色后呈紫色短杆状,细胞单个或成对存在,不呈链状排列(图 1B);琼脂糖电泳结果显示其PCR扩增产物大小为1 386 bp,与预计大小一致(图 1C);16S rRNA鉴定结果显示:SXAU06菌在系统发育进化树上与地衣芽孢杆菌为同一簇,且与地衣芽孢杆菌(NR_118996.1) 相似度高达99% (图 1D),因此,将其命名为地衣芽孢杆菌B. licheniformis SXAU06。
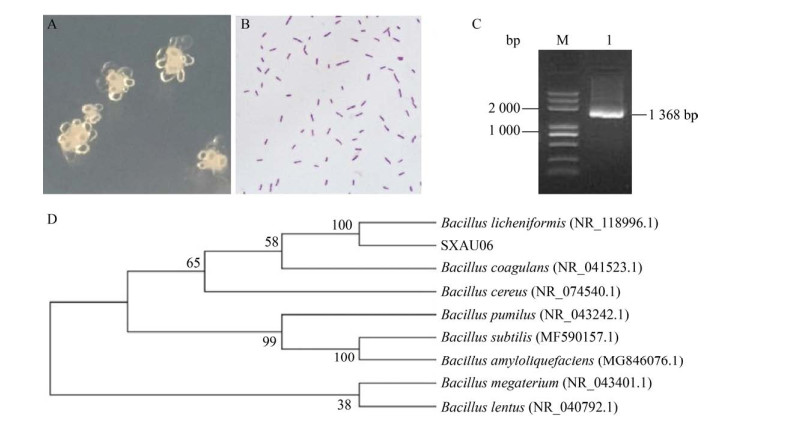 |
| 图 1 分离株SXAU06的鉴定 Fig. 1 Identification of the isolate SXAU06. (A) Growth morphology. (B) Gram staining morphology. (C) 16S rRNA amplification electrophoresis. (D) Phylogenetic tree. |
| 图选项 |
2.3 细菌素的纯化结果对B. licheniformis SXAU06产生的细菌素进行分离纯化。1 L无细胞发酵上清液通过60%饱和硫酸铵盐析获得25 mL粗提液,粗提液通过氯仿抽提、真空干燥、PBS重悬获得与粗提液相同体积的抽提液,抽提液进行分子截留后,获得分子量<3 kDa、3–10 kDa之间和>10 kDa的粗蛋白液,分别测定粗提液、抽提液和粗蛋白液的抑菌活性。抑菌结果如图 2所示,与分子量<3 kDa、3–10 kDa粗蛋白液的抑菌活性相比,>10 kDa的粗蛋白液具有较强抑菌活性。在SDS-PAGE凝胶10–15 kDa的位置有明显的抑菌区域。结果表明,B. licheniformis SXAU06所产抗菌物质是10–15 kDa的蛋白质。
 |
| 图 2 地衣芽孢杆菌SXAU06产生的抑菌物质在分离纯化过程中的抑菌活性检测 Fig. 2 Antibacterial activity assay of the antibacterial substance produced by B. licheniformis SXAU06 during the purification process. (A) Antibacterial activity after ammonium sulfate precipitation. (B) Antibacterial activity after chloroform extraction. (C) Negative control. (D) Antibacterial activity after ultrafiltration collection. (E) SDS-PAGE analysis of purified protein (> 10 kDa) solution and detection of antibacterial activity on gel. (a) Gel overlaid with S. aureus showed a clearing inhibitory zone, indicating antibacterial activity was associated with the band < 5 kDa. (b) SDS-PAGE. M: protein ladder; 1: sample. (c) Gel overlaid with S. aureus showed a clearing inhibitory zone, indicating antibacterial activity was associated with the 10–15 kDa band. |
| 图选项 |
2.4 质谱和生物信息学分析B. licheniformis SXAU06的LC-MS/MS质谱分析得到85种蛋白,肽段覆盖率>10%的蛋白如表 4所示。通过NCBI比对和ExPASy-ProtParam分析,结合SDS-PAGE分析和抑菌活性鉴定结果初步判定B. licheniformis SXAU06所产生的抑菌物质可能是蛋白大小约为14 kDa的未知蛋白,根据该蛋白的氨基酸序列和结构特点,该蛋白属于类细菌素的一种,其序列的NCBI登录号为:tr|A0A0D7XDH3|A0A0D7XDH3_BACAM。将其命名为BLIS_SXAU06。
表 4 抑菌蛋白LC-MS/MS鉴定结果Table 4 LC-MS/MS identification of antibacterial substance
| Description | Mass | Score | Coverage (%) |
| Stress response protein YvgO | 19.834 | 1 168 | 27 |
| Glucuronoxylanase | 47.259 | 1 151 | 37 |
| Uncharacterized protein | 14.047 | 1 022 | 34 |
| Beta-glucanase | 26.809 | 884 | 33 |
| Endo-14-beta-xylanase A | 48.669 | 792 | 16 |
| Uncharacterized protein | 17.032 | 769 | 38 |
| Spore cortex-lytic enzyme SleL | 49.995 | 696 | 35 |
| Uncharacterized protein | 60.560 | 622 | 24 |
| Arabinoxylan arabinofuranohydrolase | 46.880 | 558 | 13 |
| 2′, 3′-cyclic nucleotide 2′-phosphodiesterase | 14.885 | 427 | 12 |
表选项
2.5 类细菌素的温度、pH、人工胃液和人工肠液稳定性BLIS_SXAU06具有较好的热稳定性和pH稳定性。该细菌素在100 ℃条件下处理30 min后抑菌活性为100%,121 ℃处理30 min后抑菌活性为50%,4 ℃放置6个月,仍保持100%的抑菌活性。该细菌素在pH 2.0–12.0条件下,抑菌活性稳定,保持原有活性。BLIS_SXAU06对蛋白酶K不敏感,对胰蛋白酶较为敏感,保留抑菌活性的40%,对链霉蛋白酶E (Pronase E) 最敏感,抑菌活性完全丧失(表 5)。BLIS_SXAU06具有较强的耐胆碱和耐胃蛋白酶能力,在pH 2.0条件下胃蛋白酶作用6 h后抑菌活性为55%,抑菌活性随着pH值的上升而增加。在0.9%胆盐浓度条件下作用6 h后抑菌活性为45.6%,抑菌活性随着胆盐浓度的下降而增加(图 3)。
表 5 温度、pH和酶对BLIS_SXAU06抑菌活性的影响Table 5 Effects of temperature, pH and enzyme on the antimicrobial activity of BLIS_SXAU06
| Treatment | Residual activity (%)* | Treatment | Residual activity (%)* |
| Heat | pH | ||
| 70 ℃, 30 min | 100 | 2.0 | 100 |
| 80 ℃, 30 min | 100 | 3.0 | 100 |
| 90 ℃, 30 min | 100 | 4.0 | 100 |
| 100 ℃, 30 min | 100 | 5.0 | 100 |
| 121 ℃, 30 min | 50 | 6.0 | 100 |
| 4 ℃, 6 months | 100 | 7.0 | 100 |
| Enzymes | 8.0 | 100 | |
| Proteinase K | 100 | 9.0 | 100 |
| Trypsin | 40 | 10.0 | 100 |
| RNase/DNase | 100 | 11.0 | 100 |
| Pronase E | 0 | 12.0 | 100 |
| *Residual activity compared with antimicrobial activity before the treatment. | |||
表选项
 |
| 图 3 SGF和SIF对BLIS_SXAU06抑菌活性的影响 Fig. 3 Effect of SGF and SIF on the antimicrobial activity of BLIS_SXAU06. |
| 图选项 |
2.6 BLIS_SXAU06的表达和纯化SDS-PAGE分析结果显示,外源诱导表达的BLIS_SXAU06是以可溶性上清蛋白和包涵体蛋白两种形式表达(图 4A)。重组BLIS_SXAU06经过纯化后,SDS-PAGA分析结果显示,纯化后的类细菌素蛋白为单一条带(图 4B)。Western blotting结果表明,重组BLIS_SXAU06能够与鼠抗His单克隆抗体特异性结合,蛋白大小与预计大小相符(图 4C)。
 |
| 图 4 重组BLIS_SXAU06的表达纯化 Fig. 4 Expression and purification of the recombinant BLIS_SXAU06. (A) SDS-PAGE analysis of the recombinant BLIS_SXAU06. M: protein marker; 1: non-induced; 2: induced; 3: supernatant; 4: pellet. (B) SDS-PAGE analysis of the purified recombinant BLIS_SXAU06. M: protein marker; 1: samples after ultrasonic lysis; 2: flow-through; 3: elution. (C) Western blotting analysis of the recombinant BLIS_SXAU06. M: protein marker; 1: purified recombinant BLIS_SXAU06. |
| 图选项 |
2.7 重组BLIS_SXAU06的抑菌活性检测重组BLIS_SXAU06具有抑制金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和单增李斯特氏菌生长的活性(图 5A–D),PBS阴性对照孔周围的细菌生长未受到抑制(图 5E),Amp阳性对照孔周围的细菌生长受到了明显的抑制(图 5F)。结果表明,由原核表达系统表达的重组BLIS_SXAU06具有良好的抑菌活性。
 |
| 图 5 重组BLIS_SXAU06的抑菌活性检测 Fig. 5 Antibacterial activity of the recombinant BLIS_SXAU06. (A) S. aureus. (B) S. epidermidis. (C) M. luteus. (D) L. monocytogenes. (E) PBS (negative control). (F) Ampicillin (positive control). |
| 图选项 |
3 讨论芽孢杆菌作为动植物微生态的优势菌之一,不仅种类繁多,来源广泛,具有易培养、抗逆性好、加工损失少等特点[14-15],而且孕育着丰富的细菌素资源。分离和筛选具有拮抗功能的芽孢杆菌菌株及其细菌素,并对其作用、生物特性和应用进行研究,不仅可以拓展芽孢杆菌及其细菌素的研究范围,而且可以为细菌素的利用提供更丰富的选择。近年来,有研究者从多种样品中分离到具有不同功能的芽孢杆菌及其(类) 细菌素。Xin等[16]从藏猪肠道中筛选到芽孢杆菌菌株TS,并分离到具有抑制大肠杆菌和金黄色葡萄球菌生长的细菌素TP。Sharma等[17]从土壤样品中筛选到产细菌素的B. subtilis GAS101,其所产细菌素对大肠杆菌和表皮葡萄球菌的生长具有抑制作用,且具有耐高温、耐酸碱的特性。Chauhan等[18]筛选到有效抑制抗甲氧西林金黄色葡萄球菌生长的芽孢杆菌BLIS TSH58。
本研究从羊驼粪便中筛选到B. licheniformis SXAU06,该菌的发酵上清对金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和单增李斯特氏菌的生长具有明显的抑制作用。进一步运用硫酸铵沉淀、氯仿抽提、分子截留和SDS-PAGE以及牛津杯扩散法对B. licheniformis SXAU06发酵上清中细菌素的进行分离和鉴定,经质谱和生物信息学分析预测细菌素的氨基酸序列,初步判断,B. licheniformis SXAU06所产抑菌物质可能为分子量约14 kDa的蛋白。据文献报道,芽孢杆菌细菌素分为以羊毛硫菌素或环状为特征的Ⅰ类细菌素、以0.77–10.00 kDa的小分子线性肽为特征的Ⅱ类细菌素和以大于30 kDa分子量蛋白为特征的Ⅲ类细菌素。而其他许多中等大小的抗菌多肽(10–30 kDa) 和其他由杆菌产生的大分子抗菌蛋白,由于在遗传、分子或氨基酸结构等方面缺乏数据,无法按照分类法进行分类,被统称为BLIS[19]。根据芽孢杆菌细菌素分类法和数据库的比对、分析,本研究分离到的抗菌蛋白属于芽孢杆菌BLIS的一种。
细菌素应用在医药、农业和食品加工领域中,由于热加工是加工过程中最常用的方法,首先要考虑其热稳定性。Lim等研究表明,解淀粉芽孢杆菌RX7所产细菌素100 ℃处理30 min,活性保留80%,具有良好的热稳定性[20]。本文分离到的BLIS_SXAU06可耐受121 ℃处理30 min,具有耐高温特性。乳酸链球菌素(Nisin) 在酸性环境下有很强的活性,但在中性和碱性环境时,活性丧失,这个特征限制了其应用[21-23]。芽孢杆菌细菌素在耐酸碱方面表现突出,Ayed等[24]从解淀粉芽孢杆菌An6发酵产物中分离到BLIS在pH 4.0–10.0条件下仍具有抑菌活性。Minnaard等[25]从蜡样芽孢杆菌分离到的BLIS m6c和BLIS m387,在70 ℃处理30 min活性稳定,在pH 3.0–7.0范围内活性稳定。B. licheniformis SXAU06所产的BLIS_SXAU06在pH 2.0–12.0条件下抑菌活性稳定。不同细菌素对蛋白酶的敏感性不同。地衣素50.2可被链霉蛋白酶E和蛋白酶K完全失活,可被胰蛋白酶部分失活[26]。B. licheniformis SXAU06所产BLIS_SXAU06可被链霉蛋白酶E完全失活,可被胰蛋白酶和胃蛋白酶部分失活,而对蛋白酶K不敏感,这些优良特性使得BLIS_SXAU06在饲料加工、药物治疗等方面具有潜在的应用前景。
根据B. licheniformis SXAU06发酵上清对革兰氏阴性菌基本没有作用的特点,选择大肠杆菌表达系统作为BLIS_SXAU06的表达体系。低温诱导能改变折叠动力学,从而有效地提高可溶性蛋白的比例,减少中间折叠体的聚集,从而降低包涵体的表达比例[27-29],因此,为提高重组BLIS_SXAU06的表达量和分泌表达蛋白的比例,本研究按照大肠杆菌的密码子偏好性对预测蛋白的基因序列进行了密码子优化[30],并以pCold-Ⅰ作为表达质粒,进行低温低速诱导,最终获得了良好的表达效果。
综上所述,本研究从羊驼粪便中筛选到产类细菌素的B. licheniformis SXAU06,所产类细菌素不仅表现良好的抑菌活性、热稳定性、酸碱稳定性,且对人工胃液和人工肠液具有一定的耐受性。通过大肠杆菌表达系统获得了具有抑菌活性的重组BLIS_SXAU06。后续可对B. licheniformis SXAU06和BLIS_SXAU06的生物学功能进行研究,开发其在农业生产、生物医药和食品加工领域的应用。
参考文献
| [1] | Towle KM, Vederas JC. Structural features of many circular and leaderless bacteriocins are similar to those in saposins and saposin-like peptides. Medchemcomm, 2017, 8(2): 276-285. DOI:10.1039/C6MD00607H |
| [2] | 张军, 王祺, 汤伟, 等. 细菌素对产生菌获得生存优势及其诱导合成条件的研究进展. 微生物学通报, 2020, 47(3): 923-932. Zhang J, Wang Q, Tang W, et al. Bacteriocinogeny, the way to acquire survival advantages through biosynthetic regulation: a review. Microbiol China, 2020, 47(3): 923-932 (in Chinese). |
| [3] | De Mol ML, Snoeck N, De Maeseneire SL, et al. Hidden antibiotics: Where to uncover?. Biotechnol Adv, 2018, 36(8): 2201-2218. DOI:10.1016/j.biotechadv.2018.10.008 |
| [4] | Lozo J, Mirkovic N, O'Connor PM, et al. Lactolisterin BU, a novel class Ⅱ broad-spectrum bacteriocin from Lactococcus lactis subsp. lactis bv. diacetylactis BGBU1-4. Appl Environ Microbiol, 2017, 83(21): e01519-17. |
| [5] | Mehdi Y, Létourneau-Montminy MP, Gaucher ML, et al. Use of antibiotics in broiler production: global impacts and alternatives. Anim Nutr, 2018, 4(2): 170-178. DOI:10.1016/j.aninu.2018.03.002 |
| [6] | ?zel B, ?im?ek ?, Ak?elik M, 等. Innovative approaches to nisin production. Appl Microbiol Biotechnol, 2018, 102(15): 6299-6307. |
| [7] | Cotter PD, Ross RP, Hill C. Bacteriocins—a viable alternative to antibiotics?. Nat Rev Microbiol, 2013, 11(2): 95-105. DOI:10.1038/nrmicro2937 |
| [8] | 王瑞, 蔡文涛, 王喜亮, 等. 畜禽中药-益生菌复合微生态制剂的研究进展. 生物工程学报, 2019, 35(6): 972-987. Wang R, Cai WT, Wang XL, et al. Progress in Chinese medicine-probiotics compound microecological preparations for livestock and poultry. Chin J Biotech, 2019, 35(6): 972-987 (in Chinese). |
| [9] | Hertzog BB, Kaufman Y, Biswas D, et al. A sub-population of group A Streptococcus elicits a population-wide production of bacteriocins to establish dominance in the host. Cell Host Microbe, 2018, 23(3): 312-323. DOI:10.1016/j.chom.2018.02.002 |
| [10] | Wang Y, Shang N, Qin Y, et al. The complete genome sequence of Lactobacillus plantarum LPL-1, a novel antibacterial probiotic producing class Ⅱa bacteriocin. J Biotechnol, 2018, 266: 84-88. DOI:10.1016/j.jbiotec.2017.12.006 |
| [11] | Noda M, Miyauchi R, Danshiitsoodol N, et al. Expression of genes involved in bacteriocin production and self-resistance in Lactobacillus brevis 174A is mediated by two regulatory proteins. Appl Environ Microbiol, 2018, 84(7): e02707-17. |
| [12] | 吴怡然, 古小彬, 谢跃, 等. 大熊猫西氏贝蛔虫BsABF基因的原核表达及重组蛋白抗菌活性初步分析. 畜牧兽医学报, 2019, 50(1): 151-158. Wu YR, Gu XB, Xie Y, et al. Prokaryotic expression and primary evaluation of antibacterial activity of antibacterial factor in Baylisascaris schroederi. Chin J Animal Vet Sci, 2019, 50(1): 151-158 (in Chinese). |
| [13] | 中国兽药典委员会. 中华人民共和国兽药典[S]. 2015年版一部, 北京: 中国农业出版社. Commission of Chinese Veterinary Pharmacopeia. Pharmacopoeia of the People's Republic of China[S]. Volume Ⅰ 2015 edition, Beijing: China Agriculture Press. |
| [14] | Kaspar F, Neubauer P, Gimpel M. Bioactive secondary metabolites from Bacillus subtilis: a comprehensive review. J Nat Prod, 2019, 82(7): 2038-2053. DOI:10.1021/acs.jnatprod.9b00110 |
| [15] | Nicholson WL. Roles of Bacillus endospores in the environment. Cell Mol Life Sci, 2002, 59(3): 410-416. DOI:10.1007/s00018-002-8433-7 |
| [16] | Xin H, Ji S, Peng J, et al. Isolation and characterisation of a novel antibacterial peptide from a native swine intestinal tract-derived bacterium. Int J Antimicrob Agents, 2017, 49(4): 427-436. DOI:10.1016/j.ijantimicag.2016.12.012 |
| [17] | Sharma G, Dang S, Gupta S, et al. Antibacterial activity, cytotoxicity, and the mechanism of action of bacteriocin from Bacillus subtilis GAS101. Med Princ Pract, 2018, 27(2): 186-192. DOI:10.1159/000487306 |
| [18] | Chauhan AK, Maheshwari DK, Bajpai VK. Isolation and preliminary characterization of a bacteriocin-producer Bacillus strain inhibiting methicillin resistant Staphylococcus aureus. Acta Biol Hung, 2017, 68(2): 208-219. DOI:10.1556/018.68.2017.2.8 |
| [19] | Abriouel H, Franz CM, Ben Omar N, et al. Diversity and applications of Bacillus bacteriocins. FEMS Microbiol Rev, 2011, 35(1): 201-232. DOI:10.1111/j.1574-6976.2010.00244.x |
| [20] | Lim KB, Balolong MP, Kim SH, et al. Isolation and characterization of a broad spectrum bacteriocin from Bacillus amyloliquefaciens RX7. Biomed Res Int, 2016, 2016: 8521476. |
| [21] | Delves-Broughton J, Blackburn P, Evans RJ, et al. Applications of the bacteriocin, nisin. Antonie Van Leeuwenhoek, 1996, 69(2): 193-202. DOI:10.1007/BF00399424 |
| [22] | Leroy F, de Vuyst L. Temperature and pH conditions that prevail during fermentation of sausages are optimal for production of the antilisterial bacteriocin sakacin K. Appl Environ Microbiol, 1999, 65(3): 974-981. DOI:10.1128/AEM.65.3.974-981.1999 |
| [23] | Penna TCV, Moraes DA. Optimization of nisin production by Lactococcus lactis. Appl Biochem Biotechnol, 2002, 98-100: 775-789. DOI:10.1385/ABAB:98-100:1-9:775 |
| [24] | Ayed HB, Maalej H, Hmidet N, et al. Isolation and biochemical characterisation of a bacteriocin-like substance produced by Bacillus amyloliquefaciens An6. J Glob Antimicrob Resist, 2015, 3(4): 255-261. DOI:10.1016/j.jgar.2015.07.001 |
| [25] | Minnaard J, Alippi AM. Partial characterization of bacteriocin-like compounds from two strains of Bacillus cereus with biological activity against Paenibacillus larvae, the causal agent of American Foulbrood disease. Lett Appl Microbiol, 2016, 63(6): 442-449. DOI:10.1111/lam.12665 |
| [26] | Zou J, Jiang H, Cheng H, et al. Strategies for screening, purification and characterization of bacteriocins. Int J Biol Macromol, 2018, 117: 781-789. DOI:10.1016/j.ijbiomac.2018.05.233 |
| [27] | 徐雪姣, 查向东, 车媛媛, 等. 美洲拟鲽抗菌肽Pleurocidin在大肠杆菌中的高效分泌表达及优化. 生物工程学报, 2016, 32(3): 365-374. Xu XJ, Zha XD, Che YY, et al. Expression of Pleurocidin from winter flounder in Escherichia coli and optimization of culture conditions. Chin J Biotech, 2016, 32(3): 365-374 (in Chinese). |
| [28] | Humer D, Spadiut O. Wanted: more monitoring and control during inclusion body processing. World J Microbiol Biotechnol, 2018, 34(11): 158. DOI:10.1007/s11274-018-2541-5 |
| [29] | Wingfield PT, Palmer I, Liang SM. Folding and purification of insoluble (inclusion body) proteins from Escherichia coli. Curr Protoc Protein Sci, 2001, Chapter 6: Unit6.5. |
| [30] | 陈荫楠, 刘震, 石贤爱, 等. 密码子优化提高多粘类芽孢杆菌β-葡萄糖苷酶异源表达量. 中国生物化学与分子生物学报, 2017, 33(4): 414-422. Chen YN, Liu Z, Shi XA, et al. Improved heterogenous expression of Paenibacillus polymyxa β-glucosidase gene by Codon optimization. Chin J Biochem Mol Biol, 2017, 33(4): 414-422 (in Chinese). |
