

东华大学 化学化工与生物工程学院,上海 201620
收稿日期:2020-09-30;接收日期:2021-01-14;网络出版时间:2021-01-25
基金项目:上海市自然科学基金(No. 19ZR1471000),国家自然科学基金(No. 31470836) 资助
摘要:抗菌肽是目前最有希望的抗生素替代品,但是使用重组技术生产抗菌肽的策略大多步骤烦琐且价格昂贵,不利于抗菌肽的规模化生产。Oxysterlin 1是一种新型的天蚕素抗菌肽,主要对革兰氏阴性菌有抗菌活性,具有较低的细胞毒性。文中利用一种简单经济的方法在大肠杆菌中实现Oxysterlin 1的表达和纯化。将Oxysterlin 1基因克隆到含有弹性蛋白样多肽Elastin-like polypeptide (ELP) 和蛋白质内含肽(Intein) 的载体中,构建重组表达质粒pET-ELP-I-Oxysterlin 1。重组蛋白在大肠杆菌中主要以可溶性形式表达,进而通过简单的盐析和pH改变便可对目标小肽进行纯化。最终得到的Oxysterlin 1的产量约为1.2 mg/L,抑菌试验显示出预期活性,为抗菌肽的规模化生产及深入研究其抑菌机理奠定基础。
关键词:抗菌肽ELP标签蛋白质内含肽抑菌活性
Production of antimicrobial peptide (Oxysterlin 1) in Escherichia coli with ELP self-cleavage tag
Li Guo, Huaxin Liu, Ying Lin


College of Chemistry, Chemical Engineering and Biotechnology, Donghua University, Shanghai 201620, China
Received: September 30, 2020; Accepted: January 14, 2021; Published: January 25, 2021
Supported by: Grants from Science and Technology Commission of Shanghai Municipality, China (No. 19ZR1471000), National Natural Science Foundation of China (No. 31470836)
Corresponding author: Ying Lin. Tel: +86-21-67792648; E-mail: liny@dhu.edu.cn.
Abstract: Antimicrobial peptides are the most promising alternatives to antibiotics. However, the strategy of producing antimicrobial peptides by recombinant technology is complicated and expensive, which is not conducive to the large-scale production. Oxysterlin 1 is a novel type of cecropin antimicrobial peptide mainly targeting on Gram-negative bacteria and is of low cytotoxicity. In this study, a simple and cost-effective method was developed to produce Oxysterlin 1 in Escherichia coli. The Oxysterlin 1 gene was cloned into a plasmid containing elastin-like polypeptide (ELP) and protein splicing elements (intein) to construct the recombinant expression plasmid (pET-ELP-I-Oxysterlin 1). The recombinant protein was mainly expressed in soluble form in E. coli, and then the target peptide can be purified with a simple salting out method followed by pH changing. The final yield of Oxysterlin 1 was about 1.2 mg/L, and the subsequent antimicrobial experiment showed the expected antimicrobial activity. This study holds promise for large-scale production of antimicrobial peptides and the in-depth study of its antimicrobial mechanism.
Keywords: antimicrobial peptidesELP taginteinantimicrobial activity
由于抗生素的过度使用,细菌耐药性尤其是革兰氏阴性细菌对大多数抗生素的耐药性,对公共卫生构成了巨大威胁[1-2],因此迫切需要新型抗生素。抗菌肽存在于大多数生物的先天免疫系统中,包括微生物、昆虫、植物和动物等,具有广谱抗菌活性[3-6],有望成为抗生素替代品。其中昆虫抗菌肽通常通过破坏微生物膜而表现出抗微生物作用,并且不容易使微生物产生耐药性,可以作为新的抗感染药候选者[7]。
Oxysterlin 1是从蜣螂Oxysternon conspicillatum中分离得到的具有39个氨基酸的两亲性阳离子抗菌肽,属于昆虫抗菌肽中的天蚕素类,具有线性的α螺旋结构且不含有半胱氨酸。其主要对革兰氏阴性菌具有抗菌活性,同时细胞毒性较低,故而具有很高的应用价值[3]。
目前天然抗菌肽的产量很低,并且这些化合物通常难以纯化。近年来,为了提高产量,人们已经广泛研究了抗菌肽的异源表达,如大肠杆菌Escherichia coli和巴斯德毕赤酵母菌Pichia pastoris[8-9],特别是大肠杆菌,由于其表达水平高、生长快速和成本低而被普遍使用[10-11]。但是,抗菌肽的固有毒性和易降解特性使其难以在大肠杆菌中直接表达[12],因此靶蛋白通常与亲和标签融合,以中和其对宿主的固有毒性,并使用色谱分离纯化[13-15]。这种方法的缺点是需要昂贵的缓冲液、亲和树脂和设备,并且需要大量的蛋白酶将靶蛋白从亲和标签上切除,这增加了纯化过程的时间和经济成本[16]。因此,从长远来看,亲和层析并不适用于抗菌肽的规模化生产。
弹性蛋白样多肽(ELP) 与蛋白质内含肽(Intein) (EI标签) 的结合可解决这个问题[17]。ELP是一段含有110个重复的VPGXG (X为除脯氨酸之外的任意氨基酸) 多肽链,且存在相变行为。在相变温度(Tt) 以下,它们可溶,但当温度高于Tt时,它们会立即发生聚集,且此过程是可逆的[18-19]。并且,当它与其他蛋白融合表达时,也会保留这种行为[19]。此外当添加盐离子或微微加热时ELP融合蛋白会发生特异性的聚集[20],可以通过简单的离心和温度转变进行纯化。本研究使用的蛋白质内含肽是来源于结核分枝杆菌Mycobacterium tuberculosis的Mtu RecA ΔI-CM,其去除了归巢核酸内切酶结构域,保留了1–110位和383–440位的氨基酸构建成微小型的蛋白质内含肽,并通过定向进化改进了其对pH、温度的敏感性以及C-末端的断裂活性[21-22]。将EI标签和目标蛋白融合表达,可通过降低pH和提高温度触发可控的C-端断裂以释放靶蛋白[23],从而最大程度上保证目标蛋白的活性。
本文使用该系统生产抗菌肽,将Oxysterlin 1融合在ELP和Intein的下游形成ELP-I-Oxysterlin 1融合蛋白(图 1),断裂位点位于ELP-I和Oxysterlin 1之间。在大肠杆菌中诱导表达得到可溶性的融合蛋白,通过蛋白质内含肽的C端断裂获得无外源标签的抗菌肽Oxysterlin 1,抑菌实验初步证明其具有抑菌活性。
 |
| 图 1 重组表达质粒pET-ELP-Ⅰ-Oxysterlin 1示意图 Fig. 1 Schematic representation of the recombinant expression plasmid pET-ELP-Ⅰ-Oxysterlin 1. |
| 图选项 |
1 材料与方法1.1 细菌菌株、载体和酶克隆宿主E. coli Trans1-T1噬菌体抗性化学感受态细胞来自北京全式金生物技术有限公司。E. coli BL21(DE3) (中国科学院) 用作表达宿主;我们实验室保存的大肠杆菌用于抗菌测定;目的基因序列由南京金斯瑞生物科技有限公司合成并构建到pUC57克隆载体上;构建表达载体的质粒pET-ELP-I-CAT来源于David W. Wood教授实验室(美国普林斯顿大学);限制性内切酶BsrGⅠ和Hind Ⅲ及T4 DNA连接酶购自Thermo Fisher Scientific (USA);2×Taq Plus Master Mix购买于南京诺唯赞生物科技有限公司。
1.2 重组表达质粒的构建目的基因(Oxysterlin 1,GenBank登录号:GEXM01019095) 序列从文献中获得[3],并由南京金斯瑞生物科技有限公司合成。设计上游引物5′-CAGTTGTACACAACGGTAGCAAGCGTTGG-3′和下游引物5′-TAGCAAGCTTTCATTAACGAC GGCCAAC-3′将Oxysterlin 1基因序列从pUC57克隆载体中扩增出来,通过2%琼脂糖凝胶电泳分离PCR片段,并用琼脂糖胶回收试剂盒(生工生物工程(上海) 股份有限公司) 纯化。将PCR产物和表达载体pET-ELP-I-CAT分别都使用BsrGⅠ和Hind Ⅲ双酶切,经回收后将两者进行连接以构建重组表达质粒pET-ELP-I-Oxysterlin 1。将克隆好的重组表达质粒送往生工生物工程(上海) 股份有限公司进行测序验证。
1.3 重组融合蛋白ELP-I-Oxysterlin 1的诱导表达将测序成功的质粒转化到E. coli BL21(DE3)细胞中,挑取单菌落到含有100 μg/mL氨苄青霉素(Ampicillin) 的新鲜Luria-Bertani (LB) 培养基(胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L) 中,于37 ℃恒温振荡培养过夜。将过夜培养的菌液以1︰100的比例转接到新鲜的含有100 μg/mL氨苄青霉素的Terrific broth (TB) 培养基(胰蛋白胨10 g/L,酵母提取物5 g/L,磷酸二氢钾2.31 g/L,磷酸氢二钾12.54 g/L) 中,并在37 ℃摇床中培养2–3 h直至OD600约为0.8,添加终浓度0.5 mmol/L的IPTG于37 ℃摇床继续培养3–4 h以诱导蛋白表达。诱导后通过4 ℃、4 000 r/min离心30 min收集菌体细胞,并将菌体在?20 ℃冻存。
1.4 蛋白纯化将收集的菌体以20% (W/V) 的比例重悬于低盐裂解缓冲液(10 mmol/L Tris-HCl,pH 8.5,2 mmol/L EDTA) 中,并通过超声在冰浴中进行破碎裂解(工作5 s,休息7 s,功率为200–300 W)。将细胞裂解物通过4 ℃、12 000 r/min离心30 min收集上清液。在上清液中加入终浓度为0.4 mol/L的硫酸铵后轻轻颠倒试管混匀并在37 ℃水浴中孵育10 min,以沉淀ELP-I-Oxysterlin 1融合蛋白。然后于室温、10 000 r/min下离心10 min,弃去含有可溶性蛋白碎片的上清液,收获含有融合蛋白的沉淀物。将沉淀物立即重悬于冷的低pH断裂缓冲液(PBS中补充有40 mmol/L Tris-Bis,pH 6.2,2 mmol/L EDTA) 中,室温下反应过夜使断裂蛋白质内含肽发生断裂并释放目的蛋白。在断裂过夜的混合液中加入终浓度为0.4 mol/L的硫酸铵后室温孵育10 min,并在室温下10 000 r/min离心10 min,ELP-I和未断裂的ELP-I-Oxysterlin 1沉淀,Oxysterlin 1留在上清中。使用SDS-PAGE和Tricine-SDS-PAGE (北京索莱宝生物科技有限公司) 检测纯化过程。通过Bradford法测定蛋白浓度试剂盒(生工生物工程(上海) 股份有限公司) 确定纯化得到的抗菌肽浓度。考马斯亮蓝G-250可将蛋白质快速染色,以不同浓度的牛血清白蛋白为标准品,测定其在595 nm处吸收峰的值,制作标准曲线。稀释抗菌肽蛋白液使其OD595在标准曲线上,从而确定蛋白浓度。
1.5 Oxysterlin 1的活性验证1.5.1 测定抗菌肽的抑菌活性平板涂布法:将保存的大肠杆菌加入LB培养基中过夜活化,然后将菌液和含有100 μg/mL氨苄青霉素的新鲜的LB培养基以1︰100转接,2–3 h后测OD600约为0.6–0.8使菌生长到对数生长期。将菌液用新鲜LB稀释至起始OD600值约为0.01,然后加入不同浓度的抗菌肽和阴性对照磷酸盐缓冲液(PBS),放入37 ℃摇床中开始计时,孵育4 h时后收菌,用PBS洗涤3次。确定菌浓度,然后将菌液稀释104、105、106倍,分别取50 μL涂布平板,37 ℃恒温培养箱过夜培养。第2天观察抑菌效果,计算抑菌率,抑菌率=[(对照组菌落数?实验组菌落数)/对照组菌落数]×100%[24],试验重复3次,利用函数STDEV计算标准差。
打孔法:挑取大肠杆菌单菌落(5–6个) 接种至50 mL的无抗LB液体培养基中于37 ℃过夜培养,使其生长至OD600约为2.0。然后将过夜的菌液稀释2倍,按照菌液︰灭菌后的固体LB培养基(冷却至48–50 ℃) 为1︰1 000的比例混合均匀后倒入无菌的培养平板中。待其凝固后使用灭菌的打孔器打孔,分别加入抗菌肽、70%乙醇(Ethanol) 和PBS后在4 ℃冰箱预扩散2–3 h,正放于37 ℃恒温培养12–17 h观察抑菌圈。
1.5.2 PI染色法检测Oxysterlin 1对大肠杆菌细胞活力的影响同上述方法离心收集处于对数生长期的细菌细胞,用预冷的PBS洗细胞2次,然后分别用PBS、70% 乙醇、Oxysterlin 1 (1×MIC) 重悬,室温反应1 h,每15 min混合一次。反应后每管加入5 μL碘化丙啶Propidium iodide (PI,10 mg/mL) 染料,避光室温孵育15 min,荧光显微镜下观察细菌细胞[25-26]。
2 结果与分析2.1 重组表达质粒的构建抗菌肽Oxysterlin 1是含有39个氨基酸的小肽,具有连续的α螺旋结构和高疏水性。将合成的基因通过PCR扩增出来(图 2A),通过2%琼脂糖凝胶电泳分离条带,在胶上可以看到大小约为117 bp的清晰条带,与目的基因大小一致。选取BsrGⅠ和Hind Ⅲ这两个酶切位点使目的基因和pET-ELP-I-CAT表达载体产生相同的黏性末端(图 2B)。载体酶切后通过2%琼脂糖凝胶电泳分离条带,可以看到清晰的两条带,且与理论值相符,PCR产物酶切、回收和连接构建pET-ELP-I- Oxysterlin 1重组表达载体。酶切验证(图 2C) 和测序结果表明重组表达质粒构建成功。
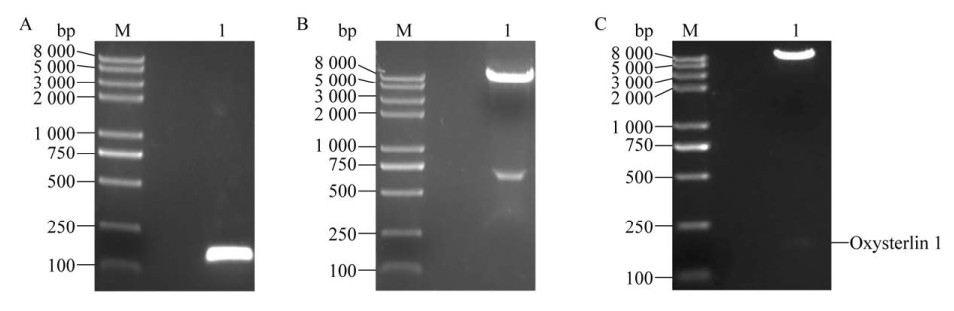 |
| 图 2 重组表达质粒的构建 Fig. 2 Construction of recombinant expression plasmid. (A) Gel electrophoresis of PCR products. Double digestion of pET-ELP-I-CAT (B) and pET-ELP-I-Oxysterlin 1 (C). M: DNA marker. |
| 图选项 |
2.2 重组蛋白表达和纯化将导入重组表达质粒的菌株诱导表达,经SDS-PAGE分析可以观察到诱导后新增69 kDa左右的条带(图 3A,泳道2),表明重组融合蛋白ELP-I-Oxysterlin 1成功表达。将菌体破碎后离心分为上清和沉淀(图 3A,泳道3和4),发现重组蛋白大多以可溶性形式表达在上清中。在上清中加入终浓度为0.4 mol/L的(NH4)2SO4沉淀ELP融合蛋白,从图中可以看出沉淀效率很高,约为95% (图 3A,泳道6),杂蛋白表现为可溶形式(图 3A,泳道5)。将沉淀使用低pH断裂缓冲液重悬(图 3A,泳道7),室温下孵育过夜,Intein发生断裂将目的蛋白释放出来。从图中可以看到发生断裂后的EI蛋白条带和未发生断裂的ELP-I-Oxysterlin 1融合蛋白条带。再次加入终浓度为0.4 mol/L的(NH4)2SO4以沉淀带有ELP-I标签的蛋白(图 3A,泳道9),目的蛋白Oxysterlin 1在上清,经离心后分离获得。由于目的蛋白较小在SDS-PAGE中无法检测到(图 3A,泳道8),采用专门分离小分子量蛋白的Tricine-SDS-PAGE进行检测,可以观察到目标蛋白(图 3B)。通过Bradford法测定Oxysterlin 1蛋白的浓度,经过计算产量约为1.2 mg/L。
 |
| 图 3 重组蛋白表达和纯化 Fig. 3 Recombinant protein expression and purification. (A) SDS-PAGE analysis. M: protein marker. Lane 1: total proteins before induction; lane 2: total proteins after induction; lane 3: supernatant of cell lysate; lane 4: precipitation of cell lysate; lane 5: supernatant from the first precipitation reaction; lane 6: precipitation of the first precipitation reaction; lane 7: resuspended precipitation; lane 8: supernatant from the second precipitation reaction; lane 9: precipitation of the second precipitation reaction. (B) Tricine-SDS-PAGE analysis of target protein. M: protein marker. lane 1: Oxysterlin 1. |
| 图选项 |
2.3 Oxysterlin 1抗菌肽的抑菌活性使用大肠杆菌作为指示菌,测定不同浓度的抗菌肽对其生长的影响。依据文献中报道的Oxysterlin 1抗菌肽的最低抑菌浓度(Minimum inhibitory concentration,MIC) 为6.25 μg/mL[3],选取1×MIC、3×MIC、5×MIC的Oxysterlin 1作为实验组,PBS作为阴性对照组。控制初始菌浓度约为0.01,从放入摇床开始计时4 h后使用平板涂布法检测1×MIC、3×MIC、5×MIC的Oxysterlin 1抑菌活性(图 4A),同时计算其抑菌率分别大约为16.2%、55.3%、62.1%。
 |
| 图 4 Oxysterlin 1的抑菌活性 Fig. 4 Identification of the antimicrobial effect of Oxysterlin 1. (A–B) Plate coating method to determine the antimicrobial activity of 1×MIC, 3×MIC and 5×MIC Oxysterlin 1 and calculate the inhibition rate of bacterial growth. (C) Identification of the antibacterial activity of Oxysterlin 1 by perforating method. 1: 2×MIC Oxysterlin 1; 2: 70% ethanol; 3: PBS. |
| 图选项 |
使用打孔法测定抑菌活性,2×MIC的Oxysterlin 1作为实验组,PBS作为阴性对照组,70%乙醇作为阳性对照组,根据是否形成抑菌圈判断抗菌肽的抑菌效果。从图 4C中可以观察到2×MIC Oxysterlin 1形成的抑菌圈(图 4C),经过测量确定其直径约为12 mm,说明Oxysterlin 1具有一定的抑菌效果。
2.4 PI染色法检测Oxysterlin 1对大肠杆菌细胞活力的影响为了更直观地观察抗菌肽的体外抑菌活性,使用PI染料对细菌细胞进行染色,其可以穿过破损的细胞膜从而嵌入双链DNA释放红色荧光,但是不能穿透活细胞的细胞膜[27-28]。因此细菌细胞的活力通过碘化丙啶PI染色法对受损的大肠杆菌的DNA染色所发出的荧光确定的。以PBS处理的细胞作为阴性对照组,70%乙醇处理的作为阳性对照组,Oxysterlin 1 (1×MIC) 处理的作为实验组。从图中我们可以看到使用Oxysterlin 1处理的实验组的红色荧光明显比阴性对照组显著增多(图 5),说明原核表达的抗菌肽具有抑菌活性,对大肠杆菌细胞会产生破坏作用。
 |
| 图 5 Oxysterlin 1对大肠杆菌细胞活力的影响 Fig. 5 Effect of Oxysterlin 1 on the cell viability of E. coli. (A) Propidium iodide (PI) staining of E. coli cells treated with PBS, 70% ethanol and Oxysterlin 1, respectively. (B) Percentage of E. coli cells stained with PI. |
| 图选项 |
3 讨论天蚕素作为昆虫抗菌肽的最大类别之一,由于其来源广泛、抗菌活性高且毒性低等特点引起了人们的兴趣[29]。目前对天蚕素和天蚕素类似物已进行了多项研究,以解释天蚕素对病原体的作用机制,并鉴定肽中特定残基的功能。大多数成熟天蚕素的第1位或第2位的色氨酸残基被认为对其抗菌活性很重要,并且其C末端残基的酰胺化会增加肽的抗菌活性和抗菌谱[29]。尽管目前公认天蚕素不与特定的受体相互作用,而是与细菌膜结合使其溶解后产生小孔进入细菌内部发挥作用,但是其中的某些方面尚不清晰[29-31]。Oxysterlin 1是来源于蜣螂的天蚕素,主要对大肠杆菌、阴沟肠杆菌、伤寒沙门氏菌等革兰氏阴性菌有抗菌活性,对革兰氏阳性菌的抗菌活性很低,并且仅在较高浓度(例如500 μg/mL) 下才对细胞具有毒性[3, 29],这与天蚕素的抗菌特征一致,说明Oxysterlin 1可以作为传统抗生素的潜在替代品。但是由于抗菌肽对细菌宿主细胞的高毒性和对细胞内蛋白酶的敏感性,在表达抗微生物肽方面遇到了困难[16]。为了解决这些问题,已使用亲和色谱法对生产抗菌肽的技术进行了多项研究[13-15]。但是高昂的成本却限制了该技术的大规模应用,成为抗菌肽应用的瓶颈。
由于ELP自断裂系统表达和纯化蛋白的过程简单且经济,所以已有多项相关研究被报道。目前有多种蛋白使用该系统生产,如过氧化氢酶、麦芽糖结合蛋白、氯霉素乙酰转移酶等,具有很高的得率[23]。此外,由于蛋白质内含肽存在提前自发断裂的行为,所以可将蛋白质内含肽分成两段表达从而解决这个问题[32],并且在该研究中还发现随着蛋白的分子量减小蛋白质内含肽的断裂效率会降低,所以在小分子量蛋白的生产上还需对该方法进行改进。也有研究将该方法进行了发酵条件的摸索,为利用ELP自断裂标签规模化生产目的蛋白奠定了基础[33]。在我们的工作中,使用自断裂的ELP系统在大肠杆菌中表达和纯化Oxysterlin 1。整个过程中不涉及任何树脂,仅使用了非常普通且便宜的缓冲液就得到了目的蛋白。但是使用该系统时,蛋白质内含肽的断裂效率仅为40%左右(图 2A),大大地降低了目标蛋白的产量,这主要是由于分子量相对较小的蛋白的断裂效率较低[32]。此外,由于ELP标签分子量大,目标蛋白的最终产量并不高(1.2 mg/L),这与先前使用该方法生产抗菌肽的研究类似[16]。但是该系统目前在抗菌肽的生产方面应用的还很少,需要进一步的优化。目前已有研究表明使用较少重复的ELP标签在达到相同纯化效果的同时可以提高抗菌肽的产量[34-35]。我们后续将会对这部分内容进行探索,期望得到最适合抗菌肽表达和纯化的ELP长度,同时我们将进行发酵条件的探索,从而达到提高抗菌肽产量和规模化生产的目的。
总之,我们使用自断裂的ELP系统得到了抗菌肽Oxysterlin 1 (图 2B),但是从图中可以看到蛋白条带的实际分子量大于理论分子量(4.45 kDa),造成这种现象的原因可能是小分子蛋白在分离过程中存在漂移现象,在其他抗菌肽研究中也有类似的现象报道[16, 36-37]。另外我们证明了抗菌肽具有抗菌活性(图 4和5),表明自断裂的ELP系统可用于抗菌肽的生产,为抗菌肽的生产进行了初步的探索。接下来我们还将对Oxysterlin 1的抑菌机理进行探索,以填补天蚕素在这方面的不足。
参考文献
| [1] | Zhang J, Zhao TH, Yang RW, et al. De novo synthesis, structural assignment and biological evaluation of pseudopaline, a metallophore produced by Pseudomonas aeruginosa. Chem Sci, 2019, 10(27): 6635-6641. DOI:10.1039/C9SC01405E |
| [2] | Kim DS, Kim SW, Song JM, et al. A new prokaryotic expression vector for the expression of antimicrobial peptide abaecin using SUMO fusion tag. Bmc Biotechnol, 2019, 19(1): 13. DOI:10.1186/s12896-019-0506-x |
| [3] | Segovia LJT, Ramirez GAT, Arias DCH, et al. Identification and characterization of novel cecropins from the Oxysternon conspicillatum neotropic dung beetle. PLoS ONE, 2017, 12(11): e0187914. DOI:10.1371/journal.pone.0187914 |
| [4] | Ashby M, Petkova A, Gani J, et al. Use of peptide libraries for identification and optimization of novel antimicrobial peptides. Curr Top Med Chem, 2017, 17(5): 537-553. |
| [5] | Haney EF, Mansour SC, Hancock RE. Antimicrobial peptides: an introduction. Methods Mol Biol, 2017, 1548: 3-22. |
| [6] | Wang GS, Li X, Wang Z. APD3: the antimicrobial peptide database as a tool for research and education. Nucleic Acids Res, 2016, 44(D1): D1087-D1093. DOI:10.1093/nar/gkv1278 |
| [7] | Wu QH, Patocka J, Kuca K. Insect antimicrobial peptides, a mini review. Toxins, 2018, 10(11): 461. DOI:10.3390/toxins10110461 |
| [8] | Wang ZL, Wang XM, Wang JH. Recent advances in antibacterial and antiendotoxic peptides or proteins from marine resources. Mar Drugs, 2018, 16(2): 57. DOI:10.3390/md16020057 |
| [9] | Aghaei S, Saffar B, Ghaedi K, et al. Functional analysis of recombinant codon-optimized bovine neutrophil beta-defensin. J Adv Res, 2016, 7(5): 815-821. DOI:10.1016/j.jare.2015.12.003 |
| [10] | Ma QS, Yu ZQ, Han B, et al. Expression and purification of lacticin q by small ubiquitin-related modifier fusion in Escherichia coli. J Microbiol, 2012, 50(2): 326-331. DOI:10.1007/s12275-012-1425-x |
| [11] | Jasniewski J, Cailliez-Grimal C, Gelhaye E, et al. Optimization of the production and purification processes of carnobacteriocins Cbn BM1 and Cbn B2 from Carnobacterium maltaromaticum CP5 by heterologous expression in Escherichia coli. J Microbiol Meth, 2008, 73(1): 41-48. DOI:10.1016/j.mimet.2008.01.008 |
| [12] | Li JF, Zhang J, Song R, et al. Production of a cytotoxic cationic antibacterial peptide in Escherichia coli using SUMO fusion partner. Appl Microbiol Biot, 2009, 84(2): 383-388. DOI:10.1007/s00253-009-2109-2 |
| [13] | Ingham AB, Sproat KW, Tizard MLV, et al. A versatile system for the expression of nonmodified bacteriocins in Escherichia coli. J Appl Microbiol, 2005, 98(3): 676-683. DOI:10.1111/j.1365-2672.2004.02502.x |
| [14] | Yu W, Gao XJ, Liu Y, et al. Fusion expression of cecropin B-like antibacterial peptide in Pichia GS115 and its antibacterial mechanism. Biotechnol Lett, 2016, 38(2): 305-312. DOI:10.1007/s10529-015-1978-y |
| [15] | Huang L, Wang JF, Zhong ZX, et al. Production of bioactive human beta-defensin-3 in Escherichia coli by soluble fusion expression. Biotechnol Lett, 2006, 28(9): 627-632. DOI:10.1007/s10529-006-0024-5 |
| [16] | Shen Y, Ai HX, Song R, et al. Expression and purification of moricin CM4 and human beta-defensins 4 in Escherichia coli using a new technology. Microbiol Res, 2010, 165(8): 713-718. DOI:10.1016/j.micres.2010.01.002 |
| [17] | Ge X, Yang DSC, Trabbic-Carlson K, et al. Self-cleavable stimulus responsive tags for protein purification without chromatography. J Am Chem Soc, 2005, 127(32): 11228-11229. DOI:10.1021/ja0531125 |
| [18] | Meyer DE, Chilkoti A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nat Biotechnol, 1999, 17(11): 1112-1115. DOI:10.1038/15100 |
| [19] | Trabbic-Carlson K, Liu L, Kim B, et al. Expression and purification of recombinant proteins from Escherichia coli: comparison of an elastin-like polypeptide fusion with an oligohistidine fusion. Protein Sci, 2004, 13(12): 3274-3284. |
| [20] | Fong BA, Wu WY, Wood DW. Optimization of ELP-intein mediated protein purification by salt substitution. Protein Expres Purif, 2009, 66(2): 198-202. DOI:10.1016/j.pep.2009.03.009 |
| [21] | Derbyshire V, Wood DW, Wu W, et al. Genetic definition of a protein-splicing domain: functional mini-inteins support structure predictions and a model for intein evolution. Proc Natl Acad Sci USA, 1998, 95(2): 762-762. |
| [22] | Van Roey P, Pereira B, Li Z, et al. Crystallographic and mutational studies of Mycobacterium tuberculosis recA mini-inteins suggest a pivotal role for a highly conserved aspartate residue. J Mol Biol, 2007, 367(1): 162-173. DOI:10.1016/j.jmb.2006.12.050 |
| [23] | Banki MR, Feng LA, Wood DW. Simple bioseparations using self-cleaving elastin-like polypeptide tags. Nat Methods, 2005, 2(9): 659-661. DOI:10.1038/nmeth787 |
| [24] | Gao Z, Qu BZ, Yao L, et al. Identification and functional characterization of amphioxus miple, ancestral type of vertebrate midkine/pleiotrophin homologues. Dev Comp Immunol, 2018, 89: 31-43. DOI:10.1016/j.dci.2018.08.005 |
| [25] | Kim JS, Jeong JH, Cho JH, et al. Antimicrohial activity of antimicrobial peptide LPcin-YK3 derived from bovine lactophoricin. J Microbiol Biotechn, 2018, 28(8): 1299-1309. DOI:10.4014/jmb.1805.05001 |
| [26] | Chen H, Wang R, Zhang J, et al. Synthesis of core-shell structured ZnO@m-SiO2 with excellent reinforcing effect and antimicrobial activity for dental resin composites. Dent Mater, 2018, 34(12): 1846-1855. DOI:10.1016/j.dental.2018.10.002 |
| [27] | Riccardi C, Nicoletti I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nat Protoc, 2006, 1(3): 1458-1461. DOI:10.1038/nprot.2006.238 |
| [28] | Zhang N, Fan YX, Li C, et al. Cell permeability and nuclear DNA staining by propidium iodide in basidiomycetous yeasts. Appl Microbiol Biot, 2018, 102(9): 4183-4191. DOI:10.1007/s00253-018-8906-8 |
| [29] | Brady D, Grapputo A, Romoli O, et al. Insect cecropins, antimicrobial peptides with potential therapeutic applications. Int J Mol Sci, 2019, 20(23): 5862. DOI:10.3390/ijms20235862 |
| [30] | Sato H, Felix JB. Peptide-membrane interactions and mechanisms of membrane destruction by amphipathic alpha-helical antimicrobial peptides. Bba-Biomembranes, 2006, 1758(9): 1245-1256. DOI:10.1016/j.bbamem.2006.02.021 |
| [31] | Efimova SS, Medvedev RY, Chulkov EG, et al. Regulation of the pore-forming activity of cecropin A by local anesthetics. Cell Tissue Biol, 2018, 12(4): 331-341. DOI:10.1134/S1990519X18040028 |
| [32] | Shi CH, Meng Q, Wood DW. A dual ELP-tagged split intein system for non-chromatographic recombinant protein purification. Appl Microbiol Biot, 2013, 97(2): 829-835. DOI:10.1007/s00253-012-4601-3 |
| [33] | Fong BA, Wood DW. Expression and purification of ELP-intein-tagged target proteins in high cell density E. coli fermentation. Microb Cell Fact, 2010, 9(1): 77. DOI:10.1186/1475-2859-9-77 |
| [34] | Yang K, Su YJ, Li JH, et al. Expression and purification of the antimicrobial peptide cecropin AD by fusion with cationic elastin-like polypeptides. Protein Expres Purif, 2012, 85(2): 200-203. DOI:10.1016/j.pep.2012.04.007 |
| [35] | Sousa DA, Mulder KCL, Nobre KS, et al. Production of a polar fish antimicrobial peptide in Escherichia coli using an ELP-intein tag. J Biotechnol, 2016, 234: 83-89. DOI:10.1016/j.jbiotec.2016.07.021 |
| [36] | Park SI, Kim JW, Yoe SM. Purification and characterization of a novel antibacterial peptide from black soldier fly (Hermetia illucens) larvae. Dev Comp Immunol, 2015, 52(1): 98-106. DOI:10.1016/j.dci.2015.04.018 |
| [37] | Li ZZ, Mao RY, Teng D, et al. Antibacterial and immunomodulatory activities of insect defensins-DLP2 and DLP4 against multidrug- resistant Staphylococcus aureus. Sci Rep-Uk, 2017, 7(1): 12124. DOI:10.1038/s41598-017-10839-4 |
